过氧化钙对黑臭水净化效果的研究
2018-06-07王兆珺徐建平
王兆珺,徐建平
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
随着我国城市经济的快速发展,城市的污水排放量不断增加,大量污染物进入河道,导致水体出现季节性或者终年黑臭[1-2].国务院于2015年4月正式发布的《水污染防治行动计划》明确提出:到2020年,地级及以上城市建成区黑臭水均控制在10%以内;到2030年,全国城市建成区黑臭水体总体消除[3-5].黑臭水体治理是当前水污染防治和水环境治理的重要任务之一.黑臭现象是上覆水体的主要表现,水体缺氧以及无机物污染是导致水体黑臭的重要因素.水体中的溶解氧(DO)量小于2 mg/L的水体易致黑臭[2,6].此时黑臭水体中的氮磷无机盐的含量要比正常水体高出3~10倍,而氮磷是导致水体富营养化的重要因素[7].如何提高黑臭水体的DO同时控制水体中的氮磷含量成为众多学者关注和研究的热点.
近年来,过氧化钙因其强氧化性和高释氧性被应用到诸多领域[8-12].过氧化钙不仅能够提高黑臭水体的溶解氧,同时对黑臭底泥中磷的释放有一定的抑制作用[13-14].通过向黑臭水体中投加过氧化钙,研究对水体中氮的去除效果,以及对黑臭水体溶解氧的改善效果.
1 材料与方法
1.1 实验材料
实验所用的过氧化钙购买自Sigma-Aldrich,纯度为75%,采用MASTERSIZE 2000激光粒度仪对购买的过氧化钙进行粒度分析,分析质量浓度为0.015 9% Vol,结果如图1所示.粒度中值为12.406 um,粒径主要集中在0.316~45.709 um,颗粒的比表面积为0.863 m2/g.
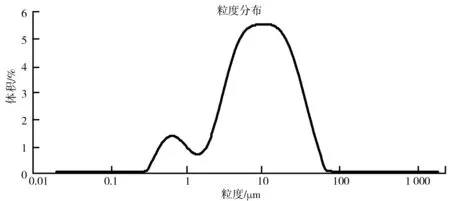
图1 过氧化钙粒度分析
实验所用黑臭水样取自安徽工程大学校内河道.采水面以下50 cm处水样,采样后马上送回实验室,并立即进行灌装和理化性质分析.其中,溶解氧和pH在现场原位测定.水样经0.45 um水系针头滤器过滤后进行氨氮的分析.运输过程中避光.其理化性质如表1所示.通过对比《城市黑臭水体整治工作指南》[15],氨氮质量浓度超过15 mg/L,表明该条校内河为中度污染的黑臭河道.

表1 安徽工程大学校内河水理化性质
1.2 实验方法
(1)过氧化钙投加量对黑臭水净化效果的研究.分别向6只顶空瓶中加入200 ml的黑臭水,再分别向各水样中投加0、0.05 g、0.2 g、0.5 g、1 g、2 g的过氧化钙,将样品置于25 ℃条件下,避光静置24 h后取出,取瓶口下1/3处水样进行检测,测定氨氮的水样经0.45 um水系针头滤器进行过滤后分析.
(2)静置时间对黑臭水净化效果的研究.取18只250 ml顶空瓶,加入200 ml的黑臭水样,分为1#和2#两实验组,分别向两组实验的水样中投加过氧化钙0.3 g、0.5 g,将样品置于25 ℃条件下,避光静置.分别于1 h、3 h、6 h、9 h、12 h、18 h、1 d、2 d、3 d后取出顶空瓶,取瓶口下1/3处水样进行检测,水样经0.45 um水系针头滤器进行过滤后分析氨氮.
(3)pH对黑臭水净化效果的研究.取14只250 ml顶空瓶,加入200 ml的黑臭水样.分为1#和2#两实验组,分别用1 mol/L的氢氧化钠和1 mol/L的H2SO4调节初始pH为2~12,对1#实验组仅调节初始pH不投加过氧化钙,向2#实验组各黑臭水样投加过氧化钙0.3 g;将样品置于恒温25 ℃条件下,避光静置24 h后取出,取瓶口下1/3处水样进行检测,水样经0.45 um水系针头滤器进行过滤后分析氨氮.
(4)投加不同量酸碱对黑臭水净化效果的研究.取15只250 ml顶空瓶,加入200 ml的黑臭水样,除一空白水样,分别向各水样中投加0.3 g过氧化钙,分为1#、2#、3# 3组,每组5个水样,将样品置于恒温25 ℃条件下,避光静置6 h后取出.分别向3组各水样中注射1 mol/L H2SO41 ml、2 ml、3 ml、4 ml、5 ml,继续将样品置于恒温25 ℃条件下,避光静置6 h后取出;分别向2#组注射1 mol/L NaOH 2 ml、3#组注射1 mol/L NaOH 4 ml,继续将样品置于恒温25 ℃条件下,避光静置12 h后取出,取瓶口下1/3处水样进行检测,水样经0.45 um水系针头滤器进行过滤后分析氨氮.
1.3 检测和计算方法
(1)指标检测方法.实验过程中,氨氮的测定采用纳氏试剂光度(HJ_535-2009),pH的测定采用电极直接测定,溶解氧的测定采用溶解氧测定仪直接测定.
(2)数据处理.实验数据处理采用Excel软件,绘图采用Origin 8.0;用标准差对试验的3组实验数据的离散程度进行表示.最终获得的实验结果,以3组检测数据的平均值为准.污染物的去除效率计算公式如下:
式中,C0为污染物初始质量浓度(mg/L);Ce为污染物的剩余质量浓度(mg/L).
2 结果与讨论
2.1 过氧化钙投加量对黑臭水净化效果的影响
(1)溶解氧和pH随过氧化钙投加量的变化.将过氧化钙投入黑臭水样静置24 h后,分别对水样的DO和pH进行测定,结果分别如图2、图3所示.由图2可见,当过氧化钙投加量为0.05 g时,DO增加量最大,从原先的缺氧状态增加10.01 mg/L ,继续增加投加量,DO持续上升,当投加量至0.5 g时,DO增加到13.87 mg/L;后续继续增加过氧化钙投加量,DO波动不大.pH和溶解氧相类似(见图3),当过氧化钙投加量为0.05 g时,pH值迅速增加至10.06,投加量大于0.5 g,pH趋于稳定.
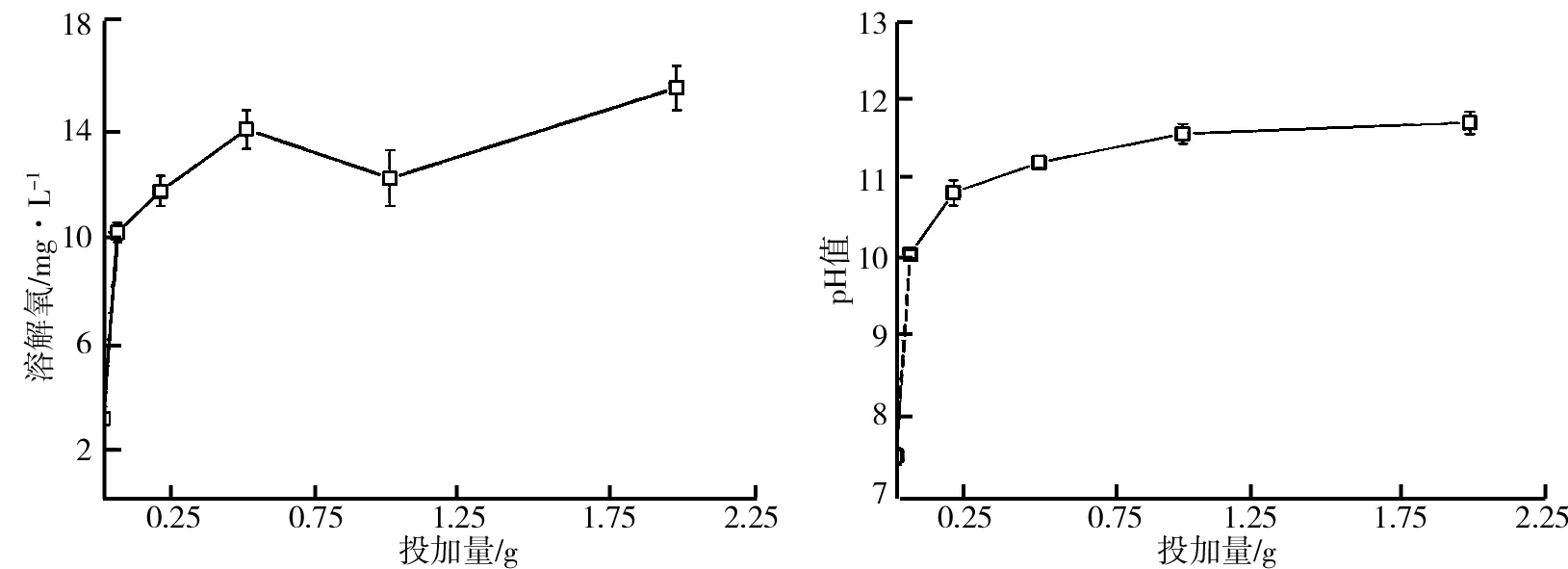
图2 溶解氧随过氧化钙投加量的变化图3 pH随过氧化钙投加量的变化
自然状态下过氧化钙投入水中,会形成Ca(OH)2和H2O2[16],每g过氧化钙最多可以释放0.47 g H2O2[17]同时生成OH-增加水体的碱性.反应过程如下所示:


相关研究表明,当pH在12~13时,过氧化钙和水反应较慢,生成的H2O2主要以O2的形式释放[18]. 由图3可知,随着过氧化钙投加量的增加,pH先增加后逐渐趋于稳定;当投加量大于0.5 g,黑臭水样的pH维持在大于11±0.5,该pH范围导致过氧化钙缓慢释氧,溶解氧浓度也波动较小(见图2).

图4 过氧化钙的投加量对氨氮的去除效率的影响
(2)过氧化钙的投加量对氮的去除效果的影响.经过不同量的过氧化钙处理之后,黑臭水样中氨氮的剩余质量浓度和氨氮去除效率变化曲线如图4所示.由图4可以看出,当过氧化钙的投加量为0~0.5 g时,氨氮的去除效率增加最快;当投加量为0.5 g时,氨氮的质量浓度为11.93 mg/L,去除效率达到38.99%,后续试验趋于稳定.所以,处理黑臭水样投加0.5 g过氧化钙较为理想.
黑臭水样中的氨氮大多以离子态和游离态存在,两者之间的电离平衡关系式如下所示:
当pH值增加,水样中游离氨逐渐增加,在一定的气液比条件下,提高pH值有利于提高氨氮的去除效率[19].相关研究表明,在pH接近11时,溶液中离子态的铵不到5%[20],故随着过氧化钙投加量的增加,黑臭水样的pH也随之增加,水样中分子态的氨氮质量浓度随之减少.由于实验是在顶空瓶中进行的,随着黑臭水样中释放的分子态氨氮逐渐增加,顶空瓶中的压强逐渐增加,达到一定平衡状态,黑臭水样中的游离态氨氮质量浓度便不再降低,所以随着过氧化钙投加量的增加,黑臭水样中氨氮的质量浓度波动较小趋于稳定.
2.2 静置时间对黑臭水净化效果的影响
(1)溶解氧和pH随静置时间的变化.DO和pH对不同质量的过氧化钙在黑臭水样中不同静置时间的变化曲线分别如图5、图6所示.其中1#为投加0.5 g过氧化钙实验组,2#为投加0.3 g过氧化钙实验组.由图5可知,2个实验组均在过氧化钙加入黑臭水样1 h时DO快速增加 ,随着静置时间的延长,DO浓度在1 h上下波动变化,差别不是很大.pH随静置时间的变化规律如图6所示.在过氧化钙加入黑臭水样1 h时,两个实验组的pH均骤升至11.64±0.5, 随着静置时间的延长,水样的pH基本稳定.在pH大于11时,过氧化钙的溶解速度较慢.所以,随着反应时间的延长,水样的溶解氧浓度波动较小,在静置1 d后溶解氧浓度逐渐下降,表明过氧化钙与水完全反应.
(2)静置时间对氮的去除效率的影响.不同质量的过氧化钙对黑臭水样中氨氮在不同静置时间条件下的剩余质量浓度和去除效率变化曲线如图7、图8所示.其中1#为投加0.5 g过氧化钙实验组,2#为投加0.3 g过氧化钙实验组.由图7和图8可知,静置1 h, 1#实验氨氮的质量浓度由初始20.54 mg/L降至11.476 mg/L,去除效率为44.18%.在1~18 h,氨氮的去除效率趋于稳定,随着静置时间的延长,氨氮的去除效率又逐渐增加,在2 d时达到极值(氨氮浓度为6.91 mg/L,去除效率达到最大65.34%).2#试验与1#基本相同.由图5和图6可知,随着静置时间的延长,实验组1#和2#的pH均维持在11.64±0.5,较高的pH条件可以提高氨氮的去除效率.当静置时间为1 d时,黑臭水样中的溶解氧质量浓度逐渐下降,顶空瓶中的压强有所下降,有利于黑臭水样中氨氮的释放,故氨氮质量浓度逐渐减小(见图7),去除效率逐渐增加(见图8).

图7 氮的质量浓度随静置时间的变化规律图8 氮的去除效率随静置时间的变化规律
2.3 pH对黑臭水净化效果的影响
(1)溶解氧和pH随初始pH的变化.DO和pH在不同初始pH下静置24 h后变化曲线如图9、图10所示.其中1#为仅改变初始pH未投加过氧化钙实验组,2#为投加0.3 g过氧化钙实验组.由图9可知,当2#实验组pH为2时,DO最高达到44.42 mg/L,随着初始pH值增加, 溶解氧逐步下降.可见,酸性条件有利于过氧化钙释氧,提高黑臭水样中的DO.分析认为,在酸性条件下更有利于过氧化钙释放出O2.由图10可知,2#实验组水样的pH基本维持在11±0.5.而1#实验组静置24 h后,pH没有发生变化.相关研究表明pH对过氧化钙的反应性能影响很大.酸性可以促进过氧化钙溶解,使过氧化钙迅速释放出O2.在Abraham Northup[18]等的研究中,当pH为6~9时,过氧化钙完全溶解需要4 h,在pH为12~13时,过氧化钙完全溶解需要62 h.所以,当2#实验组静置24 h后,在初始pH为2时,黑臭水样中溶解质量浓度最高,在pH为12时,溶解氧质量浓度较低.

图9 溶解氧随初始pH的变化图10 静置后的pH的变化
(2)初始pH对氮的去除效果的影响.在不同初始pH条件下,研究经过氧化钙处理后,黑臭水样中的氨氮的剩余质量浓度如图11所示.黑臭水样中的氨氮的去除效果如图12所示.其中1#为仅改变初始pH未投加过氧化钙实验组,2#为投加0.3 g过氧化钙实验组.由图11和12可知,在1#实验组中,随着初始pH的增加,氨氮的质量浓度逐渐降低,可见增加黑臭水样系统的pH,有利于脱氮.2#实验组的去除效率表明,较低的初始pH不利于氨氮的去除.
由于实验是在封闭的顶空瓶中进行的,所以氨氮的去除效率和瓶内的压强有一定的关系,当瓶内的压强较高时,会抑制黑臭水样中游离态的氨氮溢出水样.在pH=2时,虽然2#实验组黑臭水样静置后的pH=11.5,但是由于黑臭水样中溶解氧质量浓度较高,即便黑臭水样中游离态的氨氮质量浓度较高,也无法溢出水样,导致氨氮的去除效率相对较低.当pH=12时,水样中游离的氨氮质量浓度较高,同时由于溶解氧质量浓度相对较低,黑臭水样中游离态的氨氮溢出水样,故氨氮去除效率相对较高.在pH=6时,氨氮的质量浓度相对较高.相关研究表明,当pH=6时,过氧化钙对有机物的去除效率最高[17],水中有机氮可以被过氧化钙氧化,转化为氨氮,从而导致黑臭水样中氨氮的质量浓度升高.

图11 初始pH对氨氮剩余质量浓度的影响图12 初始pH对氨氮去除效率的影响
3 结论
黑臭水样中的溶解氧随着过氧化钙投加量的增加而增加,当过氧化钙的投加质量浓度大于2 g/L后,溶解氧增加较为缓慢,氨氮的质量浓度也随着过氧化钙投加量的增加,先增加后趋于稳定.黑臭水样的pH与过氧化钙投加量的变化与溶解氧相同.所以,综合考虑,过氧化钙的投加质量浓度为2 g/L对黑臭水处理效果为佳.
过氧化钙对黑臭水的处理效果和静置时间有关.当静置时间为1 h时黑臭水中的溶解氧质量浓度最高,随着静置时间的继续增加,溶解氧质量浓度变化逐渐减小.而氨氮的去除效率随着静置时间的增加,逐渐增加,当静置时间为2 d时,处理效率最高.黑臭水样的pH随着静置时间的增加基本保持在11±0.5.同时发现,当过氧化钙的投加质量浓度为1.2 g/L时,相对于2 g/L的过氧化钙投加质量浓度,对黑臭水样的处理效果降低较小.
pH对过氧化钙处理黑臭水影响较大,黑臭水样中的溶解氧随着pH的增加而减小;当pH为10时,对氨氮的去除效率最高.当pH为6时,氨氮的去除效率最低.对比不改变初始pH反应可知,改变初始pH总体可以提高过氧化钙对黑臭水样中氨氮的去除效率.
[1] 何荣.我国城市黑臭水体治理思路研究[J].工程技术:全文版,2016(8):228.
[2] 王旭,王永刚,孙长虹,等.城市黑臭水体形成机理与评价方法研究进展[J].应用生态学报,2016,27(4):1 331-1 340.
[3] 张列宇,王浩,李国文,等.城市黑臭水体治理技术及其发展趋势[J].环境保护,2017,45(5):62-65.
[4] 曹红业.中国典型城市黑臭水体光学特性分析及遥感识别模型研究[D].成都:西南交通大学,2017.
[5] 周飞祥,贾书惠,王巍巍.城市黑臭水体治理的实践与探索——以河南省鹤壁市海绵城市为例[J].建设科技,2016(1):21-24.
[6] 李鹏章,黄勇,李大鹏,等.水体黑臭及表观污染表征方法的研究进展[J].四川环境,2011,30(3):90-93.
[7] 孙韶玲.水体黑臭演化过程及挥发性硫化物的产生机制初步研究[D].烟台:中国科学院烟台海岸带研究所,2017.
[8] 王健,包先明.过氧化钙耦合蛋白酶对污泥厌氧消化产酸性能的影响[J].环境污染与防治,2017,39(4):352-355.
[9] 李玉芳.过氧化钙的制备及其在环保修复方面的应用研究进展[J].精细与专用化学品,2017,25(1):33-36.
[10] 蒋静南,吴湛霞.过氧化钙对淡水鱼类养殖的增氧作用[J].淡水渔业,1992(6):23-26.
[11] NORTHUP A,CASSIDY D.Calcium peroxide (CaO2) for use in modified Fenton chemistry[J].Journal of Hazardous Materials,2008,152(3):1 164-1 170.
[12] GAGO I.Coated calcium peroxide particles useful in the treatment of water[J].US,1981(4):293-426.
[13] 王熙,孙飞云,董文艺.用过氧化钙控制城市河道底泥嗅味物质及氮磷释放试验研究[J].水利水电技术,2012,43(8):66.
[14] 张亚雷,章明,李建华,等.CaO2不同投加方式对底泥磷释放的抑制效果分析[J].环境科学,2006,27(11):2 188-2 193.
[15] 林培.《城市黑臭水体整治工作指南》解读[J].建设科技,2015(18):14-15.
[16] LU S,ZHANG X,XUE Y.Application of calcium peroxide in water and soil treatment:a review[J].Journal of Hazardous Materials,2017(337):163.
[17] QIAN Y,ZHOU X,ZHANG Y,et al.Performance and properties of nanoscale calcium peroxide for toluene removal[J].Chemosphere,2013,91(5):717-723.
[18] NORTHUP A,CASSIDY D.Calcium peroxide (CaO2) for use in modified Fenton chemistry[J].Journal of Hazardous Materials,2008,152(3):1 164-1 170.
[19] 黄勇,胡旭跃,吴方同,等.氨氮吹脱效率影响因素[J].长沙理工大学学报:自然科学版,2009,6(2):88-91.
[20] WANG S,PENG Y.Natural zeolites as effective adsorbents in water and wastewater treatment[J].Chemical Engineering Journal,2010,156(1):11-24.
