地衣芽孢杆菌抗菌肽萃取条件的研究
2018-06-07胡俊,汤斌,李松
胡 俊,汤 斌,李 松
(安徽工程大学 微生物发酵安徽省工程研究中心,安徽 芜湖 241000)
抗菌肽是一种常见的生物拮抗剂,主要表现为对一些G+细菌(特别是一些致病菌,如金黄色葡萄球菌、肺炎双球菌等)具有一定的拮抗作用[1],因而在环境保护、医疗卫生和食品加工等众多领域都有着较为重要的应用.利用微生物生产抗菌肽具有生产周期短,产物易分离纯化等优点[2],是工业上抗菌肽的主要获得途径.
抗菌肽纯化方法主要包括膜分离、电泳分离、层析技术以及高效液相色谱分离等[3].在利用高效液相色谱(HPLC)对发酵液中的抗菌肽组分进行分离时,需要先对发酵液进行预处理,以降低分离体系中的蛋白丰度、分离难度以及避免造成仪器损坏.从目前的研究现状来看,预处理方式主要包括盐析、色谱柱粗分离、分级沉淀和有机萃取等[4].胡瑞萍[5]等采用盐酸沉淀和Sephadex G-50 凝胶柱分离对枯草芽孢杆菌BSD-2抗菌肽进行了粗提取;刘静[6]等在枯草芽孢杆菌抗菌肽分离纯化过程中,采用阴离子交换柱DEAE-Sepharose FF等方式对发酵粗提液进行预处理;刘颖[7]等在分离抗真菌肽的过程中,通过调节发酵液酸碱度以及利用丙酮分级沉淀等方法对目的蛋白进行了粗提.由于抗菌肽具有分子量小、结构简单、稳定性较高且在有机溶剂和水中都具有一定的溶解性等特点[8],所以,利用合适的有机溶剂对发酵液中的抗菌肽进行萃取可使其中大多数杂蛋白变性沉淀,而分子量较小的多肽类物质可部分转移至有机相中.相比其他的预处理方式,此方法操作简单且能取得较好的预处理效果,使后续HPLC分离过程简化,因而以此作为发酵液的预处理方法.
研究以地衣芽孢杆菌为生产菌株时,发酵液预处理操作过程中的各实验因素对抗菌肽的萃取效果和相对应的反萃取效果的影响,以及最佳萃取试剂、萃取和反萃取条件的确定,最终通过蛋白丰度检测对预处理效果进行了评估.相比其他预处理方式,此方法操作简单且能较好地达到预处理效果,使后续HPLC分离过程简化,因而选择此方法作为发酵液的预处理方法.
1 实验材料
(1)菌种.地衣芽孢杆菌BL32、金黄色葡萄球菌AS1.2465(以上菌株均为安徽工程大学微生物发酵工程研究中心实验室筛选保藏).
(2)试剂与仪器.试剂:氨苄青霉素钠标准品(160 万U/g,纯度≥99.9%)、乙腈(色谱纯)、甲醇(色谱纯)、95%乙醇、氯仿(AR)、正丁醇(AR)、异戊醇(AR)、硫酸镁(AR)、碳酸钙(AR)、可溶性淀粉、胰蛋白胨、酵母粉(以上药品均购自国药集团公司)以及市售豆粕.
仪器:NS4201二元分析液相色谱系统、RE52AA旋转蒸发仪、FD8-3冷冻干燥机、电热鼓风式干燥箱.
(3)培养基.LB固体培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,琼脂粉1.5%;种子培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%;发酵培养基:可溶性淀粉1%,豆粕2%,硫酸镁0.02%,碳酸钙0.05%.
2 实验方法
2.1 发酵液的获得
(1)种子液制备.用接种环从斜面菌种保藏管中挑取菌体接种于20 mL种子培养基中,于37 ℃环境中200 r/min震荡培养18 h备用.
(2)发酵液的获取.配制上述发酵培养基并加入10 L发酵罐(BIOTECH-10JS-9000C,上海保兴生物设备工程有限公司)中进行实罐灭菌,待培养基冷却至室温时接入2%的地衣芽孢杆菌种子液.控制发酵条件为37 ℃、溶氧30%(串联转速),发酵过程中恒定pH 6.5(10% 氨水调节),发酵时间为30 h.发酵结束后[9],将发酵液进行8 000 r/min离心10 min,取上清液备用.
2.2 抗菌效价与抗菌肽相对含量计算方法
(1)抗菌实验方法.抗菌实验方法采取琼脂表面扩散法[10].在LB平板表面涂布指示菌,同时在培养基表面放置牛津杯(规格:内径φ=8 mm).向牛津杯中加入100 μL待测液,平板置于一定的条件下培养,后测定牛津杯周围的抑菌圈直径大小.
(2)抗菌效价计算方法.准确称取氨苄青霉素钠1.000 g,利用超纯水配制浓度为1.000 g/mL(160 万抗菌单位)的氨苄青霉素钠标准溶液[11],对此标准溶液进行梯度稀释分别配制2~20 U/mL的标准溶液备用.取一定量的样液置入无菌EP管中用无菌水梯度稀释5~15倍,经0.22 μm的无菌过滤器过滤后按2.2(1)的方法进行抗菌实验.样液抑菌效价的测定采用国际上通用的抗生素效价测定方法“杯碟法”中的二计量法[12].即根据下列公式和抑菌圈的大小得出相应的抗菌效价.

(3)抗菌肽相对含量的测定方法.根据样液中抗菌物质的含量与其抗菌效价成正比的关系,样液中抗菌肽的相对含量主要是通过测定抑菌效价的方式体现的.发酵液中抗菌肽相对含量直接通过原发酵液的抗菌效价判断,萃取操作后溶于有机溶剂和超纯水中的抗菌肽相对含量测定方法如下:10 000 r/min离心5 min,收集有机相或水相,利用旋转蒸发仪浓缩后60 ℃烘干,溶质利用5 mL超纯水重新溶解后经0.22 μm水膜过滤.按2.2(2)所述方法测定溶解液抗菌效价.
2.3 发酵液中抗菌肽萃取条件的研究
(1)不同有机溶剂对萃取效率的影响.分别以氯仿、四氯化碳、正丁醇、异戊醇和混合醇(正丁醇∶异戊醇=1∶1)为萃取用的有机萃取剂.将有机溶剂与原发酵液上清液按体积比1∶1混合进行萃取操作.分别收集有机相和发酵液并对其中抗菌肽的相对含量进行测定.每种有机溶剂设3个平行组,抑菌性效价取相对应的平均值.
(2)萃取机溶剂/发酵清液的体积比对萃取效率的影响.控制有机溶剂与发酵清液的体积比分别为1∶1、2∶1、3∶1、4∶1、5∶1进行萃取,测定有机相和水相中的抗菌肽相对含量.各体积比设3个平行组,抑菌性效价取相对应的平均值.
(3)萃取温度对萃取效率的影响.取适量的有机溶剂和发酵上清液分别置入水浴锅中保温30 min,水浴锅的温度分别设置为25 ℃、35 ℃、45 ℃、55 ℃和65 ℃.后迅速将有机溶剂与培养液清液按合适的体积比混合,分别收集有机相和发酵液,对两者溶解的抗菌肽相对含量进行测定.各温度条件下设3个平行组,抑菌性效价取相对应的平均值.
2.4 反萃取条件的研究
反萃取是指在萃取操作以后,将溶解有抗菌肽的有机溶剂与超纯水混合,使得有机溶剂中部分抗菌肽转移至水相的实验过程,目的是为了进一步降低待分离体系中的蛋白丰度.
(1)有机相/超纯水体积比对反萃取效果的影响.分别设置反萃取过程中 V有机相/V超纯水比为1∶1、1∶2、1∶3、1∶4、1∶5,在常温下充分震荡混合均匀,按2.2(2)方法对各组有机相以及水相中的抗菌肽相对含量进行测定.各体积比设3个平行组,抑菌性效价取相对应的平均值.
(2)温度对反萃取效果的影响.取适量的有机溶剂和超纯水分别置于温度设置为25 ℃、35 ℃、45 ℃、55 ℃、65 ℃水浴锅中保温30 min后迅速将有机溶剂与超纯水按合适的体积比混合,测定各组有机溶剂和水相中抗菌肽的相对含量.各温度条件下设3个平行组,抑菌性效价取相对应的平均值.
(3)反萃取操作次数对实验效果的影响.在最适操作温度条件下,按最适体积比将含有抗菌肽的有机溶剂与超纯水进行混合,充分震荡后离心.收集上层有机相再一次按体积比加入超纯水重复上述操作2至5次,分别对每次有机相中剩余的抗菌肽相对含量进行测定.各操作次数设3个平行组,抑菌性效价取相对应的平均值.
2.5 蛋白丰度的检测
分别取发酵浓缩液、萃取操作后溶有抗菌肽的有机溶剂以及反萃取后溶有抗菌肽的水溶液经0.45 μm膜过滤后进行高效液相色谱分析.色谱检测条件分别为柱型C18柱(规格:250×8 mm),操作温度25 ℃;有机相(A相)为乙腈(色谱纯);非有机相(B相)为超纯水;A相由起始浓度30%上升至结束浓度60%;检测光波长254 nm;分离时间30 min;进液量20 μL.
3 结果与分析
3.1 萃取实验条件优化
不同有机溶剂萃取液的萃取效率和抑菌效果如图1、图2所示.由图2可知,以正丁醇为萃取溶剂时形成的抑菌圈的直径较大即以正丁醇为有机溶剂时,发酵液中的抗菌肽可较多的转移至有机相中,其萃取率为33.14%.其次为混合醇,萃取效果最差的为四氯化碳,其对抗菌肽的萃取率仅有8.28%.
V有机溶剂/V发酵液对萃取效果的影响如图3所示.温度对萃取效果的影响如图4所示.由图3可知,萃取过程中,不同的有机相与发酵液的体积比对萃取效果有一定的影响,其中设定V有机相/V发酵液为2∶1时,抗菌肽的萃取相比于V有机相/V发酵液为1∶1提高了8.53%.但之后有机溶剂量继续增加时,萃取率上升并不明显.同时由图4可得操作温度大于45 ℃时,萃取率趋于稳定,但相对于室温条件下提高了4.5%左右.
由以上优化的数据分析可得出,在发酵液的萃取预处理的过程中,以正丁醇为萃取试剂,最佳效益的萃取条件V有机相/V发酵液为2∶1,萃取温度为45 ℃.
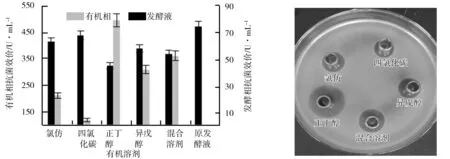
图1 有机溶剂对抗菌肽的萃取效率图2 不同有机溶剂萃取液的抑菌效果

图3 V有机溶剂/V发酵液对萃取效果的影响图4 温度对萃取效果的影响
3.2 反萃取条件优化
不同的V有机相/V超纯水对反萃取效果的影响如图5所示.不同温度对反萃取效果的影响如图6所示.有机相中残留抗菌效价与反萃取次数的关系如图7所示.由图5、图6、图7可知,在实验操作中不同的V有机相/V超纯水对反萃取的效果没有较为显著影响;相对于室温环境,设定反萃取操作温度为45 ℃时,单次反萃取率有所提高.而在最适反萃取条件下进行重复操作,进行2次反萃取时,反萃取率相对于单次操作提高了7.84%.因此,在反萃取操作中,设定V有机相/V超纯水为1∶1、操作温度为45 ℃、操作次数为2次时可获得较好的反萃取效益,反萃取率接近61.28%.

图5 不同的V有机相/V超纯水对反萃取效果的影响图6 不同温度对反萃取效果的影响

图7 有机相中残留抗菌效价与反萃取次数的关系

图8 原发酵液蛋白丰度检测结果
3.3 蛋白丰度的检测结果分析
原发酵液样品色谱检测结果如图8所示.由高效液相色谱检测数据可以看出,在原发酵液样品图谱中出现峰数目较多,可见原发酵液中蛋白丰度较大,在此基础上很难直接对抗菌肽进行分离收集.但经过有机萃取操作后,对比原发酵液的检测结果后发现,图谱中峰数目明显下降及大部分的杂蛋白组分可在正丁醇的作用下变性沉淀,继而被除去(见图9).进一步经过反萃取操作,对比图9可知,分离时间大于6.5 min出现的蛋白组分在水相中溶解度较小并被截留在有机相中,水相的蛋白组分明显下降(见图10).因此通过以上两步的操作,使得最终待分离体系中的蛋白组成相对简单,从而达到了较为理想的处理效果.
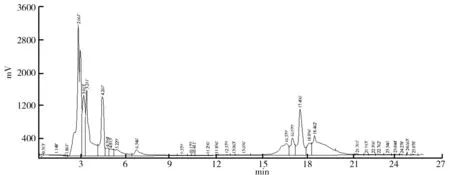
图9 萃取操作后溶于有机相蛋白丰度检测结果

图10 反萃取操作后溶于水相蛋白丰度检测结果
4 结论
有机萃取是抗菌肽纯化工艺中发酵液的预处理方法,相比与其他方法具有高效简便的优点.以正丁醇为有机萃取剂,在合适的V有机相/V发酵液和操作温度条件下,可使地衣芽孢杆菌发酵液中抗菌肽最大限度地转移至有机相中,然后进一步进行反萃取操作,对影响其效果的操作温度和反萃取操作次数进行优化.在45 ℃条件下,二次反萃取率接近61.28%,萃取操作可使发酵液中大多数杂蛋白组分被除去,使得后期高效液相色谱的分离工作难度大大降低,从而起到了相应的预处理效果.
[1] 全艳玲.地衣芽孢杆菌对有害微生物的拮抗作用[J].食品科学,2002,8(22):68-69.
[2] 喻钢,田万红,董思国,等.枯草芽孢杆菌抗菌肽的分离纯化及质谱检测[J].药物分析杂志,2014,34(10):1 902-1 906.
[3] 张亚,苏品,廖晓兰,等.多肽的分离纯化技术研究进展[J].微生物学杂志,2013,33(5):87-91.
[4] 庞秀枰,马裕钦.小分子肽分离技术研究进展[J].广东化工,2015,2(42):89-90.
[5] 胡瑞萍,张铎,张丽萍,等.枯草芽孢杆菌BSD-2一种抗菌肽的分离纯化与鉴定[J].华北农学报,2011,26(6):201-206.
[6] 刘静,王军,姚建铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物学报,2004,44(4):511-514.
[7] 刘颖,徐庆,陈章良.抗真菌肽LP-1的分离纯化及特性分析[J].微生物学报,1999,30(5):441-449.
[8] T WANG,Y F LIANG,M B WU,et al.Natural products from bacillus subtilis with antimicrobial properties[J].Chinese Journal of Chemical Engineering,2015(23):744-754.
[9] 温小娟,闫淑珍,刘维红,等.拮杭性类芽孢杆菌F53菌株的固体发酵条件研究[J].安徽农业科学,2007,35(2):461-463.
[10] 沈萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,2006.
[11] 曾东方,陈玢,桓娇,等.塑料管碟法测定抗生素的抗菌活性[J].生物学通报,2011,46(8):48.
[12] 国家药典委员会.中华人民共和国药典附录Ⅵ[M].北京:中国医药科技出版社,2005.
