植物叶片染色质免疫共沉淀方法的优化
2018-06-06张媛媛黄冬梅李丹静
张媛媛, 黄冬梅, 邓 班, 李丹静, 张 玉, 缪 颖
(福建农林大学生命科学学院分子细胞和系统生物学中心,福建 福州 350002)
迄今为止,已有多种方法用于研究蛋白质与DNA的互作,染色质免疫共沉淀技术(Chromatin immunoprecipitation, ChIP)是用于检测蛋白质与DNA体内互作的有力工具[1,2].自Gilmour和Lis[3,4]创建ChIP技术以来,ChIP方法得到不断改进和完善.ChIP技术可与高通量测序(seq)、基因芯片(chip)、实时荧光定量PCR(qPCR)等技术联合使用,广泛应用于组蛋白修饰、核小体定位及转录因子结合位点检测等方面[5].
ChIP技术的基本原理是在生物体生理状态下,利用甲醛使细胞核内DNA和蛋白质紧密交联,通过超声或酶试剂处理将染色质剪切成200~1 000 bp的小片段,利用特异性抗体沉淀与靶标蛋白结合的DNA,最后解交联并纯化DNA片段[6].虽然ChIP技术应用日趋广泛,但ChIP试验步骤繁琐,多个因素限制了ChIP的效率[7].其中超声破碎条件和免疫沉淀效率是影响该试验能否成功的关键因素.样品量、破碎时间、功率及破碎强度等均能影响超声破碎效率[8,9].Ricardi et al[10]以西红柿为材料,探索不同功率对染色质片段大小的影响,结果显示功率为20%时染色质片段最小最集中.与其他植物相比,拟南芥ChIP方法研究较为深入.张丽丽等[11]较系统地探索了超声破碎仪的破碎时间、功率、间隔时间对拟南芥染色质片段大小的影响.李东明等[12]利用另一型号超声破碎仪,优化了拟南芥野生型和突变体幼苗的ChIP方法.但是不同超声破碎仪器的条件需要重新设定和优化,并且不同植物其破碎条件也不尽相同.此外,抗体的亲和性和用量也是限制免疫沉淀效率的重要因素[13],因此不同样品量对不同抗体的用量需要进一步确定.
植物染色质构象变化参与调控植物的发育、衰老和胁迫响应过程,组蛋白修饰作为一种重要的染色质重塑机制之一,对基因的表达和抑制具有重要的调控作用[14].利用ChIP技术可以研究特定基因以及全基因组范围的组蛋白修饰的变化[6].本试验以拟南芥成熟莲座叶为材料,比较和优化不同超声破碎仪器的破碎条件,同时探索了组蛋白H3第9位赖氨酸乙酰化(H3K9ac)抗体的用量对免疫效率的影响.利用上述最适的超声破碎仪条件和H3K9ac抗体用量,以水稻旗叶为材料进行ChIP试验,获得的DNA片段可以成功用于后续的实时定量PCR(ChIP-qPCR)和高通量测序(ChIP-seq)分析.
1 材料与方法
1.1 材料
1.1.1 植物材料 植物材料是在人工气候室培养的野生型拟南芥(ArabidopsisthalianaL.Columbiaecotype)和水稻日本晴品种(OryzasativaL. cv. Nipponbare).
拟南芥生长条件为:温度22 ℃,相对湿度60% RH,光照时间13 h,黑暗时间11 h.选取抽薹后完全展开的莲座叶(约7周)作为试验材料.水稻生长条件为:温度28~32 ℃,光照时间16 h,黑暗时间8 h.水稻小穗完全从叶鞘中抽出时,取其旗叶作为第1周的试验材料,以后每隔1周取材1次,共取6次,分别记作1周、2周、3周、4周、5周、6周.
1.1.2 仪器与试剂 本试验所使用了3种超声破碎仪器,分别为:Bandelin Sonopuls HD 2070, Covaris M220 Focused-ultrasonicator、Bioruptor Plus.其中Bandelin sonopuls HD 2070为探头式超声破碎仪,而其他两种破碎仪器为非接触式超声破碎仪.
荧光定量PCR仪型号:CFX Connect(BioRad).
Microcloth(475855-1RCN)、蛋白酶抑制剂Complete Protease Inhibitor Cocktail(04693116001)购自罗氏公司、抗体H3K9ac(07-352)购自默克密理博公司.
1.2 方法
参考Gendrel et al[15]的方法,对试验条件进行优化.
1.2.1 染色质交联 将0.75~1.50 g拟南芥莲座叶置于装有37 mL的1%甲醛溶液的50 mL离心管中,真空交联15 min,缓慢释放真空.然后加入2.5 mL 2 mol·L-1的甘氨酸溶液,继续抽真空5 min终止交联反应后,再次慢慢释放真空.用40 mL双蒸水洗涤叶片3遍后,将材料上的水吸干置于液氮中快速冷冻,之后可置于-80 ℃冰箱保存,也可以继续进行试验.
1.2.2 细胞核的提取 在液氮中充分研磨叶片,然后转移叶片粉末到装有30 mL提取液1(配方:0.4 mol·L-1蔗糖、10 mmol·L-1Tris-HCl (pH 8)、10 mmol·L-1MgCl2、5 mmol·L-1β-ME、0.1 mmol·L-1PMSF、蛋白酶抑制剂)的50 mL离心管中,在4 ℃下孵育15 min,然后用4层Microcloth过滤至冰上预冷的新的50 mL离心管中.4 ℃,5 720 r·min-1离心20 min,去除上清液.用移液枪吸取1 mL提取液2(配方:0.25 mol·L-1蔗糖、10 mmol·L-1Tris-HCl (pH 8)、10 mmol·L-1MgCl2、1% Triton X-100、5 mmol·L-1β-ME、0.1 mmol·L-1PMSF、蛋白酶抑制剂),缓慢吸打重悬沉淀,将重悬液移入新的1.5 mL离心管中.4 ℃,11 440 r·min-1离心10 min,去除上清液,用300 μL提取液2重悬沉淀.将重悬的溶液缓慢加到装有1.5 mL提取液3(配方:1.7 mol·L-1蔗糖、10 mmol·L-1Tris-HCl (pH 8)、2 mmol·L-1MgCl2、0.15% Triton X-100、5 mmol·L-1β-ME、0.1 mmol·L-1PMSF、蛋白酶抑制剂)的2 mL离心管中,4 ℃,13 210 r·min-1离心1 h.去除上清液,每0.75 g起始叶片用320 μL细胞核裂解缓冲液(配方:50 mmol·L-1Tris-HCl (pH 8)、10 mmol·L-1EDTA、1% SDS、蛋白酶抑制剂)重悬沉淀,后续进行超声破碎.
1.2.3 染色质超声破碎 超声破碎是染色质共沉淀的关键步骤之一,染色质片段的大小对染色质免疫共沉淀后期分析具有显著影响,染色质片段太小或者太大会导致后期PCR分析结果呈现假阴性或假阳性,同时染色质片段太大不利于测序分析[16].超声破碎后染色质片段约200~1 000 bp,不同的超声破碎仪器、破碎条件和样品都会影响破碎的效率[17].本研究对3种超声破碎仪器的破碎条件进行探索,超声破碎仪器和条件设置如下:
1、超声破碎仪Bandelin Sonopuls HD 2070,我们设置以下2组条件进行探索:(1)6次×10 s、40% duty cycle、20% power,间隔1 min;(2)6次×30 s、40% duty cycle、25% power、间隔1 min.
2、超声破碎仪Bioruptor Plus,破碎条件设置为功率High、30 s ON、30 s OFF,超声破碎次数设置为0次、15次、20次、25次、30次.
3、超声破碎仪Covaris M220 Focused-ultrasonicator,根据说明书设置超声条件为10% duty cycle、75 Watts Intensity Peak Incident power、200 cycle per Burst、 7 ℃ bath temperature.设置0~15 min梯度,探索破碎时间对破碎效果的影响.
超声破碎后的样品,4 ℃,11 440 r·min-1,离心5 min,取上清.取5 μL上清液用于琼脂糖凝胶电泳检测破碎片段的大小,其他上清液用于后续的免疫共沉淀试验.
1.2.4 染色质免疫沉淀 取上一步获得的染色质溶液100 μL,用染色质稀释缓冲液(配方:16.7 mmol·L-1Tris-HCl (pH 8)、1.2 mmol·L-1EDTA、1.1% Triton X-100、167 mmol·L-1NaCl)稀释10倍,加入40 μL预装鲑鱼精子的蛋白A琼脂糖凝胶珠(预先用染色质稀释缓冲液清洗3次),4 ℃孵育1~2 h,去除非特异性结合信号.将上述溶液4 ℃,6 438 r·min-1离心2 min,取上清,注意如果多管操作需要合并上清.取85 μL染色质溶液(10% Input)-20 ℃保存,作为对照.各取850 μL染色质溶液分别加入不同用量(1、3、5 μL)的H3K9ac抗体,另有一管不加抗体的作为阴性对照(mock),4 ℃孵育过夜.将孵育过夜的染色质溶液加入40 μL预装鲑鱼精子的蛋白A琼脂糖凝胶珠,4 ℃孵育1~2 h.4 ℃,6 438 r·min-1离心2 min,弃上清.依次加入1 mL的低盐清洗缓冲液(配方:150 mmol·L-1NaCl、0.1% SDS、1% Triton X-100、2 mmol·L-1EDTA、20 mmol·L-1Tris-HCl (pH 8))、高盐清洗缓冲液(配方:500 mmol·L-1NaCl、0.1% SDS、1% Triton X-100、2 mmol·L-1EDTA、20 mmol·L-1Tris-HCl (pH 8))、LiCl清洗缓冲液(配方:0.25 mol·L-1LiCl、1% NP-40、1% DOC、1 mmol·L-1EDTA、10 mmol·L-1Tris-HCl (pH 8))清洗凝胶珠,每次4 ℃孵育5 min后,4 ℃,6 438 r·min-1离心2 min,弃上清.然后用1 mL的TE Buffer清洗凝胶珠2次,每次4 ℃孵育5 min后,4 ℃,6 438 r·min-1离心2 min,弃上清.加入250 μL的65 ℃预热洗脱缓冲液,短暂涡旋,置于加热快65 ℃,500 r·min-1孵育15 min.室温,6 438 r·min-1离心2 min,转移上清液至新的离心管中.重复洗脱1次,合并2次的洗脱液.取出-20 ℃保存的Input样品冰上融化后加入洗脱液至500 μL.
1.2.5 DNA纯化 在上述洗脱溶液和Input样品中加入20 μL的5 mol·L-1NaCl溶液,65 ℃孵育过夜.在样品中分别加入10 μL的0.5 mol·L-1EDTA溶液、20 μL的1 mmol·L-1Tris-HCl溶液和1 μL的20 g·L-1蛋白酶K,45 ℃孵育1 h.然后利用DNA回收试剂盒(天根,DP214-03)回收纯化DNA.
1.2.6 免疫效率分析 通过普通PCR和实时定量PCR检测不同抗体用量对免疫效率的影响.普通PCR体系为:2 μL的DNA样品、2×PCR mixture、0.5 μL的10 μmol·L-1正反向引物、加无菌水至总体积20 μL;实时定量PCR体系为:7.5 μL的Bestar SYBR Green qPCR Mastermix(DBI)、0.5 μL的10 μmol·L-1正反向引物、2 μL的DNA样品、总体积为15 μL.其中Input样品稀释为1%后使用,拟南芥的ACT7(AT5G09810)基因的正向引物序列:CGTTTCGCTTTCCTTAGTGTTAGCT,反向引物序列:AGCGAACGGATCTAGAGACTCACCTTG.水稻的ACT(Os11g0163100)正向引物:TGCGTCAGGAATTCAGAACCA,反向引物:AGCACCACGAACCTTGACCAT.
2 结果与分析
2.1 不同超声破碎仪器的超声破碎条件的探索
2.1.1 Bandelin Sonoplus HD2070破碎时间的探索 以种植7周的拟南芥成熟莲座叶为材料(图1-A),根据文献[18]将Bandelin Sonoplus HD 2070破碎条件设为6次×10 s、40% duty cycle、20% power,间隔1 min,即破碎总时间为7 min,破碎片段的条带比较弥散,主带在750~1 000 bp之间,而且2 000 bp以上还有比较明显的弥散条带(图1-B),因此,需要进一步加大功率并且延长破碎时间.设置破碎条件为6次×30 s、40% duty cycle、25% power、间隔1 min,即破碎总时间为9 min,在这个条件下破碎片段电泳条带比较集中,整体片段小于1 000 bp,而且主带约500 bp(图1-B),较为理想.
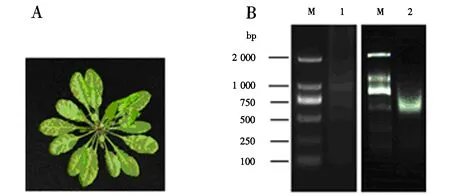
A:拟南芥莲座叶表型;B:M,DNA marker DL2000;1:超声破碎条件6×10 s、40% duty cycle、20% power,间隔1 min;2:超声破碎条件6×30 s、40% duty cycle、25% power,间隔1 min.图1 Bandelin Sonoplus HD2070超声破碎时间的探索Fig.1 Exploring for sonication time of Bandelin Sonoplus HD2070
2.1.2 Bioruptor Plus破碎时间的探索 将Bioruptor Plus的破碎条件设为功率High、30 s ON、30 s OFF,超声破碎次数分别设置为0、15、20、25、30次,即破碎时间分别为0、7.5、10、12.5、15 min,探索超声破碎时间长度,如图2所示,在破碎15次(7.5 min)以后基本上能够达到主带约500 bp,随着破碎的循环数增多,破碎片段的主带略微下移,但在不同破碎时间条件下,DNA片段差异不明显,即条带均呈弥散型,说明DNA片段均一性较差,将影响后续qPCR或测序效率.
2.1.3 Covaris M220 Focused-ultrasonicator破碎时间的探索 根据说明书设置Covaris M220 Focused-ultrasonicator的破碎条件优化破碎时间,即超声条件为10% duty cycle、75 Watts Intensity Peak Incident power、200 cycle per Burst、7 ℃ bath temperature,如图3所示,0~12 min随着破碎时间的加长,主带越明显,大片段逐渐减少,在破碎12 min后获得约500 bp且非常集中的主带,在超声破碎15 min后主带片段相较于12 min的条带片段更小,但是亮度更弱,说明片段的均一性变差,因此破碎12 min为最佳时间.

M:DNA marker DL2000;1~5:破碎次数分别为0、15、20、25、30次.图2 Bioruptor Plus超声破碎时间的探索Fig.2 Exploring for sonication time of Bioruptor Plus
由于厂家设计的差异,不同超声破碎仪器可设置参数存在差异,不同仪器的不同参数具有不可比较性.我们根据已有的研究,基于3种仪器相应较优的设定条件下,比较了它们获得理想片段所需破碎总时间的差异,并且比较了所得条带的均一性.以上结果表明,3种型号超声破碎仪器都可以获得所需大小的染色质片段.Bandelin Sonoplus HD2070破碎到500 bp片段的理论总操作时间为9 min,但是结果的稳定性较差(结果未显示).Bioruptor Plus达到目标片段大小的理论总操作时间为7.5 min,但是条带呈弥散状,均一性较差,即DNA片段大小差异较大,不利于后续免疫试验.而Covaris M220获得理想片段的时间为12 min,条带很集中,均一性好.Bandelin Sonoplus HD2070为探头式超声破碎仪器,容易造成样品污染,操作者和外界环境容易影响结果,Bioruptor Plus与Covaris M220是非接触式超声破碎仪,更加便于操作且稳定性较强.虽然Covaris M220的理论总时间最长,但是操作简便,且获得的目的片段最为集中,均一性最好,基于操作的简便性和和获得的片段的均一性、稳定性,推荐使用Covaris M220.
2.2 抗体用量对免疫效率的影响
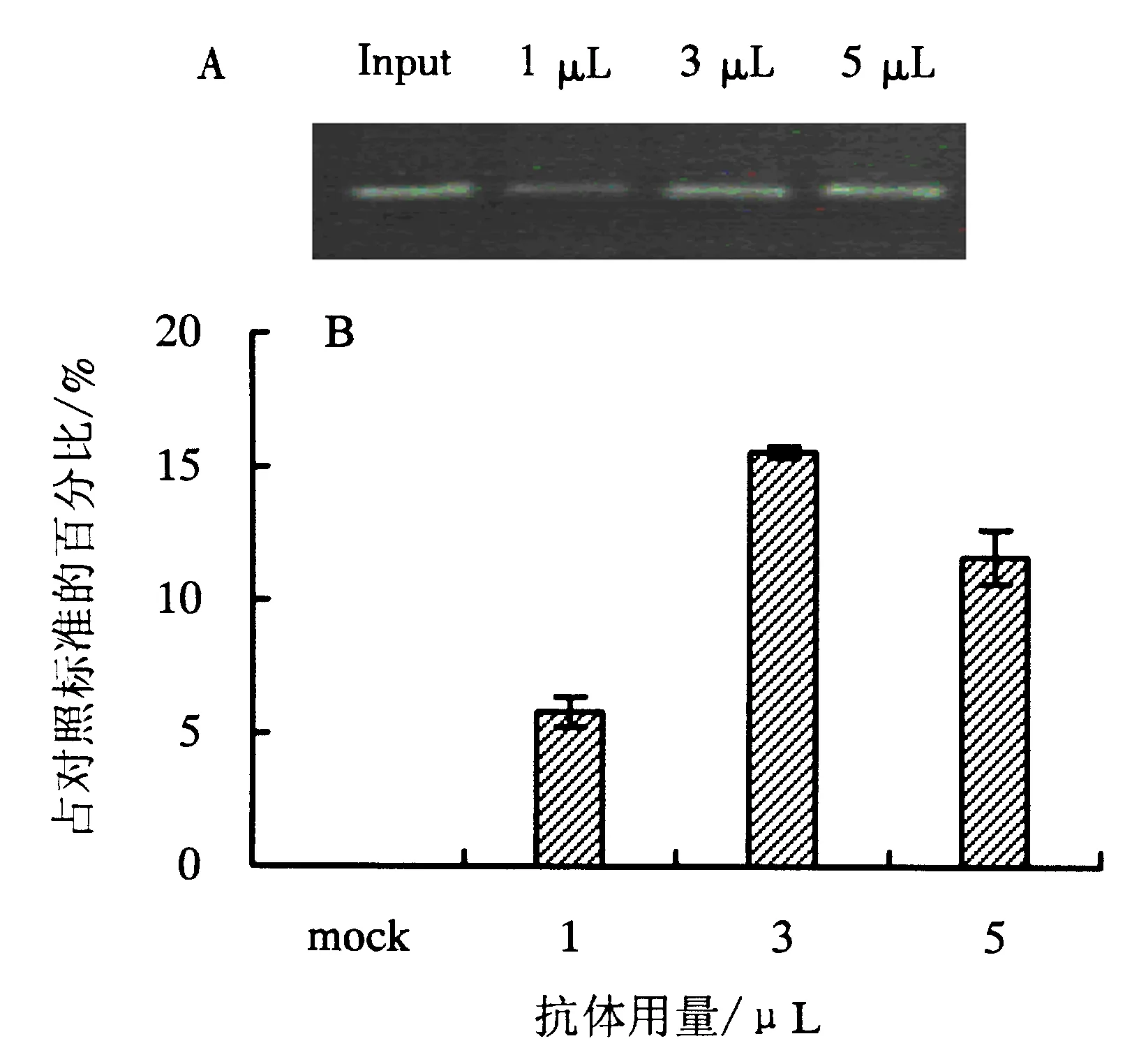
ACT7基因作为被检测基因;A:普通PCR检测不同用量的抗体的免疫结果;Input:阳性对照;B:实时定量PCR检测不同用量抗体的免疫结果;mock:阴性对照.图4 不同用量的H3K9ac抗体对免疫沉淀效率的影响Fig.4 The effect of different doses of H3K9ac antibody on immunoprecipitation efficiency
样品的浓度和抗体的亲和性都会影响免疫的结果[19],一般选择商业化的ChIP级别的抗体,此外,需要根据自己的样品浓度确定抗体用量.本研究以组蛋白H3K9ac抗体为例,通过半定量和实时定量PCR检测不同用量(1、3、5 μL)抗体对拟南芥ACT7基因上H3K9ac富集的影响,如图4所示,利用3 μL的抗体免疫共沉淀后ACT7上H3K9ac的富集水平高于1和5 μL,因此3 μL的H3K9ac抗体是用于相应起始量样品的最佳抗体用量,即约0.25 g的拟南芥叶片使用3 μL的H3K9ac抗体.
2.3 不同衰老程度的水稻旗叶超声破碎条件的比较
根据上述优化的超声破碎条件,选择Covaris M220 Focused-ultrasonicator超声仪进行后续染色质片段的破碎.以不同衰老程度的水稻旗叶为材料(图5),起始样品量都是1.5 g,用细胞核裂解液重悬细胞核沉淀,超声条件设置与拟南芥一致,需要将破碎时间延长至25 min才能获得集中在500 bp以下的片段(图6).不同衰老时期的样品的超声破碎时间并没有明显差距,如图7所示,6个衰老时期的样品主带都集中于250 bp附近.

1~6周:抽穗后1,2,3,4,5,6周的水稻旗叶.图5 不同衰老程度水稻叶片表型Fig.5 Phenotypes of rice flag leaves at different senescence stages
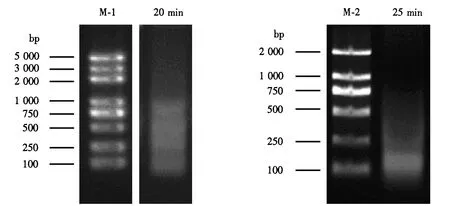
M-1:DNA marker DL2000 plus;M-2:DNA marker DL2000;破碎时间:20 min,25 min.图6 水稻样品Covaris M220 Focused-ultrasonicator超声破碎时间探索Fig.6 Exploring for sonication time of Covaris M220 Focused-ultrasonicator for rice samples

M:DNA marker Trans 2000 plus;1-6:抽穗后1、2、3、4、5、6周的水稻旗叶.图7 不同衰老程度旗叶的破碎结果Fig.7 The sonication result of rice flag leaves at different senescence stages
2.4 水稻旗叶染色质免疫共沉淀结果检测

mock:阴性对照.图8 水稻旗叶中H3K9ac抗体的免疫效率Fig.8 The immunoprecipitation efficiency of H3K9ac antibody in rice flag leaves
根据3.2的抗体用量与起始样品的比例,选取0.25 g第2周水稻叶片,以3 μL的H3K9ac为抗体进行免疫共沉淀,通过实时定量PCR检测发现ACT的H3K9ac富集水平较高(图8).将DNA样品送至诺禾公司进行测序前的质量检测显示免疫后的DNA样品主峰集中在100~500 bp,样品浓度达到0.5 ng·μL-1以上,总量也达到0.05 μg以上,符合建库要求,可进一步测序(表1).说明拟南芥的抗体用量与起始样品的比例也适用于水稻.
3 讨论
超声破碎是染色质免疫共沉淀的关键步骤之一,但不同材料对超声破碎条件的需求不同,不同超声破碎仪器的条件也不同.目前,大部分植物的染色质免疫共沉淀方案都是以幼嫩组织为材料,本研究以双子叶模式植物拟南芥成熟莲座叶为材料,并对非接触式和探头式两种主要类型的不同超声破碎仪器包括Bandelin Sonopuls HD2070、Bioruptor Plus、Covaris M220 Focused-ultrasonicator的破碎条件进行了探索,其中Bandelin Sonopuls HD2070为探头式超声破碎仪,存在以下缺点:(1)操作过程中需要避免探头与管壁接触,并且严格控制探头与液面的距离,对操作者的要求较高,更换样品需要较长时间.(2)直接接触样品,每个样品之间需要进行探头的清洗,容易造成样品污染而且.Covaris M220 Focused-ultrasonicator破碎仪器为非接触式超声破碎仪,操作更简单,不容易受到人为因素的影响,与Bioruptor Plus相比,使用Covaris M220超声破碎获得的DNA片段均一性更好,因此我们推荐使用Covaris M220 Focused-ultrasonicator仪器.

表1 DNA质量检测结果Table 1 The result of DNA quality detection
与前人相比,本研究不仅探索了多种超声破碎仪器的破碎条件,而且同时对双子叶模式植物和单子叶模式植物ChIP方法进行了优化.不同的材料可能会影响超声破碎的条件,因此,以Covaris M220 Focused-ultrasonicator仪器对单子叶模式植物水稻旗叶的染色质超声破碎条件进行探索.研究表明,水稻旗叶所需要的破碎时间更长,这可能是由于水稻叶片纤维化和硅质化程度更强、染色质长度更长,所以需要的破碎强度更大.总的来说,针对不同的植物材料和超声破碎仪器,在进行免疫共沉淀之前都需要对试验样品的破碎条件进行摸索,原则上来说超声破碎的功率不宜过大,可以适当的调整超声破碎的时间.
免疫共沉淀是染色质免疫共沉淀能否成功的决定性步骤,抗体起到关键性的作用,最好选择商业化或者在已经发表的文献中确认可以使用的抗体,对于未检测过的抗体最好使用IP/IHC/ICC进行检测[19].另外,不同抗体对表面抗原的亲和性不同,部分抗体对染色质溶液中的抑制因子比较敏感,因此需要对抗体的用量和染色质溶液的比例进行探索[20].本研究以转录活化信号H3K9ac抗体(默克密理博公司),进行抗体用量的探索,确定了相应起始量的样品对应的抗体使用量为0.25 g的拟南芥叶片使用3 μL的H3K9ac抗体(货号:07-352).染色质溶液的稀释程度可能会影响抗体的亲和性,因此,推荐用相应体积的最终染色质溶液进行免疫共沉淀.在水稻中用与拟南芥相同的抗体量进行免疫共沉淀,可以得到有效的阳性富集,因此,在拟南芥抗体的用量可以适用于水稻.对于不同的抗体,建议在免疫前检测所需抗体用量,避免信号太低以及抗体的浪费.
[1] ORLANDO V. Mapping chromosomal proteinsinvivoby formaldehyde-crosslinked-chromatin immunoprecipitation[J]. Trends in Biochemical Sciences, 2000,25(3):99-104.
[2] GADE P, KALVAKOLANU D V. Chromatin immunoprecipitation assay as a tool for analyzing transcription factor activity[J]. Methods in Molecular Biology, 2012,809:85-104.
[3] CAREY M F, PETERSON C L, SMALE S T. Chromatin immunoprecipitation (ChIP)[J/OL]. Cold Spring Harbor Protocols, 2009,4(9).doi:10.1101/pdb.prot5279.
[4] YAMAGUCHI N, WINTER C M, WU M, et al. Protocol: Chromatin immunoprecipitation fromArabidopsistissues[J/OL]. Arabidopsis Book, 2014,12.http://www.epigenome-noe.net/researchtools/protocol.php?protid=13.
[5] 孔令雯,董竞成.ChIP-chip及ChIP-seq的应用现状及其发展前景[J].国际检验医学杂志,2014,35(10):1 309-1 312.
[6] LIN X, TIRICHINE L, BOWLER C. Protocol: Chromatin immunoprecipitation (ChIP) methodology to investigate histone modifications in two model diatom species[J/OL]. Plant Methods, 2012,8(48).http://www.plantmethods.com/content/8/1/48.
[7] COLLAS P. The current state of chromatin immunoprecipitation[J]. Molecular Biotechnology, 2010,45:87-100.
[8] SPENCER V A, SUN J, LI L, et al. Chromatin immunoprecipitation: a tool for studying histone acetylation and transcription factor binding[J]. Methods, 2003,31(1):67-75.
[9] ORLANDO V, STRUTT H, PARO R. Analysis of chromatin structure byinvivoformaldehyde cross-linking[J]. Methods, 1997,11(2):205-214.
[10] RICARDI M M, GONZALEZ R M, IUSEM N D. Protocol: fine-tuning of a chromatin immunoprecipitation (ChIP) protocol in tomato[J/OL]. Plant Methods, 2010,6(11).http://www.plantmethods.com/content/6/1/11.
[11] 张丽丽,徐碧玉,刘菊华,等.染色质免疫共沉淀超声波破碎条件的研究[J].中国农学通报,2012,28(30):208-212.
[12] 李东明,宋渊,安黎哲.植物染色质免疫共沉淀方法[J].草业科学,2014,31(4):659-667.
[13] DAS P M, RAMACHANDRAN K, VANWERT J, et al. Chromatin immunoprecipitation assay[J]. BioTechniques, 2004,37(6):961-969.
[14] 黄冬梅,任育军,缪颖.植物衰老过程中的表观遗传学调控[J].植物生理学报,2014,50(9):1 293-1 304.
[15] GENDREL A, LIPPMAN Z, MARTIENSSEN R, et al. Profiling histone modification patterns in plants using genomic tiling microarrays[J]. Nature Methods, 2005,2(3):213-218.
[16] APARICIO O, GEISBERG J V, SEKINGER E, et al. Chromatin immunoprecipitation for determining the association of proteins with specific genomic sequences in vivo[J]. Current Protocols in Molecular Biology, 2005,21(3):1-33.
[17] SALEH A, ALVAREZ-VENEGAS R, AVRAMOVA Z. An efficient chromatin immunoprecipitation (ChIP) protocol for studying histone modifications inArabidopsisplants[J]. Nature Protocols, 2008,3(6):1 018-1 025.
[18] AUFSATZ W. Chromatin immunoprecipitation protocol to analyze histone modifications inArabidopsisthaliana(PROT12)[J/OL]. Epigenome Network of Excellence, 2005.http://www.epigenome-noe.net/researchtools/protocol.php_protid=13.html.
[19] NISHIKORI S, HATTORI T, FUCHS S M, et al. Broad ranges of affinity and specificity of anti-histone antibodies revealed by a quantitative peptide immunoprecipitation assay[J]. Journal of Molecular Biology, 2012,424(5):391-399.
[20] HARING M, OFFERMANN S, DANKER T, et al. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization[J/OL]. Plant Methods, 2007,3(11).http://www.plantmethods.com/content/3/1/11.
