类风湿关节炎血清1,25-二羟维生素D3水平与肺动脉压的关系
2018-06-06温鸿雁
刘 洋,温鸿雁
(山西医科大学第二医院风湿免疫科,太原 030001;*通讯作者,E-mail:wenhongyan0509@aliyun.com)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性、对称性、侵袭性关节炎为主要特征的系统性自身免疫性疾病,除关节外,可累及皮肤、眼、肾、肺、心脏等多个器官[1]。肺动脉高压(pulmonary arterial hypertension,PAH)是RA患者一种严重并发症,进行性肺动脉压升高会导致心力衰竭、呼吸衰竭等,易被忽视,病情进展快,预后差。目前流行病学调查显示RA-PAH的患病率仅有用超声心动图估计的数据,范围0.8%-27.5%[2,3]。越来越多的证据表明[4],自身免疫和炎性反应参与RA-PAH的发病,而且在某些情况下免疫调节治疗可以延缓PAH的进展,改善患者的临床症状及预后。我们前期研究已发现:维生素D可通过调节免疫系统延缓甚至逆转RA骨破坏[5-10]。同时有研究表明维生素D缺乏会激活肾素-血管紧张素-醛固酮系统(RAAS),RAAS的激活与肺动脉高压相关联,维生素D缺乏会增加肺动脉压力[11]。那么,维生素D缺乏是否对RA-PAH的发生产生潜在风险,目前尚无明确定论。维生素D的主要循环形式是通过1,25-二羟维生素D3[1,25(OH)2D3]来实现的,临床常以测量血清1,25(OH)2D3来反映维生素D的水平。为此,收集300例RA患者血清1,25(OH)2D3水平与肺动脉压进行分析,并探讨其临床意义。
1 对象与方法
1.1 研究对象
收集山西医科大学第二医院风湿免疫科2015-09~2016-12收治的300例RA患者的临床、实验室及影像学资料。均符合美国风湿病学会类风湿关节炎分类标准[12]。所有病例均已接受非甾体抗炎药、慢作用抗风湿药物等正规治疗,均无糖皮质激素、活性维生素D服用史。其中,单纯RA 213例,男45例,女168例,年龄23-85岁,病程1-40年;RA合并肺部受累67例,男25例,女42例,年龄6-81岁,病程0.1-40年,按肺部病变情况分为间质性肺炎33例(11.0%)、细菌/病毒性肺炎22例(7.33%)、慢性阻塞性肺疾病5例(1.67%)、肺结节4例(1.33%)、胸腔积液3例(1.0%);RA合并心脏受累20例,男7例,女13例,年龄42-81岁,病程0.5-32年,按心脏病变情况分为心律失常11例(3.67%)、冠心病5例(1.67%)、瓣膜病2例(0.7%)、心包积液1例(0.3%)、先心病(房间隔缺损)1例(0.3%)。本研究经过山西医科大学第二医院伦理委员会批准同意,所有参与者均签署知情同意书。
1.2 研究方法
回顾性分析300例RA患者的临床资料,包括年龄、性别、病程、疾病活动度(DAS28)、魏氏法检测的红细胞沉降率(erythrocyte sedimentation rate,ESR)、ELISA法检测的1,25(OH)2D3。其中1,25(OH)2D3<20 ng/ml称为维生素D缺乏,20 ng/ml≤1,25(OH)2D3<30 ng/ml称为维生素D不足,30 ng/ml≤1,25(OH)2D3<100 ng/ml称为维生素D理想水平[13]。采用经胸超声心动图评价肺动脉压,超声心动图由经验丰富超声心动图专家根据美国超声学会指南[14]操作。使用多普勒彩色超声心动图测量患者三尖瓣反流速度>2.8-2.9 m/s,也就是相应的肺动脉收缩压在36 mmHg(1 mmHg=0.133 kPa)左右,假定右房的压力3-5 mmHg,提示为肺动脉收缩压即右心室收缩末压力升高[15]。
1.3 统计学处理
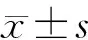
2 结果
2.1 类风湿关节炎患者合并症临床资料比较
合并肺动脉高压RA患者16例(5.3%),分别肺间质纤维化9例(3.0%),肺部感染1例(0.3%),慢性阻塞性肺疾病1例(0.3%),先心病(房间隔缺损)1例(0.3%),心律失常1例(0.3%),病因不明3例(1.0%),肺动脉压波动在36-59 mmHg。肺部受累RA组肺动脉压明显高于单纯RA组(t=-2.573,P=0.013),但心脏受累RA组与单纯RA组肺动脉压相比差异无统计学意义(t=-1.895,P=0.079)。三组1,25(OH)2D3平均水平均缺乏,但两两比较差异均无统计学意义(P>0.05,见表1)。
2.2 1,25(OH)2D3水平与肺动脉压关系
三组患者总体分析发现1,25(OH)2D3与肺动脉压之间存在负相关(r=-0.217,P<0.05)。进一步分组后发现肺部受累RA组1,25(OH)2D3与肺动脉压存在明显负相关(r=-0.447,P<0.05,见表2),而心脏受累RA组和单纯RA组1,25(OH)2D3与肺动脉尽管有数值上的负相关,但均无统计学意义。


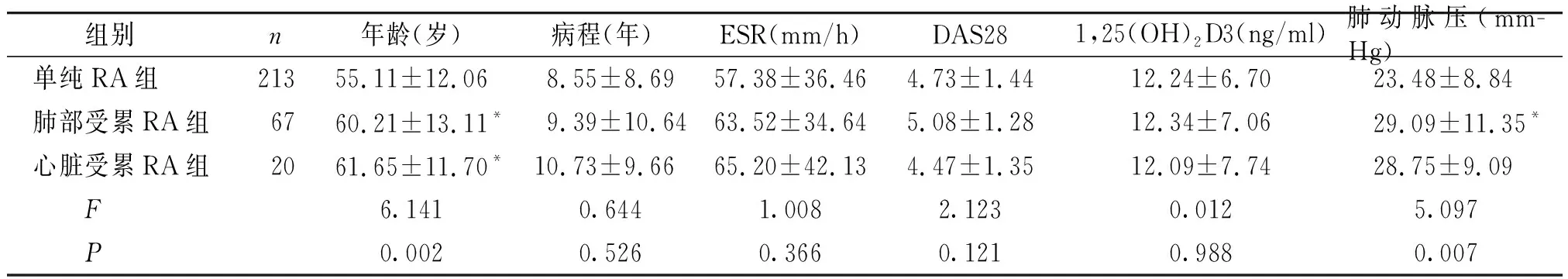
组别n年龄(岁)病程(年)ESR(mm/h)DAS281,25(OH)2D3(ng/ml)肺动脉压(mm-Hg)单纯RA组21355.11±12.06 8.55±8.6957.38±36.464.73±1.4412.24±6.70 23.48±8.84肺部受累RA组6760.21±13.11* 9.39±10.6463.52±34.645.08±1.2812.34±7.06 29.09±11.35*心脏受累RA组2061.65±11.70*10.73±9.6665.20±42.134.47±1.3512.09±7.74 28.75±9.09 F6.1410.6441.0082.1230.0125.097 P0.0020.5260.3660.1210.9880.007
与单纯RA组比较,*P<0.05
表2维生素D与肺动脉压的相关性分析
Table2Correlationbetween1,25(OH)2D3andpulmonaryarterialpressureinRApatients

分组rtP单纯RA组-0.154-1.4870.141肺部受累RA组-0.447-2.7860.009心脏受累RA组-0.170-0.5720.579
3 讨论
本研究中PAH患者16例,肺动脉压在36-59 mmHg,主要为轻度,与国外报道RA患者PAH以轻度为主相符[2]。PAH多见于结缔组织病,如系统性硬化、系统性红斑狼疮、混合性结缔组织病等[3],PAH是RA少见的并发症。一般认为是RA继发肺纤维化和肺血管炎进而导致血管内、中膜增厚,肺动脉压力升高[16],此外,类风湿因子、抗核抗体及IgG抗体等在肺血管壁的沉积提示免疫反应也发挥了重要的作用[17],这些机制已被Shah等[18]临床证实。
血清1,25(OH)2D3水平低被认为是PAH可能的危险因素,一些横断面研究也发现1,25(OH)2D3水平降低与心肺功能下降有关[19]。但是国内外仅有2篇文献[20,21]明确指出1,25(OH)2D3水平与肺动脉高压呈负相关(r=-0.29,P=0.053;r=-0.50,P<0.05),这与本研究结果一致,但均为与系统性硬皮病相关。本研究发现RA患者1,25(OH)2D3水平与肺动脉压呈负相关(r=-0.217,P<0.05)。对所收集病例以是否有肺部受累、心脏受累分类分析后发现,血清1,25(OH)2D3水平与肺动脉压有不同程度的相关性,其中肺部受累RA组相关性最大,这与文献报道一致[22,20]。Artaza等[23]研究证实了这点,同时也发现补充1,25(OH)2D3可使间充质干细胞低表达促纤维化因子如转化生长因子β(TGF-β)和纤溶酶原激活物抑制剂;高表达抗纤维化因子如骨形态发生蛋白-7,TGF-β1拮抗剂,基质金属蛋白酶、胶原蛋白分解剂等。越来越多证据表明,RA患者心血管疾病的发病风险较正常人群增高,是RA患者死亡的主要原因[24],但心脏受累RA组未发现血清1,25(OH)2D3水平与肺动脉压有统计学意义的相关性,推测在心脏受累水平上,1,25(OH)2D3可能无明显改善肺动脉高压的作用,但是仍需更多样本及实验探讨。
目前,用于PAH治疗的靶向药物目前主要有3类:前列环素及其类似物、5型磷酸二酯酶抑制剂及内皮素受体拮抗剂,但治疗远期效果不佳,预后差[25]。Mirdamadi等[22]指出PAH患者补充维生素D治疗可以改善6 min步行试验结果,从259.9 m提高到330.5 m。大鼠模型中也发现:1,25(OH)2D3早期干预可延缓肺动脉高压大鼠肺动脉平均压的升高,改善肺血流动力学、肺血管重塑和右室肥厚,减缓肺动脉高压的发展[26]。
综上,我们发现RA患者血清1,25(OH)2D3水平与肺动脉压有一定的关系,尤其对于合并肺部受累RA患者,提示对于此类患者,应予以补充维生素D的治疗。本研究的局限性在于没有对季节、地区、饮食、户外活动的时间等因素进行调整;其次,由于所收集病例数以及疾病种类的限制,进一步的研究仍需扩大样本以明确。
参考文献:
[1] 李莉,杨建一,彭芸.类风湿关节炎相关基因研究现状[J].山西医科大学学报,2002,33(6):573-575.
[2] Dawson JK, Goodson NG, Graham DR,etal. Raised pulmonary artery pressures measured with doppler echocardiography in rheumatoid arthritis patients[J]. Rheumatology(Oxford),2000, 39 (12):1320-1325.
[3] Yang X, Mardekian J, Sanders KN,etal. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: a systematic review of the literature[J]. Clin Rheumatol,2013, 32 (10):1519-1531.
[4] Rabinovitch M, Guignabert C, Humbert M,etal. Inflammation and immunity in the pathogenesis of pulmonary arterial hypertension[J]. Circ Res,2014, 115 (1):165-175.
[5] 刘丹丹,温鸿雁,李小峰,等.维生素D对自身免疫病骨代谢的影响[J].中华风湿病学杂志,2016,20(2):132-134.
[6] 温鸿雁,罗静,张晓英,等.1,25-二羟维生素D3对初诊类风湿关节炎患者外周血单个核细胞分泌Th17相关细胞因子的影响[J].中华内科杂志,2015,54(4):317-321.
[7] 李金潺,卫丹丹,李小峰,等.维生素D在自身免疫性疾病中的作用[J].中国全科医学,2015,18(18):2184-2187.
[8] 李金潺,温鸿雁,李小峰,等.风湿性疾病患者血清25-羟-维生素D水平及临床意义[J].中华临床医师杂志:电子版,2015,19(9):611-613.
[9] 温鸿雁,罗静,张军锋,等.1,25-二羟维生素D3对初诊类风湿关节炎患者核因子κB受体活化因子配体/骨保护素通路及相关细胞因子的影响[J].中华风湿病学杂志,2014,18(2):100-104.
[10] 卫丹丹,李金潺,李小峰,等.1,25-(OH)2D3在类风湿关节炎发病机制中的研究进展[J].中华风湿病学杂志,2014,18(12):846-848.
[11] Humalda JK, Goldsmith DJ, Thadhani R,etal. Vitamin D analogues to target residual proteinuria: potential impact on cardiorenal outcomes[J]. Nephrol Dial Transplant,2015, 30 (12):1988-1994.
[12] Aletaha D, Neogi T, Silman AJ,etal. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Arthritis Rheum,2010, 62 (9):2569-2581.
[13] 中华医学会儿科学分会儿童保健学组.儿童微量营养素缺乏防治建议[J].中华儿科杂志,2010,48(7):502-509.
[14] Schiller NB, Shah PM, Crawford M,etal. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms[J].J Am Soc Echocardiogr,1989,2(5):358-367.
[15] Rudski LG, Lai WW, Afilalo J,etal. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography[J]. J Am Soc Echocardiogr,2010, 23 (7):685-713.
[16] Panagiotidou E, Sourla E, Kotoulas SX,etal. Rheumatoid arthritis associated pulmonary hypertension: Clinical challenges reflecting the diversity of pathophysiology[J]. Respir Med Case Rep,2017, 20 (20):164-167.
[17] Sadeghi S, Granton JT, Akhavan P,etal. Survival in rheumatoid arthritis-associated pulmonary arterial hypertension compared with idiopathic pulmonary arterial hypertension[J]. Respirology,2015, 20 (3):481-487.
[18] Shah SJ. Pulmonary hypertension[J]. JAMA,2012, 308 (13):1366-1374.
[19] Bogaard HJ, Al Husseini A, Farkas L,etal. Severe pulmonary hypertension: The role of metabolic and endocrine disorders[J]. Pulm Circ,2012, 2 (2):148-154.
[20] Groseanu L, Bojinca V, Gudu T,etal. Low vitamin D status in systemic sclerosis and the impact on disease phenotype[J]. Eur J Rheumatol,2016, 3 (2):50-55.
[21] Atteritano M, Santoro D, Corallo G,etal. Skin involvement and pulmonary hypertension are associated with vitamin D insufficiency in scleroderma[J]. Int J Mol Sci,2016,17:2103.
[22] Mirdamadi A, Moshkdar P. Benefits from the correction of vitamin D deficiency in patients with pulmonary hypertension[J]. Caspian J Intern Med,2016, 7 (4):253-259.
[23] Artaza JN, Norris KC. Vitamin D reduces the expression of collagen and key profibrotic factors by inducing an antifibrotic phenotype in mesenchymal multipotent cells[J]. J Endocrinol,2009, 200 (2):207-221.
[24] Kapetanovic MC, Lindqvist E, Geborek P,etal. Long-term mortality rate in rheumatoid arthritis patients with disease onset in the 1980s[J]. Scand J Rheumatol,2011, 40 (6):433-438.
[25] 樊勇,郝燕捷,张卓莉.结缔组织病相关肺动脉高压自身免疫性炎症及治疗[J].中华临床免疫和变态反应杂志,2015,9(4):318-323.
[26] Mandell E, Powers KN, Harral JW,etal. Intrauterine endotoxin-induced impairs pulmonary vascular function and right ventricular performance in infant rats and improvement with early vitamin D therapy[J]. Am J Physiol Lung Cell Mol Physiol,2015, 309 (12):L1438-1446.
