邻苯二甲酸酯降解菌的筛选、降解特性及土壤修复研究
2018-06-06郭楚玲刘沙沙卢桂宁
杨 婧 ,郭楚玲 ,2,3*,刘沙沙 ,党 志 ,2,卢桂宁 ,2
(1.华南理工大学环境与能源学院,广州 510006;2.工业聚集区污染控制与生态修复教育部重点实验室,广州 510006;3.广东省环境风险防控与应急处置工程技术研究中心,广州 510006)
邻苯二甲酸酯(简称PAEs)是工业常用塑化剂,广泛应用于建筑装饰、化妆品、食品包装和医疗用具等领域[1]。由于PAEs与塑料树脂等并不是以稳定的化学键结合[2-3],且其在环境中不易分解,因此极易在塑料的生产和使用过程中释放进入土壤[4]、水和沉积物[5-6]、大气[7],甚至室内环境中[8],并可通过食物链进入人体[9],对人体造成极大危害[10]。我国环境污染中比较常见且难以降解的PAEs主要为邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)[11-13],这 3种PAEs均被美国环境保护署和中国国家环境监测中心列入优先控制污染物黑名单[1,14]。
PAEs属于持久性有机污染物,在自然环境中的光解和水解速率相当缓慢,而生物降解被认为是环境中PAEs的主要降解途径[13],从而被广泛研究[15-16]。目前,国内外有大量学者从不同环境介质中,如沉积物[17]、活性污泥[18]、污染土壤[19]等筛选 PAEs 降解菌,研究菌株降解特性、底物广谱性、推测PAEs代谢途径等。已报道的PAEs降解菌主要有:假单胞菌(Pseudomonas sp.)[9]、戈登氏菌(Gordonia sp.)[20-21]、壤霉菌(Agromyces sp.)[22]、不动杆菌(Acinetobacter sp.)[23]、红球菌(Rhodococcus sp.)[19,24]等。而近年来,随着农用塑料薄膜的广泛应用,越来越多的PAEs被释放进入农田土壤中[4],甚至有些典型膜覆盖农田土壤中PAEs总含量高达33.36 mg·kg-1,其中DEHP含量达21.31 mg·kg-1,远高于美国土壤PAEs化合物控制标准(DEHP 为 4.35 mg·kg-1)[25]。有研究表明,将 PAEs降解菌添加到污染土壤中可大幅提高土壤中PAEs的降解速率[14,19,26]。而DEHP的化学结构复杂且疏水性强,相比于DMP和DBP更难降解[27],因此,筛选出环境适应性强且有潜力运用到污染土壤修复中的DEHP高效降解菌具有一定的研究意义。
本研究从广州市沥滘污水处理厂活性污泥中分离筛选出一株DEHP高效降解菌。采用16SrRNA序列分析技术对菌株进行分子生物学鉴定,并研究菌株对DEHP的降解特性。通过GC-MS检测DEHP降解的中间产物,推测其降解途径。最后将ASW6D应用到DEHP污染土壤中,研究其对土壤中DEHP的去除效果,为实际污染土壤的生物修复提供理论依据。
1 材料与方法
1.1 实验材料
活性污泥取自广东省广州市沥滘污水处理厂二沉池。
化学试剂:DMP、DBP和DEHP购自Sigma-Aldrich Co.LLC.(中国上海),纯度>99%。实验中其他化学试剂均为分析纯,所有溶剂均为高效液相色谱(HPLC)级。
无机盐培养基(MSM):NaCl(0.75 g·L-1)、NH4NO3(0.5 g·L-1)、FeCl3(0.001 g·L-1)、K2HPO4·3H2O(1 g·L-1)、MgSO4·7H2O(0.4 g·L-1)、CaCl2(1.9 g·L-1),初始pH为7.5~8.0。
营养肉汤培养基(NB):蛋白胨(10 g·L-1)、牛肉提取物(3 g·L-1)、氯化钠(5 g·L-1),pH 为 7.2~7.6。
1.2 实验方法
1.2.1 DEHP高效降解菌的驯化与分离
将新鲜活性污泥25 mL置于250 mL锥形瓶中,加入 75 mL MSM,投加 PAEs混合液(DMP、DBP和DEHP浓度相同)作为碳源,在 30℃、150 r·min-1摇床中振荡培养7 d,然后将25 mL培养液转移到新的培养基中,并在相同条件下培养。PAEs投加浓度为35、70、105、140 mg·L-1,4 周递增一次,共驯化 16 周,得到对PAEs有稳定降解能力的菌液。通过稀释涂布平板法在营养肉汤培养基上对菌液进行筛选,勾取长势良好的单菌落到新鲜MSM中,如此反复直至分离到一株PAEs高效降解菌,命名为ASW6D。将0.5 mL DEHP(20 g·L-1)甲醇溶液加入 250 mL 锥形瓶中,待甲醇挥发后,加入10 mLASW6D菌液与90 mLMSM,30℃、150 r·min-1摇床中振荡培养7 d,连续转接4次得到ASW6D稳定培养液。
1.2.2 菌株ASW6D的形态观察与鉴定
采用平板划线法将ASW6D接种至营养肉汤培养基,30℃下培养3 d,观察菌落特征。使用场发射扫描电镜Merlin对菌株ASW6D的表面形态进行观察。菌株的16SrRNA序列测定委托生工生物工程(上海)股份有限公司完成,并用MEGA 6.06软件构建系统发育树。
1.2.3 菌悬液的制备
将 100 mL 培养液 4000 r·min-1离心 5 min,并用磷酸盐缓冲盐水(PBS,0.1 mol·L-1、pH7.8)洗涤 3次,然后将洗涤液重悬于PBS中并使用紫外分光光度计(UV-2550,Shimadzu,日本)在 600 nm 测量菌悬液吸光度,利用PBS将OD600调至0.3作为后续实验的接种物。
1.2.4 DEHP降解菌降解特性的研究
采用批量平衡试验,测定菌株ASW6D的生长曲线及其降解DEHP的动力学曲线。将2 mL菌悬液接种至18 mL MSM中,DEHP初始浓度为100 mg·L-1,150 r·min-1、30 ℃下避光振荡培养。在 6、12、24、36、48、72、96、144 h 时取样,测定溶液 OD600与 DEHP 的剩余量。为研究菌株对DEHP的降解能力以及环境因素(DEHP初始浓度为100 mg·L-1)对其降解能力的影响,本研究采用单因素实验,按照上述同样的接种培养方式在初始 DEHP 浓度(35~1000 mg·L-1),温度(10、20、30、40 ℃),初始 pH(4、5、6、7、8、9、10、11)下培养3 d后测定溶液OD600与DEHP剩余量,同时设置不接菌作为空白处理组。为研究菌株ASW6D的底物广谱性,分别选择两种环境中常见的PAEs(DMP与DBP)作为唯一碳源进行实验,DMP、DBP初始浓度均为35 mg·L-1,接种培养方式同上。
利用高效液相色谱(Agilent 1260 series)检测溶液中3种PAEs,采用外标法对3种PAEs定量,构建标准曲线(所有R2均在0.999以上)。前处理方法(回收率在85.71%~109.69%之间):在含有20 mL菌液的100 mL锥形烧瓶中,加入20 mL甲醇,超声溶解30 min,提取2 mL溶液过0.22μm微孔过滤膜,后转入色谱瓶待测。色谱条件:色谱柱为Agilent Ecliose XDBC18(150 mm×4.6 mm×2.5μm),流动相为甲醇∶水=90∶10,进样量20μL,柱温30℃,UV检测波长为224 nm。
1.2.5 DEHP降解产物的检测
将2 mL菌悬液接种至18 mL MSM中,DEHP初始浓度为 100 mg·L-1,于 0、12、24、36 h 时取样,用GC-MS(Trace DSQ,Thermo)检测 DEHP 代谢产物。前处理方法:将20 mL乙酸乙酯加入到液体培养物中,超声提取10 min后,在2250 r·min-1下离心5 min,提取上层有机相,重复上述过程两次。将有机相收集一起后旋转蒸发接近干燥,后溶解于2 mL正己烷中,过0.22μm滤膜,将最终溶液转移至色谱瓶中待测,色谱条件同Tang等[16]研究。质谱鉴定的结果与美国国家标准与技术研究所(NIST,Gaithersburg,MD)数据库的标准化合物进行比对。
1.2.6 高效降解菌在DEHP污染土壤中的应用
供试土壤采自广州市穗石村未污染农田土壤,土壤质地为壤土(砂粒54%、粉粒38%、黏粒8%),pH为 6.53,总有机碳 3.78 g·kg-1,总氮 0.31 g·kg-1,总磷0.25 g·kg-1。为了研究降解菌对DEHP污染土壤的修复潜力,以及土著微生物对其降解效果的影响,试验分别设置土壤未灭菌组与灭菌组。未灭菌组:将100 g土壤(过2 mm筛)置于250 mL锥形烧瓶中,加入DEHP丙酮溶液,调节最终浓度为100 mg·kg-1。充分混合后,溶剂蒸发24 h。然后将菌悬液均匀地接种到土壤中,最终浓度为1×107CFU·g-1。灭菌组:将土壤样品在121℃下高压灭菌1 h,后接种菌悬液,在(30±0.5)℃下避光培养。通过添加无菌水使土壤含水量保持在50%。每隔1 d收集土壤样品1 g,通过GC-MS(Trace DSQ,Thermo)测定土壤中残留的DEHP浓度。灭菌与未灭菌组均分别设置空白组。
土壤样品前处理方法:将1.0 g土壤加入玻璃离心瓶中,加入 20 mL 丙酮和己烷(1∶1,V/V)混合液,超声提取10 min,2250 r·min-1离心5 min。重复以上步骤两次。收集有机相,旋转蒸发接近干燥,后溶于10 mL正己烷中。提取2 mL溶液过0.22μm微孔滤膜后转移至色谱瓶待测,检测方法同1.2.5所示。
2 结果与讨论
2.1 DEHP高效降解菌的分离与鉴定
菌株ASW6D在平板上呈乳白色、表面干燥、边缘不整齐、粗糙型菌落(图1a),电镜图上显示其细胞形态成杆状,稍有弯曲(图1b)。PCR扩增16SrRNA基因(1477 bp),GenBank 登录号为 KY888692,基于序列在NCBI上的比对结果,菌株ASW6D与Mycobacterium mucogenicum(NR_042919.1)有很高的相似性(99%)。用MEGA 6.06软件构建的系统发育树如图2,图中ASW6D与Mycobacterium mucogenicum和Mycobacterium sp.亲缘关系最近,由此推断菌株ASW6D属于分枝杆菌属(Mycobacterium sp.)。已有文献报道Mycobacterium sp.可以降解PAEs[28],但更多的是研究其对多环芳烃的降解[29-30]。
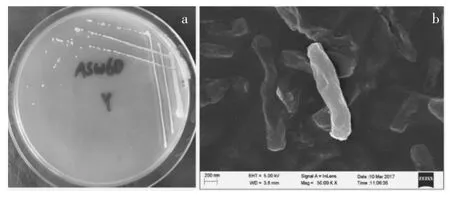
图1 菌株ASW6D的形态特征Figure 1 Morphological properties of the colonies of strain ASW6D(a)coloby(b)cell imageof SEM
2.2 菌株ASW6D对DEHP降解能力的研究
ASW6D可以将DEHP作为唯一碳源迅速生长,生长延滞期很短,6 h时开始进入对数期,24 h时OD值达到最高,同时 DEHP(100 mg·L-1)的去除率达89.34%,随后逐渐进入衰退期,DEHP最终基本被降解完(1.41%)(图3)。为进一步研究菌株ASW6D对DEHP的降解能力,采用不同初始浓度(35~1000 mg·L-1)的DEHP作为唯一的碳源。实验结果显示(图4),当DEHP浓度不高于500 mg·L-1时,3 d内降解率可达80%以上,当DEHP浓度增加至1000 mg·L-1时,降解率降低至30.44%。已有的报道中,分枝杆菌YCRL4 培养 24 h 后对 DEHP(50 mg·L-1)去除率不到50%[28],Pesudomonas sp.XB[18]和 Acinetobacter sp.SN13[23]培养 24 h 后对 DEHP(100 mg·L-1)的去除率分别为70%和40%。相比较以上几种菌株,ASW6D对DEHP具有更好的降解效果。

图2 菌株ASW6D系统发育树Figure2 Phylogenetic tree of strain ASW6D
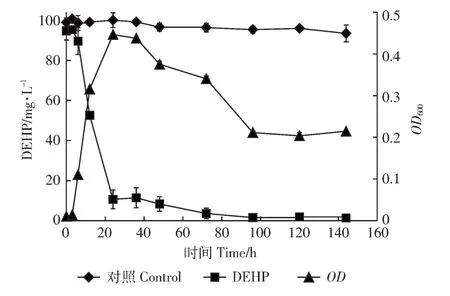
图3 菌株ASW6D利用DEHP(100 mg·L-1)的生长降解曲线Figure 3 The DEHP(100 mg·L-1)degradation curve and the growth curve of strain ASW6D

图4 不同DEHP初始浓度对DEHP降解的影响Figure 4 Effectsof different initial DEHPconcentrationson DEHPbiodegradation
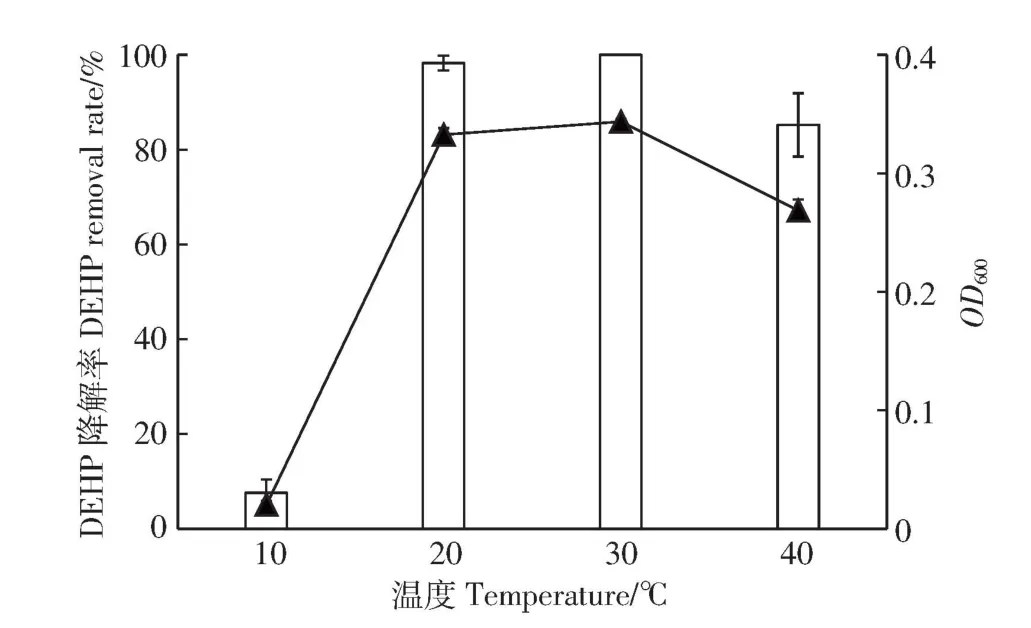
图5 温度对菌株ASW6D降解DEHP的影响Figure 5 Effects of temperature on DEHPdegradation by ASW6D
2.3 温度和pH对DEHP降解的影响
微生物主要通过分泌相关酶来分解有机物,温度和pH会影响酶的活性,从而影响微生物的生长与对有机物的降解能力[31]。从图5和图6可看出,菌株ASW6D在10℃和pH 11条件下仅有些许生长,而在20~40℃条件下,DEHP 3 d内的降解率可达85%以上;在pH 5~10条件下,降解率均大于77%。其中当温度为30℃和pH为8时,DEHP降解率高达98%以上,同时OD600值也达到0.33以上。由此可看出ASW6D的最适温度和pH值分别为30℃和8。
据文献报道,Mycobacterium sp.YC-RL4可在20~40 ℃、pH 7~9 下高效降解 DEHP[28],Acinetobacter sp.SN13的适宜温度和pH范围为25~35℃和6~9[23],Gordonia sp.HS-NH1的则为30℃和7~8[21]。对比以上菌株,ASW6D能够在相当宽的温度(20~40℃)和pH(5~10)范围下高效降解DEHP,更适合应用于污染环境的生物修复。

图6 pH对菌株ASW6D降解DEHP的影响Figure 6 Effects of pH on DEHPdegradation by ASW6D
2.4 菌株ASW6D对DMP和DBP的降解
菌株ASW6D在DMP、DBP初始浓度为35 mg·L-1时的降解曲线如图7所示,24 h时,ASW6D对DMP和DBP去除率为86.64%。对比上文DEHP的降解曲线,高效降解菌ASW6D可以快速利用短链PAEs——DMP,而对于中链PAEs——DBP和长链PAEs——DEHP的降解速度则相对较慢,该结果与先前的报道很接近[32-33]。我国环境污染中的酞酸酯主要为DMP、DBP和DEHP[11-13,34],而菌株ASW6D不仅可以高效降解DEHP,还可快速降解DMP和DBP。由此可见,ASW6D在PAEs污染环境的实际修复中具有一定的优势。
2.5 DEHP降解产物的检测与代谢路径的推测
为推测ASW6D对DEHP的降解途径,分别检测降解过程中在 0、12、24、36 h DEHP 的降解产物。DEHP降解过程中主要检测出3种物质(图8),通过与谱库(图9中d~f)的比对可以确定3种物质分别为DEHP、DBP和PA。刚开始只检测到DEHP,而在12、24、36 h时DEHP的含量逐渐降低,同时开始检测到DBP和PA,由此可推断出ASW6D降解DEHP的主要中间产物为DBP和PA。
常见的DEHP生物降解过程主要是通过酯的水解作用,将DEHP转化为邻苯二甲酸单-2-乙基己酯(MEHP),通过水解酶进一步水解为PA,最终为PA的矿化过程[3,22,28,35-36],很少有文献报道其降解过程中会产生中间产物DBP。根据GC-MS的检测结果与相关文献,推测ASW6D作用下DEHP的生物降解过程为:先通过β-氧化逐渐缩短DEHP侧链,生成DBP,DBP可能会继续通过β-氧化缩短侧链生成短链PAEs,然后再水解生成PA,也可能先通过水解作用脱一条侧链,生成邻苯二甲酸单丁酯(MBP),再继续水解生成PA,接着PA氧化开环,最终进入三羧酸循环生成 CO2和 H2O(图9),这一降解途径与菌株LMB-1降解DBP和JDC-32降解邻苯二甲酸二辛酯(DOP)的途径很类似[16,37]。
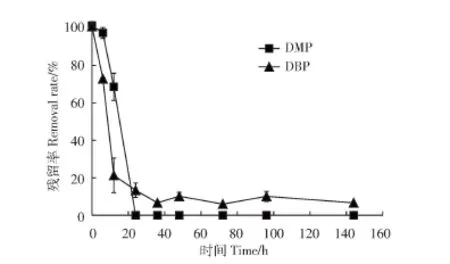
图7 ASW6D对DMP、DBP的降解曲线Figure7 The DMPand DBPdegradation curvefor thestrain ASW6D
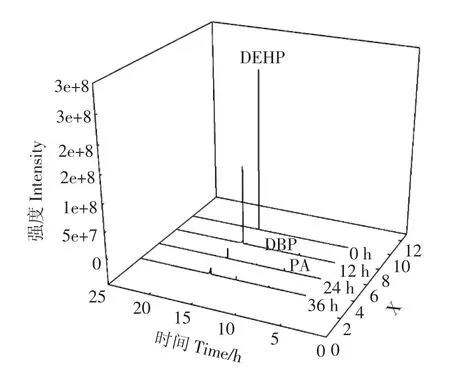
图8 ASW6D降解DEHP过程中中间产物的色谱图Figure8 Chromatogramsof the intermediates of DEHP degradation by ASW6D
2.6 菌株ASW6D在DEHP污染土壤中的应用
为进一步研究ASW6D在DEHP污染环境中的降解能力,以及土著微生物对其降解性能的影响,将ASW6D分别接种到灭菌和未灭菌土壤中,分析DEHP降解情况。接种ASW6D到未灭菌土壤18 d后,DEHP去除率为75.12%,空白组为16.45%;接种ASW6D到灭菌土壤18 d后,DEHP去除率为85.08%,空白仅去除7.54%,ASW6D的添加将DEHP去除率提高了77.54%(图10)。动力学数据进一步表明DEHP降解过程基本符合一级动力学模型(R2=0.7674~0.976 8)(表1)。土壤灭菌处理下,接种ASW6D后DEHP 的半衰期(t1/2)为 5.03 d,对照组为 71.97 d,在土壤未灭菌情况下,添加ASW6D的t1/2为6.67 d,而对照组为33.43 d(表1)。结果表明,添加菌株ASW6D可大幅降低(P<0.05)DEHP在土壤中的半衰期,加快DEHP的降解速率。秦华等[26]分别添加3种菌悬液到污染土壤(DEHP 浓度为 100 mg·kg-1)中,3 种处理下DEHP半衰期为24~35 d;加入降解菌群到PAEs混合污染土壤中,30 d后DEHP的同分异构体DOP(100 mg·kg-1)去除率不到 50%,DOP 半衰期为 28 d[38]。本研究中,外加ASW6D到DEHP污染的土壤,DEHP的半衰期为6.67 d,表明ASW6D具有较高的降解潜力。
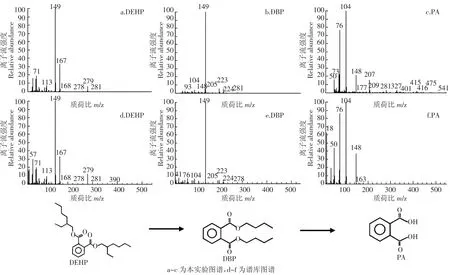
图9 ASW6D降解DEHP过程中中间产物的质谱图Figure 9 Spectra of theintermediatesof DEHPdegradation by ASW6D

图10 ASW6D对污染土壤中DEHP的降解Figure 10 Degradation of DEHPby ASW6Din containment soil

表1 ASW6D降解污染土壤中DEHP的动力学参数Table 1 Kinetic parametersof DEHPdegradation in contaminated soils by ASW6D
添加菌株ASW6D的未灭菌土壤组DEHP的降解曲线在8 d内相对灭菌组较平缓,降解速率较慢(图10)。而在8~18 d内,未灭菌土壤组的降解速率迅速加快,并逐渐超过灭菌组。该结果可能是由于菌株ASW6D与土壤中土著微生物存在某种竞争关系,所以在前8 d ASW6D的生长受到一定影响,导致DEHP的降解曲线比较平缓,而8 d后速率突然加快可能是由于菌株ASW6D在与土著微生物的竞争中逐渐占据优势,从而加快了对DEHP的降解。
综上所述,菌株ASW6D可快速去除新加入土壤的DEHP,具有高效降解DEHP的能力,表明菌株ASW6D对PAEs污染环境的生物修复具有一定的潜力与应用前景。
3 结论
(1)获得了一株可高效降解DEHP的菌株ASW6D,经形态学特征和16SrRNA序列分析,初步鉴定为分枝杆菌属(Mycobacterium sp.)。
(2)ASW6D可在较宽温度(20~40℃)和pH(5~10)范围下高效降解DEHP。DEHP生物降解过程中检测到的主要代谢物是DBP和PA。
(3)添加菌株ASW6D到DEHP污染的土壤,可明显提高DEHP的去除率,表明ASW6D在PAEs污染环境的生物修复方面具有一定的潜力。
[1]Chen JA,Li X,Li J,et al.Degradation of environmental endocrinedisruptor di-2-ethylhexyl phthalate by a newly discovered bacterium,Microbacterium sp.strain CQ0110Y[J].Applied Microbiology Biotechnology,2007,74(3):676-682.
[2]Liang DW,Zhang T,Fang H H P,et al.Phthalatesbiodegradation in the environment[J].Applied Microbiology Biotechnology,2008,80(2):183-198.
[3]Nahurira R,Ren L,Song J,et al.Degradation of di(2-Ethylhexyl)phthalate by a novel Gordonia alkanivorans strain YC-RL2[J].Current Microbiology,2017,74(3):309-319.
[4]Wang J,Lv SH,Zhang MY,et al.Effectsof plastic filmresidueson occurrence of phthalates and microbial activity in soils[J].Chemosphere,2016,151:171-177.
[5]Net S,Rabodonirina S,Sghaier R B,et al.Distribution of phthalates,pesticides and drug residues in the dissolved,particulate and sedimentary phases from transboundary rivers(France-Belgium)[J].Science of the Total Environment,2015,521/522:152-159.
[6]Selvaraj K K,Sundaramoorthy G,Ravichandran PK,et al.Phthalate esters in water and sediments of the Kaveri River,India:Environmental levels and ecotoxicological evaluations[J].Environmental Geochemistry Health,2015,37(1):83-96.
[7]Li J,Wang G,Aggarwal SG,et al.Comparison of abundances,compositions and sources of elements,inorganic ions and organic compounds in atmospheric aerosols from Xi′an and New Delhi,two megacities in Chinaand India[J].Scienceof the Total Environment,2014,476/477:485-495.
[8]Shi W,Guo J,Zhou Y B,et al.Phthalate esters on handsof officeworkers:Estimating the influence of touching surfaces[J].Environment Science&Technology Letters,2016,4(1):1-5.
[9]Liao CS,Chen L C,Chen B S,et al.Bioremediation of endocrine disruptor di-n-butyl phthalate ester by Deinococcus radiodurans and Pseudomonasstutzeri[J].Chemosphere,2010,78(3):342-346.
[10]Matsumoto M,Hirata K M,Ema M.Potential adverseeffectsof phthalic acid esterson human health:A review of recent studieson reproduction[J].Regulatory Toxicology and Pharmacology,2008,50(1):37-49.
[11]王红芬,程晗煜,洪坚平.环境中酞酸酯的污染现状及防治措施[J].环境科学与管理,2010,35(7):33-36.WANGHong-fen,CHENHan-yu,HONGJian-ping.Thestatusof phthalate esterspollution and its control measuresin the environment[J].Environmental Science and Management,2010,35(7):33-36.
[12]崔学慧,李炳华,陈鸿汉,等.中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J].生态环境学报,2010,19(2):472-479.CUIXue-hui,LIBing-hua,CHENHong-han,et al.A review of phthalic acid esterscontamination and sorption in soil and sediment,China[J].Ecologyand Environmental Sciences,2010,19(2):472-479.
[13]刘 庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J].中国生态农业学报,2012,20(8):968-975.LIU Qing,YANGHong-jun,SHI Yan-xi,et al.Research progress on phthalate esters(PAEs)organic pollutants in the environment[J].Chinese Journal of Eco-Agriculture,2012,20(8):968-975.
[14]Zhao H M,Du H,Feng NX,et al.Biodegradation of di-n-butylphthalateand phthalic acid by anovel Providencia sp.2Dand itsstimulation in a compost-amended soil[J].Biology and Fertility of Soils,2016,52(1):65-76.
[15]He L,Gielen G,Bolan NS,et al.Contamination and remediation of phthalic acid esters in agricultural soils in China:A review[J].Agronomy for Sustainable Development,2015,35(2):519-534.
[16]Tang WJ,Zhang L S,Fang Y,et al.Biodegradation of phthalate esters by newly isolated Rhizobium sp.LMB-1 and its biochemical pathway of di-n-butyl phthalate[J].Journal of Applied Microbiology,2016,121(1):177-186.
[17]Yuan SY,Huang IC,Chang BV.Biodegradation of dibutyl phthalate and di-(2-ethylhexyl)phthalate and microbial community changes in mangrove sediment[J].Journal of Hazardous Materials,2010,184(1):826-831.
[18]高静静,陈丽玮,王宜青,等.一株邻苯二甲酸二(2-乙基己基)酯(DEHP)高效降解菌的筛选及其降解特性[J].环境化学,2016,35(11):2362-2369.GAOJing-jing,CHENLi-wei,WANGYi-qing,et al.Isolation,identification of a DEHP-degradingbacteriumand itshigh effectivebiodegradation characteristics[J].Environmental Chemistry,2016,35(11):2362-2369.
[19]Wang J,Zhang M Y,Chen T,et al.Isolation and identiflcation of a di-(2-Ethylhexyl)phthalate-degrading bacterium and its role in the bioremediation of a contaminated soil[J].Pedosphere,2015,25(2):202-211.
[20]Wu X L,Wang Y Y,Dai Q Y,et al.Isolation and characterization of four di-n-butyl phthalate(DBP)-degrading Gordonia sp.strains and cloning the 3,4-phthalate dioxygenase gene[J].World Journal of Microbiology&Biotechnology,2011,27(11):2611-2617.
[21]严佳丽,陈湖星,杨 杨,等.一株高效DEHP降解菌的分离、鉴定及其降解特性[J].微生物学通报,2014,41(8):1532-1540.YAN Jia-li,CHENHu-xing,YANGYang,et al.Isolation and charac-terization of a highly efficient DEHP-degrading bacterium[J].Institute of Microbiology,2014,41(8):1532-1540.
[22]Zhao H M,Du H,Lin J,et al.Complete degradation of the endocrine disruptor di-(2-ethylhexyl)phthalateby anovel Agromyces sp.MT-O strain and itsapplication tobioremediation of contaminated soil[J].Scienceof the Total Environment,2016,562:170-178.
[23]Xu J,Lu Q,de Toledo RA,et al.Degradation of di-2-ethylhexyl phthalate(DEHP)by an indigenous isolate Acinetobacter sp.SN13[J].International Biodeterioration&Biodegradation,2017,117:205-214.
[24]Jin DC,Liang RX,Dai QY,et al.Biodegradation of di-n-butyl phthalate by Rhodococcus sp.JDC-11 and molecular detection of 3,4-phthalate dioxygenase gene[J].Journal of Microbiology Biotechnology,2010,20(10):1440-1445.
[25]宋雪英,崔小维,李嘉康,等.邻苯二甲酸酯类塑化剂的土壤生态毒理学研究进展[J].生态环境学报,2016,25(11):1885-1890.SONGXue-ying,CUIXiao-wei,LIJia-kang,et al.Research advances in soil ecotoxicology of phthalic acid esters(PAEs)exposure[J].Ecology and Environmental Sciences,2016,25(11):1885-1890.
[26]秦 华,林先贵,尹 睿,等.接种降解菌对土壤中邻苯二甲酸二异辛酯降解的影响[J].应用与环境生物学报,2006,12(6):842-845.QIN Hua,LINXian-gui,YINRui,et al.Degradation of di-(2-Ethylhexyl)phthalate in soil by inoculating microorganisms[J].Chinese Journal of Applied and Environmental Biology,2006,12(6):842-845.
[27]Li C,Tian X L,Chen ZS,et al.Biodegradation of an endocrinedisrupting chemical di-n-butyl phthalate by Serratia marcescens C9 isolated from activated sludge[J].African Journal of Microbiology Research,2012,6(11):2686-2693.
[28]Ren L,Jia Y,Ruth N,et al.Biodegradation of phthalic acid esters by a newly isolated Mycobacterium sp.YC-RL4 and thebioprocesswith environmental samples[J].Environmental Scienceand Pollution Research,2016,23(16):16609-16619.
[29]Boldrin B,Tiehm A,Fritzsche C.Degradation of phenanthrene,fluorene,fluoranthene,and pyreneby a Mycobacterium sp.[J].Applied and Environmental Microbiology,1993,59(6):1927-1930.
[30]Solano-Serena F,Marchal R,Casarégola S,et al.A Mycobacterium strain with extended capacities for degradation of gasoline hydrocarbons[J].Applied and Environmental Microbiology,2000,66(6):2392-2399.
[31]Chen S,Dong Y H,Chang C,et al.Characterization of a novel cyfluthrin-degrading bacterial strain brevibacterium aureum and its biochemicaldegradationpathway[J].BioresourceTechnology,2013,132:16-23.
[32]张 可,关 允,格 桑,等.低温邻苯二甲酸二甲酯降解菌STX-2和STX-5的分离、鉴定及降解特性[J].环境污染与防治,2017,39(1):16-27.ZHANGKe,GUAN Yun,GE Sang,et al.Isolation,identification and degradation characteristics of dimethyl phthalate degradation strains STX-2 and STX-5 at low temperature[J].Environmental Pollution&Control,2017,39(1):16-27.
[33]温志丹,高大文,李 喆,等.邻苯二甲酸酯降解菌的分离鉴定及降解特性[J].哈尔滨工业大学学报,2013,45(12):38-42.WENZhi-dan,GAODa-wen,LIZhe,et al.Isolation and identification of phthalate-degrading bacteria and their characteristics[J].Journal of Harbin Instituteof Technology,2013,45(12):38-42.
[34]周开胜,吕超田,杨 刚,等.水体中酞酸酯类环境激素污染及生物降解研究进展[J].环境科技,2009,22(4):56-59.ZHOUKai-sheng,L譈Chao-tian,YANGGang,etal.Research progress on pollution and biodegradation of environmental hormone-phthalate esters in water[J].Environmental Science and Technology,2009,22(4):56-59.
[35]Benjamin S,Pradeep S,Josh M S,et al.A monograph on the remediation of hazardous phthalates[J].Journal of Hazardous Materials,2015,298:58-72.
[36]Li D D,Yan JL,Wang L,et al.Characterization of the phthalate acid catabolic gene cluster in phthalate acid esters transforming bacterium-Gordonia sp.strain HS-NH1[J].International Biodeterioration&Biodegradation,2016,106:34-40.
[37]Wu X,Liang R,Dai Q,et al.Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp.strain JDC-2 and Arthrobacter sp.strain JDC-32 isolated from activated sludge[J].Journal of Hazardous Materials,2010,176(1/2/3):262-268.
[38]Wang J L,Zhao X,Wu W Z.Biodegradation of phthalic acid esters(PAEs)in soil bioaugmented with acclimated activated sludge[J].Process Biochemistry,2004,39(12):1837-1841.
