糖尿病足患者感染多重耐药菌的病原学分布特点与危险因素分析
2018-06-06王夏妃龚维坤孙英芬赖静波
王夏妃 龚维坤 孙英芬★ 赖静波
糖尿病是临床常见的慢性病之一,世界卫生组织预测,至2030年全球范围内糖尿病患者将达3.66亿[1],糖尿病已成为全球性的医疗问题。糖尿病足则是糖尿病常见的一种严重并发症,具有发病率高﹑护理难度大﹑易感染等特点,研究表明[2],糖尿病患者在其病程中,糖尿病足的发病率高达25%,且大部分糖尿病足患者会发生足感染[3]。当糖尿病足并发足感染时,将严重影响肢体功能,甚至需要截肢,因此对糖尿病足感染进行早期预防﹑及时治疗及后期护理显得尤为重要。近些年,多重耐药菌(MDROs)感染在糖尿病足感染患者中呈现升高趋势[4-5],给临床治疗与护理增加了难度。本资料旨在探讨糖尿病足患者并发MDROs感染的病原学分布特点及危险致病因素,以期寻找可降低MDROs感染的有效途径。
1 临床资料
1.1 一般资料 采用回顾性病例-对照研究方法,纳入2014年1月至2017年6月入住本院内分泌科的糖尿病足感染患者,根据住院期间足溃疡伤口分泌物的培养结果,分为多重耐药菌组(MDROs组)及非多重耐药菌组(非MDROs组)。本研究符合医学伦理学标准,所有治疗获得患者或家属的知情同意。入选标准:对糖尿病诊断符合1997年美国糖尿病协会对糖尿病的诊断标准,对糖尿病足感染及骨髓炎的诊断符合美国传染病学会2012年糖尿病足感染诊断和治疗临床实践指南的诊断标准[6]。MDROS定义为一种细菌对3类抗菌药物同时出现耐药,且细菌学诊断需连续2次分离出相同病原菌。排除标准:年龄<18岁;妊娠妇女;住院期间未留取足溃疡伤口分泌物培养;连续2次伤口分泌物未培养出细菌。
1.2 方法 收集两组患者的一般资料,包括性别﹑年龄﹑体重指数(BMI)﹑糖尿病病程﹑既往降糖方案﹑足溃疡情况及抗生素暴露情况。记录两组患者入院时的动脉收缩压﹑动脉舒张压﹑血糖﹑糖化血红蛋白﹑肌酐水平及住院期间抗生素使用情况(抗生素种类及使用时长)。记录既往并发症情况,包括是否合并糖尿病肾病﹑糖尿病神经病变﹑糖尿病视网膜病变﹑神经缺血性伤口﹑大血管病变及骨髓炎。详细记录足感染的病原菌分布特点及耐药情况。糖尿病肾病通过测定24h尿微量蛋白进行诊断,糖尿病神经病变通过神经肌电图检查进行诊断,糖尿病视网膜病变通过眼底镜诊断,大血管病变通过血管彩超进行诊断。双足出现≥2处的溃疡为多处溃疡。
1.3 统计学方法 采用SPSS17.0统计软件。计量资料以()表示,组间比较采用t检验;计数资料比较采用χ2检验。对影响多重耐药菌感染的因素进行多因素logistic回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料比较 共纳入糖尿病足感染患者125例,男70例,女55例;年龄41~84岁,平均(61.11±10.74)岁。其中MDROs组69例,非MDROs组56例;糖尿病病程5~17年,平均(10.57±2.86)年。MDROs组患者住院期间使用抗生素人数﹑使用抗生素种类及使用抗生素时长均明显多于非MDROs组(P<0.001);MDROs组以联合应用抗生素为主,非MDROs组以单用抗生素为主;MDROs组中既往有抗生素暴露史的人数也显著多于非MDROs组(P=0.001),且合并多处溃疡的人数也明显多于非MDROs组(P<0.05)。在并发症分析中,MDROs组患者合并骨髓炎显著多于非MDROs组患者(P<0.001)。两组间其他如糖尿病肾病﹑糖尿病神经病变﹑糖尿病视网膜病变﹑神经缺血性伤口及大血管病变情况均无显著差异(P均>0.05)。另外,两组间其他如性别﹑年龄﹑BMI等一般资料比较差异均无统计学意义(P>0.05)。
2.2 病原菌分布特点 125例糖尿病足感染患者,共分离出致病菌141株,见表1。
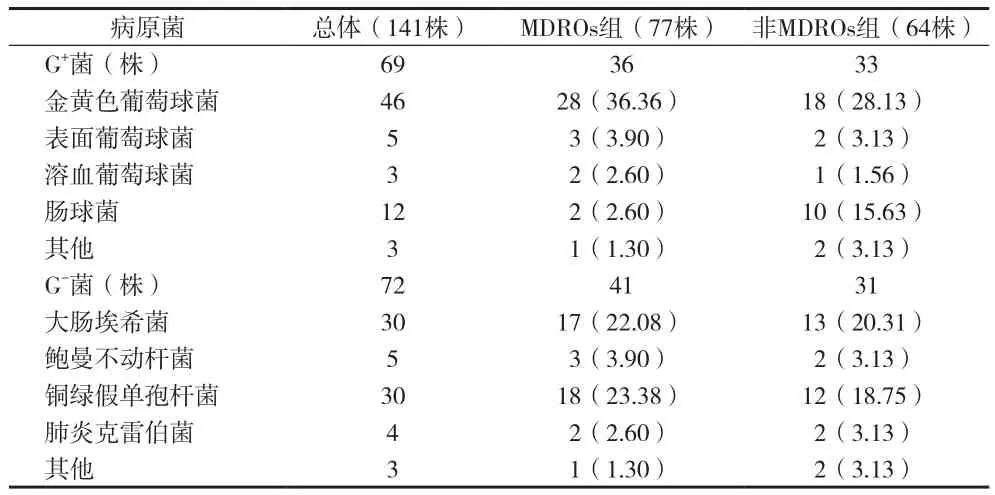
表1 141株病原菌分布情况及构成比[n(%)]
2.3 多因素logistic回归分析 对既往抗生素暴露史,多处溃疡,是否合并糖尿病肾病﹑糖尿病神经病变﹑糖尿病视网膜病变﹑神经缺血性伤口﹑大血管病变及骨髓炎等因素进行多因素logistic回归分析,结果显示:既往抗生素暴露史及并发骨髓炎是糖尿病足感染MDROs的独立危险因素,神经缺血性伤口或许与MDROs感染有关(P=0.052)。
3 讨论
本研究发现,糖尿病足患者的MDROs感染率达55.20%,且居前三位病原菌的分别是金黄色葡萄球菌﹑铜绿假单孢杆菌及大肠埃希菌,既往抗生素暴露史及并发骨髓炎是糖尿病足感染MDROs的独立危险因素,神经缺血性伤口或许也与MDROs感染有关。
本资料共纳入糖尿病足感染患者125例,其中感染MDROs患者69例,MDROs感染率达55.20%;共分离出致病菌141株,其中MDROs 77株,非MDROs 64株,MDROs分离率为54.61%。77株MDROs中,以革兰氏阴性菌为主,占53.25%,革兰氏阳性菌略低,占46.75%。此外,在MDROs中,居前三位的分别是金黄色葡萄球菌(36.36%)﹑铜绿假单孢杆菌(23.38%)及大肠埃希菌(22.08%)。Banu等[5]一项前瞻性研究也得出相似的结果,该研究共纳入100例慢性糖尿病足患者,结果发现创面病原菌中最多见的是金黄色葡萄球菌,铜绿假单孢杆菌次之。国内沈秋燕等[7]的大样本研究同样也发现,糖尿病足感染患者足部分泌物培养的病原菌仍以金黄色葡萄球菌为主。因此,糖尿病足患者MDROs感染率高,病原菌复杂,在临床工作中,加强创面及周围皮肤表面消毒,严格无菌操作,加强医护人员的手卫生及无菌观念是防范MDROs感染的有效途径。
糖尿病足并发感染时,临床上常给予多种抗生素联合治疗,而泛用广谱抗生素常是筛选MDROs的高效途径。本资料中通过对影响糖尿病足感染MDROs的诸多潜在因素进行多因素logistic回归分析,结果显示,既往抗生素暴露史及并发骨髓炎是糖尿病足感染MDROs的独立危险因素。提示对于糖尿病足患者,避免滥用抗生素,根据分泌物培养及药敏试验选择敏感抗生素,尽量使用窄谱抗生素,是降低MDROs感染的另一有效途径。
本资料存在以下不足:(1)本研究为回顾性研究,无法详细记录糖尿病足溃疡的大小与分级,不能保证分泌物培养是否存在污染可能,给结果带来一定的影响。此外,本研究为单中心研究,研究结果仅适用于本单位。(2)本研究样本量较小,尽管本研究纳入过去三年入住本科的糖尿病足感染患者,但因本研究单位规模较小,最终只纳入125例符合纳入标准的研究对象。本研究发现神经缺血性伤口或许与MDROs感染有关(P=0.052),但结果并不具有统计学意义,造成这一结果差异的原因或许与本研究样本量较小有关,因此需要后续的大样本研究予以证明。
[1] Wild S,Roglic G,Green A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030.Diabetes Care,2004,27(5):1047-1053.
[2] Singh N,Armstrong DG,Lipsky BA.Preventing Foot Ulcers in Patients With Diabetes.JAMA,2005,293(2):217-228.
[3] Prompers L,Huijberts M,Schaper N,et al.Resource utilisation and costs associated with the treatment of diabetic foot ulcers.Prospective data from the Eurodiale study.Diabetologia,2008,51(10): 1826-1834.
[4] Sinwar PD.The diabetic foot management-recent advance.Int J Surg,2015,15:27-30.
[5] Banu A,Noorul Hassan MM,Rajkumar J,et al.Spectrum of bacteria associated with diabetic foot ulcer and biofilm formation:A prospective study.Australas Med J,2015,8(9):280-285.
[6] Lipsky BA,Berendt AR,Cornia PB,et al.2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections.Clin Infect Dis,2012, 54(12):e132-173.
[7] 沈秋燕,林迪妮,朱虹,等.糖尿病足合并感染患者754株病原菌分布及耐药性分析.中华医学杂志,2014,94(12):889-894.
