F-TiO2微粒制备及其负载纳米Ag3PO4颗粒
2018-06-05孙亚男顾修全
孙亚男, 顾修全
(中国矿业大学 材料科学与工程学院, 江苏 徐州 221116)
光催化作为目前解决水污染问题一种行之有效的技术,受到广大研究者的关注。1972年,Fujishima等[1]首次发现了n型半导体TiO2单晶体能够光解水。稍后Carey等[2]和Frank等[3]利用TiO2进行紫外光降解多氯连苯、氰化物实验,并取得成功。TiO2作为最早被发现的一种光催化剂,已经被广泛研究,它有着稳定性好等特点,但是只能够吸收占比不到5%的紫外光。为此人们通过形貌调控[4]、掺杂[5-7]、使用助催化剂[8-14]、复合[15]等手段予以克服。例如,人们通过TiCl4火焰喷涂的方法制备出含20%锐钛矿相(3.2 eV)与80%金红石相(3.0 eV)的纳米粒径混合型光催化P25,显示出良好的光催化性能[16]。
2010年,Ye等[17]首次报道了Ag3PO4的光催化特性,其可见光催化降解或产氧速率远高于其他类型的可见光催化剂如WO3、BiVO4、N掺杂TiO2等。然而,由于Ag3PO4极强的光敏性,在光催化降解有机污染物的过程中,极易发生光腐蚀而变质为低催化活性的Ag。因此,人们通过各种手段对其进行改性,包括控制形貌、尺寸[18],构建异质结、Z-scheme体系等。但目前研究仍然没有一个较大的突破。
本文将不同量的纳米Ag3PO4颗粒负载在微米级的F掺杂TiO2上,制备出不同质量比的Ag3PO4/F-TiO2复合光催化剂,并对罗丹明B溶液进行降解,研究该复合光催化剂的光催化性能。
1 主要试剂与仪器
试剂:NH4F,钛酸四丁酯,CH3COOH,Na2HPO4,AgNO3,罗丹明B,无水乙醇,P25。本实验所有试剂均为分析纯,来自国药集团上海化学试剂公司。
仪器:TDL-50B低速离心机(上海安亭科学仪器厂),TG16-W高速离心机(湘仪离心机仪器有限公司),SK3300HP超声波清洗机(上海科导超声仪器有限公司),FA2004N电子天平(上海精密科学仪器有限公司),DHG-9078A鼓风干燥箱(上海精宏实验设备有限公司),85-2数显控温磁力搅拌器(金坛市大地自动化仪器厂)。
2 光催化剂的制备
2.1 F-TiO2微粒的制备
室温下,量取24 mL去离子水倒入150 mL烧杯中,称取0.72 g NH4F,加入去离子水中,搅拌20 min,得到无色透明溶液;用量筒量取36 mL的CH3COOH,搅拌10 min使其混合均匀;用1 mL注射器吸取1.5 mL的钛酸四丁酯,缓慢逐滴加入混合溶液中,滴加完成之后,搅拌30 min左右;将混合溶液转移进100 mL的聚四氟乙烯反应釜衬底内,密封好,放入反应釜内;将反应釜放入烘箱中,160 ℃水热反应9 h,使其自然冷却至室温;取出反应釜,静置一段时间后,将大部分上层清液去除后进行离心,并用去离子水和乙醇清洗几次后,放入烘箱中600 ℃烘干,得到白色粉末;将此粉末研磨均匀铺展在瓷舟内,分别在100、200、300、400 ℃下退火,得到黄色的F-TiO2。
2.2 F掺杂TiO2负载Ag3PO4复合光催化剂的制备
实验在暗态下进行。准备3个150 mL的烧杯,分别编号为#1、#2、#3;称取0.862、1.723、3.446 g的AgNO3分别加入3个烧杯中,分别量取50 mL去离子水加入烧杯中,搅拌30 min,分别加入0.1 g F掺杂TiO2,超声30 min;另取3个烧杯,分别加入0.24、0.48、0.96 g Na2HPO4,分别量取15 mL去离子水加入烧杯中,搅拌30 min,得到均匀溶液;用1 mL或5 mL注射器分别吸取Na2HPO4溶液,顺序逐滴滴加到#1、#2、#3 3个烧杯中,搅拌4 h;沉降一段时间后收集上层清液,并向其中逐滴滴加15 mL的0.15 g的Na2HPO4溶液制备出Ag3PO4;将4个烧杯中制备好的光催化剂放入烘箱中,600 ℃烘干;将所得到的样品分别标记为:A(纯的Ag3PO4),#1(F-TiO2/Ag3PO4质量比为1∶6.79),#2(F-TiO2/Ag3PO4质量比为1∶13.58),#3(F-TiO2/Ag3PO4质量比为1∶27.16)。
3 光催化剂的物相及可见光催化性能表征
采用德国BRUKER AXS公司的D8 Advance X射线衍射仪测定样品的相结构,用日本Hitachi公司的S-4800场发射扫描电子显微镜观察分析样品的微观形貌,用北京电光源所生产的150 W卤钨灯(提供可见光)进行光降解实验,用上海欣茂仪器有限公司的725 W紫外-可见分光光度计得到光降解实验中抽取试样的吸光度。
光降解实验的具体设计:首先打开氙灯预热30 min,同时取200 mL烧杯,量取50 mL、10 mg/L的罗丹明B溶液,称取0.05 g的光催化剂(P25,A,#1,#2,#3),加入烧杯中,暗态下搅拌30 min,使得催化剂达到吸附—解吸平衡;用吸管吸取2 mL溶液,放入4 mL离心管中;将烧杯放在氙灯下进行光照,每隔3 min用滴管吸取2 mL试样,直至降解完成。氙灯与液面距离约15 cm。一次降解完成后,离心回收催化剂,重新量取50 mL罗丹明B溶液,进行二次降解、三次降解实验等,待所有降解实验完成后,将所有得到的离心管样品,进行离心,抽取上层清液,检测吸光度并记录数据。吸光度检测准备工作:预热分光光度计30 min,调节最大吸收波长为550 nm,用比色皿量取去离子水进行校准。
4 结果与讨论
4.1 光催化剂的物相分析
图1为不同退火温度下得到的F-TiO2粉末的XRD图。

图1 不同退火温度下制备F-TiO2的XRD图谱
从图1中可以看出,F-TiO2的相转变温度大概在200~300 ℃之间,且400 ℃制备的F-TiO2的结晶性能最好。通过与XRD标准PDF卡片对比可知,400 ℃制备的晶型为锐钛矿相,未进行晶型转变的相中包括NH4TiO2F等杂峰。400 ℃制备的与PDF卡片中的标准峰吻合得较好,说明该样品的纯度较高。但是由于掺杂的F含量较少,所以在XRD图中并没有将F很好地展现出来。但通过进行XPS光电子能谱分析(见图2,图中E为结合能),证明了F已被掺杂到了TiO2晶格中。
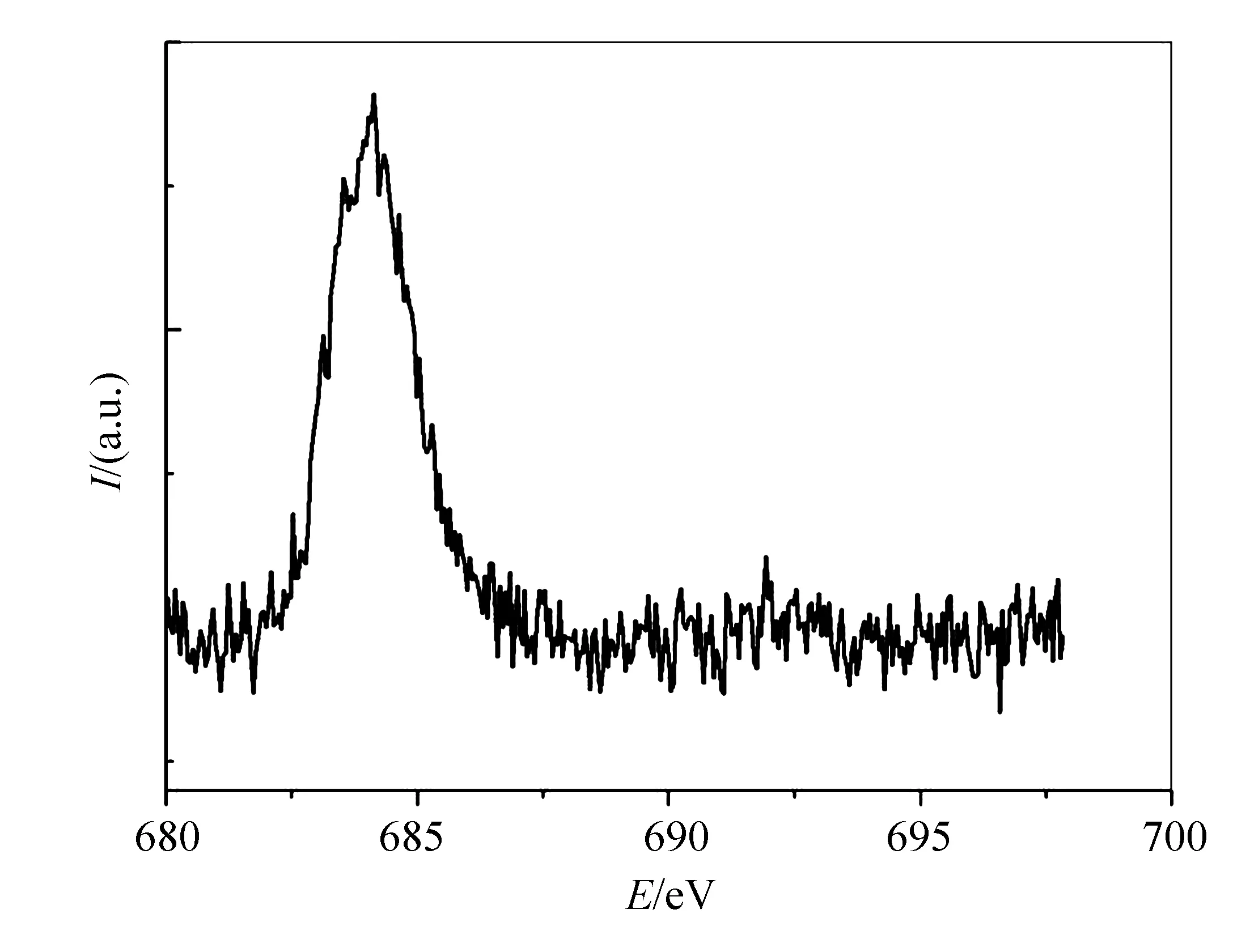
图2 F-TiO2的XPS图谱
图3为负载不同量Ag3PO4复合光催化剂的XRD图谱,从中可看出与纯Ag3PO4相比,随着负载量的增加,TiO2的峰开始变得越来越明显,这可能是由于Ag3PO4本身比较容易团聚长大,使得F-TiO2基体逐渐暴露出来。当负载量较为适当时,Ag3PO4能较完全地负载在基体之上,故#1配比的光催化剂其效果是最好的。

图3 负载不同含量Ag3PO4的复合材料的XRD图
图4为F-TiO2的场发射扫描电子显微镜(FESEM)图像,从图中可以看出微米级颗粒表面存在着很多的纳米片,这些纳米片限制Ag3PO4颗粒生长,并促进其与基体表面接触。
4.2 负载不同量的Ag3PO4复合光催化剂的性能分析
图5比较了商业化的P25以及本实验中所制备的复合光催化剂的光降解曲线(图中C0为罗丹明B溶液的初始浓度,C为经过一段时间后罗丹明溶液实际浓度)。由图可以明显看出:对P25而言,经过48 min能降解72.5%的罗丹明B溶液;纯Ag3PO4则仅需12 min就能完全降解该染料溶液;复合光催化剂则需要时间更短,仅6 min就能达到同样效果。这表明复合光催化剂在光照下确实能够有效促进光生电子-空穴对的分离,从而改善光催化剂的活性。但是,从图5也可看出,Ag3PO4负载量的多少并不影响复合材料的光催化活性。图6是不同次循环光降解实验得到的降解曲线,从中可以看出纯的Ag3PO4的光降解稳定性相对于复合光催化剂要差一些,且随着循环回收利用次数的增加,光催化活性都有所下降,但复合光催化剂依然要优于P25以及纯的Ag3PO4光催化剂。经过4次循环试验,能够看出#1配比下制备的复合光催化剂材料具有比其他两种光催化剂更加稳定的光催化性能,光催化活性衰减得较慢,即当F-TiO2的量稍大,也有利于提高复合光催化剂的稳定性。
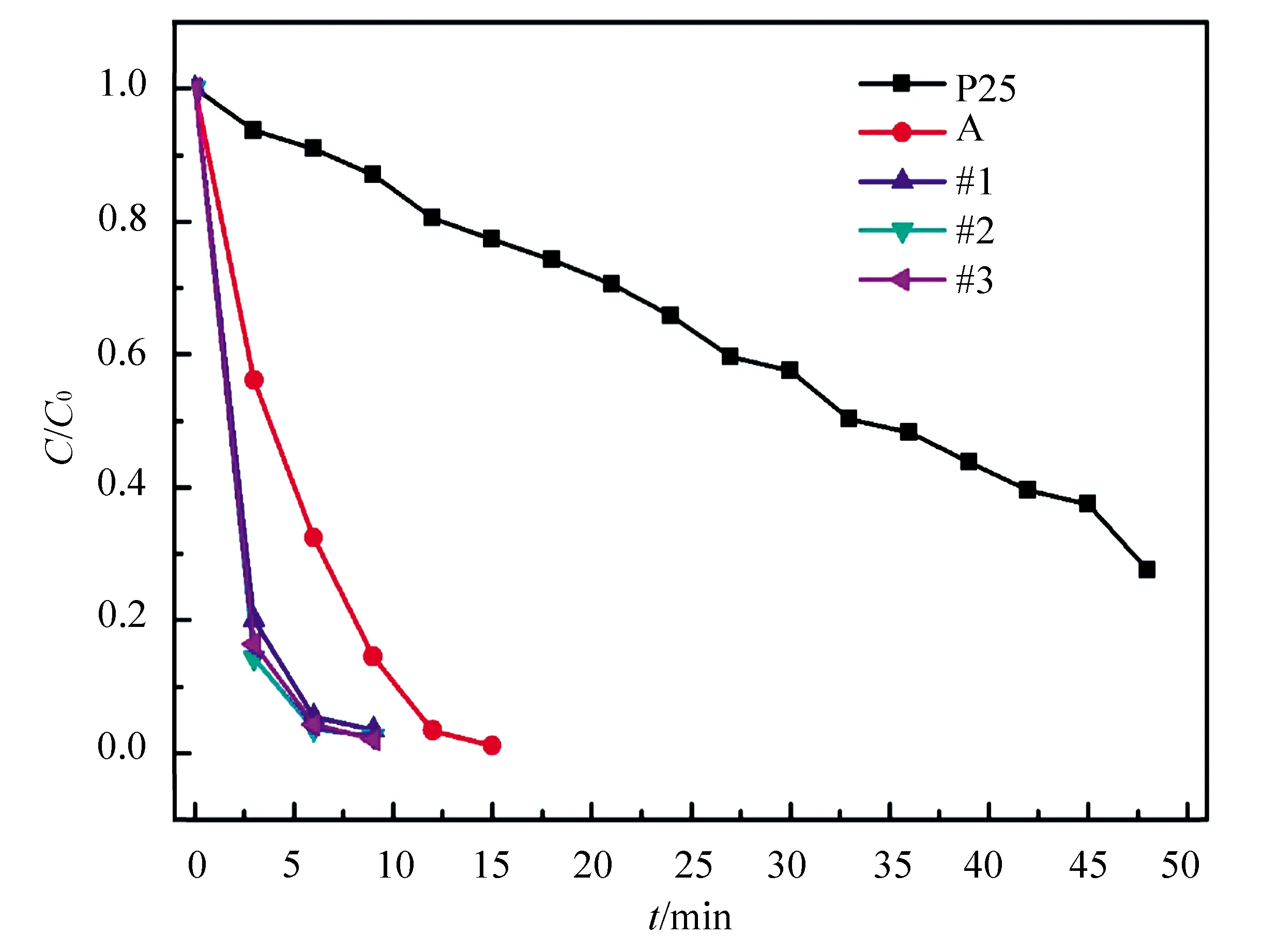
图5 不同光催化剂经过一次降解得到的光降解曲线
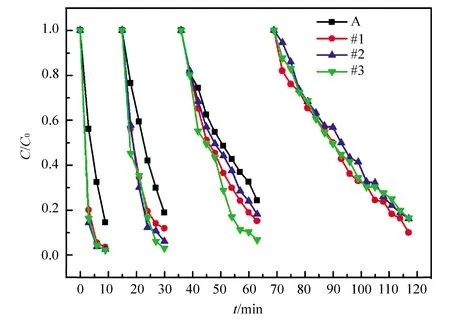
图6 从左到右为一次、二次、三次、四次循环的Ag3PO4与Ag3PO4/F-TiO2异质结构的光降解曲线
5 结语
本实验以NH4F和钛酸四丁酯为原料,利用水热法制备出F-TiO2微粒,并且在其表面负载不同量的Ag3PO4纳米颗粒,结果表明,负载Ag3PO4能有效改善F-TiO2的光催化活性,但并不能改善其稳定性。
本实验涉及微观微纳米形貌的材料的制备、如何进行相确认及扫描电镜图片分析等,通过光催化降解实验研究了降解污染物的活性及稳定性。实验内容较丰富,具有综合性,产物可重复,不仅可以提升学生的探索研究精神还可以提高学生的动手能力,培养其对科研的兴趣以及环境保护的意识。
参考文献(References)
[1] Fujishima A,Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature,1972,238(5358):37-38.
[2] Carey J,Lawrence J,Tosine H.Photodechlorination of PCB’s in the presence of titanium dioxide in aqueous suspensions[J]. Bulletin of Environmental Contamination and Toxicology,1976,16(6):697-701.
[3] Frank S N,Bard A J. Heterogeneous photocatalytic oxidation of cyanide ion in aqueous solutions at titanium dioxide powder[J]. Journal of the American Chemical Society,1977,99(1):303-304.
[4] Maeda K,Teramura K,Lu D,et al. Photocatalyst releasing hydrogen from water[J]. Nature,2006,440(7082):295-295.
[5] Hitoki G,Takata T,Kondo J,et al. An oxynitride, TaON, as an efficient water oxidation photocatalyst under visible light irradiation(λ≤ 500 nm)[J]. Chem Commun,2002,0:1698-1699.
[6] Tsuji I,Kato H,Kobayashi H,et al. Photocatalytic H2evolution reaction from aqueous solutions over band structure-controlled(AgIn)xZn2(1-x)S2solid solution photocatalysts with visible-light response and their surface nanostructures[J]. J Am Chem Soc,2004,126(41):13406-13413.
[7] Yao W,Huang C,Muradov N,et al. A novel Pd-Cr2O3/CdS photocatalyst for solar hydrogen production using a regenerable sacrificial donor[J]. J Hydrogen Energy, 2011,36:4710-4715.
[8] Romanyuk A,Oelhafen P,Formation and electronic structure of TiO2-Ag interface[J]. Solar energy materials and solar cells[J]. Sol Energy Mater Sol Cells,2007,91:1051-1054.
[9] Mandal S S,Bhattacharyya A J. Electrochemical sensing and photocatalysis using Ag-TiO2microwires[J]. Journal of Chemical Science,2012,124(5):969-978.
[10] Wang D,Zhou Z,Yang H,et al. Preparation of TiO2loaded with crystalline nano Ag by a one-step low-temperature hydrothermal method[J]. J Mater Chem,2012,22:16306-16311.
[11] Linic S,Christopher P,Ingram D B,et al. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy[J]. Nature Materials,2011,10:911-921.
[12] Awazu K,Fujimaki M,Rockstuhl C,et al. A plasmonic photocatalyst consisting of silver nanoparticles embedded in titanium dioxide[J]. J Am Chem Soc,2008,130(5):1676-1680.
[13] Christopher P,Ingram D B,Linic S,Enhancing photochemical activity of semiconductor nanoparticles with optically active Ag nanostructures: photochemistry mediated by Ag surface plasmons[J]. J Phys Chem C,2010,114(19):9173-9177.
[14] Tian Y,Tatsuma T. Mechanisms and applications of plasmon-induced charge separation at TiO2films loaded with gold nanoparticles[J]. J Am Chem Soc,2005,127(20):7632-7637.
[15] Yang L X,Duan W Y,Jiang H M,et al. Mesoporous TiO2@Ag3PO4photocatalyst with high adsorbility and enhanced photocatalytic activity under visible light[J]. Materials Research Bulletin, 2015,70:129-136.
[16] Hurum D C, Agrios G A, Gray K A, et al. Explaining the enhanced photocatalytic activity of Degussa P25 mixed-phase TiO2using EPR[J]. Journal of Physical Chemistry B, 2003,107(19):4545-4549.
[17] Yi Z,Ye J,Kikugawa N,et al. An orthophosphate semiconductor with photooxidation properties under visible-light irradiation[J]. Nature Materials,2010,9(7):559-564.
[18] Dong P,Wang Y,Li H,et al. Shape-controllable synthesis and morphology-dependent photocatalytic properties of Ag3PO4crystals[J]. J Mater Chem A,2013,1:4651-4656.
