IL-1β、IL-6及下游IDO激活与大鼠抑郁行为的关系研究*
2018-06-05伏箫燕李海燕蒋青松邱红梅
伏箫燕,李海燕,崔 婷,蒋青松,邱红梅
(重庆医科大学药理学教研室/重庆市生物化学与分子药理学重点实验室 400016)
抑郁症是一种以情绪低落、兴趣缺失为主要表现的常见精神障碍性疾病,具有不易察觉,病程长,严重者导致自杀等特征。抑郁症发病机制复杂,涉及多种病理生理学改变。近年来研究发现,免疫激活及下游吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO)通路激活与抑郁症发生密切相关[1-2]。众所周知,机体在免疫激活状态下,免疫细胞如单核-巨噬细胞、T淋巴细胞等可释放多种细胞因子,如白介素、肿瘤坏死因子等与相应受体结合调控免疫应答。白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)是重要的促炎性细胞因子,在免疫反应和炎症的启动和维持中发挥十分重要的作用,是炎性反应系统被激活的直接标志。国内外研究显示抑郁患者血清IL-1β、IL-6等促炎性细胞因子均显著升高,提示细胞因子合成、释放增多参与了临床抑郁症的发生[3]。脑内5-羟色胺(serotonin,5-HT)功能不足是公认的抑郁症发病机制之一,也是临床治疗药物的重要靶点。色氨酸作为脑内合成5-HT的前体物质,是机体所需的必需氨基酸之一,主要通过色氨酸-5-HT通路和色氨酸-犬尿氨酸通路进行代谢。新的5-HT学说认为,神经炎症因子增多,诱导色氨酸主要沿色氨酸-犬尿氨酸代谢,而使5-HT合成减少是抑郁症发病的机制之一。IDO是一种色氨酸降解酶,是肝脏以外唯一可催化色氨酸沿色氨酸-犬尿氨酸途径代谢的第一限速酶[4]。IDO在生理状态下低水平表达,但在促炎症细胞因子如IL-1、TNF等释放增多及免疫激活时可诱导其表达显著升高,催化色氨酸沿色氨酸-犬尿氨酸通路代谢,继而导致色氨酸耗竭和5-HT合成减少,诱发或加重抑郁症[5-7]。最新临床和基础研究结果均显示炎症因子释放增多、IDO过表达与抑郁症的发生密切相关。目前,临床研究主要集中于对患者血清或脑脊液,基础研究主要采用脑内注射脂多糖或β-淀粉样蛋白等诱导动物抑郁行为并研究脑内炎症因子及IDO表达变化,尚未见采用慢性不可预见刺激(CUS)诱导动物抑郁症并研究脑内皮层和海马炎症因子及IDO表达异常的报道。
研究已证实社会压力、环境变化等慢性刺激是诱发抑郁症的重要因素之一。CUS可模拟人所处的各种社会环境变化,是诱导建立动物抑郁症的常用模型之一。本研究采用孤养结合CUS建立大鼠抑郁模型,采用Western blot和PCR研究抑郁大鼠大脑皮层及海马IL-1β、 IL-6及IDO表达与动物抑郁行为的关系,进一步探索抑郁症的发病机制,寻找新的药物治疗靶点。
1 材料与方法
1.1材料
1.1.1实验动物 重庆医科大学动物中心提供清洁级雄性SD大鼠30只,体质量(200±20)g,5只/笼,自由摄食饮水,室温(23±3)℃,医学动物许可证号:SYXK(渝)2012-0001。
1.1.2仪器与试剂 荧光定量PCR仪、凝胶成像系统、垂直电泳仪(美国Bio-rad公司);Trizol、逆转录试剂盒、SYBR Green Supermix、PCR引物(日本Takara生物技术公司设计合成);BCA 蛋白浓度测定试剂盒、RIPA裂解液(江苏碧云天生物技术公司);anti IL-1β、anti IL-6(美国Affinity公司);anti-IDO(美国Abcam公司);其余各试剂均为国产分析纯。
1.2方法
1.2.1分组及建模 大鼠适应性喂养1周后,采用开场实验进行行为学测试,将得分相似的大鼠分为对照组(CG组)和模型组(MG组)。CG组大鼠5只/笼,自由摄食饮水,不予刺激。MG组大鼠采用孤养(1只/笼)结合CUS诱导建立大鼠抑郁症模型。根据本实验室前期造模方法并稍加修改,采用的刺激方式包括空笼+禁食、噪音3 h、闪频3 h、热水浴5 min(45 ℃)、冰水浴5 min(4 ℃)、通宵照明、潮湿垫料24 h、倾斜24 h、夹尾1 min、禁饮禁食24 h、电击5 min、昼夜颠倒、水平振荡10 min,每天随机给予一种刺激,4 d内不出现同种刺激方式。
1.2.2开场实验 使用规格为100 cm×100 cm×40 cm内部涂为黑色的木质敞箱,箱底部使用白色胶带均分成20 cm×20 cm的正方形格子。在昏暗安静的环境中,将大鼠至于中央格,四爪着地后开始计时,记录大鼠5 min内穿越格子数(四爪进入视为1次)、水平站立数、整理次数及大小便次数,相加得开场实验得分。
1.2.3强迫游泳实验 在安静的环境中,将被测试大鼠放入高60 cm、直径20 cm、水深30 cm的透明圆柱形玻璃桶中,水温(23±3)℃,经过2 min的适应期后,记录后5 min内的累积不动时间。
1.2.4取材 在实验第29天以4%水合氯醛(1 mL/100 g)麻醉后断头取脑,于冰上分离前脑皮层和海马并置于冻存管中,立即放入液氮中短期保存,后放置于-80 ℃冰箱保存备用。
1.2.5qRT-PCR法测定海马和皮层的IDO mRNA的表达 分别取海马和皮层40~100 mg,使用通过DEPC水浸泡过的匀浆器研磨(注意该过程使用的枪头镊子等均高压灭酶),用Trizol提取样本总RNA,并测定总RNA浓度,以1 μg/20 μL为反应体系进行逆转录,同时参照Genbank中大鼠的基因序列(由Takara公司设计合成)。IDO:上游引物5′-GAC ACC TTT TTC CAC GTT CTT C-3′,下游引物5′-TCA CCA ACG TCA TGC TTT ATT C-3′,长度185 bp;β-actin:上游引物5′-GCA GGA GTA CGA TGA GTC CG-3′,下游引物5′-CCT GAC AAT GAC TCG ACG CA-3′,长度74 bp。利用SYBR Green荧光技术在Bio-Rad CFX96荧光定量PCR仪上进行扩增,条件如下:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s;40个循环。以β-actin为内参,反应结果以Ct值表示,以2-△△Ct计算目的基因的相对表达量。
1.2.6Western blot法检测IL-1β、IL-6及IDO蛋白的表达 海马和皮层分别称取40~100 mg,在冰上加入裂解液后研磨,提取总蛋白,并用BCA法测定总蛋白浓度,按总体积的4∶1的比例加入上样缓冲液沸水煮10 min。每孔上样30 μg,按顺序采用SDS-聚丙烯酰胺凝胶电泳、PVDF转膜,5%脱脂牛奶封闭2.5 h,加入对应的一抗(以β-actin为内参)4 ℃孵育过夜,洗膜,加入辣根过氧化物酶标记的二抗(1∶3 000稀释),洗膜后用发光液(Advanstor 公司)显色,凝胶成像仪成像后,用Image Lab软件(Bio-Rad)分析结果。
1.3统计学处理 应用Graph Pad Prism 5.0统计软件对数据进行分析整理及作图,组间采用两独立样本t检验比较,以P<0.05为差异有统计学意义。
2 结 果
2.1孤养结合CUS对大鼠行为学的影响 MG组大鼠与CG组相比,其开场实验得分显著降低(P<0.01);与CG组大鼠相比,MG组大鼠不动时间显著延长(P<0.01),见图1。孤养结合CUS成功诱导大鼠产生焦虑、绝望样抑郁行为,模型建立成功。
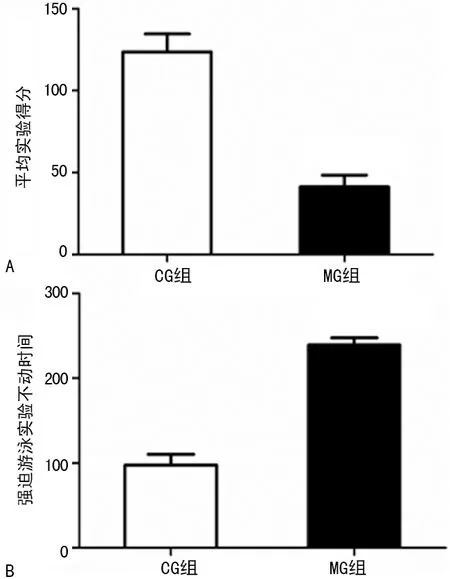
A:对开场实验得分的影响;B:对强迫游泳实验不动时间的影响
图1孤养结合CUS对大鼠行为学测试的影响
2.2孤养结合CUS对大鼠皮层和海马IL-1β、IL-6蛋白表达的影响 与CG组相比,MG组大鼠皮层和海马IL-1β、IL-6蛋白表达均明显增高(P<0.05),见图2。
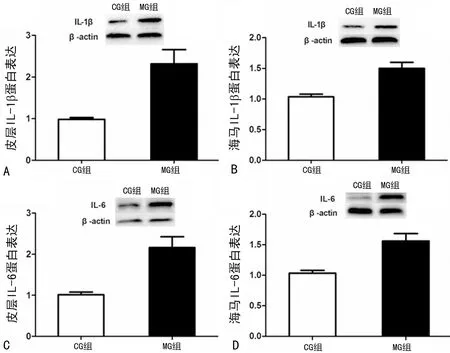
A:大鼠皮层IL-1β蛋白表达变化;B:大鼠海马IL-1β蛋白表达变化;C:大鼠皮层IL-6蛋白表达变化;D:大鼠海马IL-6蛋白表达变化
图2 Western blot法检测抑郁大鼠脑内IL-1β、IL-6蛋白表达变化
2.3孤养结合CUS对大鼠皮层和海马IDO mRNA及蛋白表达的影响 与CG组相比,MG组大鼠皮层和海马IDO mRNA及蛋白表达均明显增高(P<0.01),见图3。
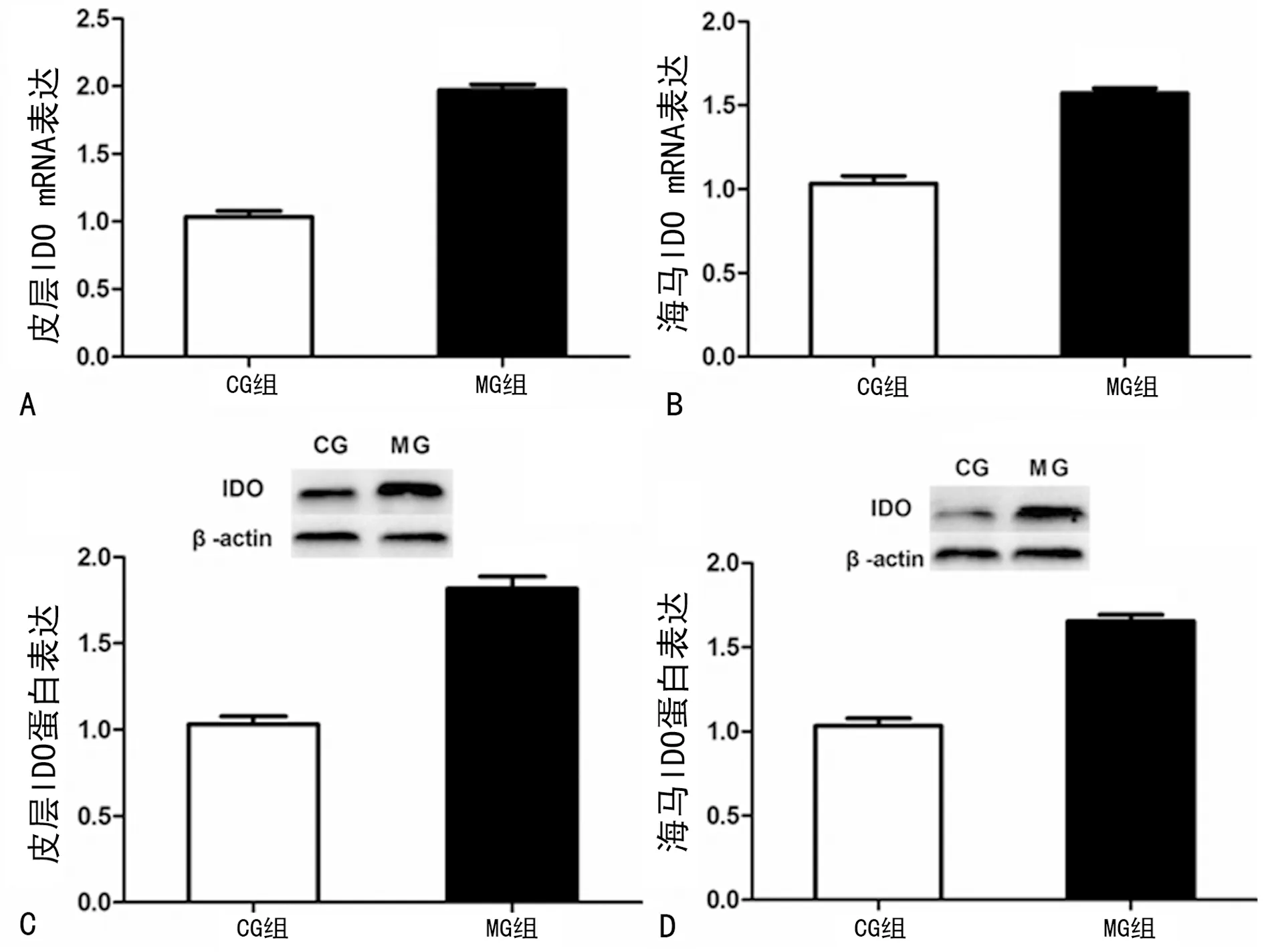
A:大鼠皮层IDO mRNA表达变化;B:大鼠海马IDO mRNA表达变化;C:大鼠皮层IDO蛋白表达变化;D:大鼠海马IDO蛋白表达变化
图3 qRT-PCR法及Western blot检测大鼠脑内IDO mRNA及蛋白表达变化
3 讨 论
抑郁症发病机制复杂,涉及社会、遗传、环境等众多因素。目前,国内外抑郁症的临床治疗和研究方向均主要集中在单胺递质系统功能的调节,但该类药物治疗无效率高达30%~40%,且治疗后也可能出现抑郁症状持续存在及复发的风险[8-9],给家庭及社会造成巨大的经济压力和社会负担。因此,进一步探索抑郁症发病机制,寻找药物防治新靶点具有十分重要的现实意义。本研究采用CUS建立大鼠抑郁模型[10],该模型可模拟抑郁患者在社会环境中接受的多种慢性刺激,是常用的慢性抑郁症模型之一。在行为学指标测定中,开场实验和被动游泳是评价大鼠抑郁行为的常用指标。结果显示,与CG组相比,MG组大鼠开场试验得分显著降低,提示其对新异环境的探究行为显著下降;MG组大鼠被动游泳实验中不动时间显著延长,提示其出现显著焦虑、绝望样抑郁行为改变,模型建立成功。
应激作为抑郁症发生的常见危险因素,可通过激活免疫系统及炎症反应,促进细胞因子释放而参与临床抑郁症的发生[11]。“抑郁症的细胞因子学说”指出,抑郁症的发生可能与炎症细胞因子释放及IDO激活等因素相关。细胞因子是一类主要由活化的免疫细胞合成和释放的可参与免疫反应、细胞生长、组织损伤修复等的可溶性小分子蛋白质。细胞因子在体内形成复杂的细胞因子调节网络,通过旁分泌、自分泌或内分泌等方式发挥相应的生理或病理作用。在多种神经系统疾病中均发现有炎症细胞因子的合成和释放增多,包括IL-1β、IL-6等。近年来研究发现,这些炎症细胞因子可能通过影响神经-免疫-内分泌调节和5-HT代谢障碍参与抑郁症的发生、发展,但尚缺乏系统研究[12-13]。目前,大量研究均发现抑郁症患者血清及脑脊液IL-1β、IL-6等炎症因子显著升高[14-18],提示这些细胞因子的激活可能参与了抑郁症的发生,但缺乏大脑实质内细胞因子变化的相关研究资料。研究结果显示,与CG组相比,MG组大鼠大脑皮层及海马IL-1β、 IL-6蛋白表达显著增加,提示大鼠抑郁行为与脑内炎症因子表达增高密切相关,并与前述临床研究结果相互印证。IDO是一种细胞内的含亚铁血红素的酶,是催化色氨酸沿犬尿氨酸通路代谢的限速酶。多种炎症细胞因子可通过过度激活IDO,诱导色氨酸主要沿犬尿氨酸途径代谢,引起色氨酸耗竭并继发5-HT合成不足,同时该途径产生的3-羟犬尿氨酸、喹啉酸等神经毒性产物也可能参与了抑郁症的发生。本研究结果显示,与CG组相比,MG组大鼠海马和皮层IDO mRNA及蛋白表达均显著升高,提示脑内出现IDO过度激活,继而可能导致色氨酸-犬尿氨酸代谢途径的过度激活,造成色氨酸耗竭和5-HT合成不足,参与抑郁症的发病。
综上所述,孤养结合CUS诱导大鼠抑郁行为可能与脑内炎症因子表达增高并诱导IDO过表达密切相关,在下一步实验中笔者将采用IDO拮抗剂及炎症因子拮抗剂来验证这一推测。
[1]SOUZA L C,JESSE C R,ANTUNES M S,et al.Indoleamine-2,3-dioxygenase mediates neurobehavioral alterations induced by an intracerebroventricular injection of amyloid-β1-42 peptide in mice[J].Brain Behav Immun,2016,56(4):363-377.
[2]JUNG I D,LEE M G,CHANG J H,et al.Blockade of indoleamine 2,3-dioxygenase protects mice against lipopolysaccharide-induced endotoxin shock[J].J Immunol,2009,182(5):3146-3154.
[3]KUNZ M,CERESE K M,GOI P D,et al.Serum levels of IL-6,IL-10 and TNF-α in patients with bipolar disorder and schizophrenia:differences in pro- and anti-inflammatory balance[J].Rev Bras Psiquiatr,2011,33(3):268-274.
[4]TAKIKAWA O.Clinical aspects of indoleamine 2,3-dioxygenase (IDO)-initiated tryptophan metabolism:IDO is a target of drug discovery for various diseases[J].Int Cong,2007,1304:290-297.
[5]MAES M,LEONARD B E,MYINT A M,et al.The new′5-HT′hypothesis of depression:cell-mediated immune activation induces indoleamine 2,3-dioxygenase,which leads to lower plasma tryptophan and an increased synthesis of detrimental tryptophan catabolites(TRYCATs),both of which contribute to the onset of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(3):702-721.
[6]MIURA H,OZAKI N,SAWADA M,et al.A Link between stress and depression:shifts in the balance between the kynurenine and serotonin pathways of tryptophan metabolism and the etiology and pathophysiology of depression[J].Stress,2008,11(3):198-209.
[7]HEPGUL N,MONDELLI V,PARIANTE C M.Psychological and biological mechanisms of cytokine induced depression[J].Epidemiol Psichiatr Soc,2010,19(2):98-102.
[8]THASE M E,HAIGHT B R,RICHARD N,et al.Remission rates following antidepressant therapy with bupropion or selective serotonin reuptake inhibitors:a meta-analysis of original data from 7 randomized controlled trials[J].J Clin Psychiatry,2005,66(8):974-981.
[9]GHAEMI S N.Why antidepressants are not antidepressants:STEP-BD,STAR*D,and the return of neurotic depression[J].Bipolar Disord,2008,10(8):957-968.
[10]胡小娅,李娜,费慧芝,等.瑞波西汀抗抑郁作用的非转运体抑制机制研究[J].第三军医大学学报,2012,34(19):1977-1980.
[11]HUGHES M M,CONNOR T J,HARKIN A.Stress-Related immune markers in depression:implications for treatment[J].Int J Neuropsychopharmacol,2016,19(6):pyw001.
[12]DANTZER R,CAPURON L,IRWIN M R,et al.Identification and treatment of symptoms associated with inflammation in medically ill patients[J].Psychoneuroendocrinology,2008,33(1):18-29.
[13]IRWIN M R,MILLER A H.Depressive disorders and immunity:20 years of progress and discovery[J].Brain Behav Immun,2007,21(4):374-383.
[14]MOTA R,GAZAL M,ACOSTA B A,et al.Interleukin-1β is associated with depressive episode in major depression but not in bipolar disorder[J].J Psychiatr Res,2013,47(12):2011-2014.
[15]KHANDAKER G M,PEARSON R M,ZAMMIT S,et al.Association of serum interleukin 6 and C-reactive protein in childhood with depression and psychosis in young adult life:a population-based longitudinal study[J].JAMA Psychiatry,2014,71(10):1121-1128.
[16]KEM S,SKOOQ I,BRJESSON-HANSON A,et al.Higher CSF interleukin-6 and CSF interleukin-8 in current depression in older women.Results from a population-based sample[J].Brain Behav Immun,2014,41(1):55-58.
[17]MARTINEZ J M,GARAKANI A,YEHUDA R,et al.Proinflammatory and“resiliency”proteins in the CSF of patients with major depression[J].Depress Anxiety,2012,29(1):32-38.
[18]FELGER J C,LOTRICH F E.Inflammatory cytokines in depression:neurobiological mechanisms and therapeutic implications[J].Neuroscience,2013,246(5):199-229.
