基于线性回归的玉米生物量预测模型及验证
2018-06-05仇瑞承苗艳龙
仇瑞承,苗艳龙,张 漫※,李 寒,孙 红
(1. 中国农业大学现代精细农业系统集成研究教育部重点实验室, 北京 100083; 2. 中国农业大学农业部农业信息获取技术重点实验室,北京100083)
0 引 言
玉米生物量可以表征玉米生长过程中的株型结构、光吸收和碳同化情况、营养状况等,是玉米生态学参数的一个重要指标[1-2]。玉米生物量包括地表生物量和地下生物量两部分[3]。由于地下生物量难以测量,地表生物量也可以用于评估玉米地下根系的长势,所以大部分研究集中在玉米地表生物量的测量[4]。
传统的玉米地表生物量测量多是破坏性的,通过人工采集玉米植株,称量其鲜质量后,进行干燥处理,再测量干质量。这种测量方法工作量大,且对玉米的破坏是不可逆的。因此,目前国内外对玉米生物量的测量研究,多是应用玉米相关表型参数来估算其生物量,建立生物量的测量或者预测模型[5]。Freeman等[6]的研究表明,玉米株高是估算玉米生物量的重要指标,Wang等[7]、Li等[8]、Tilly等[9]在研究中应用机载雷达测量玉米株高,用以估算玉米生物量,决定系数大于 0.80。但是,应用单一变量预测玉米生物量,存在模型鲁棒性差等缺陷。
氮元素作为作物生长不可缺少的元素,直接影响作物生物量的积累[10-12],Mistele等[13]指出应用光谱传感器测量玉米的氮含量也可以预测玉米生物量,Montes等[14]将光栅传感器测得的玉米株高与光谱传感器测得的光谱数据,采用支持向量机的方法进行回归分析,进而对玉米生物量进行预测,提高了模型的准确度,决定系数达到 0.97。此外,应用光谱数据也可推算玉米的植被指数[15-16],如叶面积指数 LAI[6]、归一化植被指数NDVI[4,17-19]、土壤校正植被指数SAVI[20]等,将其与玉米株高相结合,也可对玉米生物量进行高精度的预测[21]。但是,应用光谱传感器测量玉米的氮含量及植被指数易受外界光照影响,使得测量结果存在差异,且其设备价格昂贵,测量成本较高。
Pordesimo等[22]、Ciampitti等[23]通过分析玉米茎杆,提出应用玉米茎粗和株高预测玉米生物量,决定系数分别达到0.83和0.75。但是研究所提出的模型较为复杂,茎杆待测量部位为玉米茎杆中部,茎粗参数较难获得。
针对上述问题,本文拟以玉米株高、茎杆末端的长轴、短轴为输入参数,进行线性回归分析,建立玉米小喇叭口期的地表生物量预测模型,并应用所建立的模型对玉米大喇叭口期的生物量进行预测,以评估模型的通用性,从而为实现玉米生物量的快速测量提供理论依据。
1 材料与方法
1.1 数据获取
试验地点为中国农业大学上庄实验站(40.08°N,116.11°E)。试验用玉米品种为平展型的农大84和紧凑型的京农科728。玉米于2015年5月21日播种,行长度12 m,行距60 cm,株距30 cm,每个品种各45行。相关参数测量日期分别为2015年6月21日(小喇叭口期)和2015年6月28日(大喇叭口期)。测量时,每3~4行选择 1行目标行,在目标行选择具有代表性的样本 4~5个,分别测量玉米的株高 H(玉米叶片最高点至地面的距离)和最底端茎节的长轴L、短轴S,然后收获玉米的地上部分,装入塑封袋中密封。试验当天将样本运输到实验室,人工称量玉米植株的鲜质量 FW 后,放入烘干箱进行烘干,烘干温度为75 ℃,待玉米植株质量恒定后称量其干质量DW。
1.2 数据处理
首先对获得的玉米株高、茎粗和生物量数据进行筛选,剔除异常数据;然后应用SPSS软件对玉米小喇叭口期的数据进行线性回归分析,建立玉米生物量的预测模型,并应用玉米大喇叭口期的数据对模型进行验证。
1.2.1 数据筛选
计算玉米样本鲜质量和干质量的比值,得到玉米各生育期的质量含水率[24]。对玉米样本数据进行筛选,剔除含水率远高于均值的样本,获得农大84小喇叭口期样本40例和大喇叭口期样本40例,京农科728小喇叭口期样本40例和大喇叭口期样本37例。应用玉米小喇叭口期样本数据进行建模分析,应用大喇叭口期样本数据对模型进行检验。
1.2.2 数据分析
以玉米株高H、茎杆长轴L、茎杆短轴S为自变量,玉米鲜质量FW、干质量DW为因变量,应用SPSS软件和Matlab软件对样本数据进行分析,包括共线性检验、线性回归分析、事后检验和交叉验证。
首先,对回归分析中的自变量进行共线性检验。计算自变量之间的相关系数,选择方差膨胀因子(VIF)作为评判指标[25],如式(1)所示。

式中 r表示自变量之间的相关系数。如果 VIF值大于10[26],则认为自变量之间存在共线性。
应用SPSS软件对样本数据进行线性回归分析,包括多元线性回归和逐步回归。应用玉米小喇叭口期的数据建立玉米鲜质量、玉米干质量的预测模型,并对玉米大喇叭口期的数据进行测试。选用决定系数 R2、均方根误差RMSE(式(2))和相对均方根误差rRMSE(式(3))作为模型预测精度的评价指标[5]。
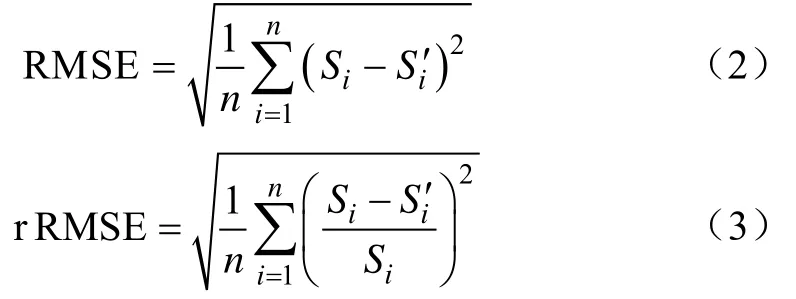
式中 n表示样本数量,Si表示人工测量值,iS′表示预测值。通常较大的R2、较小的RMSE和rRMSE表明回归效果较好。选用 P值对回归模型中各参数的显著性进行检验,评价标准如下:

在P<0.05条件下,进行单因素方差分析(ANOVA)Duncan检验,以评估不同模型之间的差异性[27]。应用Matlab软件,采用“留一法”对模型进行交叉验证。
2 结果与分析
2.1 玉米小喇叭口期生物量模型
2.1.1 样本特征
对农大84和京农科728样本数据进行分析,在不同生育时期的主要特征参数如表1所示。由表1可知,玉米的鲜质量、干质量与玉米株高、茎杆长轴、短轴相比,具有较高的变异系数,呈现更广的空间变异。

表1 农大84、京农科728样本的主要特征Table 1 Main characteristics of Nongda 84 and Jingnongke 728 samples
2.1.2 变量共线性检验
为了保证线性回归的准确性,对自变量玉米株高H,茎杆长轴L和茎杆短轴S进行共线性检验。农大84和京农科728中,3个参数之间的相关系数、VIF值如表2所示。农大84的VIF值范围为1.090~2.342;京农科72的VIF值范围为1.393~2.189,都满足VIF<10,表明H、L、S之间的共线性可以被忽略,3个自变量都可用于建立模型。
2.1.3 玉米生物量预测多元回归模型建立
分别以H、L、S单一变量为自变量,或几个变量组合为自变量,以玉米小喇叭口期鲜质量FW,干质量DW为因变量,建立多元回归模型。农大84、京农科728的鲜质量、干质量预测模型如表3所示。
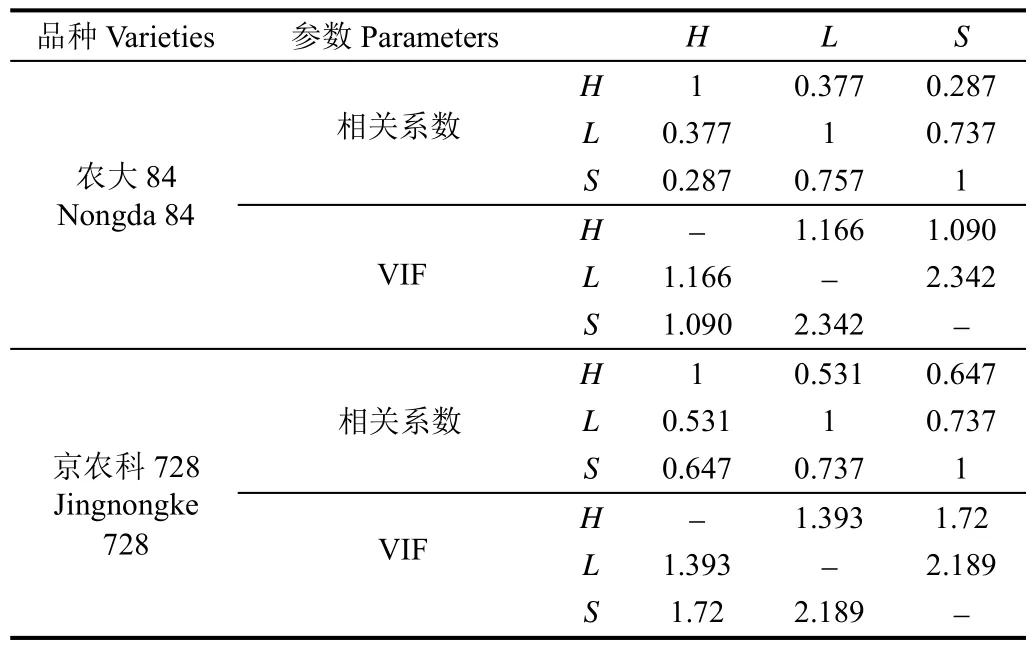
表2 农大84、京农科728中H、L、S间的相关系数和VIF值Table 2 Correlations and VIF values among H, L, and S of Nongda 84 and Jingnong 728

表3 农大84、京农科728生物量模型及评价Table 3 Biomass model and evaluation indicators of Nongda 84 and Jingnongke 728
上述生物量模型中,各自变量P值均小于0.001,表明统计结果非常显著。
以H、L和S为单一输入量,建立表3中的模型1、2、3。由结果可知,L、S与玉米鲜质量和干质量的相关性高于H,且模型2、3的精度优于模型1。
以 H、L、S为输入量,建立的生物量预测模型 4,与玉米鲜质量和干质量呈现的相关性最高,且预测精度也最高。针对农大84的鲜质量和干质量,模型4的决定系数R2分别为0.908和0.910;均方根误差RMSE分别为5.503和0.575 g;相对均方根误差rRMSE分别为7.21%和 7.05%。针对京农科 728的鲜质量和干质量,模型 4的决定系数R2分别为0.919和0.929;均方根误差RMSE分别为6.408和0.533 g;相对均方根误差rRMSE分别为7.70%和6.79%。
在玉米的鲜质量和干质量中,玉米茎杆质量所占比例最高,且玉米茎杆横切面近似为椭圆,玉米茎杆可近似看作一椭圆柱体,可由此建立玉米生物量模型。椭圆的面积、椭圆柱体的体积可分别由式(5)、(6)计算获得。
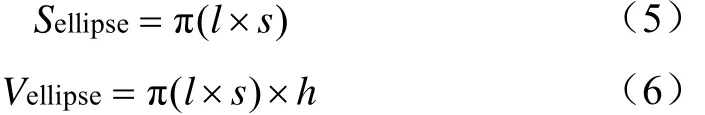
式中Sellipse表示椭圆面积,l、s分别表示椭圆的长半轴和短半轴,Vellipse表示椭圆柱体体积,h表示柱体高度。以此为依据,建立表3中的模型5~9。其中,模型5、6与Ciampitti等[23]建立的玉米生物量模型相似。
由表3的回归结果可知,模型7的拟合效果最优,优于模型5、6。针对农大84的鲜质量和干质量,模型7的决定系数R2分别为0.874和0.877;均方根误差RMSE分别为6.449和0.674 g;相对均方根误差rRMSE分别为8.02%和8.00%。针对京农科728的鲜质量和干质量,模型 7的决定系数 R2分别为 0.893和0.903;均方根误差RMSE分别为7.363和0.628 g;相对均方根误差rRMSE分别为8.82%和7.48%。
2.1.4 玉米生物量预测逐步回归模型建立
参考多元线性回归所建立的模型,以H、L、S、S×H、L×H、L×S、L×S×H 为自变量,FW、DW 为因变量,应用逐步回归方法,建立玉米生物量预测模型。逐步回归方法可确保模型中只包含显著性变量,可与多元线性回归模型进行比较。农大84和京农科728的鲜质量、干质量预测模型如图1所示。
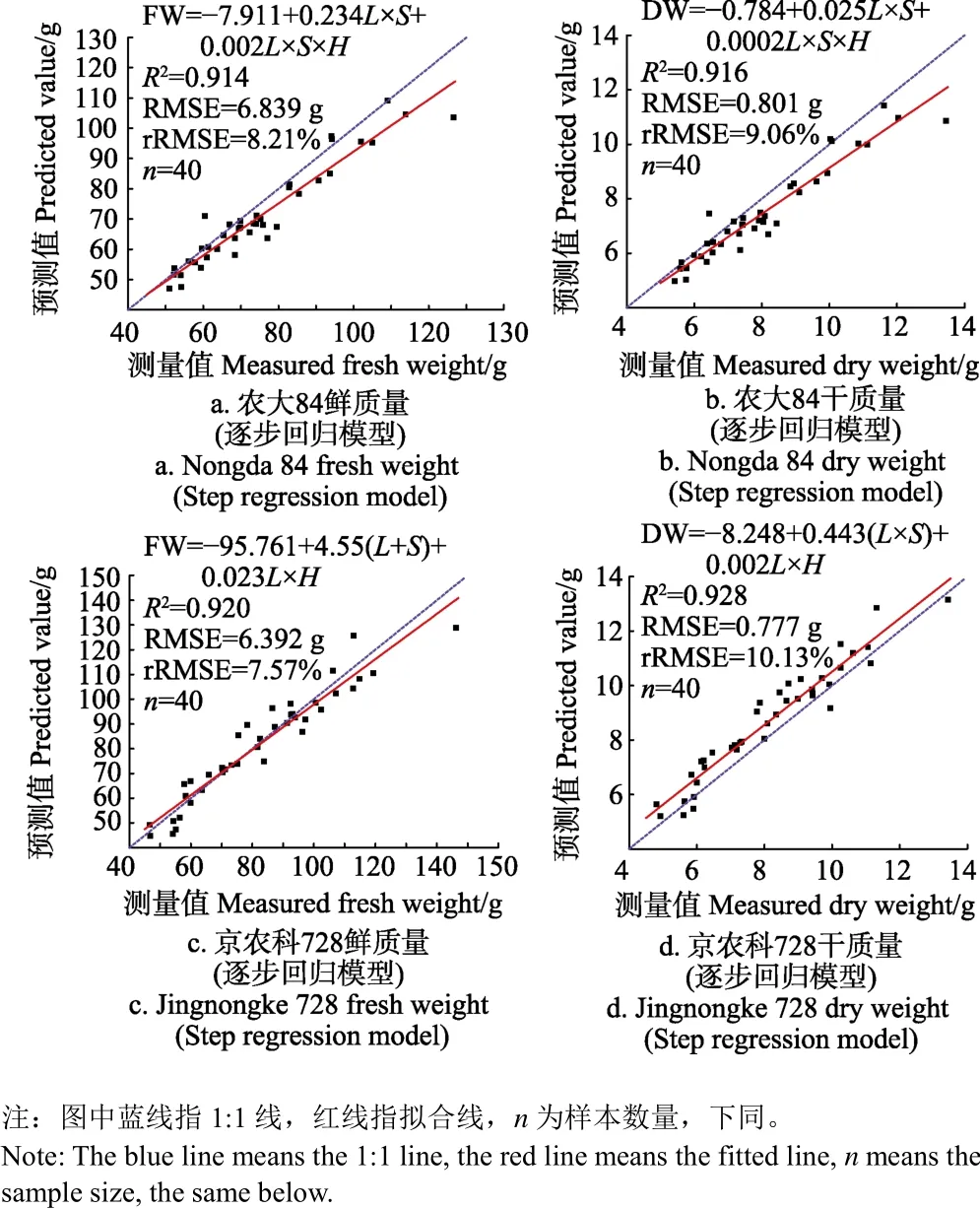
图1 小喇叭口期玉米生物量逐步回归模型预测值与实测值比较Fig.1 Comparison of measured value and step regression model predicted value of maize biomass at small trumpet stage
其中,针对农大84的鲜质量和干质量,模型的决定系数R2分别为0.914和0.916;均方根误差RMSE分别为6.839和0.801 g;相对均方根误差rRMSE分别为8.21%和9.06%。针对京农科728的鲜质量和干质量,模型的决定系数R2分别为0.920和0.928;均方根误差RMSE分别为6.392和0.777 g;相对均方根误差rRMSE分别为7.57%和10.13%。
2.1.5 模型交叉验证
为了从有限的样本数据中获得尽可能多的信息,采用“留一法”[28]对多元回归模型4、7和逐步回归模型进行内部交叉验证,以检验模型的稳定性和可靠性,结果如表 4所示。由交叉验证结果可知,交叉验证获得的决定系数R2和均方根误差RMSE[29]与原模型相近。与原模型相比,模型4的决定系数差值小于0.027,RMSE的差值小于 0.993和 0.081 g;模型 7的决定系数差值小于0.016,RMSE的差值小于0.503和0.039 g;逐步回归模型的决定系数差值小于 0.017,RMSE的差值小于 1.016和0.192 g,说明所建模型具有较好的稳定性和预测能力。

表 4 农大84、京农科728小喇叭口期生物量模型交叉验证Table 4 Cross-validation of biomass model for Nongda 84 and Jingnongke 728 at small trumpet stage
2.2 玉米大喇叭口期生物量预测
随着玉米的生长,田间采样难度逐渐增大,玉米的烘干时间也相应延长,人工测量玉米生物量变得更加困难。应用2.1节建立的玉米生物量模型对玉米大喇叭口期生物量进行预测,以降低生物量测量的工作强度。
单因素方差分析结果显示,表 3所建立的多元回归模型4、7和2.1.4节所建立的逐步回归模型没有明显差异,应用 3个模型对大喇叭口期数据进行检验,预测值与实测值比较结果如图2、图3所示。

图2 农大84大喇叭口期生物量预测值与实测值比较Fig.2 Comparison of measured value and model predicted value for Nongda 84 biomass at large trumpet stage
由图2可知,多元回归模型4、7和逐步回归模型对农大84大喇叭口期的生物量预测精度较高,其中逐步回归模型的决定系数最高,且RMSE、rRMSE值最低,针对鲜质量和干质量,其决定系数分别为 0.866、0.875,RMSE分别为30.790和2.752 g,rRMSE分别为13.53%、11.41%。多元回归模型 7的预测精度略低于逐步回归模型,针对鲜质量和干质量,其决定系数分别为 0.860和0.863,RMSE分别为36.047和2.957 g,rRMSE分别为17.83%和12.39%。但其模型相对简单,不需要株高H参与运算,可降低生物量测量的工作量。

图3 京农科728大喇叭口期生物量预测值与实测值比较Fig.3 Comparison of measured value and model predicted value for Jingnongke 728 biomass at large trumpet stage
由图3可知,多元回归模型4、7和逐步回归模型对京农科 728大喇叭口期的生物量预测精度较低,都具有较小的决定系数和较大的RMSE、rRMSE。3个模型中,多元回归模型7的预测精度最高,RMSE、rRMSE较小,其对京农科 728大喇叭口期的鲜质量的决定系数为0.539,RMSE为46.338 g,rRMSE为17.08%,对干质量的决定系数为0.496,RMSE为7.298 g,rRMSE为25.67%。
由图2、图3可知,应用玉米小喇叭口期的生物量模型对大喇叭口期的生物量进行预测,农大84的预测精度优于京农科728。农大84为平展型玉米,光照大部分集中于植株的上方,尤其在田间封垄后,影响作物的光能利用率。而京农科 728为紧凑型玉米,上部叶片向上挺举,株型较高,尤其在玉米生长后期特征更加明显。该株型扩大了玉米的光合面积,群体受光率远远优于平展型玉米,生物量能够快速积累[30]。穗期的玉米生长迅速,应用京农科 728小喇叭口期的生物量模型预测大喇叭口期生物量,使得预测结果偏差较大。
3 结 论
1)本文对单株玉米生物量样本数据进行分析,以单株玉米测得的株高和茎粗参数为输入,建立玉米生物量的线性回归模型。结果表明,与玉米株高参数相比,玉米茎粗与生物量的相关性较高,其决定系数高于0.738,可应用茎粗参数建立模型预测玉米生物量。
2)应用玉米的株高、茎粗参数建立了玉米小喇叭口期的生物量预测模型。其中,本文所提出的多元回归模型4、7和逐步回归模型对平展型农大84、紧凑型京农科728都具有较好的适用性,针对鲜质量和干质量,模型的决定系数分别高于 0.874和 0.877,RMSE分别小于 7.363和0.801 g、rRMSE分别小于8.82%和10.13%。对模型的“留一法”交叉验证结果表明,模型具有较好的稳定性,可用于玉米小喇叭口期生物量的测量。
3)应用建立的玉米小喇叭口期生物量预测模型对玉米大喇叭口期生物量进行预测,平展型农大84的预测效果优于紧凑型京农科 728。逐步回归模型对平展型农大84大喇叭口期鲜质量和干质量的预测精度最高,其决定系数分别为0.866和0.875,RMSE分别为30.790和2.752 g,rRMSE分别为13.53%和11.41%,具有较好的适用性,可用于平展型玉米大喇叭口期生物量的预测。
[1] 张凤霞. 密度、个体大小和种子大小对作物生物量分配的影响[D]. 杨凌: 西北农林科技大学, 2016.Zhang Fengxia. Effect of Density, Individual and Seed size on Distribution of Biomass[D]. Yangling: Northwest A&F University, 2016. (in Chinese with English abstract)
[2] 张学林,赵亚丽,赵胜超,等. 氮肥对夏玉米灌浆期地上部器官生物量分配的影响[J]. 西北农林学报, 2013, 22(2):39-46.Zhang Xuelin, Zhao Yali, Zhao Shengchao, et al. Effects of nitrogen fertilization on distribution of aboveground biomass of summer maize during the filling stage[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2013, 22(2): 39-46.(in Chinese with English abstract)
[3] Dietzel R, Jarchow M E, Liebman M. Above- and belowground growth, biomass, and nitrogen use in maize and reconstructed prairie cropping systems[J]. Crop Science,2015, 55: 910-923.
[4] 郑阳. 作物生物量遥感估算方法研究[D]. 北京: 中国科学院遥感与数字地球研究所, 2017.Zheng Yang. Research on Biomass Estimation of Crops with Remote Sensing[D]. Beijing: Chinese Academy of Sciences,Institute of Remote Sensing and Digital Earth, 2017. (in Chinese with English abstract)
[5] Marshall M, Thenkabail P. Developing in situ non-destructive estimates of crop biomass to address issues of scale in remote sensing[J]. Remote Sensing, 2015, 7(1):808-835.
[6] Freeman K W, Girma K, Arnall D B, et al. By-plant prediction of corn forage biomass and nitrogen uptake at various growth stages using remote sensing and plant height[J]. Agronomy Journal, 2007, 99(2): 530-536.
[7] Wang C, Nie S, Xi X, et al. Estimating the biomass of maize with hyperspectral and LiDAR data[J]. Remote Sensing,2017, 9(1): 11-22.
[8] Li W, Niu Z, Huang N, et al. Airborne LiDAR technique for estimating biomass components of maize: a case study in Zhangye city, Northwest China[J]. Ecological Indicators,2015, 57: 486-496.
[9] Tilly N, Hoffmeister D, Schiedung H, et al. Terrestrial laser scanning for plant height measurement and biomass estimation of maize[C]// ISPRS International Archives of Photogrammetry, Remote Sensing and Spatial Information Sciences, 2014, XL-7: 181-187.
[10] Mistele B, Schmidhalter U. Tractor-based quadrilateral spectral reflectance measurements to detect biomass and total aerial nitrogen in winter wheat[J]. Agronomy Journal, 2010,102(2): 499-506.
[11] Serrano L, Filella I, Penuelas J. Remote sensing of biomass and yield of winter wheat under different nitrogen supplies[J].Crop Science, 2000, 40: 723-731.
[12] Teixeira E I, George M, Herreman T, et al. The impact of water and nitrogen limitation on maize biomass and resource-use efficiencies for radiation, water and nitrogen[J].Field Crops Research, 2014, 168(8): 109-118.
[13] Mistele B, Schmiahalter U. Spectral measurements of the total aerial N and biomass dry weight in maize using a quadrilateral-view optic[J]. Field Crops Research, 2008,106(1): 94-103.
[14] Montes J M, Technow F, Dhillon B S, et al. High-throughput non-destructive biomass determination during eraly plant development in maize under field conditions[J]. Field Crops Research, 2011, 121(2): 268-273.
[15] Wang C, Nie S, Xi X, et al. Estimating the biomass of maize with hyperspectral and LiDAR data[J]. Remote Sensing,2017, 9(1): 11-22.
[16] Battude M, Al Bitar A, Morin D, et al. Estimating maize biomass and yield over large areas using high spatial and temporal resolution Sentinel-2 like remote sensing data[J].Remote Sensing of Environment, 2016, 184: 668-681.
[17] Zheng Y, Zhang M, Wu B. Using high spatial and temporal resolution data blended from SPOT-5 and MODIS to map biomass of summer maize[C]//In Fifth International Conference on Agro-Geoinformatics, IEEE, 2016: 1-5.
[18] Kross A, Mcnairn H, Lapen D, et al. Assessment of RapidEye vegetation indices for estimation of leaf area index and biomass in corn and soybean crops[J]. International Journal of Applied Earth Observation and Geoinformation,2015, 34: 235-248.
[19] 刘明,冯锐,纪瑞鹏,等. 基于 MODIS-NDVI的春玉米叶面积指数和地上生物量估算[J]. 中国农学通报, 2015,31(6): 80-87.Liu Ming,Feng Rui,Ji Ruipeng,et al. Estimation of leaf area index and aboveground biomass of spring maize by MODIS-NDVI[J]. Chinese Agricultural Science Bulletin,2015, 31(6): 80-87. (in Chinese with English abstract)
[20] 武婕,李玉环,李增兵,等. 基于 SPOT-5遥感影像估算玉米成熟期地上生物量及其碳氮累积量[J]. 植物营养与肥料学报,2014,20(1):64-74.Wu Jie, Li Yuhuan, Li Zengbing, et al. Estimation of biomass and C and N accumulation at the maturity stage of corn using synchronous SPOT-5 spectral parameters[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(1): 64-74. (in Chinese with English abstract)
[21] Tilly N, Aasen H, Bareth G. Fusion of plant height and vegetation indices for the estimation of barley biomass[J].Remote Sensing, 2015, 7(9): 11449-11480.
[22] Pordesimo L O, Edens W C, Sokhansanj S. Distribution of aboveground biomass in corn stover[J]. Biomass and Bioenergy, 2004, 26(4): 337-343.
[23] Ciampitti I A, Zhang H, Friedemann P, et al. Potential physiological frameworks for mid-season field phenotyping of final plant nitrogen uptake, nitrogen use efficiency, and grain yield in maize[J]. Crop Science, 2012, 52: 2728-2742.[24] Pandey P, Ge Y, Stoerger V, et al. High throughput in vivo analysis of plant leaf chemical properties using hyperspectral imaging[J]. Frontiers in Plant Science, 2017, 8: 1348.
[25] Rouphael Y, Mouneimne A H, Ismail A, et al. Modeling individual leaf area of rose (Rosa hybrida L.) based on leaf length and width measurement[J]. Photosynthetica, 2010,48(1): 9-15.
[26] Mousavi B A, Karimian F Z, Bannayan M. Modeling individual leaf area of basil (Ocimum basilicum) using different methods[J]. International Journal of Plant Production, 2011, 5(4): 439-448.
[27] Li W, Niu Z, Chen H, et al. Remote estimation of canopy height and aboveground biomass of maize using high-resolution stereo images from a low-cost unmanned aerial vehicle system[J]. Ecological Indicators, 2016, 67: 637-648.
[28] 汪景荣,张卓勇,张振伟,等. 偏最小二乘法和THz-TDS在正品大黄鉴定中的应用[J]. 光谱学与光谱分析,2016,36(2):316-321.Wang Jingrong, Zhang Zhuoyong, Zhang Zhenwei, et al.Identification of official rhubarb samples by using PLS and terahertz time-domain spectroscopy[J]. Spectroscopy and Spectral Analysis, 2016, 36(2): 316-321. (in Chinese with English abstract)
[29] Lü X, Zhang T, Xiao F, et al. Noninvasive blood glucose analysis based on near-infrared reflectance spectroscopy[J].Spectroscopy and Spectral Analysis, 2016, 36(7): 2312-2317.
[30] 朱宇. 紧凑型杂交玉米高产性能的探索研究[J]. 北京农业,2015, 6: 9.
