外源酶制剂对烤烟烟叶香气品质及燃烧特性的影响
2018-06-05樊文举高娟娟张建新西北农林科技大学食品科学与工程学院陕西杨凌712100
樊文举,高娟娟,张建新(西北农林科技大学食品科学与工程学院, 陕西 杨凌 712100)
【研究意义】烟叶是卷烟工业的命脉,烟叶的好坏直接决定卷烟的品质[1]。优质烟叶不仅要求香气浓郁,还要求吃味醇和、劲头适中,而这些内在品质主要取决于烟叶中香气物质的种类和含量[2]。近年来,随着我国“减害降焦”目标的实现,在降低烟叶焦油量的同时,烟叶的香气品质也随之下降。【前人研究进展】为了保证烟草的香气质量,烟草科技工作者采取多种手段来对烟草进行提质增香研究,如改进栽培技术、改善烘烤工艺和人工加香等。其中,通过改进栽培技术和烘烤工艺提质增香的研究已经趋于成熟。目前,人们研究最多的是通过人工加香的方式来提升烟叶的香气品质,常用的增香剂主要有美拉德反应产物[3-4]、植物精油[5]、糖类物质和酶制剂等[6-8]。何邦华等[9]利用果胶酶对烟丝进行处理,结果发现烟丝美拉德反应产物增加了67.2 %。普元柱等[10]研究结果表明,经风味蛋白酶处理的烟叶感官品质明显改善,其中香气质变好,杂气和刺激性均得到了有效降低。同时燃烧性质作为烟叶最重要的物理性质之一,与烟气中各种化学成分密切相关。关于烟叶的物理性质,烟草工作者已进行了大量研究,王娟等[11]、樊军辉等[12]、武圣江等[13]分别研究了环境、品种和烘烤工艺对烟叶物理性质的影响。【本研究切入点】利用酶制剂对烟叶增香的研究主要针对烤后烟叶进行处理,对烤前鲜烟叶进行提质增香研究还相对较少,且酶制剂处理对烟叶燃烧特性影响的研究报道也较少。【拟解决的关键问题】本研究以秦岭烟区主栽品种YN99烟叶为试验材料,立足于前人对烟叶的酶解经验,选用中性蛋白酶、木瓜蛋白酶、风味蛋白酶、纤维素酶、果胶酶、糖化酶和α-淀粉酶等对采后鲜烟叶进行处理,以期改善陕西烟叶香气品质及物理性质,为该地区烤烟烟叶提质增香研究提供科学依据,同时为该地区农民增产增收提供技术指导。
1 材料与方法
1.1 试验材料
试验于2015年在陕西省商洛市镇安县青铜关镇丰收村进行。供试烟叶为当地主栽品种YN99,种植株距为50~53 cm,行距为110~115 cm,实验田土壤为红棕壤,肥力中等,按照优质烤烟的栽培生产技术规范进行田间管理。取样前,选择长势、株高、叶片数以及叶色基本一致且叶片完整并充分展开的烟株,以其中部烟叶(第8~12叶位)为试验材料,依据烟叶成熟采收技术标准,采取成熟度一致的烟叶。
1.2 试验设计
试验设7种不同酶处理,每种处理分别设置6个浓度水平,共42种酶处理,见表1。每个酶处理选取50片左右烟叶,用软毛刷轻轻将叶片表面杂尘除净,称量后放置于干净的塑料薄膜上。称取一定质量的酶制剂,用蒸馏水溶解后定容于1000 mL容量瓶中,计算出配制好的酶溶液中单位体积的酶活力单位。根据施加量的要求,用量筒量取一定体积的酶溶液,适当稀释后,用小型微雾喷雾器均匀地喷洒在烟叶表面,不进行任何处理的烟叶为空白对照CK,自然通风条件下晾制2~4 h,晾制时应避免阳光直射,然后进行编烟、烘烤。烘烤采用密集气流下降式烤房,烘烤方式为挂杆式烘烤,上、中、下3层均匀装烟,烘烤工艺采用八点式精准密集烤烟工艺。
1.3 测定项目及方法
1.3.1 香气成分的测定 准确称取1 g烟样,精确至0.001 g,置于15 mL顶空瓶中,加入10 μl内标溶液(407.68 μg/μl 乙酸苯乙酯溶液),加盖密封,放在自动进样槽中,进样前将老化好的萃取头插在顶空瓶中,于孵化器中70 ℃边振摇边吸附40 min,然后进行进样检测。
GC/MS条件:色谱柱DB-17MS(30 m×0.25 mm×0.25 μm),炉温箱初始温度40 ℃,保持3 min,以4 ℃/min升至120 ℃;以6 ℃/min升至240 ℃,保持12 min;进样口温度250 ℃;载气为氦气,流速1.93 mL/min,分流比为10。电离方式为EI,70 eV;传输线温度230 ℃;离子源温度230 ℃;质量扫描范围35~500 amu;发射电流 100 μA,检测电压1.4 kV。利用随机Excalibur工作站NIST2002标准谱库自动检索各组分质谱数据,得到烟叶香气成分的定性结果。
烟叶中不同香气成分的定量结果按照内标法计算得出,假定其相对内标校正因子为1,计算公式如下:


表1 试验设计Table 1 Experiment design
其中,ms是烟样中香气成分含量(μg/g);mi是内标物的含量(μg/g);As是香气成分的峰面积;Ai是内标的峰面积;m0是烟样的质量(g)。
1.3.2 热重分析 将烟样置于干燥箱中,40 ℃烘2 h左右,粉碎后过40目筛,即得分析烟末。称取5 mg 左右的烟末,置于同步热分析仪的小坩埚中,参比物为Al2O3。以10 ℃/min的升温速度将样品从室温30 ℃加热至600 ℃。热解气氛为氮气∶氧气=9∶1(体积比),载气流速为100 mL/min。
1.4 数据处理与分析
采用Excel 2016对试验数据进行处理,用SPSS 22.0进行主成分分析和聚类分析,用Origin 8.5.1进行绘图。
2 结果与分析
2.1 不同酶处理对烟叶香气成分的影响
本研究共检测出63种挥发性香气物质(表2),按香气化学结构可分为醇类(9种)、酸类(2种)、酮类(16种)、醛类(8种)、酯类(5种)、烷烃类(19种)、烯烃类(3种)和氮杂环类(1种)。由表3可知,不同处理烟叶中烯烃类香气含量最高,平均含量为1352.35 μg/g,其次,含量较高的香气成分为醇类和酮类化合物,平均含量分别为674.03和651.15 μg/g,烟叶中的醛类化合物(195.74 μg/g)和酯类化合物(154.14 μg/g)含量相对较少,但是对烟叶香气质量的提升也十分重要,主要起到增加烟气香甜气味和浓度的作用,使烟支吸食起来更加醇和顺口。烟叶挥发性香气成分中的氮杂环类化合物主要是二烯烟碱,平均含量为154.29 μg/g,占总挥发性香气物质的4 %左右,是存在于烟叶中的一种碱性含氮化合物,烟气中适量的烟碱含量可以给吸食者一定的生理刺激和较好的香吃味,但是烟碱过高,则会产生较强的生理刺激和不适感。从香气总量排序来看,经120和160 U/g的果胶酶(T5)处理的烟叶中香气总量最高,分别为5101.91和5003.22 μg/g。
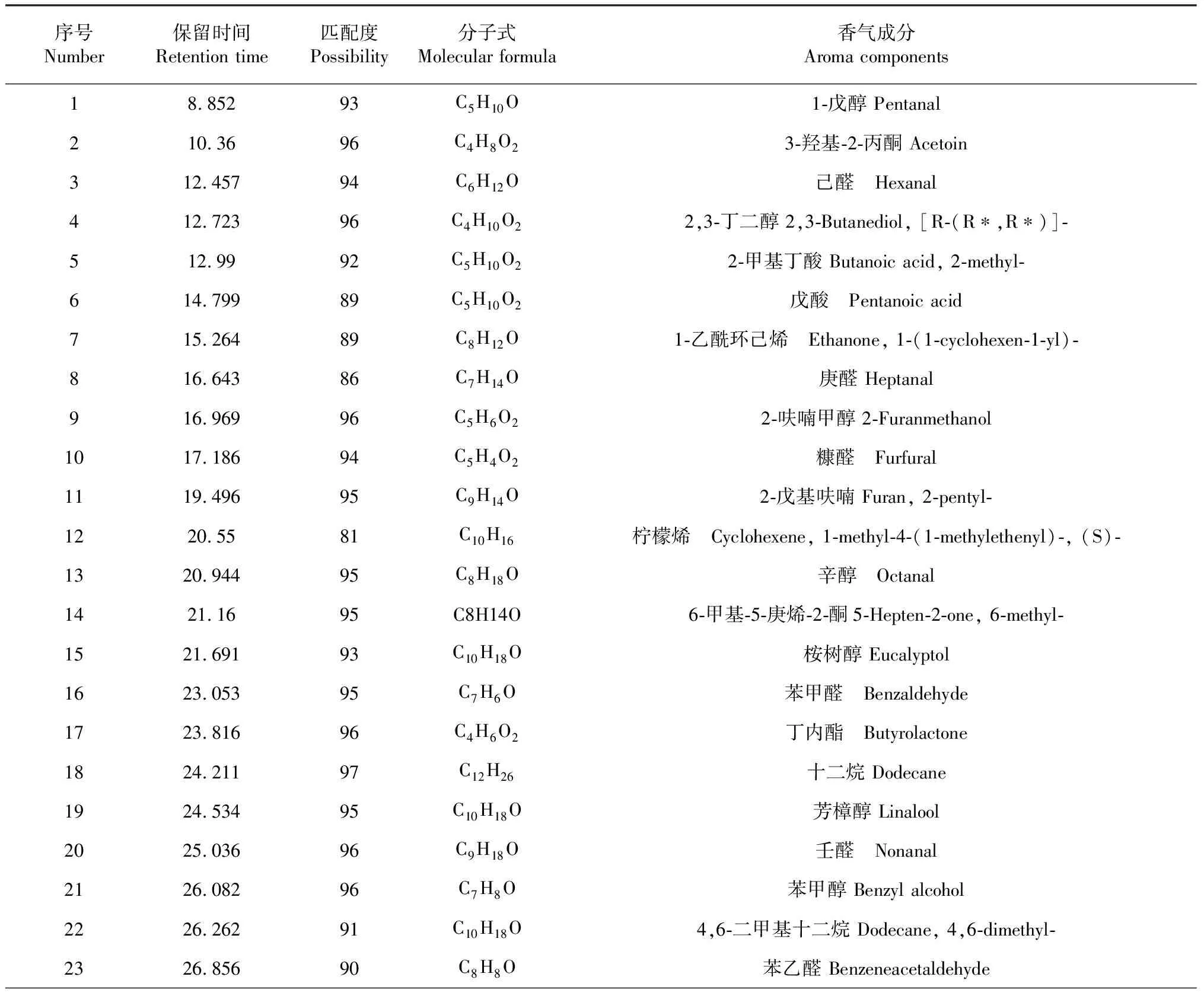
表2 烟叶挥发性香气成分检测结果Table 2 Detection result of volatile aroma components in tobacco leaves
续表2 Continued table 2

序号Number 保留时间Retention time匹配度Possibility分子式Molecular formula香气成分Aroma components2427.10184C9H16O24-羟基-3-甲基-辛内酯 (+/-)-5-Butyl-4-methyldihydro-2(3H)-furanone2527.48389C6H6O33,4-二甲基-2,5-呋喃二酮 2,5-Furandione, 3,4-dimethyl-2627.82796C13H28十三烷 Tridecane2729.00992C10H16O2-茨酮 Bicyclo[2.2.1]heptan-2-one, 1,7,7-trimethyl-, (1S)-2829.15997C8H10O苯乙醇 Phenylethyl Alcohol2929.27892C15H322,6,10-三甲基十二烷 Dodecane, 2,6,10-trimethyl-3029.39191C15H32十四烷,5-甲基 Tetradecane, 5-methyl-3129.67693C16H34十六烷 Hexadecane3229.80790C20H422,6,10,4-四甲基十六烷 Hexadecane, 2,6,10,14-tetramethyl-3330.24592C9H12O24-氧代异佛尔酮 2,6,6-Trimethyl-2-cyclohexene-1,4-dione3430.39987C6H8O43,5-羟基-6-甲基-2,3-二氢-4H-吡喃-4-酮 4H-Pyran-4-one,2,3-dihydro-3,5-dihydroxy-6- methyl-3530.54894C9H10O2乙酸苯甲酯 Acetic acid, phenylmethyl ester3630.66292C13H26庚环己烷 Heptylcyclohexane3730.95997C14H30十四烷 Tetradecane3831.05482C10H14O1,3-环己烯-1-甲醛,2,6,6-三甲基 1,3-Cyclohexadiene-1-carboxaldehyde, 2,6,6- trimethyl-3931.37695C10H16O环柠檬醛 1-Cyclohexene-1-carboxaldehyde, 2,6,6-trimethyl-4032.21590C16H342,6,10-三甲基十三烷 2,6,10-Trimethyltridecane4132.31788C13H283-甲基-3-乙基-十烷 Decane, 3-ethyl-3-methyl-4232.47392C15H32十四烷,4-甲基 Tetradecane, 4-methyl-4332.58891C15H32十四烷,2-甲基 Tetradecane, 2-methyl-4432.90984C17H365,5-二甲基戊烷 5,5-Dibutylnonane4533.49589C16H32十一环戊烷 Cyclopentane, undecyl-4633.64289C14H28正辛基环己烷 Cyclohexane, octyl-4733.7191C18H38十八烷 Octadecane4833.83887C11H22O3-异丁基-5-甲基-2-己酮 1,1-Di(isobutyl)acetone4933.99791C13H22O茄酮 6,8-Nonadien-2-one, 8-methyl-5-(1-methylethyl)-, (E)-5034.20690C12H24O23,7-二甲基乙酸辛酯 3,7-Dimethyloctyl acetate5134.31980C11H20O2-2(3H)-呋喃酮,5-丁基二氢 2(3H)-Furanone, 5-butyldihydro-5235.13882C25H522-甲基二十四烷 2-Methyltetracosane5335.94191C13H18O大马酮 2-Buten-1-one, 1-(2,6,6-trimethyl-1,3-cyclohexadien-1-yl)-, (E)-5436.28386C15H30O正壬环己烷 n-Nonylcyclohexane5536.50789C13H20O二氢大马酮 2-Buten-1-one, 1-(2,6,6-trimethyl-1-cyclohexen-1-yl)-5636.61396C13H22O香叶基丙酮 5,9-Undecadien-2-one, 6,10-dimethyl-, (E)-5740.21880C11H16O21,8(2H,5H)-萘二酮,六氢基-8a-甲基-1,8(2H,5H)-Naphthalenedione, hexahydro-8a-methyl-,5841.41994C10H10N2二烯烟碱 Nicotyrine5941.83897C20H38新植二烯 Neophytadiene6042.39497C11H16O2二氢猕猴桃内酯 2(4H)-Benzofuranone, 5,6,7,7a-tetrahydro-4,4,7a-trimethyl-, 6142.87785C15H30O金合欢醇 (2E,6E)-3,7,11-Trimethyl-2,6,10-dodecatrien-1-ol6242.94289C13H18O巨豆三烯酮 Megastigmatrienone6343.20388C18H36O植酮 2-pentadecanone,6,10,14-trimethyl

表3 不同处理烟叶中香气组分含量Table 3 Aroma components content in tobacco leaves of different treatments
续表3 Continued table 3

处理Treatments香气组分 Aroma components醇类(Y1)酸类(Y2)酮类(Y3)醛类(Y4)酯类(Y5)烷烃类(Y6)烯烃类(Y7)氮杂环(Y8)香气总量Total aroma排序RankingT7A4553.223.12489.2170.69115.6435.541295.89148.13231.3332T7A5531.4718.45471.63175.89123.96470.921129.95143.313065.5837T7A6623.7123.08538.08189.44133.13483.031157.33166.43314.2229CK654.9315.79629.03190.41141.79427.381025.6142.163227.0934
注: T1~T7分别表示中性蛋白酶、木瓜蛋白酶、风味蛋白酶、纤维素酶、果胶酶、糖化酶、α-淀粉酶,CK为空白对照。A1~A6表示酶浓度分别为25、50、75、100、120、160 U/g。
Note: T1-T7 represent neutral protease, papain, flavor protease, cellulase, pectinase, glucoamylase and alpha amylase respectively and CK is blank control. A1-A6 represent the enzyme concentration of 25,50,75,100,120,160 U/g.
2.2 主成分分析
主成分分析法是将原来多个指标重新组合成一组新的且彼此无关的少量综合指标,从而用少量指标来综合反映原来变量信息的一种数理统计方法[14-15]。本研究用主成分分析不同酶处理烟叶中香气组成,筛选出了香气品质最优的几种酶处理烟叶。由表4可知,前4个主成分的累积方差贡献达到89.05 %,能够代表样本绝大部分的信息,因此选前4个主成分进行分析。表5为前4个主成分的载荷矩阵,由表4~5可以得出,第一主成分PC1单独说明了整个原始数据标准变异的62.65 %,主要综合了醇类、酸类、酮类、醛类、酯类、烯烃类和二烯烟碱等7个因子的变异信息,构成了烟叶的基础香气。第二主成分PC2方差贡献率为12.83 %,主要以烷烃类化合物(X6)的影响为主,烷烃类化合物主要分布于烟叶表面的蜡质层中,可以有效防止烟叶水分和香气的挥发,是烟草中天然的保润剂。第三主成分PC3和第四主成分PC4方差贡献率分别为7.23%、6.34 %,主要以二烯烟碱(X8)和烯烃类化合物(X7)的影响为主。总的来说,PC1和PC2对香气物质的贡献较大,累计方差贡献率达到75.47 %。

表4 特征值与累计贡献率Table 4 Eigenvalue and cumulative contribution rate

表5 主成分载荷矩阵Table 5 Principal component load matrix
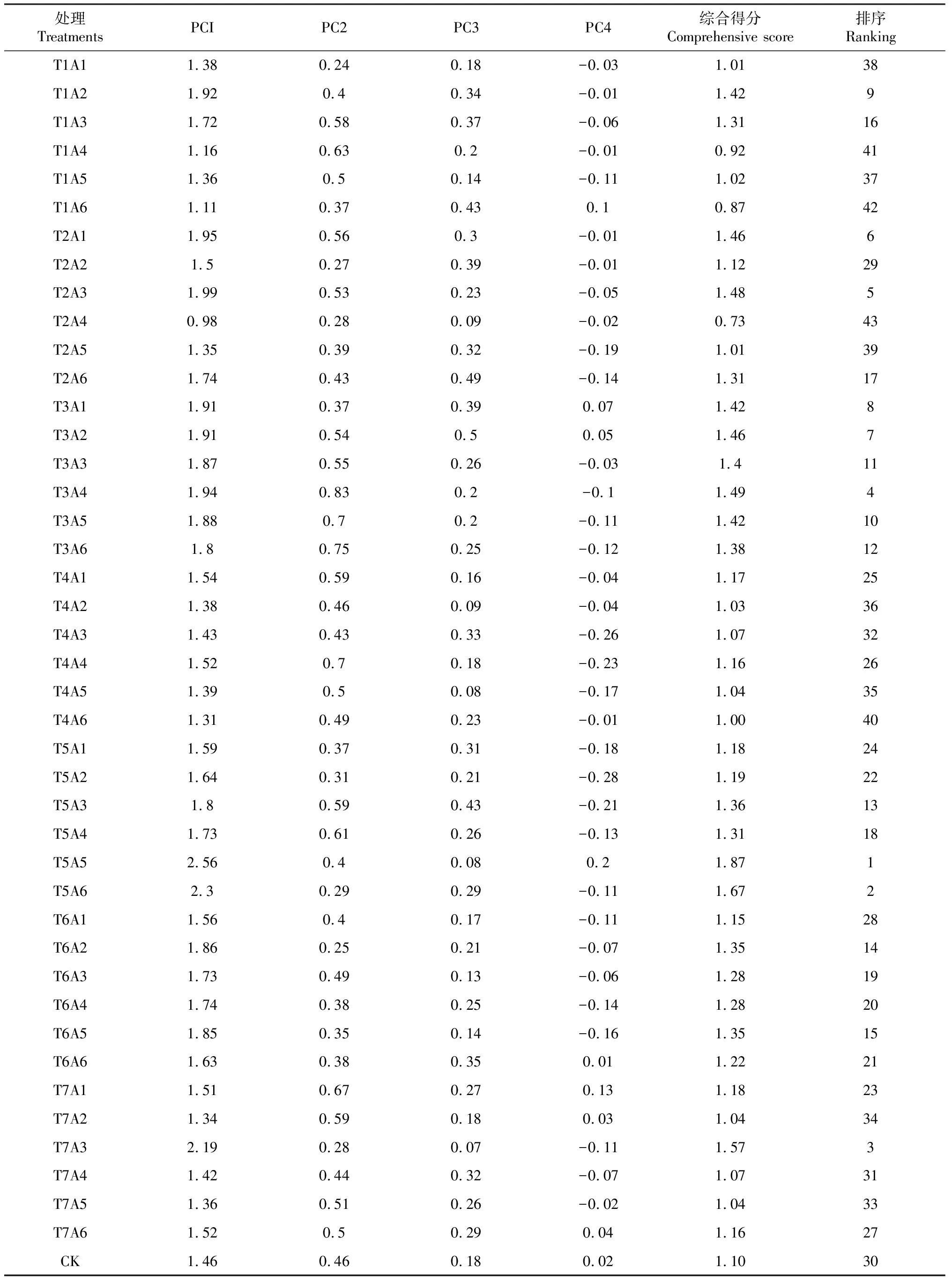
表6 不同处理烟叶香气主成分得分Table 6 Principal component scores of aroma in different treatments
注: T1~T7分别表示中性蛋白酶、木瓜蛋白酶、风味蛋白酶、纤维素酶、果胶酶、糖化酶、α-淀粉酶,CK为空白对照。A1~A6表示酶浓度分别为25、50、75、100、120、160 U/g。
Note: T1-T7 represent neutral protease, papain, flavor protease, cellulase, pectinase, glucoamylase and alpha amylase respectively and CK is blank control. A1-A6 represent the enzyme concentration of 25 ,50 ,75,100,120,160 U/g.

图1 主成分分析PC1、PC2得分图Fig.1 PCA scores for 42 tobacco treatments on PC1 and PC2
由表6可知,经120和160 U/g的果胶酶(T5)处理的烟叶主成分综合得分最高,说明这2种酶处理下烟叶的综合香气品质最优,与香气总量排名结果一致。由PCA得分图(图1)可以看出,主成分得分最高的两种处理T5A5和T5A6均落在得分图的第四区间,表明这2种酶处理的烟叶中基础香气品质最佳,但在PC2上分布较靠下,这2种处理的烟叶的保润性能还有待进一步提升。
2.3 聚类分析
以烟叶中8种不同的香气组分含量作为变量指标,对42个不同酶处理烟样进行系统聚类。由图2可知,42个不同酶处理烟样分为了4个类别。第一类聚集了3个不同处理烟样,即T7A3、T5A6和T5A5,这3种处理的烟样的香气品质最为类似,并且在主成分分析中得分最高,烟叶整体香气质量最佳。第二类聚集了16个不同处理烟样,包括了所有的风味蛋白酶(T3)处理和中性蛋白酶(T1)、木瓜蛋白酶(T2)和糖化酶(T6)的部分浓度处理的烟样,并且这些烟样的香气总量较高,主成分得分排名比较靠前,说明这些烟样的香气品质较好。第三类聚集了16个不同处理烟样,主要有α-淀粉酶(T7)和纤维素酶(T4)处理的烟叶,说明经这两种酶处理的烟叶香气风格比较类似,但是整体香气质量欠佳。第四类聚集了7个不同处理烟样,分别为T1A1、T2A2、T5A1、T5A2、T6A1、T6A3和T6A6,经这几种处理的烟样中香气总量均较低,在所有处理中处于中下水平。总体来说,经同一种酶处理的烟叶香气风格比较类似,说明不同酶对烤烟香气的影响机理不同,具体的影响机制还有待进一步研究。

图2 不同处理烟叶聚类分析谱系图Fig.2 Dendrogram of cluster analysis of tobacco leaves with different treatments
2.4 热重分析
以CK为例,图3为对照烟叶热重(TG)和微分热重(DTG)曲线,其中TG曲线表示了烟样质量随温度的变化规律,DTG曲线表示的是烟样质量的变化量随温度的变化规律。由图3可以看出,未经任何处理的对照样品热失重主要分为4个明显的阶段:①室温~120 ℃,样品质量损失率为8.2 %,此阶段主要为烟样中吸附水的蒸发[16],并伴随烟草中小部分极易挥发的物质和烷烃类化合物的挥发[17]。②120~250 ℃,样品质量损失率为23.5 %,此阶段主要是样品中易挥发性物质的挥发[18],也有研究认为是烟碱的挥发和一些高质量分数的香气物质的挥发[19]。③250~434 ℃,样品质量损失率最大为34.2 %,此阶段主要为烟样中一些大分子物质,如果胶、纤维素、木质素、蛋白质等的降解[20],同时焦油态产物在此阶段最为丰富[19]。④434~600 ℃,样品质量损失率较小,损失量为8.7 %,此阶段为样品高温炭化过程,主要生成大量的小分子气态化合物及一些多环芳烃等,此阶段对烟草香气物质的形成贡献不大。经过以上4个阶段的热解反应,最终烟样残余产物的质量为原始烟样质量的25.5 %。

图3 对照烟叶TG/DTG曲线Fig.3 TG/DTG curve of control tobacco leaves

表7 不同处理烟叶热失重过程比较Table 7 Comparison of pyrolysis process of tobacco leaves with different treatments
由表7可知,第Ⅰ阶段最大失重速率温度在56.6~86.0 ℃,其中经中性蛋白酶处理的烟叶最大失重速率温度最大(86.0 ℃),纤维素酶和糖化酶处理的烟叶次之,α-淀粉酶和果胶酶处理的烟叶最大失重速率温度较小,分别为56.6和58.9 ℃,均低于对照烟叶。此温度值的大小主要反映了不同烟叶中物理结合水温度敏感性的强弱,即最大失重速率时对应的温度越大说明烟叶的持水能力越强[21];该阶段的质量损失率在4.8 %~7.9 %,其中经过酶处理的烟叶在此阶段的质量损失率均低于对照烟叶,可能是由于酶处理加快了烟叶在烘烤阶段的失水。
第Ⅱ阶段,最大失重速率温度在195.8~203.4 ℃,不同处理间差异不是太大,其中以果胶酶处理的烟叶在此阶段的最大失重速率温度最高,糖化酶处理的烟叶最低。该阶段的质量损失率在19.9 %~24.2 %,其中对照烟叶的质量损失率最低(19.9 %),木瓜蛋白酶、中性蛋白酶和果胶酶处理的烟叶质量损失率最高,说明这些酶处理的烟叶在此阶段挥发性物质最多。
第Ⅲ阶段,最大失重速率温度在314.3~330.5 ℃,其中中性蛋白酶处理的烟叶在此阶段的最大失重速率温度最高(330.5 ℃),α-淀粉酶和果胶酶处理的烟叶最低(314.3 ℃);该阶段的质量损失率较其它几个阶段都高(34.1 %~37.1 %),其中以果胶酶处理的烟叶最高(37.1 %),风味蛋白酶处理的烟叶次之(36.1 %),纤维素酶、糖化酶和α-淀粉酶处理的烟叶质量损失率相当。
第Ⅳ阶段,主要为烟叶炭化阶段,较第Ⅱ和Ⅲ阶段对烟叶挥发性物质的贡献不大,此阶段最大失重速率温度在466.4~474.0 ℃,其中经木瓜蛋白酶、风味蛋白酶和糖化酶处理的烟叶在此阶段的DTG曲线无明显峰值。该阶段的质量损失率在5.4 %~12.9 %,不同处理间差异较大,其中以α-淀粉酶处理的烟叶在此阶段的失重率最高,中性蛋白酶处理的烟叶失重率最低。当温度升至600 ℃后,不同处理烟叶的质量残余率为23.8 %~30.3 %,其中经果胶酶处理的烟叶残余量最低(23.8 %),纤维素酶、中性蛋白酶和糖化酶处理的烟叶残余量较高。
综上所述,热解过程的第Ⅱ和Ⅲ阶段烟样热失重率最高,对烟叶香气质量的贡献最大,其中经果胶酶处理的烟叶在这两个阶段的失重率最高为60.3 %,说明果胶酶处理可以使烟叶中的大分子物质(果胶、纤维素、蛋白质等)更好地暴露出来,增加了烟叶燃烧时挥发性香气物质的含量。
3 讨 论
3.1 烟叶香气成分组成和含量
香气品质作为衡量烤烟质量的重要指标之一,其品质的优劣在很大程度上取决于香气物质的含量和组成[22]。本研究利用HS-GC/MS联用对不同酶处理的烟样香气成分进行分析,共检测出63种挥发性香气物质,主要分为醇类(9种)、酸类(2种)、酮类(16种)、醛类(8种)、酯类(5种)、烷烃类(19种)、烯烃类(3种)和氮杂环类(1种),其中以烯烃类(主要为新植二烯)、醇类、酮类和烷烃类为主,构成了烟叶的主体香气,此结果与Xiang 等人[23]的研究结果基本一致。王林等[24]利用酶浓度为40 U/g的中性蛋白酶、糖化酶和α-淀粉酶对烘烤前烟叶进行处理发现,经酶处理过的烟叶中挥发性香气物质的总量显著高于空白对照,本研究得出的结论与此相符。从不同酶处理烟叶的香气总量排序和主成分得分来看,经120和160 U/g果胶酶处理的烟叶整体香气质量最佳,于建军等人[25]的研究发现果胶酶处理能够有效降解烟叶细胞壁物质,改变了烟叶的纤维结构,使中性香气物质显著增加。系统聚类分析把42个不同酶处理烟样分成了4个类别,其结果与主成分排名顺序基本一致,说明经同一种酶处理的烟叶香气风格比较类似。
3.2 烟叶热解性质
热重分析是指在模拟烟支燃烧时的气氛条件(10 %氧气浓度)和空气流速的条件下,通过程序控温来测量烟样的质量与燃烧温度变化关系的一种分析技术,目前已成为研究烟草燃烧、热解过程及其动力学行为的有效工具[26-28]。本研究通过对不同处理烟样热解性质进行分析,得到不同处理烟样均经历了4个不同的热失重阶段,此结果与Qin等人[29]研究发现基本一致。第Ⅱ阶段和第Ⅲ阶段烟样热失重率最高,对烟叶挥发性香气物质贡献最大,其中经果胶酶处理的烟叶在这两个阶段的失重率最高,最终样品质量残余率最低,与香气总量研究的结果相符。
4 结 论
(1)不同酶处理烟样中共检测出63种挥发性香气物质,其中以烯烃类(主要为新植二烯)、醇类、酮类和烷烃类为主,构成了烟叶的主体香气,其中经120和160 U/g果胶酶处理的烟叶整体香气质量最佳。
(2)经果胶酶处理的烟叶在第Ⅱ和Ⅲ阶段热失重率最高,最终样品质量残余率最低,说明果胶酶处理可以有效提高烟叶中香气物质含量,改善烤烟烟叶香气质量。
参考文献:
[1]吴丽君,石凤学,刘 晶,等. 烟草香气成分分析研究进展[J]. 中国农学通报, 2014,30(21):251-257.
[2]樊文举,高娟娟,王玉堂,等. 秦岭烟区不同基因型烤烟化学成分与挥发性香气物质研究[J]. 山地农业生物学报,2016,35(6):18-25.
[3]鲍辰卿,邱家丹,许春平,等. 美拉德反应产物在烤烟型卷烟中的增香效果[J]. 轻工科技,2015(8):131-133.
[4]毕莉莎,李 璠,刘志华. 美拉德反应产物的抗氧化性及在烟草中应用研究进展[J]. 云南化工,2010,37(1):58-61.
[5]叶超凡,邵 平,孙培龙. 烟用天然植物增香保润技术的研究进展[J]. 农产品加工(学刊), 2012(3):33-38.
[6]陈熠熠. 烟草和蜂蜜中糖类的测定及其在烟草中热裂解行为的研究[D]. 湖南师范大学,2013.
[7]景延秋,刘晓迪,宫长荣,等. 烤前喷施糖类物质对烤烟化学成分及香气物质含量的影响[J]. 河南农业大学学报,2013,47(6):663-666.
[8]刘光快,韦克苏,高 贵,等. 采后烤前喷施外源添加剂对烤烟上部烟叶品质的影响[J]. 核农学报,2015,29(8):1559-1565.
[9]何邦华,申晓锋,陈 兴,等. 利用果胶酶改善烟梗内在品质的研究[J]. 农业科学与技术(英文版), 2013,41(9):1299-1302,1321.
[10]普元柱,包秀萍,王松峰,等. 风味蛋白酶降低烟叶中蛋白质含量的研究[J]. 食品工业,2013,34(8):146-149.
[11]王 娟,李文娟,周丽娟,等. 云南主要烟区初烤烟叶物理特性的稳定性及质量水平分析[J]. 湖南农业科学,2013(17):28-31.
[12]樊军辉,陈江华,宋朝鹏,等. 不同烤房烘烤过程中烟叶形态和物理特性的变化[J]. 西北农林科技大学学报(自然科学版),2010,38(6):109-114.
[13]武圣江,宋朝鹏,贺 帆,等. 密集烘烤过程中烟叶生理指标和物理特性及细胞超微结构变化[J]. 中国农业科学,2011,44(1):125-132.
[14]高惠璇. 应用多元统计分析[M]. 北京:北京大学出版社出版,2005.
[15]Nurjuliana M,Che Man Y B,Mat Hashim D,et al. Rapid identification of pork for halal authentication using the electronic nose and gas chromatography mass spectrometer with headspace analyzer[J]. Meat Science,2011,88(4):638-644.
[16]Yang Y,Jin S,Lin Y,et al. Catalytic gasification of tobacco rob in steam-nitrogen mixture: Kinetic study and fuel gas analysis[J]. Energy,2012,44(1):509-514.
[17]Torikai K,Uwano Y,Nakamori T,et al. Erratum to ‘Study on tobacco components involved in the pyrolytic generation of selected smoke constituents’[J]. Food and Chemical Toxicology,2005,43(9):1449.
[18]孙伟峰. 利用酶法和外加香料法对下部烟叶的增香提质研究[D]. 江南大学,2013.
[19]胡永华,宁 敏,张晓宇,等. 不同热失重阶段烟草的裂解产物[J]. 烟草科技,2015,48(3):66-73.
[20]Marcilla A,Beltran M I,Gómez-Siurana A,et al. TGA/FTIR study of the pyrolysis of diammonium hydrogen phosphate-tobacco mixtures[J]. Journal of Analytical and Applied Pyrolysis,2015,112:48-55.
[21]凌 军,王绍坤,胡巍耀,等. 烟叶热分解过程及其动力学分析[J]. 西南农业学报,2016,29(4):976-981.
[22]刘 燕,阙劲松,于良君,等. 烤烟致香物质含量的主要影响因素及其提高的可能途径[J]. 中国农学通报,2013,29(22):83-89.
[23]Xiang Z, Cai K, Liang G, et al. Analysis of volatile flavour components in flue-cured tobacco by headspace solid-phase microextraction combined with GC×GC-TOFMS[J]. Analytical Methods,2014,6(10):3300.
[24]王 林,朱金峰,许自成,等. 不同酶制剂对烤烟上部叶化学成分、游离态和糖苷结合态中性香气成分的影响[J]. 生物技术进展,2015,29(6):455-460.
[25]于建军,马海燕,杨寒文,等. 利用果胶酶降解烟叶中果胶的研究[J]. 江西农业学报,2009,21(3):136-138.
[26]Senneca O,Chirone R,Salatino P,et al. Patterns and kinetics of pyrolysis of tobacco under inert and oxidative conditions[J]. Journal of Analytical and Applied Pyrolysis,2007,79(12):227-233.
[27]Wongsiriamnuay T,Tippayawong N. Non-isothermal pyrolysis characteristics of giant sensitive plants using thermogravimetric analysis[J]. Bioresource Technology,2010,101(14):5638-5644.
[28]夏 鸣,李金广,乔国宝,等. 烤烟的燃烧特性及动力学分析[J]. 烟草科技, 2012,36(11):38-41.
[29]Qin Z,Luo X,Rong N,et al. Preparation and Analysis of Physicochemical Properties of Tobacco Stem Biochar[J]. Journal of Nanoscience & Nanotechnology,2016,16(12):12237-12243.
