T-2毒素完全抗原制备及免疫学检测方法的建立
2018-06-05郉云瑞孙亚宁姚静静王英华郝慧芳柴书军李俊鹏胡骁飞
郉云瑞,孙亚宁,姚静静,王英华,郝慧芳,柴书军,李俊鹏,胡骁飞*
(1.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 2.河南省动物疫病预防控制中心,河南 郑州 450008; 3.平顶山农业科学院,河南 平顶山 467000)
T-2毒素是一种倍半萜烯化合物,是单端孢霉 A 型毒素中最主要也是毒性最强的一种,可由多种真菌产生,是污染田间作物、库存谷物及动物饲料的主要毒素之一[1]。 人和动物误食被污染的谷物或饲料会引起急性或慢性中毒[2-3],继而造成免疫系统[4-5]、神经系统[6]、生殖系统[7-8]及消化系统[9-10]等方面的机能障碍。1973年,联合国粮农组织(FAO)和世界卫生组织(WHO)把T-2毒素同黄曲霉素一样作为自然存在的最危险的食品污染源。1987年,FAO和WHO对面粉、大米等禾谷类作物中T-2毒素含量做出限量要求,不得超过100 μg/kg。我国食品安全国家标准对食品中T-2毒素限量无明确要求,但GB 21693—2008要求饲料中T-2毒素含量不能超过1 000 μg/kg。
为了减少T-2毒素对动物及人类危害,科研工作者建立了多种T-2毒素的监控检测方法,主要有气相色谱法(GC)[11-12]、色质联用法(LC-MS/MS)[13-16]、高效液相色谱法(HPLC)及衍生方法[17-19]。仪器检测方法尽管灵敏、准确,但对操作者的技术要求高,且步骤繁琐、仪器昂贵,不适于现场大批量快速筛查,限制了其使用范围。免疫学快速检测方法具有成本低、速度快、灵敏度高等优点,越来越受到人们的重视,已经在兽药残留、农药残留、霉菌毒素污染领域得到广泛应用[20-24],其中胶体金试纸因具有快速、灵敏、准确等优点,且是唯一能实现一步操作的免疫学快速检测技术,在现场筛查中应用最为广泛。目前,关于T-2毒素免疫学检测方法已有报道,王坤等[25]成功制备出T-2完全抗原,获得鼠源多克隆抗体,IC50为324 ng/mL;Li等[26]建立在单克隆抗体基础上检测水稻中T-2毒素的方法,IC50为22.09 ng/mL;Li等[27]基于单克隆抗体建立检测T-2毒素的化学发光免疫分析法,IC50为33.28 ng/mL,但至今未见T-2毒素胶体金检测试纸的报道。检测试纸为完全抑制模式,同时检测时需要对样品进行有机试剂处理,进行20倍以上的稀释才可用于检测,因此,要求抗体具有特别高的灵敏性。为制备高灵敏的T-2毒素抗体,通过分析T-2毒素的分子结构,采用新的方法合成T-2毒素的人工抗原,免疫小鼠,制备出灵敏度高、特异性强的多抗血清,并初步建立了T-2毒素免疫学检测方法,旨在为灵敏度高、特异性强的T-2毒素单克隆抗体制备及T-2毒素胶体金检测试纸的研制奠定基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂 T-2毒素、N,N′-羰基二咪唑(CDI)、伏马菌素B1(FB1)、黄曲霉毒素B1(AFB1)、脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)及赭曲霉毒素A(OTA)均为Sigma产品;牛血清蛋白(BSA)和鸡卵清蛋白(OVA)均为Pierce产品;羊抗鼠酶标二抗(GaMIgG-HRP)为华美生物工程有限公司产品;其他试剂均为分析纯。
稀释液(PBS):0.01 mol/L的磷酸盐缓冲溶液,pH值为7.4;包被液(CBS):0.05 mol/L的碳酸盐缓冲液;洗液(PBST):含0.05% Tween-20 的PBS混合液;封闭液:猪血清浓度为5%的PBST溶液;显色液:TMB显色液;终止液:2 mol/L的硫酸溶液。
1.1.2 供试动物 6~8周龄SPF级BALB/c小鼠,购自郑州大学医学院实验动物中心,由河南省农业科学院动物免疫学重点实验室饲养。
1.2 方法
1.2.1 T-2毒素完全抗原的合成 称取2 mg T-2毒素、13 mg CDI溶于500 μL无水四氢呋喃,室温反应1 h,将溶液烘干,取100 μL 二甲基甲酰胺(DMF)将烘干后的产物溶解备用,将此溶液标记为A液。称取8 mg BSA溶于1mL PBS中。将BSA溶液缓慢滴加到A液,混匀后室温反应4 h。反应产物在PBS溶液中透析3 d,5 000 r/min离心5 min,收集上清-20 ℃冻存备用。合成路线如图1。采用同样的方式合成包被原T-2-OVA。

图1 T-2-BSA合成路线
1.2.2 T-2毒素完全抗原的鉴定
1.2.2.1 SDS-PAGE鉴定 参照文献[28]制得12%的分离胶和5%的浓缩胶,浓缩胶和分离胶电压分别为60 V和90 V,加样20 μL,蛋白质含量为2 μg,考马斯亮蓝染色2~3 h,脱色10~12 h,期间每隔1 h换 1次脱色液,脱色完成后扫描拍照。
1.2.2.2 小鼠免疫鉴定 将制备好的完全抗原T-2-BSA免疫6只 6~8周龄的BALB/c 雌性小鼠,免疫4次,每次免疫间隔2周,免疫剂量为200 μL/只,含蛋白质30 μg。第4次免疫10 d后断尾采血,用 PBS稀释后5 000 r/min 离心 5 min,取上清,弃去沉淀,制备其多克隆抗血清(pAb)。
采用间接ELISA测定pAb效价。操作步骤如下:用CBS将T-2-OVA稀释1 000倍,混匀后每孔加 50 μL,37 ℃温箱中放置2 h后用 PBST洗板5~6次,拍干;每孔加入封闭液200 μL,37 ℃温箱中放置1.5 h,洗板5~6 次,拍干;每孔用50 μL的PBS 铺底;在第一排每孔加 50 μL多抗血清,依次往下倍比稀释,设阴性对照孔,37 ℃温箱放置 15 min,洗板、拍干;每孔加 50 μL稀释过的羊抗鼠酶标二抗(用含5%猪血清的 PBST进行 1∶1 000 倍稀释),37 ℃温箱放置30 min,洗板、拍干;每孔加 50 μL显色液,室温显色 10 min;每孔加 50 μL终止液,终止显色,用酶标仪测OD450值;结果判定:待测孔OD450/阴性孔OD450≥2.1,则为阳性孔。
采用间接竞争ELISA测定pAb敏感性(IC50)。取包被封闭好的96孔板,每孔用50 μL的PBS 铺底;每孔加50 μL不同质量浓度的T-2毒素标准品溶液(500、250、125、62.5、31.25、15.625、7.8 125、3.90 625、1.953 125 ng/mL)作为抑制剂,每孔再加效价OD450值为1.0 左右的前一孔多抗血清50 μL,后续步骤同血清效价的测定。
1.2.3 T-2免疫学检测方法的初步建立
1.2.3.1 T-2-OVA最佳稀释倍数和T-2 pAb最佳工作质量浓度的确定 采用方阵滴定法:用CBS将包被原稀释至500、1 000、2 000、4 000、8 000倍,抗体以不同的比例进行稀释,依照间接ELISA操作步骤测定后,选择不同包被浓度下OD450值在1.0左右的孔所对应的上一个T-2 pAb稀释倍数,采用阻断ELISA测定其敏感性,敏感性较好的一组所对应的质量浓度即为包被原最佳稀释倍数和抗体最佳工作质量浓度。
1.2.3.2 标准曲线的绘制 配制不同质量浓度的T-2毒素标准品溶液(同小鼠敏感性测定时的标准品质量浓度),用已建立的间接竞争ELISA方法进行测定。以T-2标准品质量浓度(ng/mL)的对数值为横坐标,B/B0(B0:T-2 标准品质量浓度为0时的OD450;B:不同质量浓度T-2标准品的 OD450)为纵坐标,绘制标准曲线。计算出试剂盒的IC50和检测限(以LOD表示)。
1.2.3.3 试剂盒特异性测定 特异性采用交叉反应率来表示。选择FB1、AFB1、DON、ZEN、OTA及载体蛋白BSA和OVA作为竞争物,测定各竞争物的IC50,交叉反应率为试剂盒的IC50与各竞争物的IC50的百分比。
2 结果与分析
2.1 T-2毒素完全抗原的鉴定结果
由图2可知,T-2-BSA的泳动速度小于BSA,可见 BSA的分子质量小于T-2-BSA,表明 T-2与BSA偶联成功。
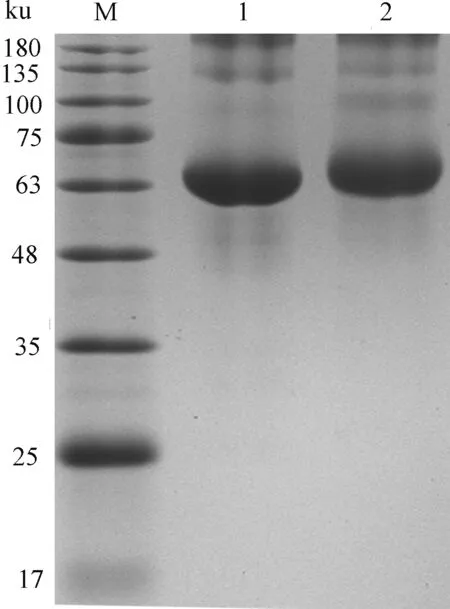
M.蛋白质Marker;1.BSA;2.T-2-BSA
2.2 T-2毒素多抗血清的鉴定结果
由表1可知,免疫的6只小鼠所产生的抗体效价高达1×104以上,说明偶联后的完全抗原具有较好的免疫效果。选择OD450在1.0左右孔对应的上一孔多抗血清稀释倍数,采用间接竞争ELISA测定其IC50。由表2可知,免疫的6只小鼠血清均对T-2毒素有抑制作用,除1号小鼠IC50在500 ng/mL以上,其他小鼠IC50均在100 ng/mL以下,且2号和6号小鼠抗体敏感性相对较高,IC50在15 ng/mL左右。由此可见,本试验所合成的完全抗原T-2-BSA偶联成功,且能够有效刺激动物机体产生抗T-2毒素的特异性抗体。
2.3 T-2毒素免疫学检测方法的建立
2.3.1 T-2-OVA最佳稀释倍数和T-2 pAb最佳工作浓度的确定 采用方阵滴定法测定不同包被原稀释倍数下6号小鼠多抗效价,结果见表3。选择OD450值在1.0左右时所对应的上一孔抗体稀释度进行间接竞争ELISA检测,由图3可知,在包被原为1∶1 000倍稀释,抗体在1∶1 500 倍稀释时其IC50最低,敏感性最高,即初步确定包被原稀释度为1∶1 000,抗体稀释度为1∶1 500。
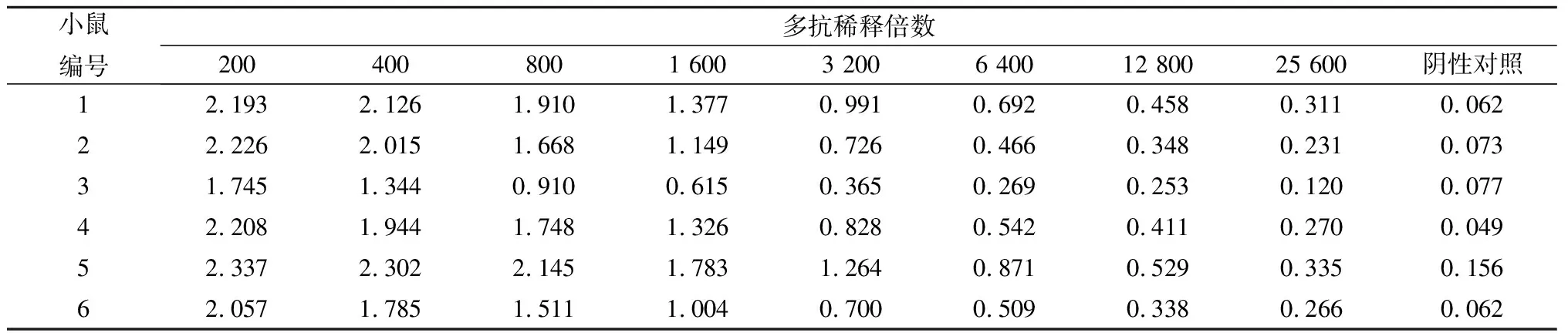
表1 间接ELISA测定的多抗血清效价
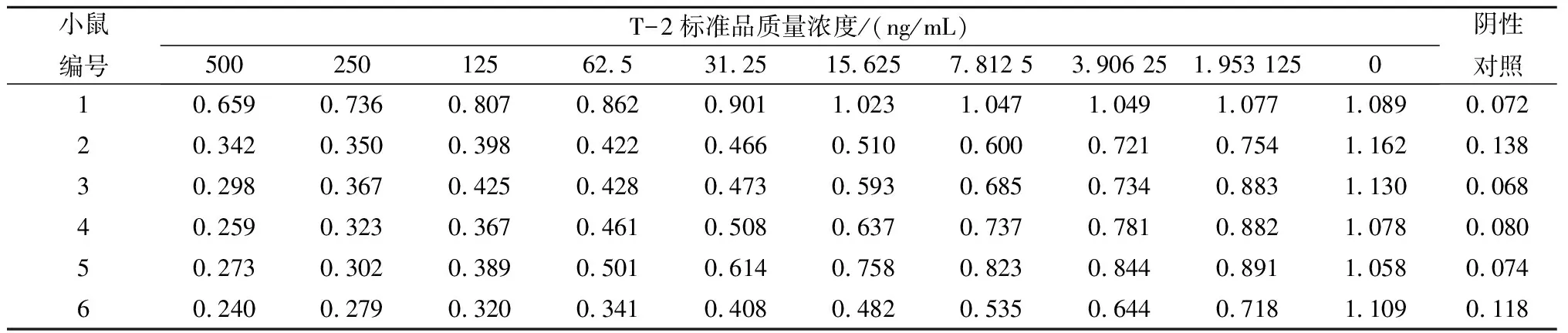
表2 间接竞争ELISA测定的多抗血清抑制效价
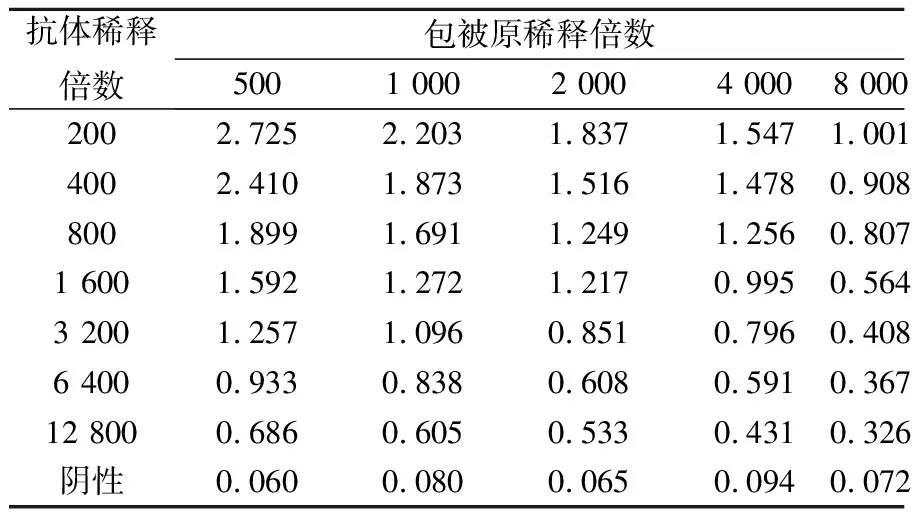
表3 不同包被原稀释度下的血清效价测定结果
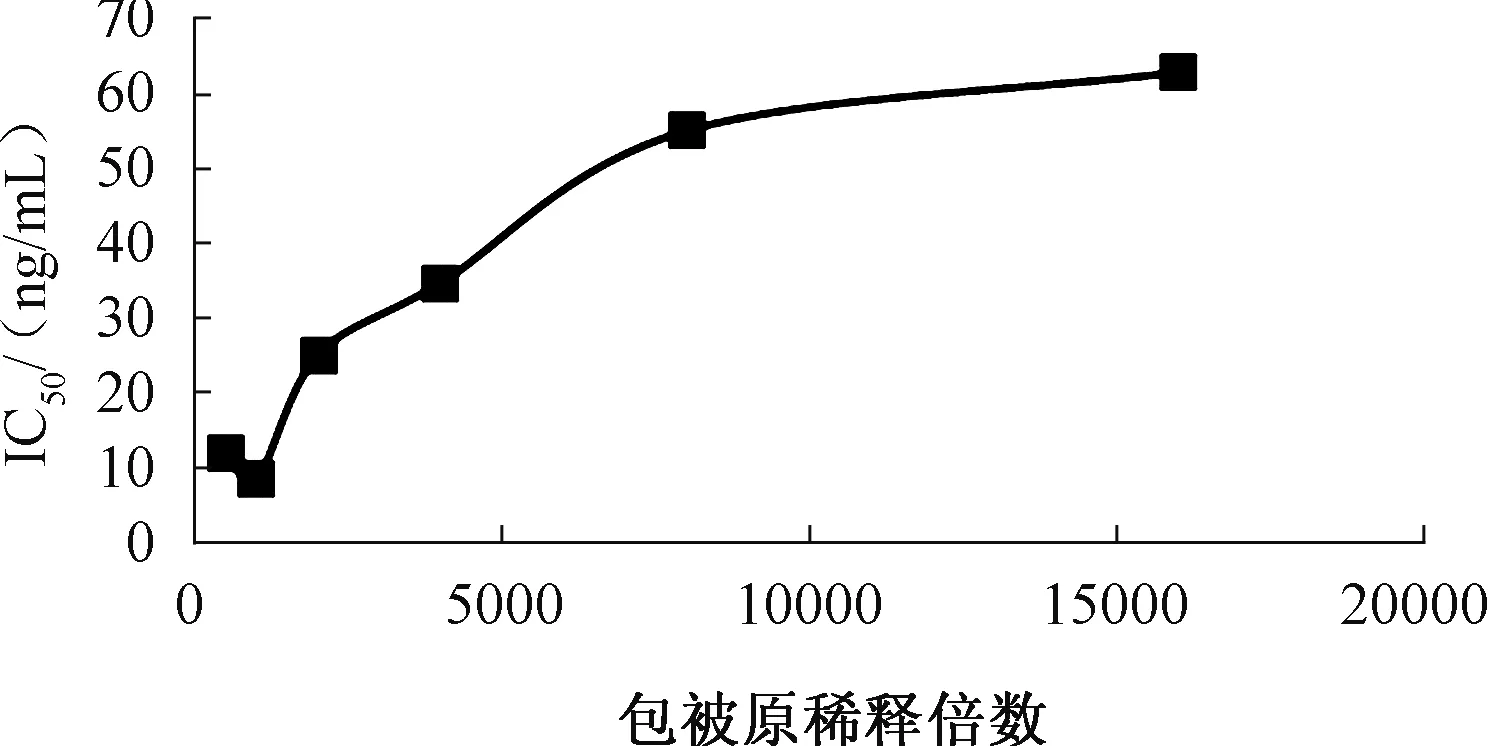
图3 不同抗原抗体稀释度下的IC50变化曲线
2.3.2 T-2毒素间接竞争ELISA检测试剂盒的标准曲线绘制 根据已确定的包被浓度和抗体工作浓度确定反应体系,初步建立间接竞争ELISA检测方法。利用所建立的间接竞争ELISA检测体系绘制标准曲线如图4所示,标准曲线的线性回归方程为y=-0.178 6x+0.664 5,R2=0.966 2,根据回归方程计算出间接竞争ELISA检测试剂盒的IC50为 8.34 ng/mL,检测限为0.048 ng/mL。
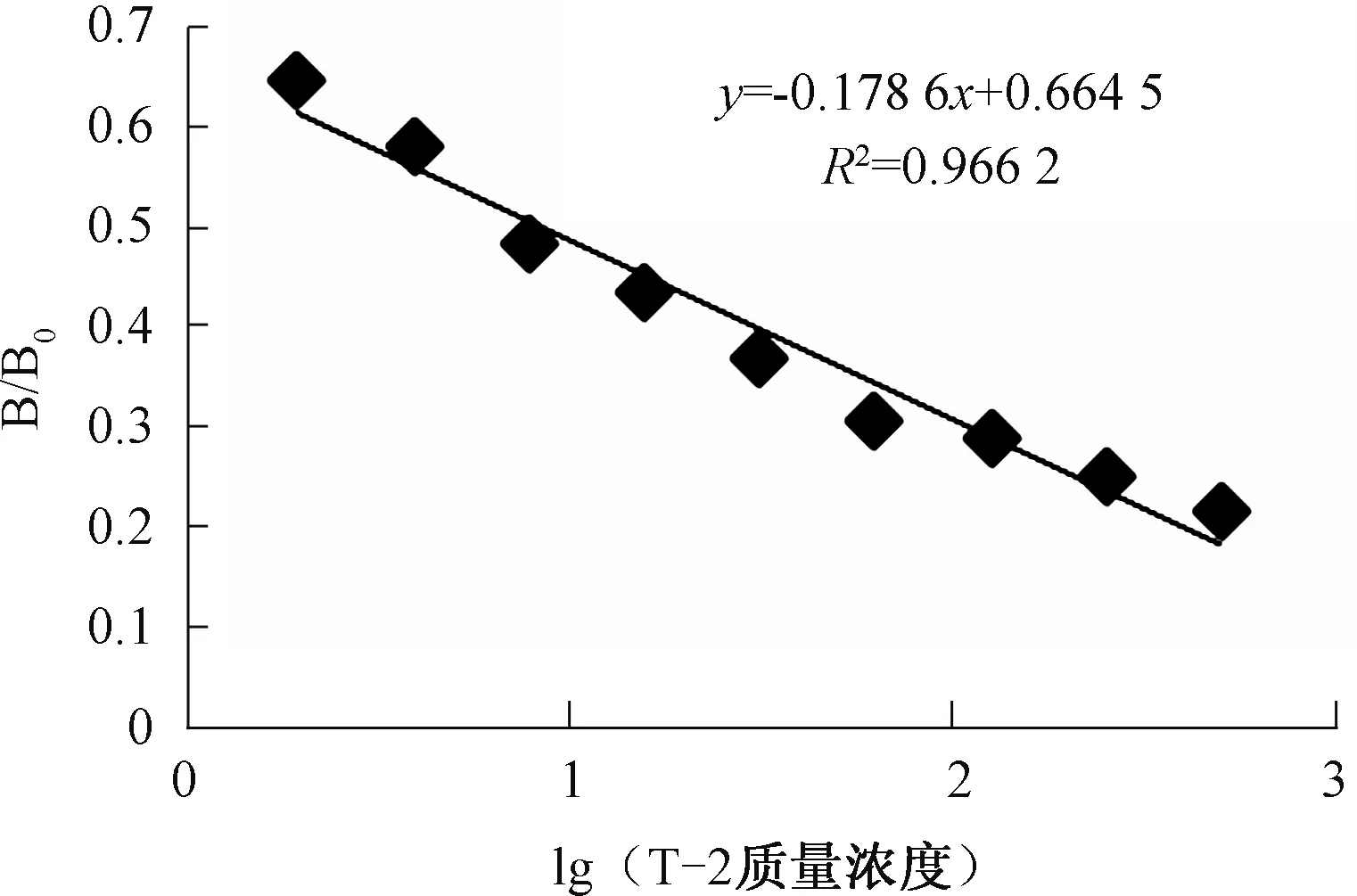
图4 T-2毒素间接竞争ELISA检测试剂盒标准曲线
2.3.3 间接竞争 ELISA检测试剂盒特异性鉴定结果 由表4可知,间接竞争ELISA检测试剂盒与其他霉菌毒素及载体蛋白BSA和OVA的交叉反应率均小于 0.1%,说明其具有良好的特异性。

表4 多抗血清与真菌产物的交叉反应
3 结论与讨论
T-2毒素由于分子质量小,属于半抗原范畴,只有与大分子物质结合后,才能刺激动物机体产生特异性抗体。相关报道[25-27,29]均采用琥珀酸酐法或戊二酸酐法先将T-2毒素分子上的羟基改造成羧基,再利用混合酸干法或碳化二亚胺法将改造后的半抗原与载体蛋白偶联。采用以上方法合成T-2毒素完全抗原,制备出的抗原免疫效果较差,且产生的特异性抗体较少。上述方法前期半抗原改造操作比较复杂,对温度要求较高,后期与蛋白质偶联时,混合酸酐法会引入新的活性基团,产生新的抗原决定簇,增加交叉反应;碳化二亚胺法虽操作简单,但其缩合没有选择性,易造成蛋白质间的自连,降低偶联效率。本研究采用CDI一步法合成完全抗原T-2-BSA和包被原T-2-OVA,CDI是一种具有较强反应活性的化合物,它可与羧基、氨基、羟基等官能团直接进行反应,不需要对半抗原进行其他活性基团的引入,操作简单,大大减少副反应产物的生成,从而提高偶联效率,由于CDI易吸收空气中的水分而变质,因此,操作应在除湿干燥环境下进行。本试验成功制备出T-2毒素完全抗原,并获得了效价高、敏感性强的多克隆抗体。
关于包被抗原和抗体稀释度的确定,相关报道[30-31]通常采用间接ELISA法的棋盘试验来确定,这种方法比较适用于只用效价作为评价依据的大分子的检测,而小分子物质的检测是以其抗体敏感性作为评价依据,因此,棋盘法所选取的最佳浓度无法体现出小分子抗体的特性。本试验采用间接竞争ELISA方法测定抗体在不同包被原浓度下的敏感性,选择抗体敏感性最好的一组作为最佳反应体系浓度,不仅可以最大化地体现出小分子抗体的特性,而且更具有参考意义。
通过细胞融合制备的单克隆抗体灵敏度要比相应的多克隆抗体血清的灵敏度提高10倍甚至更高[32-33]。本试验中通过动物免疫后,多克隆抗体血清的IC50值为8.34 ng/mL,制备的单克隆抗体IC50值应该在0.83 ng/mL以下。相对而言,该多克隆抗体血清具有较高的灵敏度,一般认为,单克隆抗体制备时小鼠细胞融合的好坏直接影响试验结果,其取决于多抗血清敏感性的高低,本试验所制备的多抗血清敏感性高,为以后进行细胞融合制备敏感性强的单克隆抗体奠定了良好的基础。
综上,成功制备出了T-2毒素完全抗原,通过免疫小鼠获得了效价高、灵敏度高的多抗血清,并在此基础上初步建立了T-2毒素间接竞争ELISA检测方法,该方法灵敏度高、特异性强,为进一步监控T-2毒素污染提供了技术支撑。
参考文献:
[1] Desjarins A E.From yellow rain to green wheat:25 years of trichothecene biosynthesis research[J].Journal of Agricultural and Food Chemistry,2009,57(11):4478-4484.
[2] Pande V V,Kurkure N V,Bhandarkar A G.Effect of T-2 toxin on growth,performance and haematobiochemical alterations in broilers[J].Indian Journal of Experimental Biology,2006,44(1):86-88.
[3] Meissonniet G M,Laffitte J,Raymond I,etal.Sublinical doses of T-2 toxin impair acquired immune response and liver cytochrome P450 in pigs[J].Toxicology,2008,247(1):46-54.
[4] Li M,Harkema J R,Islam Z,etal.T-2 toxin impairs murine immune response to respiratory reovirus and exacerbates viral bronchiolitis[J].Toxicology and Applied Pharmacology,2006,217(1):76-85.
[5] Minervini F,Fornelli F,Lucivero G,etal.T-2 toxin immunotoxicity on human B and T lymphoid cell lines[J].Toxicology,2005,210(1):81-91.
[6] Sehata S,Kiyosawa N,Atsumi F,etal.Microarray analysis of T-2 toxin-induced liver,placenta and fetal liver lesions in pregnant rats[J].Experimental and Toxicologic Pathology,2005,57(1):15-28.
[7] 张勇法,杨建英.T-2毒素对小鼠睾丸雄激素结合蛋白和抑制素表达的影响[J].毒理学杂志,2011,25(3):169-172.
[8] Sehata S,Kiyosawa N,Sakuma K,etal.Gene expression profiles in pregnant rats treated with T-2 toxin[J].Experimental and Toxicologic Pathology,2004,55(5):357-366.
[9] Sokolovic M,Verice G V,Slmpraga B.T-2 toxin:Incidene and toxicity in poultry [J].Archives of Industrial and Toxicology,2008,59(1):43-52.
[10] Albarenque S M,Doi K.T-2 toxin-induced apoptosis in rat keratinocyte primary cultures[J].Experimental and Molecular Pathology,2005,78(2):144-149.
[11] Soleimany F,Jinap S,Abas F.Determination of mycotoxins in cereals by liquid chromatography tandem mass spectrometry [J].Food Chemistry,2012,130(4):1055-1060.
[12] Valle F M,Mateo E M,Mateo R,etal.Determination of type A and type B trichothecenes in paprika and chili pepper using LC-triple quadrupole-MS and GC-ECD [J].Talanta,2011,84(4):1112-1117.
[13] 庄倩,曲宝涵,李彦,等.高效液相色谱-串联质谱法同时测定饲料中9种霉菌毒素及其代谢物[J].分析科学学报,2016,32(1):37-42.
[14] Juan C,Ritieni A,Maries J.Determination of trichothecenes and zearalenones in grain cereal,flour and bread by liquid chromatography tandem mass spectrometry[J].Food Chemistry,2012,134(4):2389-2397.
[15] 李静,马飞,李培武,等.农产品与饲料中T-2毒素免疫亲和柱净化-液相色谱串联质谱检测技术研究[J].分析测试学报,2014,33(10):1095-1101.
[16] Bernhardt K,Valenta H,Kersten S,etal.Determination of T-2 toxin,HT-2 toxin,and three other type A trichothecenes in layer feed by high-performance liquid chromatography-tandem mass spectrometry (LC-MS/MS)-comparison of two sample preparation methods[J].Mycotoxin Research,2016,32(2):89-97.
[17] Visconti A,Lattanzio V M,Pascale M,etal.Analysis of T-2 and HT-2 toxins in cereal grains by immunoaffinity clean-up and liquid chromatography with fluorescence detection [J].Journal of Chromatography A,2005,1075(1/2):151-158.
[18] Lippolis V,Pascale M,Maragos C M,etal.Improvement of detection sensitivity of T-2 and HT-2 toxins using different fluorescent labeling reagents by high-performance liquid chromatography[J].Talanta,2008,74(5):1476-1483.
[19] 姚洪菊,王绍萍,李德安,等.高效液相色谱紫外检测器测定粮食中的T-2毒素[J].公共卫生与预防医学,2014,25(6):17-19.
[20] Sun Y,Hu X,Zhang Y,etal.Development of an immunochromatographic strip test for the rapid detection of zearalenone in corn[J].Journal of Agricultural & Food Chemistry,2014,62(46):11116-11121.
[21] Sun Y,Xing G,Yang J,etal.Development of an immunochromatographic test strip for simultaneous,qualitative and quantitative detection of Ochratoxin A and Zearalenone in cereal[J].Journal of the Science of Food & Agriculture,2016,96(11):3673.
[22] Yao J,Sun Y,Li Q,etal.Colloidal gold-McAb probe-based rapid immunoassay strip for simultaneous detection of fumonisins in maize[J].Journal of the Science of Food & Agriculture,2017,97(7):2223-2229.
[23] Song C,Liu Q,Zhi A,etal.Development of a lateral flow colloidal gold immunoassay strip for the rapid detection of olaquindox residues[J].Journal of Agricultural & Food Chemistry,2011,59(17):9319-9326.
[24] 王玲玲,职爱民,邓瑞广,等.百菌清残留阻断ELISA试剂盒的研制及鉴定[J].食品安全质量检测学报,2012,3(6):710-715.
[25] 王坤,李清洲,胡骁飞,等.T-2毒素完全抗原的合成及鼠源多克隆抗血清的制备[J].河南农业科学,2013,42(5):158-162.
[26] Li Y,Luo X,Yang S,etal.High specific monoclonal antibody production and development of an ELISA method for monitoring T-2 Toxin in rice[J].Journal of Agricultural and Food Chemistry,2014,62(7):1492-1497.
[27] Li Y,Zhang J,Mao X,etal.High-sensitivity chemiluminescent immunoassay investigation and application for the detection of T-2 toxin and major metabolite HT-2 toxin[J].Journal of the Science of Food and Agriculture,2016,97(3):818-822.
[28] 郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999.
[29] Peng D,Chang F,Wang Y,etal.Development of a sensitive monoclonal-based enzyme-linked immunosorbentassay for monitoring T-2 toxin in food and feed[J].Food Additives and Contaminants(Part A),2016,33(4):683-692.
[30] 张亮,李培武,张奇,等.粮油产品T-2毒素单克隆抗体研制及应用[J].中国油料作物学报,2015,37(5):724-729.
[31] 冯才伟,郝士元,孙满义,等.饲料中T-2毒素直接竞争ELISA检测方法的建立[J].河南农业科学,2013,42(1):110-113.
[32] 姚静静,胡骁飞,韩俊岭,等.伏马菌素B1单克隆抗体的制备及免疫学检测方法初步应用[J].畜牧兽医学报,2016,47(5):1009-1017.
[33] 孙亚宁,滕蔓,胡骁飞,等.抗赭曲霉毒素A单克隆抗体的制备及免疫学鉴定[J].食品科学,2011,32(9):236-240.
