连续弱光下水杨酸对重瓣百合Elena开花前后光合特性及生长的影响
2018-06-05艾星梅黄美娟黄海泉
艾星梅,黄美娟,黄海泉
(西南林业大学 园林学院,云南 昆明 650224)
百合属(Lilium)为多年生鳞茎草本植物,喜阴湿环境,但需一定强度的光照[1],因此,适度遮荫有利于百合的生长。研究表明,70%~75%遮荫处理的百合能有效地吸收光能[2-3],显著提高株高/茎粗比和叶绿素含量[4-5],提高光合速率[6-7],但随着遮荫时间的延长和程度的增加,百合净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)等均显著降低[4,8]。水杨酸(SA)作为一种内源酚类生长调节剂,在一定浓度范围内能提高植物的光合作用速率,增强植物对逆境的适应能力,有利于植物生长发育、开花及叶片进行光合作用[9-11]。因此,探讨不同浓度SA对连续弱光条件下百合开花前后光合特性及生长的影响,对新型百合品种的栽培管理措施具有重要意义。刘伟等[12]研究表明,1.0 mmol/L SA可有效调控低温弱光下黄瓜幼苗叶片的光合功能,提高其低温弱光耐性。王俊玲等[13]在40%和70%自然光下施用SA可显著增加韭菜叶片的吸光系数(Abs),有效缓解逆境对韭菜的伤害。韩浩章等[14]研究表明,连续弱光条件下,不同浓度的SA处理提高了黄瓜叶片总叶绿素含量、最大光合速率、光饱和点、表观量子效率和光补偿点,表明SA能够提高黄瓜叶片在弱光下对光的利用潜力。李璟等[15]研究了大棚条件下3个百合品种的光合特性,结果表明,3种百合均有较低的光补偿点、暗呼吸速率和表观量子效率,较高的光饱和点和最大净光合速率,对低光照有较强的利用能力。此外,植物叶片在不同生育期光合作用的变化,也是评价植株光合生产能力的重要理论依据[16-18]。因此,一定程度的弱光能够延缓植株衰老,延长生育期。目前,有关使用不同浓度SA处理连续弱光下重瓣百合光合特性及生长状况的研究尚未见报道。鉴于此,以荷兰引进的重瓣百合品种Elena为材料,在70%连续弱光条件下,通过灌施不同浓度SA,探讨其植株开花前后叶片的光合特性及生长状况,为制定重瓣百合栽培管理措施提供理论依据。
1 材料和方法
1.1 试验材料
供试百合种球为2016年从荷兰引进的百合品种Elena,花重瓣,红色,种球周径14~16 cm。种植前采用0.1%高锰酸钾溶液浸泡5~10 min,然后用清水冲洗,晾干后待用。
1.2 试验方法
1.2.1 试验设计 试验于2016年6月中旬至9月下旬在西南林业大学后山苗圃基地大棚内进行,地处东经102°45′、北纬26°03′。所有种球均采用盆栽方式种植,盆径规格为17 cm×12 cm×14.5 cm(口径×底径×盆高),栽培基质配方为红土∶草炭土∶山沙∶珍珠岩=4∶3∶2∶1(体积比),基质混匀后施多菌灵消毒,将晾干后的种球种植于装好基质的盆中,定植后浇透水。试验共设0(CK)、0.5、1.0、1.5、2.0、2.5 mmol/L 6个SA浓度处理,分别设为SA0、SA1、SA2、SA3、SA4、SA5,每个处理11盆,每盆栽植2个种球。种植后用不同浓度的SA对盆栽植株根部进行第1次浇施,每盆灌根50 mL,种植期间共浇施4次,每次间隔1周。幼苗期不遮荫,待植株即将进行花芽分化到末花期采用70%遮光率的遮阳网连续遮荫处理,分别于现蕾期(80%植株花芽已形成)和盛花期(80%花朵完全开放)从每个处理中随机选择3盆长势良好的植株,每盆选择上部完全展开并向阳的叶片,在晴朗无风天气测定其光合参数及各项生长指标,每株测定3次,取平均值。
1.2.2 光合光响应曲线的测定 选择晴朗无风的天气,分别于现蕾期(8月中旬)和盛花期(9月初),采用LI-6400XT便携式光合作用系统(LI-6400XT-02B LED叶室,美国LI-COR公司)测定不同浓度SA处理下 Elena 的Pn/PAR响应曲线。光合有效辐射PAR为1 800、1 500、1 200、1 000、800、600、400、200、150、100、80、60、40、20、0 μmol/(m2·s)。PAR≤200 μmol/(m2·s)时,得到Pn/PAR直线回归方程y=ax+b,其中,x表示PAR,y表示Pn,a是表观量子效率,直线与x轴的交点为光补偿点(LCP);PAR>200 μmol/(m2·s)时,采用非直角双曲线方程拟合Elena叶片的Pn/PAR曲线[19]。
式中,Pn为净光合速率,PAR为光合有效辐射,Pmax为最大光合速率,φ为表观量子效率,K为曲线曲角,Rd为暗呼吸速率。φ、Pmax、Rd和K由拟合曲线得到。将Pmax预测值代入拟合直线方程求得光饱和点(LSP)。
1.2.3 光合CO2响应曲线的测定 根据光响应曲线的测定结果估计饱和光强,采用CO2注入系统,用LI-6400XT便携式光合作用系统测定不同SA处理下Elena的Pn/Ci响应曲线。测定时恒定温度为25 ℃,CO2浓度梯度为400、300、200、150、100、50、400、400、600、800、1 000、1 200、1 500、1 800 μmol/mol,每处理重复3次,取平均值。当Ci≤200 μmol/mol时,得到Pn/Ci响应直线回归方程y=ax+b,x表示Ci,y表示Pn,a是CE(RuBP羧化率),直线与x轴的交点为CO2补偿点(CCP);Ci>200 μmol/mol时,采用非直角双曲线方程拟合Elena叶片的Pn/Ci曲线[19]。
式中,Pn为净光合速率,CE为表观羧化效率,Jmax为最大羧化速率,Ci为胞间CO2浓度,Rp为光呼吸速率,Vc、Jmax、Rp、K由拟合曲线得到,根据Pn/Ci曲线的变化趋势估计CO2饱和点(CSP)。
1.2.4 生长指标及相对叶绿素含量的测定 不同浓度的SA处理后,分别记录各处理百合植株的花期,并于现蕾期和盛花期用直尺和游标卡尺测定株高和茎粗,用SPAD-502便携式叶绿素仪测定上、中、下不同部位完全叶片的相对叶绿素含量,每处理重复3次,取平均值。此外,从植株第1朵花开放时起,每天记录不同处理花朵开放的数量,统计开放时间。
1.3 统计分析
试验数据采用Excel 2010进行处理和作图,通过SPSS 17.0进行非线性回归和方差分析。
2 结果与分析
2.1 连续弱光下SA对Elena开花前后叶片净光合速率的影响
由图1可以看出,70%连续遮荫条件下,不同浓度SA处理的Elena植株叶片Pn/PAR响应曲线均呈急剧上升后趋于平缓的变化趋势,现蕾期,当PAR≤1 200 μmol/(m2·s)时,0 mmol/L(CK)SA处理的 Elena 植株Pn最高,为9.42 μmol/(m2·s),均高于其他SA处理;PAR>1 200 μmol/(m2·s)时,CK处理的植株Pn呈缓慢下降趋势,而其他SA处理的植株叶片Pn继续增加,呈饱和趋近型;盛花期各处理的Pn均显著高于现蕾期(P<0.05)。
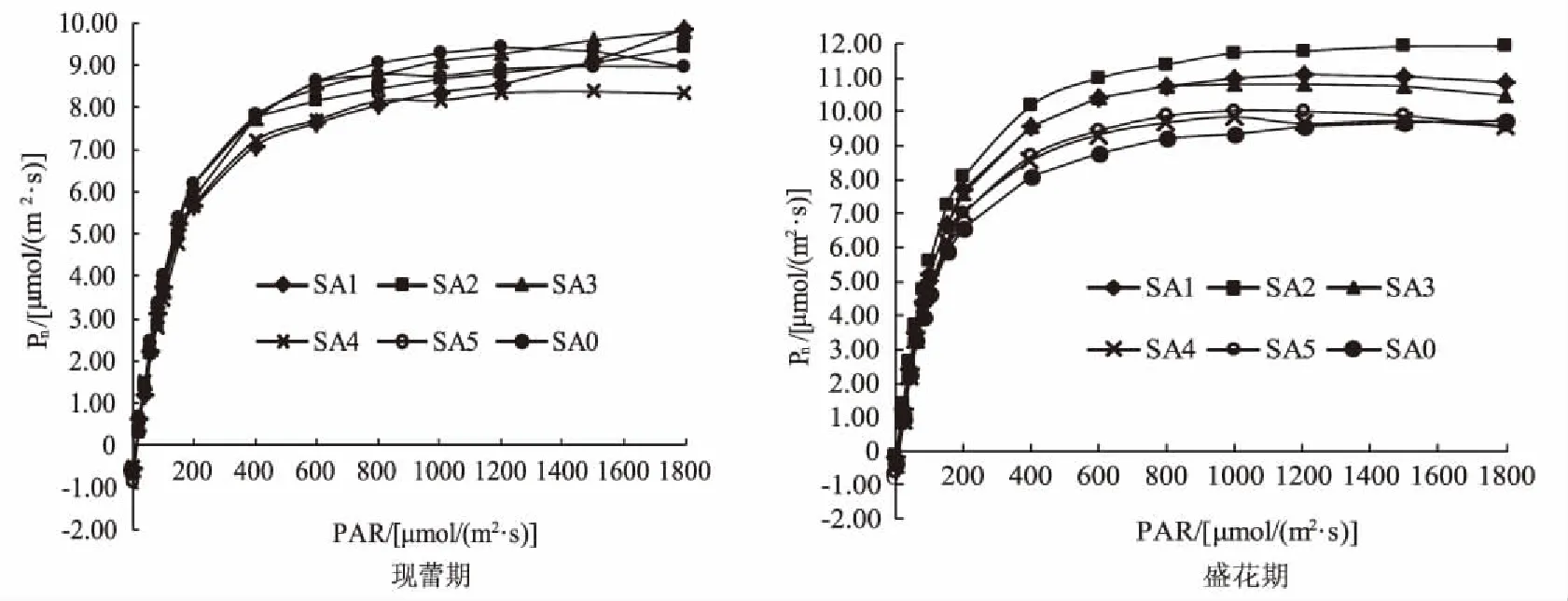
图1 连续弱光下不同浓度SA对Elena植株现蕾期和盛花期净光合速率的影响
由表1可知,施用0.5、1.0、1.5 mmol/L SA的Elena植株在现蕾期和盛花期的Pmax均高于其他SA处理,其中1.0 mmol/L SA处理的植株盛花期的Pmax最高,为12.65 μmol/(m2·s),2.0、2.5 mmol/L SA处理的Elena植株Pmax较低,现蕾期分别为9.23、10.16 μmol/(m2·s)。可以看出,连续弱光下不同SA处理对盛花期植株Pmax的影响表现为1.0 mmol/L>0.5 mmol/L>1.5 mmol/L >2.5 mmol/L>2.0 mmol/L>0 mmol /L,0.5~1.5 mmol/L的SA 均能提高连续弱光下Elena植株的Pmax,对Pmax有明显的促进作用。
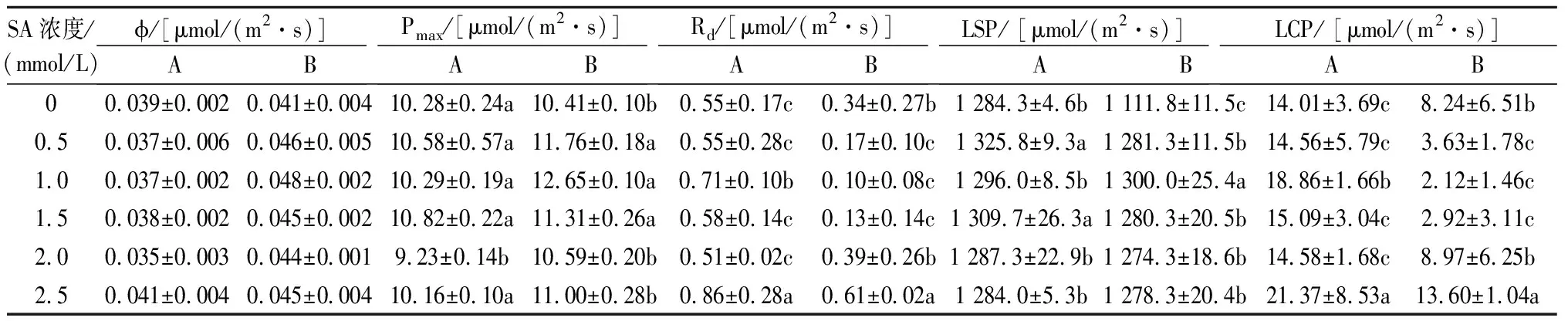
表1 连续弱光下SA对Elena开花前后光合参数的影响
注:A为现蕾期,B为盛花期。同列数据后不同小写字母表示差异显著(P<0.05),未标注说明差异不显著,下同。
2.2 连续弱光下SA对Elena光合参数的影响
由表1可知,70%连续弱光条件下,施用不同浓度SA后,Elena的各项光合参数均发生了一定的变化。除了2.5 mmol/L SA处理的植株在现蕾期的LSP略低于CK以外,其余SA处理植株的LSP在开花前后均高于CK,随着SA浓度的增加,LSP呈先升后降的变化趋势,其中以0.5~1.5 mmol/L SA处理的LSP较高,说明在70%连续弱光条件下一定浓度的SA处理可提高Elena对光强的利用能力;盛花期时不同SA处理植株的LCP均显著低于现蕾期,其中施用0.5、1.0、1.5 mmol/L SA植株的LCP分别比CK下降55.95%、74.27%和64.56%,差异均达到显著水平(P<0.05),2.0、2.5 mmol/L SA处理植株的LCP则高于CK。
从表1可看出,不同SA处理的植株在盛花期的φ均大于现蕾期,且高于CK,说明在弱光下不同浓度SA处理均能提高Elena对弱光的吸收能力。此外,随着SA处理时间的延长,植株的暗呼吸速率(Rd)逐渐降低,盛花期的Rd均低于现蕾期,其中施用0.5、1.0、1.5 mmol/L SA植株的Rd均低于CK,且差异显著,而2.0、2.5 mmol/LSA处理植株的Rd在盛花期均高于CK,说明一定浓度SA处理有利于提高Elena植株对弱光的适应能力。
2.3 连续弱光下SA对Elena CO2响应曲线的影响
Elena的CO2响应曲线变化规律与光响应曲线相似,施用不同浓度的SA后Pn随着CO2浓度的升高呈相似的变化趋势,当CO2浓度为0~400 μmol/mol时,Pn迅速增加,此后随着Ci浓度的逐渐升高,叶片的Pn缓慢上升并逐渐接近饱和状态。Elena叶片的CO2响应曲线参数见表2,70%连续弱光条件下,不同SA处理的植株在现蕾期的Jmax均高于CK,其中施用0.5、1.0 mmol/L SA的植株Jmax较高,分别比CK上升了67.8%和41.1%,差异显著(P<0.05),随着遮荫时间的延长,到达盛花期时,0.5、1.0 mmol/L SA处理的植株叶片Jmax有所下降,其他SA处理(包括CK)的Jmax则呈上升的趋势。
由表2可以看出,不同SA处理的植株CSP随着植株的生长发育和遮荫时间的延长呈上升趋势,其中施用0.5、1.0、1.5 mmol/L SA的植株盛花期CSP较高,而2.0、2.5 mmol/L SA处理的植株CSP低于CK。此外,各SA处理的植株在盛花期的CCP均呈不同程度的下降趋势,其中施用0.5、1.0 mmol/L SA的植株CCP低于CK,其他SA处理的CCP均高于CK。5个SA处理的植株光呼吸速率(Rp)均高于CK,且Elena的Rp远比Rd高,说明连续遮光下Elena植株的呼吸作用更加强烈,随着Elena植株的不断生长发育,不同SA处理的表观羧化效率(CE)逐渐升高,其中0.5、1.0、1.5 mmol/L SA处理的植株CE均高于CK,但差异不显著。

表2 连续弱光下SA对Elena开花前后CO2响应曲线参数的影响
2.4 连续弱光下SA对Elena 开花前后叶片Gs和Tr的影响
由表3可知,与CK相比,不同浓度的SA处理均提高了现蕾期Elena的Gs和Tr,Gs随着SA浓度的增加先升后降,但各处理间的Gs差异不显著(P>0.05);现蕾期,Tr呈不规律的变化趋势,随着遮荫时间的延长,盛花期植株的Tr随SA浓度的增加先升后降,其中施用1.0 mmol/L SA的植株在盛花期的Tr最高,比CK升高了65.3%,其次为0.5、1.5 mmol/L SA处理的植株。
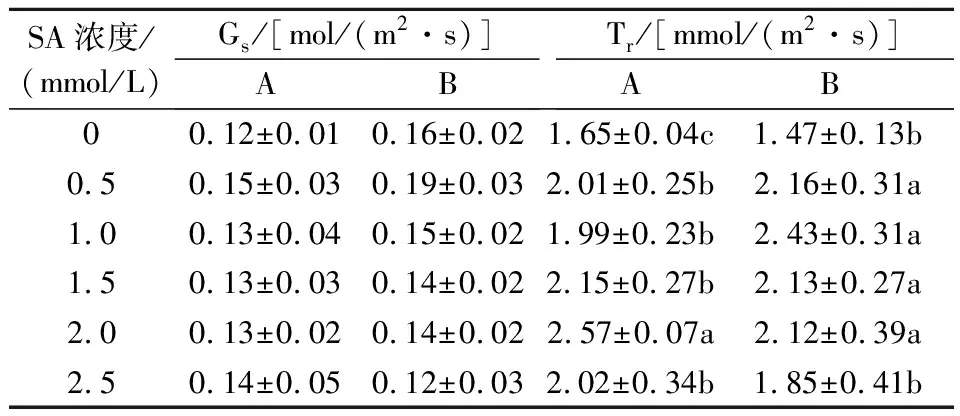
表3 连续弱光下SA对Elena开花前后叶片Gs和Tr的影响
2.5 连续弱光下SA对Elena植株生长指标及SPAD的影响
植物光合作用效率的改变,最终可引起生物产量的变化。由表4可以看出,与CK相比,0.5、1.0、1.5 mmol/L SA处理均不同程度地提高了Elena在现蕾期和盛花期的相对叶绿素含量、株高和茎粗,盛花期时,0.5、1.0 mmol/L SA处理的植株株高和SPAD值均显著高于CK(P<0.05),而不同SA处理的植株茎粗则无明显差异性。此外,本试验还记录了不同浓度SA处理Elena植株的花朵开放时间,结果表明,与CK相比,不同SA处理均可有效延长开花时间,尤其以1.0 mmol/L SA处理的植株效果明显,其次为0.5、1.5 mmol/L SA处理的植株,说明在70%连续弱光条件下,适宜浓度的SA处理在一定程度上可以促进植株生长,有效延长开花期。
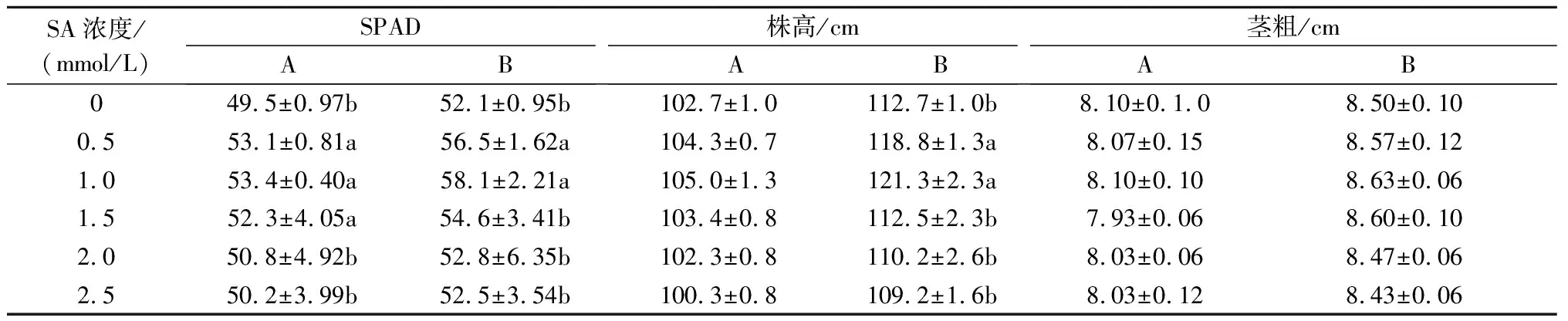
表4 连续弱光下SA对Elena生长指标及SPAD的影响
3 结论与讨论
目前已有非直角双曲线模型和直角双曲线模型[20]、Prado-Moraes模型[21]、叶子飘新模型[22]等拟合模型可拟合出植物重要的光合参数。由于非直角双曲线模型拟合度较高,因此,本试验运用非直角双曲线模型结合SPSS 17.0的非线性回归,在PAR≤200 μmol/(m2·s)时以直线回归作为补充,计算连续弱光下不同浓度SA处理Elena开花前后的光响应曲线相关参数并绘制出拟合图。
SA作为一种信号分子,是调节光合作用,提高植物环境适应能力的重要途径之一[23]。Wang等[24]研究表明,使用100 mg/L的SA处理能缓解弱光对烤烟植株叶片生长的抑制,提高烟株光能利用率,促进烟株正常生长发育。毕焕改等[25]研究表明,1.0 mmol/L SA可以提高光合酶的活性,缓解亚适温弱光对黄瓜幼苗光合作用的影响,增强其对亚适温弱光的适应性。SA还能够减轻逆境对植物的伤害[26-27]。在本试验中,从形态上来看,0.5、1.0、1.5 mmol/L SA处理均提高了Elena植株的相对叶绿素含量、株高和茎粗,促进了植株的生长,且能正常生长开花。从光合参数来看,Pmax能反映植物的光合潜力,其中施用0.5、1.0、1.5 mmol/L SA后的Elena植株Pmax均高于CK,因此,不同浓度的SA能提高连续弱光条件下Elena的光能利用率。研究表明,较高的φ和较低的Rd能够提高植株对弱光的利用能力[4,14],本试验中,1.0 mmol/LSA处理的Elena植株LSP和φ在盛花期达到最高,LCP和Rd最低,其次为0.5、1.5 mmol/L SA处理的植株,说明Elena植株对弱光的利用能力较强,Rd最低还有利于植物同化物的积累,是植物适应弱光环境的一种表现[28],2.0、2.5 mmol/L SA处理对光的适应性较差。此外,不同浓度的SA处理对Elena的LSP、LCP的影响程度不同,说明Elena潜在光合能力很大。
CO2是植物进行光合作用的碳源,Ci的变化可以影响羧化效率,从而影响植物净光合速率。从整体作用效果来看,在70%连续弱光条件下,随着Ci的逐渐升高,叶片的Pn缓慢上升并逐渐接近饱和。施用不同浓度的SA后Elena的Jmax均高于CK,说明适宜浓度的SA处理有利于提高光合速率。CSP和CCP是判断植物是否具有高光合效率遗传特性的一个重要指标[28],CCP较低、CSP较高的植株对CO2环境的适应性较强,CCP越低的植物常常具有较高净光合速率的特点,因此,低CCP也常常被用作选育高产品种的指标[29-30],在70%遮荫条件下,0.5、1.0、1.5 mmol/L SA处理的植株CSP均高于CK,0.5、1.0 mmol/L SA处理的CCP低于CK。在温室条件下,CO2浓度均不会成为影响百合光合作用的限制因子,采用提高CO2浓度或适宜的SA处理措施均可促进百合的光合作用。
在70%连续遮荫条件下,SA可有效改善Elena植株在弱光下的光合特性及生长状况,促进其生长,提高光合作用,其中以1.0 mmol/L SA灌根效果较好,0.5、1.5 mmol/L SA灌根效果次之。
参考文献:
[1] 施爱萍,张金政,张启翔,等.不同遮荫水平下4个玉簪品种的生长性状分析[J].植物研究,2004,24(4):486-490.
[2] 王祥宁,熊丽,陈敏,等.不同光照条件下东方百合生长状态及生物量的分配[J].西南农业学报,2007,20(5):1091-1096.
[3] Liu Q H,Wu X,Chen B C,etal.Effects of low light on agronomic and physiological characteristics of rice including grain yield and quality[J].Rice Science,2014,21(5):243-251.
[4] 喇燕菲,张启翔,潘会堂,等.弱光条件下东方百合的生长发育及光合特性研究[J].北京林业大学学报,2010,32(4):213-217.
[5] 郭太君,胡昕,葛新新,等.遮荫对细叶百合和松叶百合生长发育及光合色素含量的影响[J].东北农业大学学报,2013,44(7):128-131.
[6] 刘筱,赵景龙,邓洁,等.遮阴对不同大小种球大百合生长与光合特性的影响[J].安徽农业科学,2011,39(36):22274-22276.
[7] 吴珍珍.遮阴和水分处理对大百合生理特性的影响[D].雅安:四川农业大学,2015.
[8] 张安林,潘远智,姜贝贝,等.遮荫对香水百合光合特性及叶绿素荧光参数的影响[J].西南师范大学学报(自然科学版),2011,36(5):163-167.
[9] Senaratna T,Toucbell D,Bunn E,etal.Acetyl salicylic acid and salicylic acid induce multiple stress tolerance in bean and tomato plants[J].Plant Growth Regul,2000,30(2):157-161.
[10] Khan W,Prithiviraj B,Smith D L.Photosynthetic responses of corn and soybean to foliar application of salicylates[J].J Plant Physiol,2003,160(5):485-492.
[11] 唐艳萍,文涛,孙歆,等.水杨酸对植物光合作用影响的研究进展[J].西北植物学报,2015,35(8):1701-1708.
[12] 刘伟,艾希珍,梁文娟,等.低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J].应用生态学报,2009,20(2): 441-445.
[13] 王俊玲,高志奎,霍捷.不同光强下外源水杨酸对韭菜硝酸盐累积及PSⅡ活性的影响[J].华北农学报,2011,26(1):47-50.
[14] 韩浩章,王晓立,张颖,等.水杨酸对连续弱光条件下黄瓜开花期光合特性的影响[J].内蒙古农业大学学报,2014,35(1):21-24.
[15] 李璟,晏晓霞,蔡仕珍,等.三个百合品种光合特性研究[J].黑龙江农业科学,2015 (4):60-66.
[17] Guo J M,William A J,Mattiqrew H T.Diurnal and seasonal photosynthesis in two asparagus cultivars with contrasting yield[J].Crop Sci,2002,42(2):399-405.
[18] 徐克章,张美善,武志海,等.人参不同生育期叶片光合作用变化的研究[J].作物学报,2006,32(10):1519-1524.
[19] 张小全,徐德应,赵茂盛,等.CO2增长对杉木中龄林针叶光合生理生态的影响[J].生态学报,2000,20(3):390-396.
[20] Thornley J H M.Mathematical models in plant physiology[M].London:Academic Press,1976:86-110.
[21] Prado C H,Moraes J A P V D.Photosynthetic capacity and specific leaf mass in twenty woody species of cerrado vegetation under field condition[J].Photosynthetica,1997(33):103-112.
[22] Ye Z P.A new model for relationship between light intensity and the rate of photosynthesis inOryzasativa[J].Photosynthetica,2007(45):637-640.
[23] Janda T,Gondor O K,Yordanova R,etal.Salicylic acid and photosynthesis:Signaling and effects[J].Acta Physiologiae Plantarum,2014,36(10):2537-2546.
[24] Wang H,Liu G S,Yun F.Effects of salicylic acid on photosynthesis and chlorophyll fluorescence characteristics of fluecured tobacco leaf in subdued light[J].Agricultural Science & Technology,2014,15(1):33-38.
[25] 毕焕改,董绪兵,王美玲,等.钙和水杨酸对亚适温弱光下黄瓜幼苗光合酶活性和基因表达的影响[J].园艺学报,2015,42 (1):56-64.
[26] 张彩霞.水杨酸减轻水稻高温伤害的机理研究[D].北京:中国农业科学院,2015.
[27] 张永平,陈幼源,杨少军,等.外源水杨酸对镉胁迫甜瓜幼苗生长与光合气体交换和叶绿素荧光特性的影响[J].西北植物学报,2014,34(4):778-785.
[28] Kitao M,Lei T T,Koike T,etal.Susceptibility to photoinhibition of three deciduous broadleaf tree species with different successional traits raised under various light regimes[J].Plant Cell and Environment,2000,23(1):81-89.
[29] 赵勋,李因刚,柳新红,等.白花树不同种源苗木光合-CO2响应[J].江西农业大学学报,2011,33(6):1128-1133.
[30] 于贵瑞,王秋凤.植物光合、蒸腾与水分利用的生理生态学[M].北京:科学出版社,2010.
