葡萄籽原花青素对老年阻塞性睡眠呼吸暂停低通气综合征病人氧化应激及炎症反应的影响
2018-06-05,,,
, ,,
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)属于鼾症的一类,指病人睡眠时上气道塌陷阻塞引起呼吸暂停和低通气,伴有打鼾、血氧饱和度下降、白天嗜睡及睡眠结构紊乱等临床病症。据估计我国中老年人,鼾症发病率在60%以上,其中OSAHS为20%~40%[1]。OSAHS病人出现不同程度的低氧血症及高碳酸血症,引起全身多系统、多器官的渐进性损害,与心脑血管疾病和代谢等疾病的发生发展密切相关,严重者引起病人死亡[2-3]。氧化应激是OSAHS病理进程中的关键环节,近年来动物实验已证实抗氧化治疗对低氧诱导的心肌组织、神经组织等保护作用,为抗氧化治疗在临床应用提供依据。
葡萄籽原花青素(grape seedproanthocyanidin extract,GSPE)是从葡萄籽中提取的生物类黄酮物质,动物实验显示,GSPE可提高机体对缺氧的耐受能力,拮抗长期低氧对心、脑、肾等重要脏器的损伤[4-5]。GSPE对OSAHS病人的治疗效果报道较少。本研究在持续气道正压通气(continuous positive airways pressure,CPAP)治疗基础上应用GSPE干预老年OSAHS病人,观察对氧化应激及炎症反应的影响。
1 资料与方法
1.1 研究对象 选择2012年12月—2014年12月在我院门诊以打鼾就诊并确诊为OSAHS病人108例。纳入标准:所有病人诊断标准均符合OSAHS诊治指南2011年修订版有关OSAHS的诊断标准[6];多导睡眠监测系统(polysonmography,PSG)显示睡眠呼吸暂停低通气指数(AHI)20次/h~40次/h的中度OSAHS病人,最低血氧饱和度(lowest oxygen saturation,LSaO2)为65%~84%;病人知情同意并接受本试验的治疗方法,签署知情同意书,服从本研究安排;年龄≥60岁,初中及以上文化程度。排除标准:酒精或药物依赖者;有精神疾病史或近3个月应用过精神类药物者;患有其他精神疾患、感染性疾病、心脑血管疾病及严重肝肾疾病等重要脏器疾病;近3个月有创伤及手术史。
将108例老年OSAHS病人随机分为对照组(36例),GSPE A组(36例)与GSPE B组(36例)。治疗过程中,对照组2例、GSPE A组2例和GSPE B组 3例剔除(剔除原因均为不愿坚持CPAP治疗)。3组最终纳入研究人数:对照组34例、GSPE A组 34例、GSPE B组33例。3组一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 3组一般资料比较
1.2 治疗方法 对照组:采用瑞典博雅(BREAS)PV101全自动正压无创呼吸机经鼻CPAP治疗,呼吸频率为6次/min~40次/min,压力范围6 cmH2O~12 cmH2O(1 cmH2O=0.098 kPa)。使用前均经CPAP压力调定,压力滴定治疗均在夜间进行,起始压力为4 cmH2O,最初治疗时最低SaO2在85%以上,AHI每小时<5次,此时缺氧症状不严重,病人自觉症状轻。每2周根据病人缺氧改善情况和血气分析结果及时调整吸入氧浓度,调试压力滴定,待病人病情好转后再逐渐下调呼吸机参数,并减少通气治疗时间,延长停机时间。要求病人每晚至少使用CPAP治疗7 h,连续治疗8周。GSPE A组在CPAP治疗基础上给予GSPE口服,每粒100 mg,每次1粒,每日2次;GSPE B组在CPAP治疗基础上给予GSPE口服每粒100 mg,每次2粒,每日2次;口服时间均为8周。
1.3 检测指标 治疗前后3组病人均监测PSG、血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD),白细胞介素-6(interleukin 6,IL-6),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测。
1.3.1 PSG监测 澳大利亚Compumedics公司生产的多导睡眠仪进行夜间连续7 h PSG监测。检查者试验前1周禁用兴奋、催眠类药物。选取AHI、夜间平均血氧饱和度(mean oxygen saturation,MSaO2)和夜间LSaO2为观察指标。
1.3.2 疗效评价标准 以AHI减少程度及SaO2提高程度判断其疗效,治愈:呼吸暂停、打鼾症状基本消失,AHI每小时<5次、SaO2>90%;显效:呼吸暂停、打鼾症状明显减轻,AHI每小时<20次和降低≥50%;有效:呼吸暂停、打鼾症状减轻,AHI降低25%;无效:症状无明显变化,AHI降低5%。
1.3.3 血清MDA含量和SOD测定 应用双抗体夹心酶标免疫分析法测定标本MDA和SOD水平。使用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。计算公式:MDA含量(nmol/mL)=(测定管吸光度-测定空白管吸光度)÷(标准管吸光度-标准空白管吸光度)×标准品浓度(10 nmol/mL)×样本测试前稀释倍数;SOD活力(U/mL)=(对照管吸光度-测定管吸光度)÷对照管吸光度÷50%×反应体系的稀释倍数×样本测试前的稀释倍数。
1.3.4 血清TNF-α及IL-6检测 抽取清晨空腹静脉血3 mL,3 000 r/min离心15 min后,置-20 ℃下冰冻待测。采用放射免疫法检测IL-6和TNF-α,试剂盒由北京华英生物技术研究公司提供,操作过程严格按照说明书进行。

2 结 果
2.1 3组临床治疗效果比较 GSPE B组总有效率显著高于对照组和GSPE A组,差异有统计学意义(P<0.05);GSPE A组与对照组比较,差异无统计学意义(P>0.05)。详见表2。
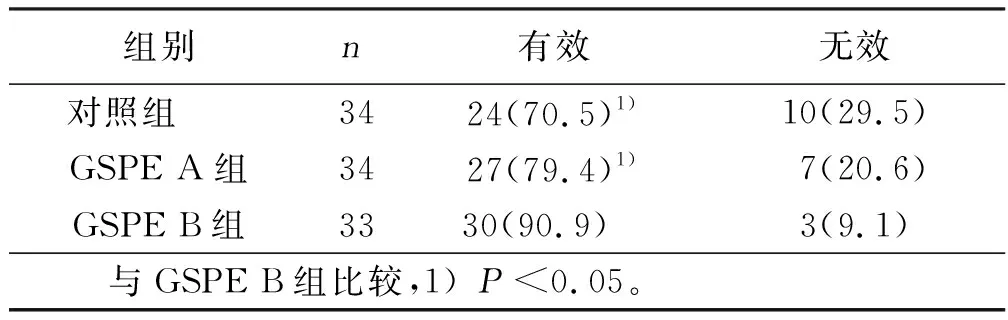
表2 3组临床治疗效果比较 例(%)
2.2 3组病人LSaO2和SaO2<90%时间比较 治疗前,3组LSaO2和SaO2<90%时间比较,差异无统计学意义(P>0.05);治疗后,GSPE A组和GSPE B组LSaO2高于对照组,SaO2<90%时间低于对照组,差异有统计学意义(P<0.05);GSPE B组LSaO2高于GSPE A组,SaO2<90%时间低于GSPE A组,差异有统计学意义(P<0.05)。详见表3。


组别n LSaO2(%) 治疗前治疗后 SaO2<90%时间(s) 治疗前治疗后对照组3468.75±13.1078.32±13.18 154.78±103.72110.78±70.33 GSPE A组3467.88±12.9282.96±10.241)155.92±107.3398.24±65.081)GSPE B组3367.28±12.8689.12±9.301)2)155.13±110.02 82.77±69.441)2) 与对照组治疗后比较,1)P<0.05;与GSPE A组治疗后比较,2)P<0.05。
2.3 3组病人MDA含量和SOD水平比较 治疗前,3组MDA含量和SOD水平比较,差异无统计学意义(P>0.05)。治疗后GSPE A组和GSPE B组MDA含量低于对照组(P<0.05);GSPE B组MDA低于GSPE A组,差异有统计学意义。但3组间SOD水平差异无统计学意义(P>0.05)。详见表4。


组别n MDA(nmol/mL) 治疗前治疗后 SOD(U/mL) 治疗前治疗后对照组 34157.78±9.7297.96±13.2411.38±2.2617.56±2.88GSPE A组34158.92±10.1285.38±12.221)10.96±2.8418.33±3.10GSPE B组33158.13±9.9669.40±13.701)2)11.24±2.7818.49±3.22 与对照组治疗后比较,1)P<0.05;与GSPE A组治疗后比较,2)P<0.05。
2.4 3组病人血清IL-6和TNF-α水平比较 治疗前,3组IL-6和TNF-α水平比较,差异无统计学意义(P>0.05)。治疗后,GSPE A组和GSPE B组IL-6和TNF-α低于对照组,差异有统计学意义(P<0.05);GSPE B组IL-6和TNF-α低于GSPE A组,差异有统计学意义(P<0.05)。详见表5。


组别n TNF-α 治疗前治疗后 IL-6 治疗前治疗后对照组3470.28±3.36 51.32±4.2842.33±7.5833.14±7.22GSPE A组3469.44±3.9242.80±5.481)43.12±8.1426.33±6.381)GSPE B组3370.44±3.5832.42±6.331)2)42.40±7.8220.10±5.961)2) 与对照组治疗后比较,1)P<0.05;与GSPE A组治疗后比较,2)P<0.05。
3 讨 论
本研究结果显示:与对照组比较,GSPE A组治疗有效率出现增高趋势,且GSPE B组有效率显著更高,说明GSPE对老年OSAHS有一定的治疗效果,与目前国内外报道氧化剂可用于治疗OSAHS的结论基本一致[7-8]。有研究显示,GSPE可拮抗疲劳导致呼吸肌组织内氧自由基损伤,减轻呼吸肌组织疲劳;提高大脑低氧耐受能力,减轻中枢性疲劳[9-10],这可能是GSPE治疗效果增高的原因之一。
OSAHS是一种氧化应激性的疾病,有研究分别检测OSAHS病人下呼吸道局部和血浆氧化应激标志物8-羟基脱氧鸟苷和MDA含量明显升高,经CPAP治疗后使MDA和8-羟基脱氧鸟苷水平明显下降[11]。Christou等[12]研究表明OSAHS病人血浆氧化代谢产物增高的,增高程度与AHI呈正相关,而病人血浆>抗氧化能力与AHI呈负相关。氧化应激不仅与OSAHS病人嗜睡、反应迟钝、情绪障碍、认知障碍等密切相关,同时氧化应激在一定程度上导致OSAHS病人心脑血管疾病的发生[13]。
为明确GSPE治疗OSAHS的作用,本研究进一步观察MDA含量和SOD水平变化,结果显示GSPE组MDA水平呈剂量依赖式降低,但SOD变化不明显,提示GSPE对提高机体抗氧化能力的作用不明显,其拮抗OSAHS病人体内氧化应激反应主要通过清除氧自由基含量实现。OSAHS病人以反复低氧-复氧为特征,正常氧与低氧间动脉血氧饱和度差可达30%~70%,类似缺血-再灌注,产生大量氧自由基。GSPE本身具有极强的抗氧化能力,可迅速清除病人体内氧自由基含量。本研究GSPE组LSaO2显著提高,SaO2<90%时间显著降低,即GSPE改善病人低氧状态,抑制氧自由基产生,是本研究中MDA显著降低的原因。
OSAHS病人体内炎症反应明显增强,且这种炎症反应与氧化应激关系密切,有学者在OSAHS合并证模型中,发现伴随活性氧(reactive oxygen species,ROS)增多,核因子-κB激活,其下游蛋白如TNF-α和细胞间黏附分子-1明显增多[14]。本研究结果显示GSPE对OSAHS病人氧化应激具有很好的拮抗作用,为证实GSPE可减轻OSAHS病人的炎症反应,进一步说明GSPE拮抗氧化应激的可靠性,因此本研究观察血清IL-6和TNF-α变化,其中TNF-α作为一种介导多向性炎症反应和免疫调节的重要致炎细胞因子,可激活核因子-κB及p38丝裂原活化蛋白激酶信号通路,引起炎症因子IL-6、TNF-α、IL-1因子进一步表达增加,造成恶性循环;而IL-6不仅具有趋化炎细胞活性的作用,同时可加重局部炎症反应,二者变化加速OSAHS病人心脑血管疾病的发生[15]。本研究结果显示GSPE组二者水平呈剂量依赖式降低,说明GSPE以降低OSAHS病人的炎症反应。动物实验证实,GSPE可抑制炎症通路p38丝裂原活化蛋白激酶的激活及核因子-κB向胞内移位,发挥较强的抗炎作用[16]。目前GSPE已应用到与炎症反应密切相关的疾病如高血压、动脉粥样硬化疾病的防治中,取得较好的效果。
综上所述,本研究发现GSPE对OSAHS有一定的治疗效果,可降低病人氧自由基水平、拮抗炎症反应,但抗氧化能力不明显,为抗氧化剂在OSAHS的临床应用提供一定理论支持。
参考文献:
[1] 余招平,徐文安,刘祖欣.阻塞性睡眠呼吸暂停综合征与脑卒中的关系[J].中华全科医学,2011,9(8):1284-1285.
[2] Dong MJ,Peng B,Lin XT,et al.The prevalence of dementia in the People's Republic of China;a systemic analysis of 1980-2004 studies[J].Age Aging,2007,36(6):619-624.
[3] Koistinaho M,Koistinaho J.Interactions between Alzheimer' s disease and cerebral ischemia-focus on inflammation[J].Brain Res Rev,2005,48(2):240-250.
[4] Zhao YN,Guo X,Wang HY,et al.The neuroprotective effects of grape seed proanthocyanidin on rat brain injury caused by chronic intermittent hypoxia[J].Neurology Asia,2014,19(4):399-403.
[5] 尹霞,李柏成,赵宇光,等.抗氧化剂对慢性间歇性乏氧所致小鼠心肌重构的保护作用[J].中华心血管病杂志,2014,42(11):944-950.
[6] 中华医学会呼吸病学分会睡眠呼吸疾病学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(草案)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[7] 叶胜兰,李程红.乙酰半胱氨酸泡腾片干预阻塞性睡眠呼吸暂停综合征患者T淋巴细胞亚群分布的临床观察[J].中国医院药学杂志,2013,33(9):709-712.
[8] Madamanchi NR,Hakim ZS,Runge MS.Oxidative stress in atherogenesis and anerial thrombosis:the disconnect between cellular studies and clinical outcomes[J].J Thromb Haemost,2005,3(2):254-26.
[9] 刘协,李小宁.葡萄籽提取物原花青素的抗疲劳作用研究[J].实用预防医学,2004,11(1):36-38.
[10] Feng Y,Liu YM,Leblanc MH,et al.Grape seed extract given three hours after injury suppresses lipid peroxidation and reduces hypoxicischemic brain injury in neonatal rats[J].Pediatr Res,2007,61(3):295-300.
[11] Jurado-Gamez B,Gomez-Chaparro JL,Munoz-Calero M,et al.Serum proteomic changes in adults with obstructive sleep apnoea[J].J Sleep Res,2012,21(2):139-146.
[12] Christou K,Moulas AN,Pastaka C,et al.Antioxidant capacity in obstructive sleep apnea patients[J].Sleep Med,2003,4(3):225-228.
[13] Kohler MM,Craig S,Pepperell JC,et al.CPAP improves endothelial function in patients with minimally symptomatic OSA:results from a subset study of the MOSAIC trial [J].Chest,2013,144(3):896-902.
[14] Ryan S,Taylor CT,Mcnicholos WT.Systemic inflanamation:a key factor in the pathogenesis of cardiovascular complications in obstructive sleep apnoea syndrome?[J].Postgrad Med,2009,85(1010):693-698.
[15] Zhao YN,Wang HY,Li JM,et al.Hippocampal mitogen-activated protein kinase activation is associated with intermittent hypoxia in a rat model of obstructive sleep apnea syndrome[J].Molecular Medicine Report,2016,13(1):137-145.
[16] 吴秀香,张妍,孙柳青,等.葡萄籽原花青素对肾血管性高血压犬鼠血管重塑的影响[J].中国病理生理杂志,2012,28(6):1023-1027.
