头痛宁胶囊对偏头痛大鼠血清多巴胺、多巴胺-β-羟化酶、去甲肾上腺素水平的影响
2018-06-05,
,
偏头痛的发病机制尚不明确,可能由于其多重混合的症候学特征(头痛及神经病学、精神病学和交感神经系统症状)很难以一种或多种相关的病理生理学过程解释,基因突变、基因多态性、线粒体功能失调、神经递质代谢及中枢神经系统离子通道是导致偏头痛发生的主要生物因素,多因子的生物行为功能失调导致大脑额叶过度兴奋,诱发疼痛通路的反常激活,导致偏头痛发生[1]。既往研究发现,神经递质的代谢异常在偏头痛发病过程中起重要作用,本研究观察头痛宁胶囊对偏头痛大鼠血清多巴胺(DA)、多巴胺-β-羟化酶(Dβ-H)、去甲肾上腺素(NE)水平的影响,探讨头痛宁胶囊治疗偏头痛的作用机制。
1 材料与方法
1.1 实验动物与试剂 健康雄性清洁级Wistar大鼠36只,体重250 g~300 g,均由山西医科大学动物实验中心提供,安静屏蔽环境下喂养,室温控制在22 ℃。硝酸甘油注射液,每支5 mg,由北京益民药业有限公司生产;头痛宁胶囊,每粒0.4 g,由陕西步长制药有限公司生产。使用蒸馏水配制低剂量头痛宁胶囊悬液(380 mg/kg)和高剂量头痛宁胶囊悬液(760 mg/kg)。测定DA、Dβ-H、NE的ELISA试剂盒均购自武汉博士德生物科技有限公司。
1.2 实验方法
1.2.1 造模与分组 将36只健康雄性Wistar大鼠普通喂养1周后,采用随机分组法分为将36只健康雄性Wistar大鼠普通喂养1周,随机分为空白对照组(6只)和偏头痛模型组(30只)。空白对照组给予生理盐水皮下注射。偏头痛模型组根据Tassorelli等[2]研究的方法皮下注射硝酸甘油(NTG)制备大鼠偏头痛模型,并随机分为模型对照组,预防高剂量组、预防低剂量组,治疗高剂量组、治疗低剂量组,每组6只。空白对照组给予蒸馏水2 mL/(kg·d)灌胃7 d,第7天灌胃30 min后给予10 mL/kg生理盐水皮下注射;模型对照组给予蒸馏水2 mL/(kg·d)灌胃7 d,第7天灌胃30 min后再次给予10 mL/kg硝酸甘油皮下注射;治疗高剂量组、低剂量组给予蒸馏水2 mL/(kg·d)灌胃7 d,第7天灌胃30 min后再次给予10 mL/kg硝酸甘油皮下注射,造模30 min后分别给予头痛宁胶囊760 mg/kg和380 mg/kg灌胃;预防高剂量组、低剂量组分别给予头痛宁胶囊760 mg/kg和380 mg/kg灌胃7 d,第7天灌胃30 min后再次给予10 mL/kg硝酸甘油皮下注射。分别观察大鼠的症状行为学表现。
1.2.2 标本采集 各组末次给药后,通过大鼠连续断尾采血法[3]分别于30 min、60 min和180 min使用血清分离促凝管收集标本,以3 000 r/min离心30 min,收集血清待检。
1.2.3 DA、Dβ-H、NE水平测定 准备6只小试管,将标准品分别稀释(DA:600 pg/mL,300 pg/mL,150 pg/mL,75 pg/mL,37.5 pg/mL,0 pg/mL;Dβ-H:160 ng/mL,80 ng/mL,40 ng/mL,20 ng/mL,10 ng/mL,0 ng/mL;NE:800 pg/mL,400 pg/mL,200 pg/mL,100 pg/mL,50 pg/mL,0 pg/mL);在酶标包被板上分别设标准品孔、空白孔、待测样品孔,依次加入标准品50 μL、蒸馏水50 μL、样品40 μL+生物素标记的抗DA(Dβ-H/NE)抗体10 μL,采用封板膜封板后置37 ℃温育箱30 min;浓缩洗涤液用蒸馏水稀释20倍,之后揭掉封板膜,弃液,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干,除空白孔外,每孔加入酶标试剂50 μL,再次温育,洗涤,之后每孔加入显色剂A、B各50 μL,37 ℃避光显色15 min,之后每孔加终止液50 μL,终止反应。以空白孔凋零,450 nm波长依序测量各孔吸光度(OD值),以标准物的浓度为横坐标,OD值为纵坐标,绘制标准曲线,计算样品浓度。

2 结 果
2.1 行为学观察 通过观察各组大鼠末次给药后不同时间的行为症状学(挠头、咬趾/尾、往返动作、爬笼等)发现,空白对照组末次给药30 min内出现爬笼、咬趾/尾动作多于其他组,可能为药物激惹所致;预防高剂量组、低剂量组偏头痛相关行为较模型对照组明显减少;治疗高剂量组与模型对照组比较,偏头痛相关行为减少,治疗低剂量组与模型对照组比较,差异无统计学意义(P>0.05)。
2.2 各组大鼠不同时间DA、Dβ-H、NE水平比较 经过单因素方差分析,6组间DA、Dβ-H、NE含量变化有统计学意义(P<0.05)。各组进行多重比较,显示预防高剂量组60 min及180 min血清Dβ-H含量与空白对照组比较,差异无统计学意义(P>0.05);预防高剂量组60 min血清NE含量与空白对照组比较,差异无统计学意义(P>0.05)。其余各组两两比较,差异有统计学意义(P<0.05)。详见表1~表3。

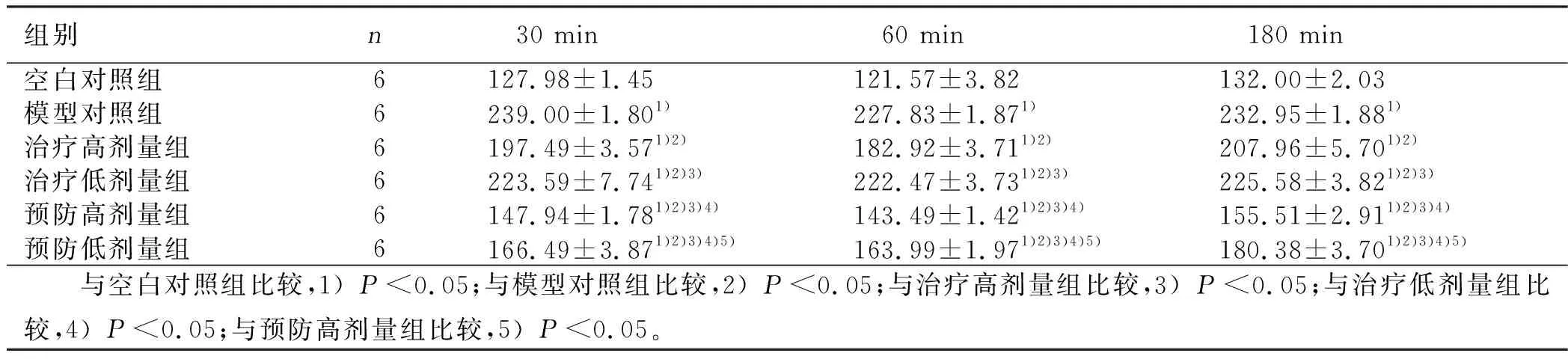
组别n 30 min 60 min 180 min空白对照组6127.98±1.45121.57±3.82132.00±2.03模型对照组6239.00±1.801)227.83±1.871)232.95±1.881)治疗高剂量组6197.49±3.571)2)182.92±3.711)2)207.96±5.701)2)治疗低剂量组6223.59±7.741)2)3)222.47±3.731)2)3)225.58±3.821)2)3)预防高剂量组6147.94±1.781)2)3)4)143.49±1.421)2)3)4)155.51±2.911)2)3)4)预防低剂量组6166.49±3.871)2)3)4)5)163.99±1.971)2)3)4)5)180.38±3.701)2)3)4)5) 与空白对照组比较,1)P<0.05;与模型对照组比较,2)P<0.05;与治疗高剂量组比较,3)P<0.05;与治疗低剂量组比较,4)P<0.05;与预防高剂量组比较,5)P<0.05。

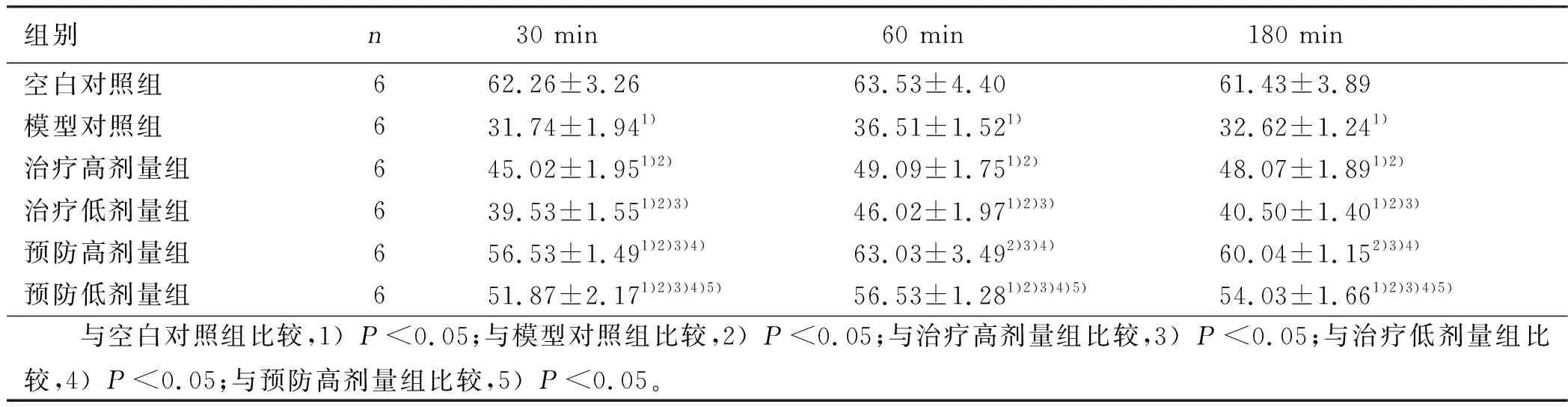
组别n 30 min 60 min 180 min空白对照组662.26±3.2663.53±4.4061.43±3.89模型对照组631.74±1.941)36.51±1.521)32.62±1.241)治疗高剂量组645.02±1.951)2)49.09±1.751)2)48.07±1.891)2)治疗低剂量组639.53±1.551)2)3)46.02±1.971)2)3)40.50±1.401)2)3)预防高剂量组656.53±1.491)2)3)4)63.03±3.492)3)4)60.04±1.152)3)4)预防低剂量组651.87±2.171)2)3)4)5)56.53±1.281)2)3)4)5)54.03±1.661)2)3)4)5) 与空白对照组比较,1)P<0.05;与模型对照组比较,2)P<0.05;与治疗高剂量组比较,3)P<0.05;与治疗低剂量组比较,4)P<0.05;与预防高剂量组比较,5)P<0.05。


组别n 30 min 60 min 180 min空白对照组6324.92±9.42325.40±9.27325.77±9.68模型对照组6180.51±3.731)201.07±1.831)191.50±1.271)治疗高剂量组6238.15±2.031)2)259.58±2.691)2)249.48±2.721)2)治疗低剂量组6206.48±2.661)2)3)230.03±2.121)2)3)213.75±3.941)2)3)预防高剂量组6306.82±4.651)2)3)4)325.48±11.842)3)4)308.55±8.621)2)3)4)预防低剂量组6277.03±7.911)2)3)4)5)290.03±10.051)2)3)4)5)290.76±6.151)2)3)4)5) 与空白对照组比较,1)P<0.05;与模型对照组比较,2)P<0.05;与治疗高剂量组比较,3)P<0.05;与治疗低剂量组比较,4)P<0.05;与预防高剂量组比较,5)P<0.05。
2.3 DA、Dβ-H、NE水平相关性分析 DA与NE存在负相关关系,DA与Dβ-H存在负相关关系,NE与Dβ-H存在正相关关系。详见表4。
表4 DA、Dβ-H、NE水平相关性分析(r值)

因素DANENE -0.7981)1.000Dβ-H-0.7621) 0.9391) 注:1)P<0.01。
3 讨 论
Dβ-H是催化DA合成NE的主要限速酶,位于肾上腺素和NE神经元和神经内分泌细胞的细胞膜内侧,肾上腺髓质的嗜铬颗粒,储存于交感神经末梢囊泡内,Dβ-H在血管上分布丰富,包括较多交感神经分布的大脑血管,偏头痛病人血清Dβ-H水平降低,可能与Dβ-H中基因的多态性及等位基因分布不同相关[4-5];Gallai等[5]通过比较无先兆偏头痛病人、紧张性头痛病人和健康志愿者血清Dβ-H含量,发现无先兆偏头痛病人、紧张性头痛病人血清Dβ-H含量明显低于健康志愿者,低剂量Dβ-H导致交感神经功能失调从而诱发偏头痛。有研究通过对受偏头痛影响的家庭独立样本进行传递失衡检验分析显示同一Dβ-H标志物的等位基因传递发生畸变,而对与家庭无关联的偏头痛病例和健康对照者Dβ-H等位基因的分布特征进行检测,结果显示表达二核苷酸多态性的特定等位基因频率在两者中存在差异,表明Dβ-H等位基因畸变可能增加偏头痛病人易感性[6]。Ghosh等[7]为研究在印度北部人群中多巴胺能基因的DNA片段长度、DNA重复序列及单核苷酸多态性是否与偏头痛的发生发展以及遗传相关联,纳入301例偏头痛病人(其中202例无先兆偏头痛和99例有先兆偏头痛病人)和202名健康对照者,将Dβ-H部分基因进行克隆,并使其变性,造成DNA点突变、插入或去除,观察发现Dβ-H 19 bp插入缺失多态性与偏头痛发生显著相关,尤其在女性,DRD2 Ncol基因表达改变未发现与偏头痛易感性相关。有研究通过对275例高加索人偏头痛病人和275名健康对照组检测分析两种不同Dβ-H基因多态性(一种为功能性的增加/缺失启动子,另一种为编码区单个碱基的替换或调换),发现单个碱基改变与偏头痛无显著相关性,而编码Dβ-H基因增加/缺失变异体可增加偏头痛发生率,特别在视觉、言语、感觉、运动等先兆偏头痛病人中常见;这种变异型在性别层面分析显示,存在纯合子缺失基因型男性发生偏头痛的风险是女性的3倍[8]。
DA是一种儿茶酚胺类神经递质,在大脑内主要分布于中脑边缘、中脑皮质、黑质纹状体和结节漏斗部,受脊髓灰质后角、下丘脑中部及丘脑中继核调节,在丘脑中可通过与D1和D2受体结合促进丘脑神经元细胞膜的去极化和增加丘脑腹后外侧核/丘脑腹后内侧核感觉神经元的放电,促进先兆偏头痛的发生[9]。DA有5种受体,其中DRD1和DRD5通过激活腺苷酸环化酶发挥作用;DRD2、DRD3和DRD4抑制腺苷酸环化酶;DRD3和DRD4多态性可能与偏头痛无相关性[4,10]。有研究显示,先兆偏头痛病人编码D2DR的Ncol基因多态性高于无先兆偏头痛及健康者,提示Ncol基因突变可能是诱发偏头痛发生的一个病理生理机制[11]。有较多研究未发现DRD2的Ncol基因多态性与偏头痛相关[12-13]。
NE是一种单胺类神经递质,在周围神经系统主要由交感神经储存和释放,自主神经功能障碍可诱导偏头痛发作,偏头痛发作时交感神经储存的NE相对消耗及其他交感神经的共转运体如DA、三磷酸腺苷和腺苷释放增加[14],中枢神经系统主要由几个小的脑干神经核合成和释放,在前额叶皮层和海马区域具有重要的调节作用[15],NE降低可扩张血管,增加血流量,且可通过降低中枢神经系统的痛阈,诱发偏头痛[16]。NE对偏头痛的影响存在争议,有研究认为NE含量增加有助于疼痛性信号由脑膜传入硬脑膜和硬脑膜的成纤维细胞,可能是由于NE激活硬脑膜成纤维细胞上的肾上腺素能受体,增加细胞外信号调节激酶的磷酸化和白介素-6释放,使偏头痛进入头痛期[17]。
近期研究表明,酪氨酸代谢在偏头痛的发病机制中起到重要作用,酪氨酸有两条不同的代谢途径,第一条途径通过酪氨酸羟化酶、多巴胺脱羧酶及Dβ-H产生3,4-二羟基苯丙氨酸(DOPA)、DA、NE和肾上腺素(E),其中Dβ-H通过催化分解DA产生NE;第二条途径为酪氨酸脱羧酶合成酪胺、章鱼胺和脱氧肾上腺素,章鱼胺和脱氧肾上腺素的合成需要Dβ-H和苯乙醇胺-N-甲基转移酶(PNMT)的激活[1]。本实验主要研究酪氨酸代谢的第一条途径,有研究认为可能由于偏头痛病人Dβ-H基因或Dβ-H受体基因的多态性改变降低Dβ-H的活性,从而增加DA水平,降低NE水平[18]。
本研究通过观察各组大鼠行为学症状改变,发现预防高剂量组、低剂量组偏头痛相关行为较模型对照组明显减少,治疗高剂量组与模型对照组相比偏头痛相关行为减少,治疗低剂量组与模型对照组比较偏头痛相关行为改变差异不明显,提示头痛宁胶囊的预防作用大于治疗作用。通过对各组大鼠血清DA、Dβ-H、NE含量进行测定、分析,发现与模型对照组比较,头痛宁胶囊预防剂量组和治疗剂量组DA含量降低,Dβ-H和NE含量升高,60 min及180 min时预防高剂量组Dβ-H含量与空白对照组比较,差异无统计学意义(P>0.05),与模型对照组比较,差异有统计学意义(P<0.05);60 min时预防高剂量组NE含量与空白对照组比较,差异无统计学意义(P>0.05),与模型对照组比较,差异有统计学意义(P<0.05)。提示预防高剂量头痛宁胶囊对偏头痛大鼠血清Dβ-H、NE含量影响较大,可使Dβ-H、NE含量升高,接近空白对照组,且预防高剂量组、低剂量组DA、Dβ-H、NE含量与治疗高剂量组、低剂量组比较,差异有统计学意义(P<0.05)。进一步提示头痛宁胶囊的预防作用大于治疗作用;同时,治疗高剂量组、低剂量组比较,差异有统计学意义(P<0.05);预防高剂量组、低剂量组比较,差异有统计学意义(P<0.05),提示不同剂量的头痛宁胶囊对DA、Dβ-H、NE含量影响不同。
本实验分析各组间DA、Dβ-H、NE含量的相关性,发现DA与NE存在负相关关系,DA与Dβ-H存在负相关关系,NE与Dβ-H存在正相关关系,提示头痛宁胶囊可降低DA水平,升高NE水平、Dβ-H水平,可能通过增加Dβ-H的活性使DA合成NE增加,达到治疗及预防偏头痛目的。
参考文献:
[1] D'Andrea G.Pathogenesis of chronic migraine:the role of neuromodulators[J].Headache the Journal of Head & Face Pain,2012,52(7):1155-1163.
[2] Tassorelli C,Joseph SA.Systemic nitroglycerin induces fos immunoreactivity in brain stem and forebrain structures of the rat[J].Brain Research,1995,682(1/2):167-181.
[3] 田顺亮,钱学华.大鼠断尾取血固定装置的设计及取血的方法[J].中国比较医学杂志,2006,16(7):419-421.
[4] 邓玉,陈强,孔敏露,等.偏头痛的多巴胺机制研究进展[J].中国疼痛医学杂志,2016,22(3):210-213.
[5] Gallai V,Gaiti A,Sarchielli P,et al.Evidence for an altered dopamine beta-hydroxylase activity in migraine and tension-type headache[J].Acta Neurologica Scandinavica,1992,86(4):403.
[6] Lea RA,Dohy A,Jordan K,et al.Evidence for allelic association of the dopamine beta-hydroxylase gene (DBH) with susceptibility to typical migraine [J].Neurogenetics,2000,3(1):35-40.
[7] Ghosh J,Sunil PDM,Mittal B.Role of dopaminergic gene polymorphisms (DBH 19 bp Indel and DRD2 NcoI) in genetic susceptibility to migraine in North Indian population [J].Pain Medicine,2011,12(7):1109-1111.
[8] Fernandez F,Lea RA,Colson NJ,et al.Association between a 19 bp deletion polymorphism at the dopamine beta-hydroxylase (DBH) locus and migraine with aura[J].Journal of the Neurological Sciences,2006,251(1):118-123.
[9] Noseda R,Borsook D,Burstein R.Neuropeptides and neurotransmitters that modulate thalamo-cortical pathways relevant to migraine headache[J].Headache,2017,57(S2):97.
[10] Barbanti P,Fofi L,Aurilia C,et al.Dopaminergic symptoms in migraine[J].Neurological Sciences,2013,34(1):67-70.
[11] Peroutka SJ,Wilhoit T,Jones K.Clinical susceptibility to migraine with aura is modified by dopamine D2 receptor (DRD2) NcoI alleles[J].Neurology,1997,49(1):201-206.
[12] Todt U,Netzer C,Toliat M,et al.New genetic evidence for involvement of the dopamine system in migraine with aura[J].Human Genetics,2009,125(3):265-279.
[13] Corominas R,Ribases M,Camia M,et al.Two-stage case-control association study of dopamine-related genes and migraine[J].BMC Medical Genetics,2009,10(1):95.
[14] Peroutka SJ.Migraine:a chronic sympathetic nervous system disorder[J].Headache,2010,44(1):53-64.
[15] Borodovitsyna O,Flamini M,Chandler D.Noradrenergic modulation of cognition in health and disease[J].Neural Plasticity,2017,2017(2):6031478.
[16] Tassorelli C,Greco R,Wang D,et al.Nitroglycerin induces hyperalgesia in rats-a time-course study[J].European Journal of Pharmacology,2003,464(3):159-162.
[17] Wei X,Yan J,Tillu D,et al.Meningeal norepinephrine produces headache behaviors in rats via actions both on dural afferents and fibroblasts[J].Cephalalgia,2015,35(12):1054-1064.
[18] D'Andrea G,Leon A.Pathogenesis of migraine:from neurotransmitters to neuromodulators and beyond[J].Neurological Sciences,2010,31(1):1-7.
