右心室经胸穿刺测压法在肺动脉高压大鼠模型中的应用
2018-06-04,,,,,*
,,,,,*
(1.广西医科大学第一附属医院儿科 广西 南宁 530021;2.柳州市工人医院儿科)
建立高肺血流量型肺动脉高压动物模型,对深入研究其机制有至关重要的作用,Garcia[1]曾在大鼠腹主动脉与下腔静脉间行穿刺分流术,正常饲养11周后可建立高肺血流量型肺动脉高压模型。但是模型饲养周期长达11周,期间腹主动脉与下腔静脉间的瘘口存在闭合的可能性,这成为影响模型最终建成的关键问题,并且运用传统右心导管法测量肺动脉压力后,大鼠立即死亡,无法进行自身前后对照。本研究利用在右心室流出道及肺动脉主干均无狭窄的前提下,肺动脉收缩压与右心室收缩压基本一致的原理[2-4],采用经胸右心室穿刺法测量右心室压来间接反映肺动脉压,对术后6周大鼠模型进行中期筛查,探讨建模末期模型成功率是否能明显提高,右心室压是否能实现自身前后对照。
1 材料和方法
1.1动物
健康SD大鼠共46只,雌雄各半,体重200-250g,由广西医科大学实验动物中心提供,并经广西医科大学动物伦理委员会批准。
1.2主要的试剂及仪器
5%水合氯醛溶液,肝素注射液(100mg/支),庆大霉素注射液(80000U/支),苏木素,伊红,12号注射器针头,小哈巴狗血管夹,8-0带针缝线,小动物手术台,耳钉,一次性使用静脉输液针 (0.45×13.5mm),MPA-CFS心功能分析系统及配套的压力换能器(上海奥尔科特生物科技有限公司),体视显微镜,光学显微镜,电子天平。
1.3方法
1.3.1 测压及建立动物模型 大鼠麻醉后仰卧固定,取出一次性使用静脉输液针(0.45×13.5mm),输液针导管内充满1∶100肝素生理盐水,通过医用三通管将其末端连接压力换能器,连接到心功能分析系统。打开MPA心功能分析系统,将心室压B通道定标。食指触摸大鼠心尖搏动最强点并标记,在胸部正中线处测量胸骨角及胸骨体的体表长度,并在其7:3处标记,在此点及其周围触摸,络合碘消毒胸前区及针头,以搏动最明显处作为穿刺点,针尖指向心尖标记点以60度角方向刺入,进针有突破感后缓慢进针,可发现一次性静脉输液针随心跳搏动,心功能分析系统显示波浪状压力曲线,数值窗口显示右心室收缩压、舒张压及平均压,提示已进入右心室,固定针尖此位置20余秒,之后保存压力数值及压力曲线文件。开腹拉开肠管,暴露腹主动脉及下腔静脉,用小哈巴狗钳将腹主动脉夹闭,用12号一次性针头穿透腹主动脉壁进入相邻的下腔静脉内,用8-0号线荷包缝合腹主动脉壁的穿刺口,腹腔注射庆大霉素200u/kg预防感染,分层缝合肌层和皮肤。术后1周,发现大鼠死亡6只,将存活的大鼠模型按随机数字方法,平均分为实验组(n=20)及对照组(n=20),模型大鼠用耳钉编号。术后6周采用上述方法测量右心室压,淘汰压力前后变化小于6mmHg的模型大鼠。
1.3.2 评估模型成功建立情况 术后11周用上述方法测量右心室压。观察模型大鼠一般情况,看其是否出现呼吸急促、趾端口唇紫绀,喜蜷缩等。开腹观察下腔静脉大体情况,看其是否明显增宽,颜色是否呈鲜红色,是否伴有搏动等;在显微镜下分离右心室与左心室+室间隔,用滤纸吸干后用电子天平称重,计算右心室肥厚指数(right ventricle hypertrophy index,RVHI),即右心室重量/左心室+室间隔重量;将左肺上叶固定,石蜡包埋后做成5um的切片,脱水脱蜡后用苏木精 - 伊红(HE)染色,镜下观察肺动脉,观察动脉管壁是否明显增厚,管腔是否出现狭窄及肌化程度。统计以上5项实验结果,综合评估建模末期的模型成功情况。
1.4统计学处理
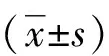
2 结 果
2.1右心室压变化情况
术前行右心室压检测,右心室平均压为12.1±1.48mmHg。术后6周再次测量,实验组与对照组右心室平均压分别为(17.87±1.96mmHg)和(17.49±2.51mmHg),实验组与对照组比较,差异无统计学意义(P>0.05),术后6周与术前压力比较,显著高于术前(P<0.05)。术后11周,实验组与对照组右心室平均压分别为(27.97±3.27mmHg)和(23.67±5.63mmHg),实验组显著高于对照组,(P<0.05)。见图1及图2。
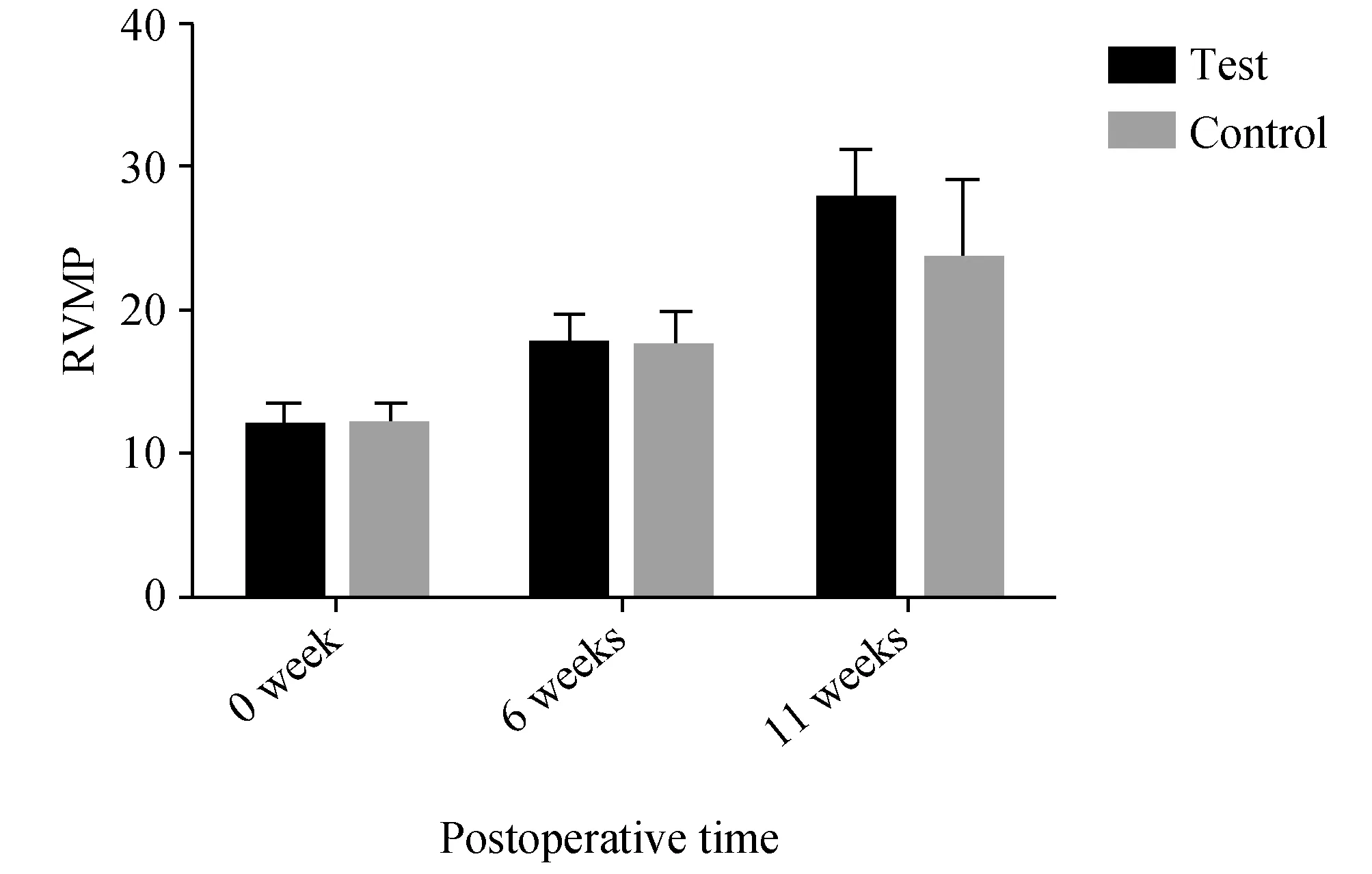
图1 各时间段右心室平均压力(RVMP)比较(mmHg)与对照组比较,*P<0.05
2.2术后11周模型大鼠一般情况及下腔静脉观察情况
实验组模型大鼠出现毛发稀疏,部分可见趾端及口唇紫绀,呼吸急促,活动量减少,喜蜷缩,开腹后发现下腔静脉明显增粗,并呈鲜红色,伴搏动,对照组模型大鼠部分出现上述变化。
2.3术后11周模型大鼠右心室肥厚指数
实验组与对照组右心室肥厚指数分别是(0.33±0.02)和(0.28±0.06),实验组与对照组比较,实验组显著高于对照组(P<0.05)。
2.4术后11周模型大鼠肺动脉HE染色
HE染色结果可见实验组右心室平均压高于25mmHg的模型大鼠肺动脉发生了肌化,管壁增厚,管腔出现狭窄,平滑肌增殖明显,血管周围有炎性细胞浸润;对照组右心室平均压低于25mmHg的模型大鼠肺动脉肌化程度轻,动脉壁有轻度增厚,管腔未见明显狭窄。见图3。
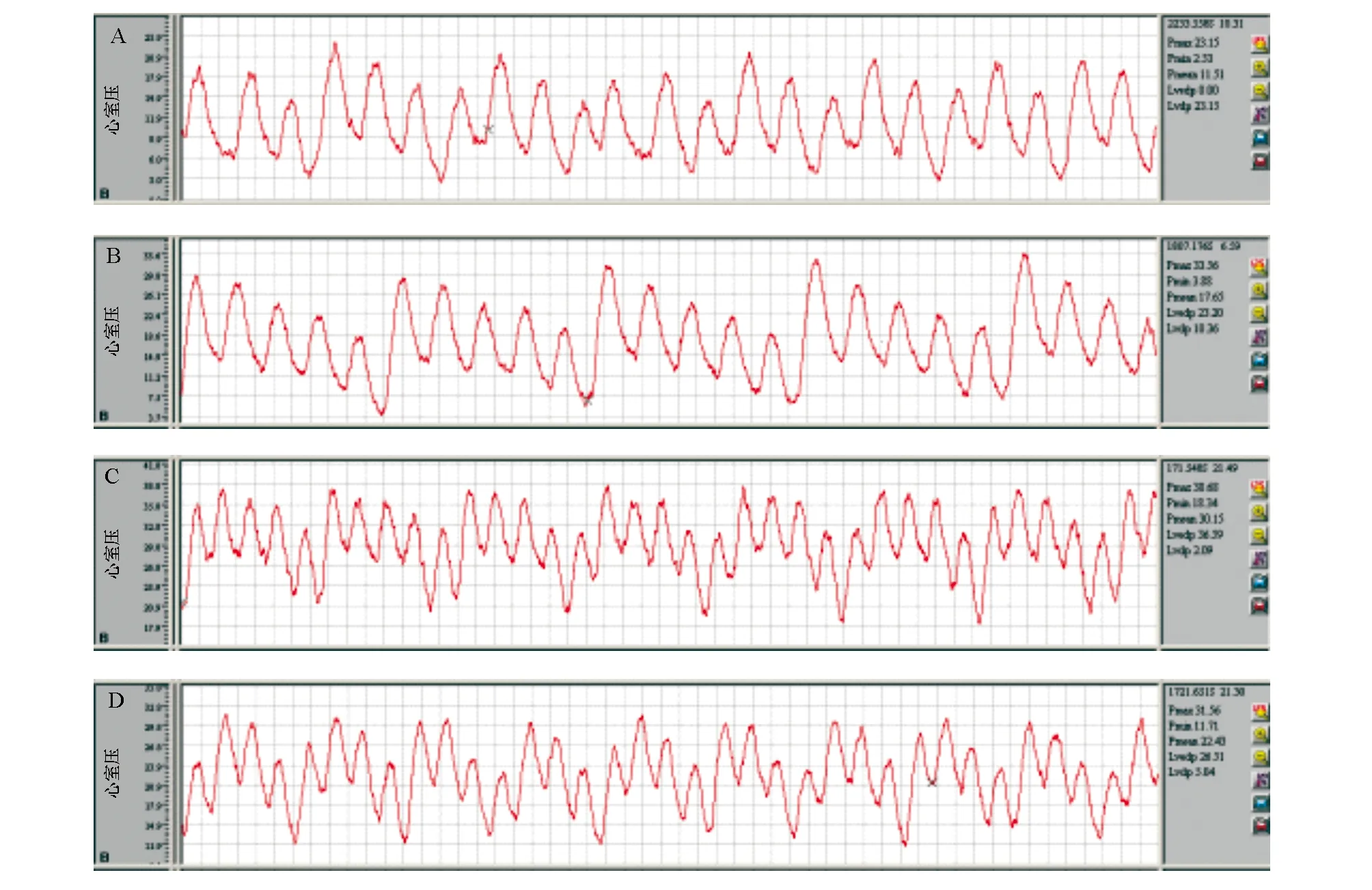
图2 各时间段采集的右心室压数值及曲线A:术前;B:术后6周;C:术后11周(实验组);D: 术后11周(对照组)
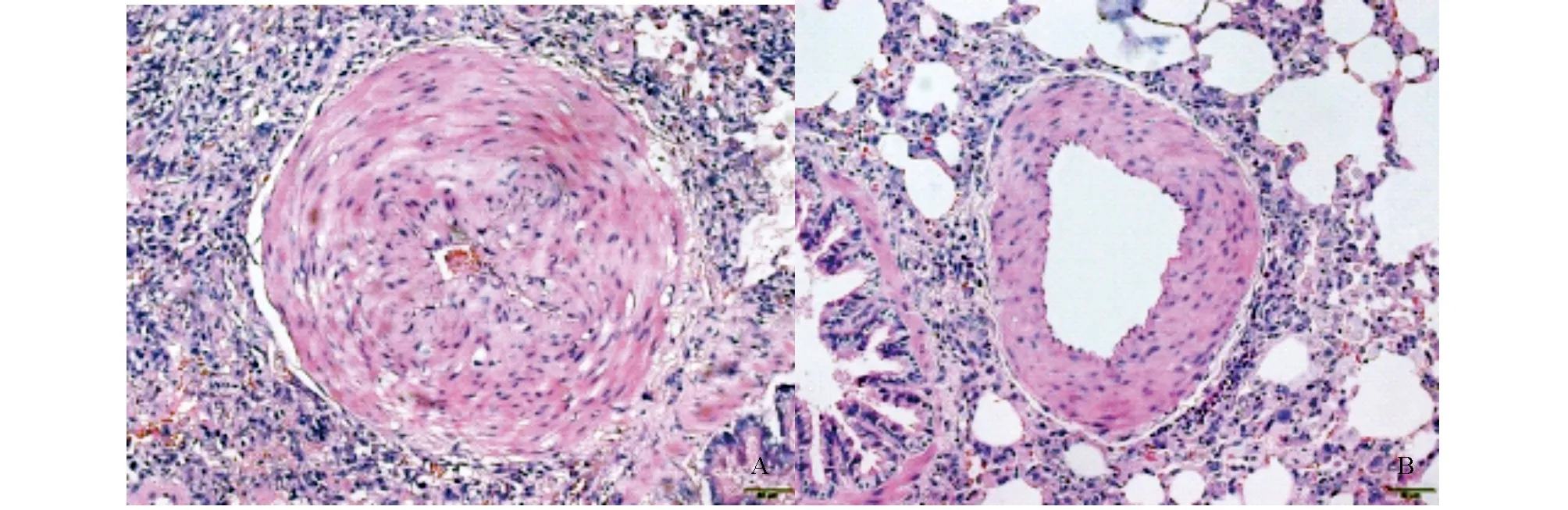
图3 大鼠肺动脉HE染色(200×)A:实验组;B:对照组
2.5模型大鼠最终成功情况
实验组成功建模9只,失败1只,对照组成功建模10只,失败10只,实验组与对照组成功率分别为90%和50%,实验组显著高于对照组(P<0.05)。
3 讨 论
高肺血流量型肺动脉高压是小儿先天性心脏病左向右型的一种常见的并发症,其极大程度增加了患儿围手术期风险,严重影响了手术效果和患儿预后,是患儿病残和病死的重要原因之一,深入探讨肺动脉高压形成的机制对先心病的治疗和预后有重要意义。大鼠动静脉分流模型常运用于此研究中,因模型形成过程中有瘘口闭合的可能性,在建模末期模型成功率并不高。传统的右心导管法测量肺动脉高压[5-7],由于其缺乏可重复性,不能作为模型大鼠自身前后对照的检测方法。
现国际上已有研究者运用右心室压力变化情况用来间接反映肺动脉压力变化情况[8-11],运用传统的右心导管法测量右心室压操作较为困难,成功率较低,缺乏重复性。曾有学者提出在超声引导下穿刺右心室,在胸骨右缘4-5肋间并紧贴胸骨向心尖方向以60°角斜行刺入[4],其后又有学者提出在心尖搏动最强处向头侧上移0.1-0.3mm作为穿刺点垂直刺入[3],该方法简单易行无需超声辅助,但心脏在跳动过程中,右心室腔的位置也在不断变化中,所以该方法适用于对心脏的体表投影较为熟悉的操作者。本方法在前人的研究基础上进行了改进,就穿刺点这一问题进行了前期大鼠胸部解剖,发现4-5肋间大致位于胸骨角至胸骨体的7∶3处,穿刺前在胸骨右缘触摸此处附近心脏搏动较强的点,以协助准确定位穿刺点,心尖位置则可由心脏体表搏动最强点来确定,大鼠右心室呈斜向前下的锥体形,向心尖方向以60°角斜行刺入更易刺入右心室腔,方法简便易学,并且穿刺后大鼠仍可继续存活,一般情况无特殊改变,为实施自身右心室压前后对照提供了可行性。术后11周,右心室平均压力测量高于25mmHg的模型大鼠出现一般情况、下腔静脉、右心室肥厚程度及肺动脉病理情况的明显改变,对比右心室平均压力测量低于25mmHg的模型大鼠,发现上述改变不明显,说明此方法在检测大鼠肺动脉高压方面的可靠性。
本研究运用改良后的右心室经胸穿刺测压法对肺动脉高压模型大鼠进行多次右心室压力的测量,在建模中期淘汰部分模型大鼠,明显提高了建模末期模型的成功率,减少了动物饲养的损耗。此外,本研究亦发现右心室经胸穿刺测压法在对肺动脉高压模型大鼠进行前后自身对照方面有显著优势,为后期的实验研究发现了一条简单易行的新思路。
参考文献:
[1] GARCIA R, DIEBOLD S. Simple, rapid, and effective method of producing aortocaval shunts in the rat[J]. Cardiovasc Res.1990,24(5):430-2.
[2] XIONG M, YAO JP, WU ZK, et al. Fibrosis of pulmonary vascular remodeling in carotid artery-jugular vein shunt pulmonary artery hypertension model of rats[J]. Eur J Cardiothorac Surg.2012,41(1):162-6.
[3] 劳金泉, 邓燕, 张锋, 等. 经胸右心室穿刺法测量大鼠右心室压力的研究[J]. 现代生物医学进展.2017(04):619-6.
[4] 信怡, 黄国英, 夏红萍, 等. 大鼠经胸右心室穿刺测压的可行性研究[J]. 复旦学报(医学版).2006(05):639-41.
[5] AIELLO RJ, BOURASSA PA, ZHANG Q, et al. Tryptophan hydroxylase 1 Inhibition Impacts Pulmonary Vascular Remodeling in Two Rat Models of Pulmonary Hypertension[J]. J Pharmacol Exp Ther.2017,360(2):267-79.
[6] DENG C, WU D, YANG M, et al. The role of tissue factor and autophagy in pulmonary vascular remodeling in a rat model for chronic thromboembolic pulmonary hypertension[J]. Respir Res.2016,17(1):65.
[7] FUKUMITSU M, KAWADA T, SHIMIZU S, et al. Wave reflection correlates with pulmonary vascular wall thickening in rats with pulmonary arterial hypertension[J]. Int J Cardiol.2017,249:396-401.
[8] YUNG LM, NIKOLIC I, PASKIN-FLERLAGE SD, et al. A Selective Transforming Growth Factor-beta Ligand Trap Attenuates Pulmonary Hypertension[J]. Am J Respir Crit Care Med.2016,194(9):1140-151.
[9] YANG P, READ C, KUC RE, et al. Elabela/Toddler Is an Endogenous Agonist of the Apelin APJ Receptor in the Adult Cardiovascular System, and Exogenous Administration of the Peptide Compensates for the Downregulation of Its Expression in Pulmonary Arterial Hypertension[J]. Circulation.2017,135(12):1160-73.
[10] LI X, HE Y, XU Y, et al. KLF5 mediates vascular remodeling via HIF-1alpha in hypoxic pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol.2016,310(4):L299-310.
[11] ZHANG B, NIU W, XU D, et al. Oxymatrine prevents hypoxia- and monocrotaline-induced pulmonary hypertension in rats[J]. Free Radic Biol Med.2014,69:198-207.
