热休克预处理骨髓间充质干细胞对化疗性卵巢早衰的疗效观察
2018-06-02陈小莹李欣然王清汪庆如付霞霏
陈小莹,李欣然,王清,汪庆如,付霞霏
随着化疗药物在恶性肿瘤、自身免疫性疾病中的广泛应用,相关疾病患者的生存期明显延长,但同时也使其中的女性患者面临着化疗药物所致卵巢早衰引起的低雌激素症状及不孕等问题[1-2]。近年来,随着干细胞移植的兴起及深入研究,化疗性卵巢早衰的治疗取得了一定进展。临床研究表明,干细胞移植能有效治疗心肌梗死等损伤性疾病[3],恢复损伤组织、器官的功能。动物实验研究也表明,间充质干细胞(mesenchymal stem cells,MSCs)移植能部分恢复化疗药物所致的卵巢损伤[4]。但是干细胞移植的治疗效果并没有达到预期,移植后细胞丢失是其主要原因,如何提高移植细胞的存活率是提高疗效的关键所在。热休克预处理作为一种提高细胞抗凋亡能力的有效方法得到深入研究,有文献报道其可通过上调热休克蛋白(heat shock protein,HSP)如HSP27、HSP70的表达来提高细胞的抗凋亡能力[5-6]。本研究建立了化疗性卵巢早衰大鼠模型,并对其进行了热休克预处理后的骨髓间充质干细胞(BMSCs)移植,检测移植后大鼠卵巢结构和内分泌功能的变化,以探讨热休克预处理BMSCs在化疗性卵巢早衰中的应用价值。
1 材料与方法
1.1 实验材料 Wistar大鼠BMSCs及其完全培养基购自中国广州赛业生物科技有限公司,胰蛋白酶购自美国Gibco公司,Cell Count Kit-8 (CCK-8)试剂盒购自日本Dojindo公司,PBS缓冲液购自美国Hyclone公司,CM-Dil标记液购自美国Thermo Fisher Scientific公司。
1.2 实验动物 125只近交系SPF级Wistar雌性大鼠(体重180~200g),另5只4~5周龄雌性Wistar大鼠(体重80~100g)用于分离培养BMSCs,均购自南方医科大学实验动物中心[许可证号:SYXK(粤)2011-0074]。
1.3 BMSCs的分离、培养及鉴定 无菌条件下分离大鼠双侧股骨及胫骨,用剪刀从中间剪断股骨及胫骨,用注射器抽取适量含10%胎牛血清的完全培养液反复冲洗骨髓腔至髓腔变白,用完全培养液调节将所得细胞浓度为约1×109/ml后直接接种于25cm2塑料透气培养瓶中。将培养瓶放置在37℃、5%CO2培养箱中常规培养,48h后观察到有少量细胞贴壁后半量更换细胞生长液,以后每2~3d全量更换新鲜培养液,待细胞铺满培养瓶约80%时可进行1:2传代,用0.25%胰酶消化,以5×104/ml细胞浓度传代扩增。取第3代BMSCs,制成单细胞悬液,采用流式细胞仪对细胞表面标志CD44、CD45、CD29、CD34进行鉴定。选取生长状态良好的第3代BMSCs进行实验。
1.4 热休克预处理BMSCs 细胞贴壁状态下,将培养瓶用封口膜封口,再用塑料袋密封整个培养瓶。将整个培养瓶置于42℃恒温水浴箱水浴1h,取下塑料袋及封口膜,更换新鲜培养液,放置于37℃、5%CO2培养箱中常规培养48h。
1.5 CM-Dil标记热休克BMSCs BMSCs热休克处理后48h制成细胞悬液,按最终浓度4µg/ml加入适量1mg/ml的CM-Dil储存液,37℃培养箱中孵育30min后,1000r/min离心5min,弃去上清液,PBS洗2次。
1.6 动物分组及处理 实验前对大鼠进行阴道涂片,选取具有正常动情周期的大鼠纳入实验。实验前剪尾取血1ml,离心后收集血清,于–80℃保存,同批检测性激素雌二醇(estrogen,E2)、卵泡刺激素(follicule-stimulating hormone,FSH)水平,并了解基础内分泌水平。
大鼠随机分为5组:正常对照组(不注射药物)、模型组、假手术组、BMSCs组、热休克BMSCs组,每组25只。除正常对照组外,其余4组建立化疗性卵巢早衰动物模型,建模方案为在给予环磷酰胺首次负荷剂量50mg/kg腹腔注射后,以8mg/(kg·d)的剂量连续腹腔注射14d[7]。在建模结束后第1天,BMSCs组双侧卵巢各注射含有1×l06个BMSCs的20μl细胞悬液,热休克BMSCs组双侧卵巢各注射含有1×l06个热休克预处理BMSCs的20μl细胞悬液,假手术组则双侧卵巢各注射20μl生理盐水。移植时以2%戊巴比妥钠0.025ml/10g剂量进行腹腔注射麻醉大鼠,无菌条件下开腹直接注射移植至双侧卵巢。
1.7 观察指标 移植后第1、15、30、45、60天所有大鼠在发情间期采血留取血清,且各组各时间点分批处死大鼠5只,留取卵巢标本。
1.7.1 大鼠阴道涂片观察动情周期变化 每天早上8:00进行阴道涂片,自然风干后滴加适量亚甲蓝染液,经1~2min后用水漂洗,自然干燥后置于显微镜下观察。
1.7.2 血清E2、FSH检测 用化学发光法检测血清E2、FSH水平,按试剂盒说明书操作。
1.7.3 卵泡计数 卵巢组织常规进行石蜡包埋,切片(5μm),取每第12张石蜡切片进行HE染色计算卵泡数。卵泡分类根据以下标准进行:①始基卵泡,含有单层梭形颗粒细胞;②初级卵泡,单层颗粒细胞中至少有3个立方形颗粒细胞;③次级卵泡,至少有两层颗粒细胞而没有卵泡腔;④窦卵泡,至少含有两层颗粒细胞并且有卵泡腔[8]。
1.7.4 颗粒细胞凋亡检测 用TUNEL法检测卵巢颗粒细胞凋亡情况,按试剂盒说明书操作。显微镜下计数染色的凋亡颗粒细胞个数,至少在8个不同部位计数100个颗粒细胞,计算凋亡颗粒细胞所占比例。
1.8 统计学处理 采用SPSS 20.0软件进行分析。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05为差异有统计学意义;行×列表计数资料以率表示,多组间比较采用χ2检验或Fisher确切概率法,进一步两两比较采用χ2分割检验,校对后的检验水平α=0.0045。
2 结 果
2.1 大鼠动情周期的变化 大鼠正常的动情周期为4~5d,分为动情前期、动情期、动情后期和动情间期(图1)。实验中,正常对照组大鼠动情周期无改变;模型组和假手术组大鼠在实验中动情周期持续紊乱。细胞移植后16~30d,热休克BMSCs组与BMSCs组大鼠开始恢复正常动情周期;热休克BMSCs组恢复正常动情周期的大鼠只数虽多于BMSCs组,但差异无统计学意义(P1-15d=1.0,P16-30d=0.358,P31-45d=0.325,P46-60d=0.5,表1)。

表1 各组各时间点具有正常动情周期的大鼠只数Tab.1 The number of rats having normal estrus cycle in each group at different time points

图1 大鼠的动情周期 (亚甲蓝染色 ×200)Fig.1 Estrus cycle of rat (methylene blue staining ×200)A. Proestrus; B. Oestrus; C. Postestrus; D. Anestrus
2.2 各组大鼠E2、FSH水平变化 各组大鼠基础E2、FSH水平无明显差异(FE2=0.671,PE2=0.614;FFSH=1.773,PFSH=0.139)。细胞移植后第1天,与正常对照组比较,其余4组E2水平明显降低,而FSH则明显升高,差异有统计学意义(FE2=9.419,PE2=0.000;FFSH=64.122,PFSH=0.000)。但模型组、假手术组、BMSCs组、热休克BMSCs组间比较,E2、FSH水平差异无统计学意义。此后,模型组和假手术组E2水平持续下降,FSH水平持续上升。细胞移植后15d,热休克BMSCs组与BMSCs组大鼠的E2水平开始明显高于模型组与假手术组(P<0.05),但两组间比较差异无统计学意义。细胞移植后15d,热休克BMSCs组及BMSCs组大鼠FSH明显低于模型组及假手术组(P<0.05),但随后BMSC组FSH水平转而呈缓慢上升趋势。移植第30、45、60天,热休克MSC组E2水平明显高于BMSC组(P<0.05),但仍低于正常对照组(P<0.05);而FSH水平则明显低于BMSC组(P<0.05),却高于正常对照组(P<0.05,图2)。
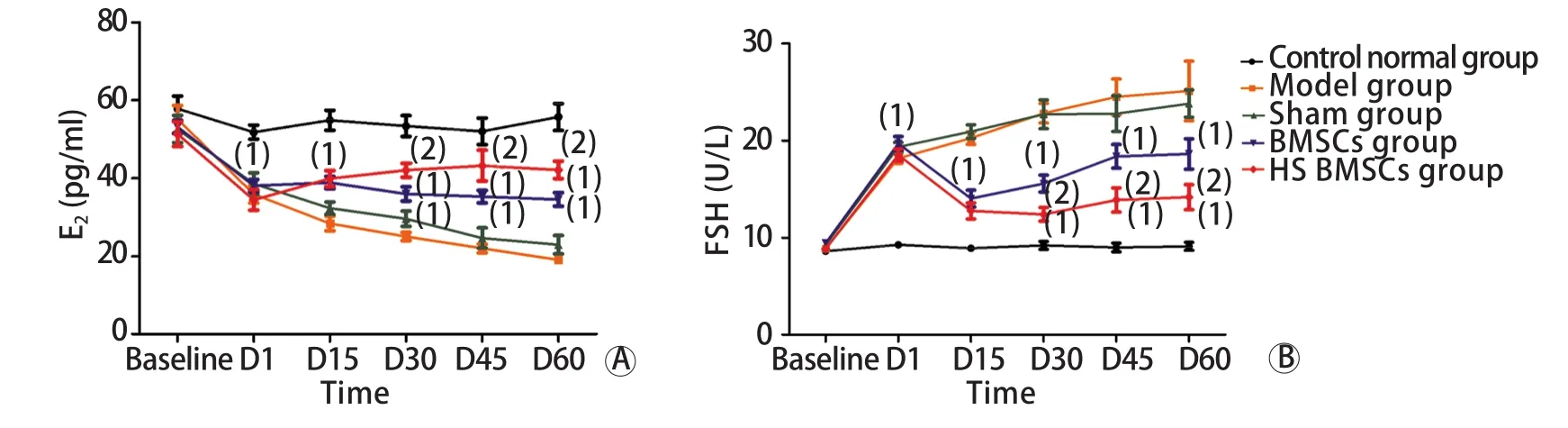
图2 各组大鼠E2 (A)及FSH(B)的变化曲线Fig.2 The curve of E2 (A) and FSH (B) in each group of rats
2.3 各组大鼠卵巢各级卵泡计数情况 细胞移植后第1天及第15天,模型组、假手术组、BMSCs组、热休克BMSCs组各级卵泡数均明显少于正常对照组(FD1,始基卵泡=3.491,PD1,始基卵泡=0.026;FD1,初级卵泡=4.367,PD1,初级卵泡=0.011;FD1,次级卵泡=3.065,PD1,次级卵泡=0.040;FD1,窦卵泡=4.039,PD1,窦卵泡=0.015;FD15,始基卵泡=9.147,PD15,始基卵泡=0.000;FD15,初级卵泡=13.088,PD15,初级卵泡=0.000;FD15,次级卵泡=6.657,PD15,次级卵泡=0.001;FD15,窦卵泡=13.423,PD15,窦卵泡=0.000),但模型组、假手术组、BMSCs组、热休克BMSCs组间比较差异无统计学意义(P>0.05)。细胞移植第30天,BMSCs组和热休克BMSCs组大鼠各级卵泡数较前无明显减少,而模型组及假手术组各级卵泡数仍继续减少,但4组间各级卵泡数差异无统计学意义(P>0.05)。细胞移植第45天及第60天,BMSCs组和热休克BMSCs组大鼠各级卵泡数均明显高于模型组及假手术组(P<0.05),且热休克BMSCs组大鼠各级卵泡数均高于BMSCs组,差异有统计学意义(P<0.05),但仍明显低于正常对照组(P<0.05,图3)。2.4 各组大鼠卵巢颗粒细胞凋亡情况 细胞移植后第1天,模型组、假手术组、BMSCs组、热休克BMSCs组的卵巢颗粒细胞凋亡指数均明显高于正常对照组,差异有统计学意义(F=43.574,P=0.000),但模型组、假手术组、BMSCs组、热休克BMSCs组间比较差异无统计学意义(P>0.05)。细胞移植第15、30、45、60天,BMSCs组和热休克BMSCs组大鼠卵巢颗粒细胞凋亡指数均较细胞移植后第1天明显降低,且明显低于模型组及假手术组(P<0.05);而热休克BMSCs组颗粒细胞凋亡指数低于BMSCs组(P<0.05),但仍高于正常对照组(P<0.05,图4)。

图3 各组大鼠不同时间点的各级卵泡数Fig.3 The amount of primordial follicles (A), primary follicles (B), secondary follicles (C) and antral follicles (D) in each group of rats at different time points
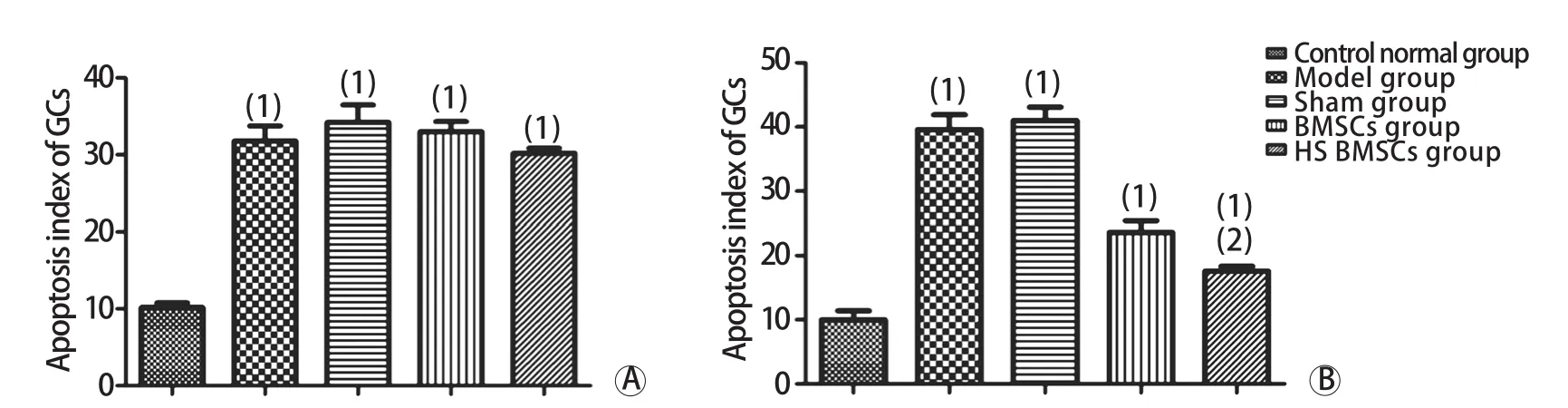
图4 细胞移植后第1(A)、60天(B)各组大鼠卵巢颗粒细胞凋亡指数Fig.4 Apoptotic index of ovarian granulosa cells in each group of rats at the first day (A) and sixty days (B) after cell transplantation
3 讨 论
自化疗药物应用于临床治疗以来,在为肿瘤及免疫性疾病患者带来希望的同时,也给其中的女性患者带来了严重的远期危害。化疗性卵巢早衰患者的低雌激素症状严重影响了其生活质量,而卵巢早衰带来的不孕问题更是对年轻女性及其家庭造成了严重影响[9]。目前化疗性卵巢早衰的治疗方法包括激素补充治疗[10]、卵巢冷冻移植[11]、卵子捐赠体外受精-胚胎移植等,但这些方法均有其局限性:激素补充治疗能缓解患者的围绝经期症状,但并不能从根本上进行治疗;卵巢冷冻移植技术目前尚未成熟,仍有待进一步研究;卵子捐赠则存在伦理学问题。
目前已有多个研究显示干细胞移植可改善化疗药物所致的卵巢功能受损[4,12],但移植后细胞存活率低,严重影响了其治疗效果。研究显示,干细胞移植后的存活率仅10%~20%,而其凋亡、坏死多发生于移植后的4d内[13]。因此,如何提高移植干细胞的存活力并保持其生物学活性成为目前亟须解决的问题,是当今干细胞研究领域的热点。
1962 年Ritossa[14]最早发现热休克反应的存在,他观察到在环境温度升高时果蝇染色体发生蓬松现象,并具有转录活性。随后1974年Tissieres等[15]证实Ritossa当时所猜测的这种物质是一组特殊蛋白质,并把这组蛋白质命名为HSP。进一步体外实验研究发现热休克处理可提高移植细胞的抗凋亡能力,Feng等[16]证实热休克处理的BMSCs移植后存活率明显提高,从而能更有效地改善心脏功能及减少小鼠缺血心肌的纤维化。因此,热休克可作为细胞移植前一种较为理想的预处理方法。
本实验对BMSCs进行热休克预处理,用于治疗大鼠化疗性卵巢早衰。阴道涂片结果显示,热休克BMSCs组在细胞移植后16~30d即有大鼠恢复正常动情期,但大鼠动情周期恢复率与BMSCs组相比差异无统计学意义。血清E2及FSH检测结果显示细胞移植30d后,热休克BMSCs组大鼠E2水平逐渐升高,且与BMSCs组相比升高更为明显,而FSH则明显下降。卵泡计数结果显示细胞移植第45天后,热休克BMSCs组大鼠各级卵泡数均多于BMSCs组。上述结果表明,BMSCs经热休克预处理后能更好地改善化疗所致的受损卵巢的内分泌功能,并具有更强大的减少卵泡闭锁、修复损伤卵巢结构的效果。同时,本实验发现,热休克BMSCs组与BMSCs组相比卵巢颗粒细胞凋亡减少更明显,这提示热休克预处理BMSCs通过减少卵巢颗粒细胞的凋亡从而发挥修复损伤卵巢的作用。
HSP作为分子伴侣在应激状态下具有重要作用,能在应激状态下帮助蛋白质正确折叠,加快正常蛋白质合成的恢复[17]。研究表明,BMSCs经过一定程度的热休克处理能在一定时间内持续高表达HSP,如HSP27、70、90等[5,16,18]。这提示热休克处理的细胞可通过高表达HSP而提高抗凋亡能力。且HSP能在细胞受到短暂刺激后长时间持续表达,帮助细胞度过移植后的凋亡高峰,从而增加移植细胞的存活率,提高细胞移植的治疗效果。此外,干细胞能够通过外泌体分泌具有生物活性的细胞因子或蛋白质,从而改变宿主细胞的生物学特性[19]。而有研究证实,干细胞经热休克预处理后能旁分泌富含热休克转录因子1的囊泡,从而重塑宿主细胞的相关染色体[16]。这也是经热休克处理的干细胞能更好地修复受损组织的可能机制之一。
综上所述,本研究表明BMSCs经热休克处理后能减少卵巢颗粒细胞的凋亡,减轻卵泡闭锁,增加各级卵泡数量,改善激素水平,对化疗药物诱导的卵巢结构及功能损伤具有更显著的修复作用,为今后临床应用BMSCs移植治疗卵巢早衰提供了一种有效的移植前处理方法。但热休克处理对细胞的保护作用机制可能是多方面的,仍有待进一步深入研究。
[1]Blumenfeld Z. Chemotherapy and fertility[J]. Best Pract Res Clin Obstet Gynaecol, 2012, 26(3): 379-390.
[2]Li XR, He YL, Wang XF, et al. Therapeutic effect of lentivirusmediated miR-21 on chemotherapy-induced premature ovarian failure in rats[J]. Med J Chin PLA, 2017, 42(9): 759-763. [李欣然, 何援利, 王雪峰, 等. 慢病毒介导的miR-21对化疗所致大鼠卵巢早衰的治疗作用[J]. 解放军医学杂志, 2017, 42(9):759-763.]
[3]Mathiasen AB, Qayyum AA, Jorgensen E, et al. Bone marrowderived mesenchymal stromal cell treatment in patients with severe ischaemic heart failure: a randomized placebo-controlled trial (MSC-HF trial)[J]. Eur Heart J, 2015, 36(27): 1744-1753.
[4]Fu X, He Y, Xie C, et al. Bone marrow mesenchymal stem cell transplantation improves ovarian function and structure in rats with chemotherapy-induced ovarian damage[J]. Cytotherapy,2008, 10(4): 353-363.
[5]Moloney TC, Hoban DB, Barry FP, et al. Kinetics of thermally induced heat shock protein 27 and 70 expression by bone marrow-derived mesenchymal stem cells[J]. Protein Sci, 2012,21(6): 904-909.
[6]Geng Y, Peng N, Tong HS, et al. Protective effects of heat shock protein 70 on the acute lung injury of rats with heat stroke and its mechanism[J]. Med J Chin PLA, 2017, 42(4): 295-300. [耿焱, 彭娜, 童华生, 等. 热休克蛋白70对中暑大鼠急性肺损伤的保护作用及机制研究[J]. 解放军医学杂志, 2017, 42(4):295-300.]
[7]Fu X, He Y, Wang X, et al. Overexpression of miR-21 in stem cells improves ovarian structure and function in rats with chemotherapy-induced ovarian damage by targeting PDCD4 and PTEN to inhibit granulosa cell apoptosis[J]. Stem Cell Res Ther, 2017, 8(1): 187.
[8]Devine PJ, Sipes IG, Hoyer PB. Initiation of delayed ovotoxicity by in vitro and in vivo exposures of rat ovaries to 4-vinylcyclohexene diepoxide[J]. Reprod Toxicol, 2004, 19(1):71-77.
[9]Turan V, Oktay K. Sexual and fertility adverse effects associated with chemotherapy treatment in women[J]. Expert Opin Drug Saf, 2014, 13(6): 775-783.
[10]Gelbaya T, Vitthala S, Nardo L, et al. Optimizing hormone therapy for future reproductive performance in women with premature ovarian failure[J]. Gynecol Endocrinol, 2011, 27(1):1-7.
[11]Donnez J, Dolmans MM. Fertility preservation in women[J].Nat Rev Endocrinol, 2013, 9(12): 735-749.
[12]Kilic S, Pinarli F, Ozogul C, et al. Protection from cyclophosphamide-induced ovarian damage with bone marrowderived mesenchymal stem cells during puberty[J]. Gynecol Endocrinol, 2014, 30(2): 135-140.
[13]Zhang M, Methot D, Poppa V, et al. Cardiomyocyte grafting for cardiac repair: graft cell death and anti-death strategies[J]. J Mol Cell Cardiol, 2001, 33(5): 907-921.
[14]Ritossa F. A new puffing pattern induced by temperature shock and DNP in drosophila[J]. Experientia, 1962, 18(12): 571-573.
[15]Tissieres A, Mitchell HK, Tracy UM. Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs[J]. J Mol Biol, 1974, 84(3): 389-398.
[16]Feng Y, Huang W, Meng W, et al. Heat shock improves Sca-1+stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway[J]. Stem Cells, 2014, 32(2):462-472.
[17]Morrow G, Hightower LE, Tanguay RM. Small heat shock proteins: big folding machines[J]. Cell Stress Chaperones, 2015,20(2): 207-212.
[18]Qiao PF, Yao L, Zhang XC, et al. Heat shock pretreatment improves stem cell repair following ischemia-reperfusion injury via autophagy[J]. World J Gastroenterol, 2015, 21(45): 12822-12834.
[19]Bruno S, Camussi G. Role of mesenchymal stem cell-derived microvesicles in tissue repair[J]. Pediatr Nephrol, 2013, 28(12):2249-2254.
