扭转原肠胚形成同系物1基因过表达对人胃腺癌细胞株BGC-823增殖的影响
2018-06-01袁静怡曾嘉丽帅春刘玥
袁静怡,曾嘉丽,帅春,刘玥,3
(1南方医科大学基础医学院,广州 510515;2 广东省妇幼保健院;3广东省生物芯片重点实验室)
胃癌是来源于胃黏膜上皮的恶性肿瘤,发病率居于恶性肿瘤第五位[1],病死率居于癌症病死率第二位[2,3]。我国胃癌发病率居高不下[4]。目前临床尚无有效的胃癌治疗方法。扭转原肠胚形成同系物1(TWSG1,在非哺乳类脊椎动物中称为Tsg)是一种高度保守的分泌蛋白,最早发现于果蝇属中[5],其表达产物是分泌型的BMP绑定糖蛋白,参与多种疾病的调控[6]。研究[7]发现,TWSG1基因在胆管癌和肝癌组织细胞中的表达量比正常细胞明显升高。在人恶性间皮瘤中,TWSG1基因启动子区域CpG岛的异常甲基化可能促进肿瘤细胞生存能力,或当暴露于分化不利的条件时,将会导致肿瘤异质性[8]。Alexandra 等[9]研究发现,在结直肠癌中TWSG1可能是一个典型的癌症抑制基因。因此,可推测TWSG1在不同肿瘤的发生、发育、转移过程中的作用机制存在差异。而有关于TWSG1基因在胃腺癌发生、发展中的作用机制相关报道较少。2016年1月~2017年6月,我们构建TWSG1基因真核表达质粒,并用其转染人胃腺癌细胞株BGC-823,观察其对BGC-823细胞增殖的影响。现将结果报告如下。
1 材料与方法
1.1 细胞、试剂与仪器 感受态大肠杆菌DH5α为本实验室制备,人胃腺癌BGC-823细胞和pTSB-CMV-MCS-SBP-3Flag-EGFP-F2A-PuroR质粒为南方医院中心实验室保存。BGC-823于RPMI-1640完全培养基中培养(内含10%灭活小牛血清+1%双抗(100 units/mL 青霉素和100 μg/mL链霉素)。细胞置于37 ℃,5% CO2的培养箱中培养,并进行常规更换培养液与传代操作。质粒小提试剂盒(天根生化科技有限公司)、限制性内切酶、DNA Ladder、核酸胶回收试剂盒,以及T4DNA连接酶和Taq聚合酶(Takara公司),转染试剂脂质体LipofectamineTM2000(Invitrogen公司),Trizol(Invitrogen公司)、逆转录试剂盒(Invitrogen公司),SYBR Premix Ex Taq TMⅡKit(Takara公司),RIPA细胞裂解液、BCA蛋白浓度测定试剂盒(北京康为世纪生物科技有限公司),PVDF膜(millipore公司),TWSG1兔抗人多克隆抗体(Abcam公司),HRP标记的羊抗兔IgG(北京天德悦公司),ECL发光液(美国Thermo Scientific Pierce公司),CCK8(日本DOJINDO)。细胞培养皿(Corning公司)、六孔板(Corning公司)、EP管(Corning公司)和八联管(Corning公司)。测序由上海生工公司完成,克隆引物和RT-qPCR引物由上海生工公司合成。离心机(Beckman公司); Infinite M200酶标仪(Tecan公司);NanoDrop2000超微量分光光度计(Thermo公司);小型水平电泳仪(Bio-Rad公司);EclipseTi-s荧光倒置显微镜(Nikon公司);7500Real-TimePCR仪(AppliedBiosystems公司)。
1.2 TWSG1基因真核表达质粒的构建 扩增TWSG1基因,上下游引物分别为5′- GAATTCATGAAGTTACACTATGTTGCTGTG-3′;5′- GGATCCTTAAAACATGCAGTTCATACATTTG-3′,反应条件为95 ℃、5 min,95 ℃、15 s,60 ℃、15 s,72 ℃、30 s,共40个循环。扩增产物和pTSB-CMV-MCS-SBP-3Flag-EGFP-F2A-PuroR质粒同时采用EcoR Ⅰ和BamH Ⅰ双酶切后进行连接,转化感受态大肠杆菌DH5a,挑取阳性菌落。菌落扩大培养后按照天根质粒小提试剂盒步骤进行质粒的抽提,用NanoDrop2000超微量分光光度计测定质粒DNA浓度及纯度,用EcoR Ⅰ和BamH I进行双酶切鉴定,根据DNA Ladder鉴定目的基因克隆的正确性,并将酶切鉴定为阳性克隆质粒进行测序鉴定。
1.3 BGC-823细胞分组及TWSG1真核表达质粒转染 取对数生长期细胞接种于6孔板中,将细胞分为观察组和对照组,待细胞汇合率达70%~80%时观察组和对照组分别转染TWSG1真核表达质粒、空白质粒载体,所有操作均按照LipofectamineTM2000脂质体说明书进行。然后加入1 μg/mL嘌呤霉素筛选至出现单克隆,取多个单克隆分别加入0.5 μg/mL嘌呤霉素继续培养,筛选稳定表达TWSG1的细胞株。经鉴定后观察组重组表达质粒测序鉴定结果测序结果与NCBI收录的人TWSG1基因序列完全相同。
采用Real-Time PCR法检测两组细胞TWSG1基因。采用TRIzol提取总RNA,扩增TWSG1基因,上下游引物分别为5′-GGTCATATGAGAAGCAGGTG-3′;5′-GTGTGCTAACAGTAGCACATG-3′,以GAPDH为内参,上下游引物分别为5′-CAAGAAGGTGGTGAAGCAGGC-3′;5′-CATACCAGGAAATGAGCTTGAC-3′,反应条件为95 ℃预变性30 s;95 ℃10 s,60 ℃ 30 s,72 ℃30 s,40个循环。TWSG1相对表达量以2-ΔΔCt表示,ΔΔCt=[(样本Ct目的基因-样本Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因)]。 采用Western blotting法检测TWSG1蛋白。收集各组细胞,加入RIPA细胞裂解液提取蛋白,采用BCA法测定蛋白浓度,进行SDS-PAGE电泳,转PVDF膜,封闭后加入一抗(1∶1 000稀释)4 ℃孵育过夜,二抗(1∶6 000稀释)室温孵育1 h,ECL化学发光。用图像分析系统分析,以相应目的蛋白条带的积分光密度值表示TWSG1蛋白的表达情况。实验重复3次,取平均值。
1.4 两组细胞增殖情况观察 采用CCK-8法。取转染48 h各组细胞,接种于96孔板内,每组设9孔,每孔约1×103个细胞,连续培养3天。分别于24、48、72 h取出3孔细胞,每孔加入10 μL CCK-8试剂,37 ℃、5% CO2的培养箱孵育4 h后,酶标仪在450 nm波长处测定并记录各组光密度值(OD值)。

2 结果
两组细胞TWSG1基因及蛋白相对表达量比较见表1。
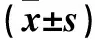
表1 两组细胞TWSG1基因及蛋白相对表达量比较
注:与空白组比较,*P<0.05;与对照组比较,#P<0.05。
培养24、48、72 h时两组细胞OD值比较见表2,两组细胞生长曲线见图2。与对照组比较,培养24、48、72 h时观察组细胞OD值均降低(P均<0.05)。
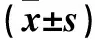
表2 培养24、48、72 h时两组细胞OD值比较
注:与空白组、对照组比较,*P<0.05;与本组前一培养时间比较,#P<0.05。
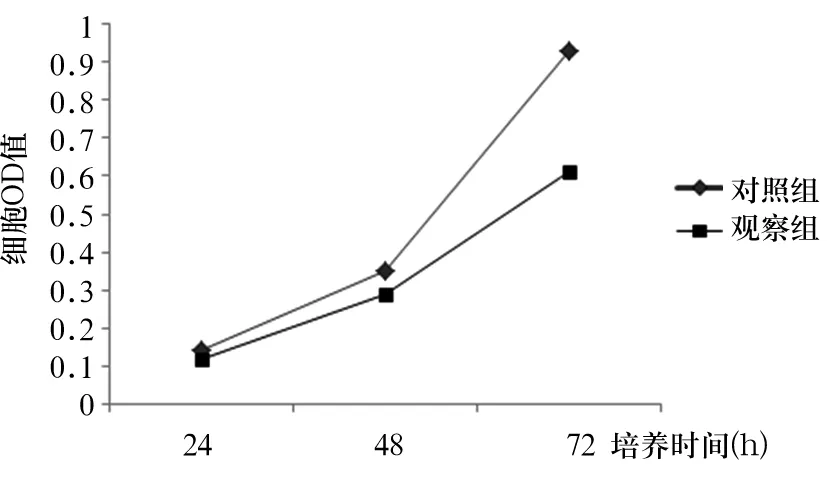
图2 两组细胞生长曲线
3 讨论
TWSG1基因编码保守性的疏水蛋白,在非洲爪蟾蜍中,Tsg通过其与腱蛋白相似的富含半胱氨酸残基的结构域直接与BMPs结合[10]。目前关于TWSG1的大部分研究是探讨其通过BMP信号调节铁调素的表达,有研究认为TWSG1能下调铁调素的表达[11,12],其机制可能与BMP信号转导有关。Forsman 等[13]发现TWSG1可通过激活BMP信号通路,促进乳腺导管分支、簇状结构形成等发育过程,而Yamada 等[14]发现在肾小球硬化症中 TWSG1是BMP主要的负调节因子。目前关于TWSG1的大部分研究是探讨其通过BMP信号调节铁调素的表达,TWSG1能下调铁调素的表达[15,16],其机制可能与BMP信号转导有关[17],Tanno 等[18]发现TWSG1在β-球蛋白生成障碍性贫血老鼠中表达显著上调。同时,国内有研究[19]发现TWSG1在慢性高原病大鼠的肝组织中表达上调。此外,TWSG1参与许多生长发育进程,Tanno 等[20]发现其可调控早期胚胎发育, Heinke 等[21]认为其参与血管细胞的动态平衡调节。
从目前的研究状况来看,TWSG1对不同的肿瘤细胞的调控具有双向性,有研究发现在结直肠癌中TWSG1可能是一个典型的癌症抑制基因[9],其在许多结直肠癌组织中检测到存在缺失。此外,Forsman 等[22]发现在小鼠乳腺发育的重要时间点均有TWSG1的表达,其对乳腺癌的发生起到重要作用。而Xia 等[23]发现TWSG1在转移型乳头状甲状腺癌中的表达高于非转移型乳头状甲状腺癌,敲低TWSG1的表达能够抑制转移型乳头状甲状腺癌细胞的增殖、迁移和侵袭,由此推断其可能是乳头状甲状腺癌的新型诊断以及治疗靶点。他们还发现当TWSG1在K1细胞表达下调时,Id1和p-Smad1/5的mRNA和蛋白表达水平显著下降。而当TWSG1在TPC1细胞中过表达时Id1和p-Smad1/5的表达也增强。他们推论TWSG1可以激活乳头状甲状腺瘤细胞中的BMP信号通路。Johnston 等[7]通过对含有肝癌和胆管细胞癌的组织芯片进行免疫组化分析,发现免疫组化和WB的结果均显示胆管细胞癌的TWSG1表达量高于肝癌,且高表达于上皮细胞区域,而通过免疫组化技术发现BMP4也高表达于胆管细胞癌,此差异有统计学意义。于此同时,他们检测到TWSG1高表达于人胆管细胞癌细胞系(OZ;Huh-28;HuCCT-1)和人肝癌细胞系HepG2,但是在人肝正常上皮细胞THLE-3内不表达。而通过WB技术发现BMP4也高表达于人胆管细胞癌细胞系(OZ;Huh-28;HuCCT-1),在HepG2和THLE-3细胞中均有一定表达。因此他们推断肝癌和胆管细胞癌组织中TWSG1的高表达能够激活BMP4分子,进而激活BMP信号通路。
然而,关于TWSG1对胃癌的作用的研究报道就十分有限,有研究[24]发现NKX6.3是小鼠胃部幽门中G/D细胞系的一种选择性调控因子,其可直接结合TWSG1基因转录起始位点的启动子上游序列,从而提高TWSG1的mRNA和蛋白表达量。与此同时,NKX6.3并不会影响BMPR-II蛋白表达量。接着通过免疫共沉淀技术发现在AGS细胞和MKN1细胞中NKX6.3诱导TWSG1与BMP4分子结合,并抑制BMP4分子与BMPR-II分子的结合,而沉默NKX6.3或TWSG1基因能使BMP4分子重新与BMPR-II分子结合。当BMP4分子与BMPR-II分子的结合受到抑制时,能导致BMP-SMAD信号通路失活,最终抑制胃黏膜的肠化生,减少胃癌的发生率。
综上所述,TWSG1基因过表达可抑制BGC-823细胞的增殖。
参考文献:
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):359-386.
[2] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[3] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics,2002[J]. CA Cancer J Clin, 2005,55(2):74-108.
[4] Siegel R, Ma J, Zou Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[5] Graf D, Timmons PM, Hitchins M, et al. Evolutionary conservation, developmental expression, and genomic mapping of mammalian Twisted gastrulation[J]. Mammalian Genome, 2001,12(7):554-560.
[6] Oelgeschlager M, Larrain J, Geissert D, et al. The evolutionarily conserved BMP-binding protein Twisted gastrulation promotes BMP signalling[J]. Nature, 2000,405(6788):757-763.
[7] Johnston J, Al-Bahrani R, Abuetabh Y, et al. Twisted gastrulation expression in cholangiocellular and hepatocellular carcinoma[J]. J Clin Pathol,2012,65(10):945-948.
[8] Kim MC, Kim NY, Seo YR,etal. An Integrated Analysis of the Genome-Wide Profiles of DNA Methylation and mRNA Expression Defining the Side Population of a Human Malignant Mesothelioma Cell Line[J].J Cancer, 2016,7(12):1668-1679.
[9] Gylfe AE, Katainen R, Kondelin J,etal. Eleven candidate susceptibility genes for common familial colorectal cancer[J]. PLoS Genet, 2013,9(10):e1003876.
[10]Oelgeschlager M, Larrain J, Geissert D, et al. The evolutionarily conserved BMP-binding protein Twisted gastrulation promotes BMP signalling[J]. Nature, 2000,405(6788):757-763.
[11] Troilo H, Barrett A, Zuk A,et al. Structural characterization of twisted gastrulation provides insights into opposing functions on the BMP signalling pathway[J]. Matrix Biol, 2016,55(1):49-62.
[12] Huntley R, Davydova J, Petry A, et al. The Function of Twisted Gastrulation in Regulating Osteoclast Differentiation is Dependent on BMP Binding[J]. J Cell Biochem, 2015,116(10):2239-2246.
[13] Forsman CL, Ng BC, Heinze RK, et al. BMP-binding protein twisted gastrulation is required in mammary gland epithelium for normal ductal elongation and myoepithelial compartmentalization. Dev Biol, 2013, 373(1): 95-106.
[14] Yamada SJ, Nakamura M, Asada J, et al., Twisted gastrulation, a BMP antagonist, exacerbates podocyte injury[J]. PLoS One, 2014, 9(2): e89135.
[15] Finkenstedt A, Bianchi P,Theurl I, et al. Regulation of iron metabolism through GDF15 and hepcidin in pyruvate kinase deficiency[J]. Br J Haematol,2008,144(5):789-793.
[16] Tanno T, Bhanu NV, Oneal PA, et al. High levels of GDF15 in thalassemia suppress expression of the iron regulatory protein hepeidin[J]. Nat Med, 2007,13(9): 1096-1101.
[17] Tanno T, Miller JL. Iron loading and overloading due to ineffective erythropoiesis [J] . Adv Hematol , 2010 , 2010 :358283.
[18] Tanno T, Porayette P, Sripichai O, et al. Identification of TWSG1 as a second novel erythroid regulator of hepcidinexpression in murine and human cells[J]. Blood,2009,114(1):181-186.
[19] 刘玉洁,耿惠.慢性高原病大鼠肝组织中扭转原肠胚形成同系物1、铁调素表达观察[J]. 山东医药, 2017,57(15):31-34.
[20] Troilo H, Barrett AL, Wohl AP, et al. The role of chordin fragments generated by partial tolloid cleavage in regulating BMP activity[J]. Biochem Soc Trans, 2015,43(5):795-800.
[21] Heinke J, Juschkat M, Charlet A, et al. Antagonism and synergy between extracellular BMP modulators Tsg and BMPER balance blood vessel formation[J]. J Cell Sci, 2013,126(Pt 14):3082-3094.
[22] Forsman CL, Ng BC, Heinze RK,et al. BMP-binding protein twisted gastrulation is required in mammary gland epithelium for normal ductal elongation and myoepithelial compartmentalization[J]. Dev Biol, 2013,373(1):95-106.
[23]Xia S, Ji R, Xu Y, et al. Twisted Gastrulation BMP Signaling Modulator 1 Regulates Papillary Thyroid Cancer Cell Motility and Proliferation[J]. J Cancer, 2017,8(14):2816-2827.
[24] Yoon JH,Choi SS,Kim O,et al. Inactivation of NKX6.3 in the stomach leads to abnormal expression of CDX2 and SOX2 required for gastric-to-intestinal transdifferentiation[J]. Modern Pathology, 2016,29(2):194-208.
