纤维素酶解预处理辅助超声法制备竹浆纳米纤维素
2018-06-01汪雪琴卢麒麟林凤采张松华唐丽荣
汪雪琴,卢麒麟,林凤采,杨 旋,张松华,黄 彪,唐丽荣,2※
(1. 福建农林大学材料工程学院,福州 350002;2. 福建农林大学金山学院,福州 350002)
0 引 言
纳米纤维素是指至少有一维空间尺寸为纳米级别的纤维素材料[1-2],其不仅具有纤维素的基本结构和性能,还具有区别于天然纤维素的纳米颗粒的特性[3]。首先,与天然纤维素相比,它具有非常高的强度、杨氏模量和张应力[4]。其次,它表面较强的化学反应活性,使其可用于纤维素的化学改性[5-6];因其水悬浮液呈稳定的胶状液,因此可作为药物赋形剂;纳米纤维素胶能耐高温和低温,具有乳化和增稠的作用,还可作为食品添加剂[7-8]。另外,它具有巨大的比表面积,可利用尺寸效应引起的化学、物理性质方面的变化会明显改变材料的光、电、磁等性能,可在一定程度上优化纤维素的性能,使其在精细化工、材料等领域具有更广阔的应用前景[9]。
目前纳米纤维素的制备主要有化学法[10-11]、物理法和生物法。传统化学方法制备纳米纤维素是用酸水解[12-13],氢离子进入纤维素内部,使纤维素结构中的β-1,4-糖苷键断裂,其对设备的腐蚀性大,回收处理反应残留物困难,容易对环境造成污染;常规物理法制备纳米纤维素需要高速研磨设备或高压设备等特殊设备,能耗高,制备时间长,纤维素的降解程度难以控制。因此,在纳米纤维素的制备过程中,如何提高纤维素的化学反应活性是关键问题,在此基础上研发出新型的绿色、低能耗、高效的制备方法具有重要的意义[14-15]。陈文帅等[16]利用超声波植物细胞粉碎机的高强度超声波空化作用(超声功率1 200 W),制备得到了尺寸分布均匀的高长径比、网状缠结的杨木木粉纤维素纳米纤丝,表明高强度超声波处理可以实现纤维素纤丝化。Tang等[17]采用离子交换树脂作为催化剂协同超声波的作用,制备了稳定性较好的棒状纳米纤维素,Lu等[11]以巨菌草中提取的纤维素为原料,采用氯化铁作为纤维素水解的催化剂,结合超声波处理的方法制备了纳米纤维素,进一步说明超声波活化作用在纳米纤维素的制备过程中发挥较大的作用。除此之外,一系列有关协同超声空化作用制备纳米纤维素的研究已有报道[18-20]。
中国是竹子大国,竹子产量居世界首位。竹子具有很强的可再生性,通过研究竹浆提取纳米纤维素对于高效利用可再生农林副产物及保护环境具有重要意义。纤维素酶法水解是利用纤维素酶选择性酶解纤维素的无定形区以及不完美的结晶区,最终获得纳米纤维素[21]。酶解法为低能耗的绿色过程,不仅可以提高产品的质量及纯度,还可以减少化学品用量,环境污染少、反应比较专一、反应条件温和且获得的纳米纤维素性能好。目前研究中结合机械处理或酸水解制备纳米纤维素,存在产率低[22-23]、制备时间长[24]、耗能大以及环境污染大[25]等问题。针对以上问题,本研究将酶处理法与超声空化技术相结合,使纤维素在酶预处理过程中,纤维素分子链发生断裂,进一步在超声波空化作用下绿色、高效地解离出纳米尺度的纤维素纤维。
1 试验材料和方法
1.1 材 料
人纤浆(漂白硫酸盐竹浆),α-纤维素质量分数大于94%,购自福建南平纸股份有限公司;纤维素酶(多类纤维素酶复合体,包含外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶),购自山东省泰安市信得利生物科技有限公司;柠檬酸(分析纯)、柠檬酸钠(分析纯)购自国药集团化学试剂有限公司。
1.2 分析测试仪器及测试条件
采用美国FEI公司的NOVA Nano SEM 230型场发射扫描电子显微镜(FESEM)观测样品形貌,样品表面喷金处理;采用美国 TECNAI G2F20透射电子显微镜(TEM)观察样品的微观形貌;采用德国MARS Ⅲ 旋转流变仪对CNF的流变性能进行测试;采用荷兰飞利浦X'Pert Pro MPD型X射线粉末衍射仪(XRD)测试样品的晶体结构,测试参数为:以Cu-Kα为射线源,Ni片滤波,管电压 80 kV,扫描范围 2θ=5°~60°,扫描速度 0.1°/s;采用NICOLET 380型傅里叶变换红外光谱仪(FTIR)分析样品的表面官能团,1 mg样品和200 mg KBr均匀混合压片,测量范围 4 000~400 cm–1;采用德国耐驰NETZSCH STA 449C型同步热分析仪(TG)分析CNF的热稳定性,流速30 mL/min的N2气氛围下,测试温度范围 30~700 ℃,升温速率 10 ℃/min;采用 SZP-06型Zeta电位测定仪测量样品的表面电荷;采用昆山禾创超声仪器有限公司 KH-500DE型数控超声波清洗器对样品进行超声处理。
1.3 CNF的制备过程
将pH值为5.0的100 mL柠檬酸-柠檬酸钠缓冲液和一定量稀释的酶液加入装有4 g绝干浆料的烧杯中,在一定温度下搅拌反应,搅拌速率100 r/min,到达反应时间后将酶解液于100 ℃水浴锅中加热20 min,移入超声波反应器中,超声功率500 W,超声频率40 kHz处理0~6 h,将所得悬浮液高速离心,收集上清液测定还原糖(reducing sugar,RS)含量,继续离心洗涤直至上层出现胶体状溶液,收集该胶体溶液即为纳米纤维素溶液(cellulose nanofibrils,CNF),收集剩余纤维(remaining fiber,RF)干燥并称质量。
1.4 试验设计
根据预试验单因素试验:对酶用量(5%、6%、7%、8%、9%)、酶解温度(40、45、50、55、60 ℃)、酶解时间(8、9、10、11、12 h)、超声时间(3、4、5、6、7 h)等因素各选取5个试验参数以确定各因素的试验参数范围。
正交试验:采用 L9(33)正交表设计对酶用量(8%、9%、10%)、酶解时间(9、10、11 h)和酶解温度(45、50、55 ℃)3个影响CNF得率、还原糖量、剩余纤维的主要因素进行优化,从而确定最优的制备方案。
1.5 CNF得率的测定
纳米纤维素悬浮液静置均匀分散,测出其总体积,量取25 mL悬浮液于称量瓶中,真空冷冻干燥至恒质量,CNF的得率由式(1)计算。
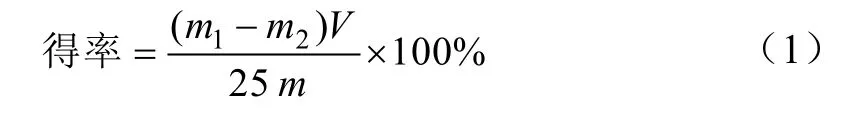
式中 m1为干燥后样品与称量瓶的总质量,g;m2为称量瓶的质量,g;m为竹浆纤维的质量,g;V为纳米纤维素悬浮液的总体积,mL。
1.6 CNF结晶度的测定
酶解法纳米纤维素的结晶度指数(crystallinity, CrI)通过 Segal法[26-28]估算,由公式(2)、(3)计算,通过测量002峰和无定形区的衍射强度。

式中I002表示2θ=22.5°即002晶面峰的强度,代表结晶区的衍射强度;而Iam表示2θ=18°时峰的强度,代表无定型区的衍射强度。
1.7 还原糖及剩余纤维素量的测定
水解液的还原糖含量用 3,5-二硝基水杨酸比色法[29]测定,通过公式(4)计算,剩余纤维素量以公式(5)计算。

式中m3表示查葡萄糖标准曲线得到的还原糖含量,mg;V1表示水解液的总体积,mL;n表示稀释倍数;m4表示原料的质量,g;m5表示离心后剩余纤维干质量,g。
2 试验结果与分析
2.1 单因素试验分析
2.1.1 酶用量的影响
在酶解温度50 ℃,酶解时间10 h,超声时间6 h的条件下,考察酶用量对纳米纤维素得率的影响(如图1所示)。
由图可知,随着酶用量的增大,纳米纤维素的得率先增大后减少,还原糖量持续增加。这可能是由于较低酶用量时,纤维素酶和纤维素的结合位点较少,因此酶解率较低。当酶用量小于 8%时,随着酶用量的增大,为纤维素酶与纤维素提供了更多的结合位点,促进无定形区的水解,更多的纤维素糖苷键断裂,CNF产率增大,达到最高值62.48%。但当酶用量进一步增大时,还原糖量呈现增长趋势,达到43.21%,而CNF得率开始降低,可能是由于所制得的纳米纤维素上的部分无定形区纤维素被水解成还原糖。因此,考虑到以上因素,8%酶用量较为合适。
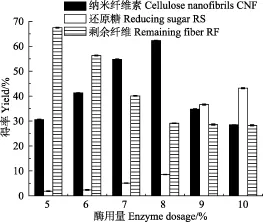
图1 酶用量对纳米纤维素得率的影响Fig.1 Effect of enzyme dosage on yield of CNF
2.1.2 酶解温度的影响
在酶用量为8%、酶解时间10 h、超声时间6 h的条件下,考察酶解温度对纳米纤维素得率的影响(如图 2所示)。

图2 酶解温度对纳米纤维素得率的影响Fig.2 Effect of enzymolysis temperature on yield of CNF
由图可知,随着反应温度的升高,纳米纤维素和还原糖量均呈现先升高后降低的趋势,当反应温度达到50 ℃时,纳米纤维素得率(62.60%)和还原糖量(8.63%)的均达到最大值。其主要原因可能是,当温度较低时,纤维素酶活性不高,反应程度不够,纳米纤维素和还原糖量均较低。随着反应温度的升高,纤维素酶的活性增大,竹浆纤维的水解程度提高,纳米纤维素得率增加,但温度过高会导致纤维素酶失活,当酶解温度升高至60 ℃时,纳米纤维素得率仅为33.74%,而还原糖量趋于零。由此可知随着温度的进一步升高,纳米纤维素和还原糖量均呈下降趋势。
2.1.3 酶解时间的影响
在酶解温度50 ℃,酶用量为8%,超声时间6 h的条件下,考察反应时间对纳米纤维素得率的影响如图 3所示。由图可知,随着反应时间的延长,还原糖量逐渐增加,而纳米纤维的得率呈现先增加后降低的趋势。在反应时间8~10 h内,随着反应时间的增加,纳米纤维素的得率逐渐增大;当酶解时间达到10 h时,纳米纤维素得率达到最高62.55%;在反应时间10~12 h内,随着反应时间的延长,纳米纤维素的得率呈下降趋势。这主要是由于在反应时间10 h内,纤维素较易水解的无定形区被降解,分离出纳米级纤维素纤丝,纳米纤维素得率增加;当反应时间高于 10 h,纤维素水解较完全,剩余纤维含量趋于稳定,说明纤维素酶开始进一步水解已生成的纳米纤维素,因此纳米纤维素得率逐渐降低。
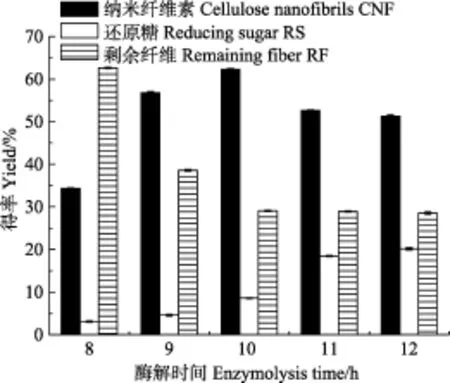
图3 酶解时间对纳米纤维素得率的影响Fig.3 Effect of enzymolysis time on yield of CNF
2.1.4 超声时间的影响
在酶解温度50 ℃,酶用量为8%,酶解时间10 h的条件下,考察超声时间对纳米纤维素得率的影响(如图4所示)。
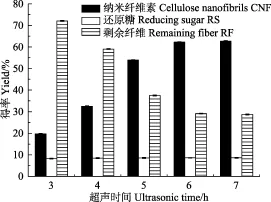
图4 超声时间对纳米纤维素得率的影响Fig.4 Effect of ultrasonic time on yield of CNF
由图可知,随着超声时间的增加,纳米纤维素的得率逐渐增大然后趋于平缓,而还原糖的含量几乎不发生改变。超声时间达到6 h时,纳米纤维素得率达到最高值62.38%。超声处理中,超声波高频振动在超声液体中传导,推动介质的作用在负压区产生大量的微小真空气泡,闭合于正压区,产生空化效应[30],无数气泡受压爆破产生的强大冲击力可将经过酶预处理后的纤维素打散剥离,导致纤维素被破碎形成纳米纤维素。足够长的超声时间可将附着在纤维素大分子表面及死角的CNF彻底剥离,继续延长超声时间CNF的得率不再增加。还原糖量在整个超声过程中处于恒定值,说明超声波处理并不会导致纤维素的过度降解,并且糖类小分子可以简单地通过离心分离出来。
2.2 正交试验结果与分析
根据单因素试验结果,采用正交法设计3因素3水平试验,以CNF得率、还原糖量、剩余纤维含量为指标,结果见表1。

表1 正交试验设计及其结果Table 1 Design and results of orthogonal experiment
试验获得CNF的最佳工艺条件为酶用量8%,酶解温度 50 ℃,酶解时间 10 h,纳米纤维素得率最高达到62.39%。由此可见,正交试验设计与单因素试验结果能够很好地相符。由试验结果的极差值可以发现,酶解温度对纳米纤维素得率影响最显著(R=23.433),其次是酶用量(R=10.767),酶解时间对纳米纤维素得率影响较小(R=10.333)。Tang等[17]采用强酸性阳离子交换树脂催化水解纤维素辅助超声波法,在离子交换树脂与微晶纤维素的质量比例为 10∶1,温度为 48 ℃,时间为 189 min制备得到纳米纤维素最大产率50.04%。Lu等[11]采用FeCl3催化水解竹浆纤维辅助超声波法,在反应温度 107 ℃,反应时间58 min,超声时间186 min制备纳米纤维素得率为22.10%。同样辅助超声波作用,纳米纤维素的酶法制备具有较高的产率。
2.3 形貌分析
图5为竹浆纤维和CNF的微观形貌。

图5 竹浆纤维和CNF的微观形貌图Fig.5 Microstructure of bamboo pulp fiber and CNF
图5a、5b为扫描电镜观察下的竹浆纤维的形貌,由图可知竹浆纤维呈卷曲扁平的棒状结构,表面较为粗糙,平均直径为15 μm左右,长度几百微米。图5c为制备的CNF的透射电镜图,由图可知,纳米纤维素呈束状聚集,这主要是由于纳米粒子间较强的氢键作用力,使其侧向附着力较强,发生侧向聚集,此特性使其在复合材料中能够提供较好的增强作用。由此可见,采用酶预处理结合超声空化作用可以制备 CNF,但有待进一步研究如何有效地控制其在溶剂中的分散性。
CNF的直径与长度尺寸分布如图6所示。

图6 CNF的直径与长度尺寸分布Fig.6 Distribution of diameter and length of CNF
由图6a可观察到,CNF直径为2~24 nm,其中约30%为3~6 nm;由图6b可知,CNF的长度主要为50~450 nm,其中约有44%长度小于150 nm。Tang等[17]采用强酸性阳离子交换树脂催化水解纤维素辅助超声波法,获得了直径约为10~40 nm,长度为100~400 nm的普通短杆状纳米纤维素。Lu等[11]采用FeCl3催化水解竹浆纤维辅助超声波法,获得长度为100~200 nm,宽度为10~20 nm的短棒状纳米纤维素。同样辅助超声波作用,3种方法制备得到的纳米纤维素具有相似的形貌结构。
2.4 XRD分析
图7所示为竹浆纤维及CNF的X射线衍射图。
由图可观察到竹浆纤维与CNF衍射峰的位置并无显著差异,均出现位于14.5°,18°及22.5°的3个强峰,对应于纤维素的 101,101¯,002晶面,因此认为纳米纤维素晶体属于纤维素Ⅰ型。与竹浆纤维(结晶度63.70%)相比,CNF的结晶度增大到73.05%。这是由于进行酶解反应时,纤维素酶可以轻易地进攻可及度和反应活性大的无定形区,使大部分无定形区参加反应而降解,使得CNF的结晶度大幅提高。Tang等[17]采用强酸性阳离子交换树脂催化水解纤维素辅助超声波法,获得的纳米纤维素结晶度由 72.25%提高到 84.26%。Lu等[11]采用 FeCl3催化水解竹浆纤维辅助超声波法,获得的纳米纤维素结晶度指数从69.5%提高到79.4%。同样辅助超声波作用,3种方法制备得到的纳米纤维素的结晶度得到了相当程度的提高,均保持纤维素I型晶体不变。

图7 竹浆纤维和CNF的XRD图Fig.7 XRD diffraction of bamboo pulp fiber and CNF
2.5 FTIR分析
图8所示为竹浆纤维与CNF的傅里叶变换红外光谱图。
由图可知CNF表现出与天然纤维素相似的吸收峰分布,存在纤维素固有的特征峰:吸收峰位置在 3 347、2 900、1 058、1 430 cm–1分别对应为纤维素固有的羟基、亚甲基(-CH2-)的 C-H对称、纤维素醇的 C-O、饱和C-H的伸缩振动吸收峰。并且发现在吸收峰 1 058 cm–1附近有很多较弱的肩峰,1 112和1 165 cm–1分别对应于纤维素分子内醚的C-O、C-C骨架峰。895 cm–1对应于特征性β-(1→4)-糖苷键的C-O-C伸缩振动。CNF与天然纤维素的谱图没有显著差异,说明CNF化学结构未发生变化,这对于CNF表现出的特殊性可以解释为源于纳米尺寸效应。
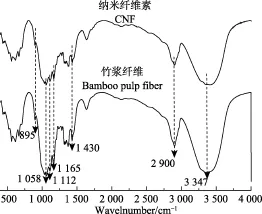
图8 竹浆纤维和CNF的红外光谱图Fig.8 FTIR spectrum of bamboo pulp fiber and CNF
2.6 流变分析
图9a、9b分别为不同浓度的CNF胶体的剪切率-剪切应力(γ-τ)和剪切率-粘度(γ-η)曲线。从图9a可知,γ-τ曲线为非线性关系,CNF胶体表现出非牛顿流体的性质。从图9b可明显观察到,在低剪切率下,CNF胶体的粘度相对较大,这是由于此时CNF胶粒间相互粘连,相互作用力大,导致体系粘度较大。随着剪切率的增大,胶体粘度的变化趋于平缓,这是由于机械力可以降低纤维素胶体间的粘连作用。随着剪切速率的提高,纳米纤维素胶体粘度随之减小,胶体呈现典型的剪切变稀行为,证明 CNF胶体属于假塑性流体[31]。胶体黏度随剪切应力增大变化平缓,说明CNF胶体具有较好的稳定性。
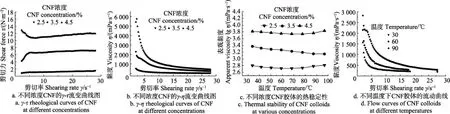
图9 CNF的γ-τ和γ-η流变曲线图,胶体的热稳定性图及胶体的流动曲线Fig.9 γ-τ and γ-η rheological curves,thermal stability and flow curves of CNF
由图9c、9d可知,不同浓度的CNF胶体的粘度随着温度升高逐渐降低,这是由于分子热运动随着温度的升高而加快,流动阻力随之降低,进而导致粘度下降。当温度升高到75 ℃时,由于胶粒间的部分液体受热蒸发,胶粒间碰撞几率变大促使流动阻力增大,导致表观粘度略有增大。此特性有利于纳米纤维素在聚合物基质中,增强复合材料的弹性模量和结构稳定性,减缓复合材料的破坏。
2.7 TGA分析
图10为竹浆纤维和CNF的热分析测试的TG和DTG谱图。竹浆纤维和CNF在温度25~120 ℃时出现的质量损失,为纤维素热分解的脱水过程,是样品表面从空气中吸附了少量的自由水受热挥发导致的。CNF的起始热分解温度(250 ℃)比竹浆纤维(303 ℃)来得低,最大失重速率温度(300 ℃)也比竹浆纤维(350 ℃)来得低。在温度 200~350 ℃之间,CNF的热稳定性低于竹浆纤维,这是由于酶解促使纤维素长链发生断裂,一些小分子纤维素链吸附于CNF表面,在较低温度下,会先降解这些小分子纤维素链。当温度高于350 ℃时,制备的CNF的热稳定性高于竹浆纤维,在 700 ℃时竹浆纤维残余率为3.4%,而CNF仍有15.3%。纤维素酶解反应在温和条件下进行,非晶区和有缺陷的晶体被剔除,而对完美的结晶区的损害较小[32-33],对形成分子排列规整度增强的晶体有积极作用。纤维素结晶区晶体的排列对热稳定性有一定影响[34],CNF在对耐热性要求较高的生物复合材料领域具有潜在应用价值[35-36]。

图10 竹浆纤维和CNF的TG及 DTG曲线Fig.10 TG and DTG curves of bamboo pulp fiber and CNF
3 放大试验设计及其结果分析
在单因素试验与正交试验的基础上,根据得到的CNF最佳工艺条件以放大100倍的规模模拟工业化生产。将干质量400 g的浆板碎片和pH值为5.0的10 L柠檬酸-柠檬酸钠缓冲液加入到打浆机(TD6-23型Valley式打浆机)中打浆处理0.5 h左右得到浆液,将浆液移入超级恒温水浴(HH-601型,金坛市易晨仪器制造有限公司)中加热,待浆液温度达到50 ℃后,加入8%(纤维素酶/竹浆纤维质量比)的纤维素酶开启循环按钮进行搅拌,每隔一小时取样一次,进行CNF的收集,样品分别标记为Rn(n代表酶解时间,h)。酶解至10 h时,将部分浆料移入超声波反应器中超声处理,每隔一小时取样一次,进行CNF的收集,样品分别标记Sn(n代表超声时间,h),其余浆液继续在水浴锅中反应,每隔一小时取样一次。取样液均为100 mL,分别进行CNF产率和还原糖量的测定。
3.1 CNF得率变化分析
如图11a、11b所示分别为放大试验中R6~R12、S1~S7的取样结果。如图 11 a可知,在纯酶解作用下,CNF得率随着酶解时间的延长,呈现先增加后降低的趋势,还原糖量持续增加,这与单因素试验所表现的趋势一致,CNF的得率均在酶解时间10 h时达到最大值,只是纯酶解作用的 CNF得率(15.8%)比协同超声作用的得率(61.92%)低很多。如图 11b所示,随着超声时间的延长,CNF的得率呈现先增加后趋于平缓的趋势,CNF得率在超声时间6 h时达到最大值(61.92%),与单因素试验所表现的趋势一致,CNF最大得率与单因素试验没有显著差异,试验出现的偏差是由于放大试验自身的局限性引起的。超声细胞粉碎机处理可以得到纳米纤维素,但是其单次处理量小,反应过程中仪器放热严重,无法实现放大试验。放大试验结果表明,酶处理后的竹浆纤维,内部组织结构松弛,分子间内聚力下降,有利于细纤维化的进行,可获得一定量的纤维素纳米产物,进一步超声波处理可以将CNF从纤维素大分子上彻底剥离,协同超声波处理可以有效提高CNF的得率。
3.2 超声1~7 h的样品的XRD分析
图12为放大试验样品Sn(n=1~7)的X射线衍射图。
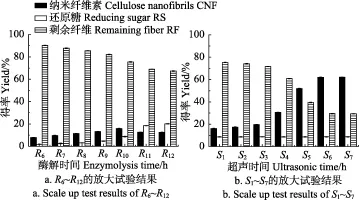
图11 R6~R12和S1~S7的放大试验结果Fig.11 Scale up test results of R6~R12 and S1~S7
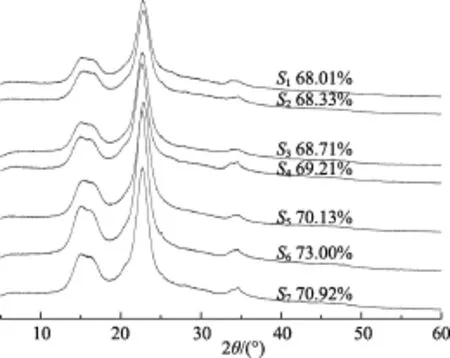
图12 不同超声处理时间样品的XRD图Fig.12 XRD diffractions of samples at different ultrasonic treatment time
由图可知样品 S6的结晶度(73%)与单因素试验(73.05%)结果相符。分析不同试样的结晶度可知,与竹浆纤维相比,超声处理4 h后的样品的结晶度由63.7%增加到69.21%,超声时间增加到6 h,样品的结晶度达到了73%,继续增加超声时间到7 h,样品的结晶度下降至70.92%,可能是因为随着超声时间的延长,机械作用力强度增大,部分结晶区的有序结构受到破坏,产生了更多的无序区域。
3.3 透光率分析
将样品 Sn(n=1~6)分别加水稀释至纤维素浓度为0.1%,充分摇匀,测试波长700 nm处的透光率,测试结果如图13所示。
由图可知,短时间(1~3 h)的超声处理,对产物的透光率影响较小,超声时间大于3 h时,透光率开始下降,透光率在超声时间为6 h时达到最低值。这可能是由于当超声时间6 h时,纳米纤维素的结晶度达到最大值,此时分子排列规整度最强,入射光线从聚合物表面反射出来导致透过光量损失,故而透光率下降[37]。
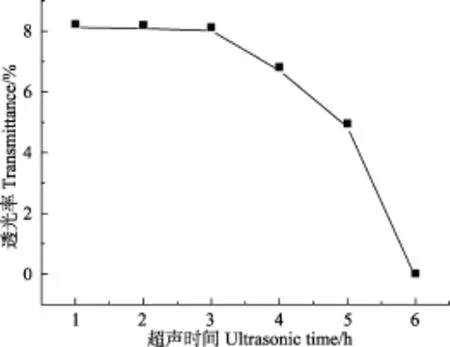
图13 不同超声处理时间样品的透光率变化曲线图Fig.13 Change curve of light transmittance at different ultrasonic treatment time
3.4 分散稳定性分析
为明显观察CNF在水中的分散稳定性,将测试玩透光率的样品静置一段时间,观察其沉降现象,浓度均为0.1%的不同超声处理时间的样品及其静置24 h后对比。观察发现,在静置24 h后,短时间超声处理的样品聚沉现象较为明显,超声5 h的样品发生轻微的聚沉,而超声6 h的样品比较稳定,几乎不发生沉降,可见超声处理6 h的样品在水中的分散性良好,该胶体较为稳定。
3.5 表面电荷测试
表 2显示了不同超声时间制备得到的纳米纤维素及竹浆纤维在水介质中的表面电荷值。纤维素分子中所带基团的存在直接影响了纤维素的所带电荷。由表2可知,纤维素在水介质中呈电负性,这可能是由于带负电基团羟基、糖醛酸的存在,与FTIR分析结果相符。Zeta电位值(绝对值)越高,表示越强的静电排斥作用,有利于物质更好地分散在水中,更不容易发生团聚沉降现象。S1~S6均表现出较竹浆纤维(Zeta电位值–8 mV)更强的电负性,且超声时间6 h的样品Zeta电位(绝对值)达到最大值(-32.6 mV),说明超声6 h的样品分散稳定性最强,这与分散性稳定性分析结果相符。随着超声时间的延长,纳米纤维素的Zeta电位(绝对值)呈增大趋势,这可能是由于超声空化作用促进了纳米纤维素的进一步分散,减少了纳米纤维素之间团聚的产生,使得其在水溶液中的分散性增强,Zeta电位值增大。
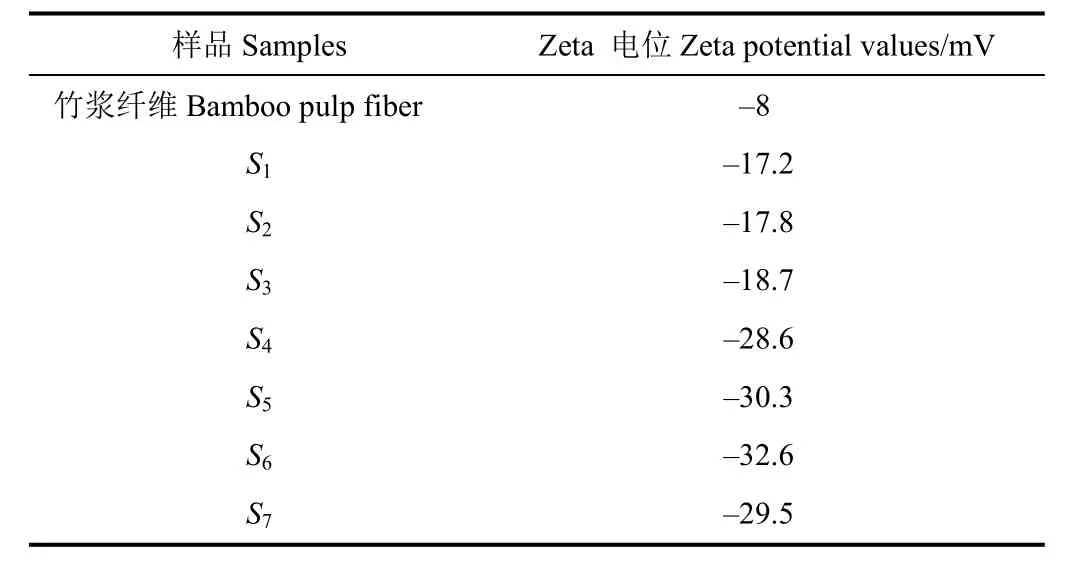
表2 纳米纤维素悬浮液的Zeta电位Table 2 Zeta potential values of aqueous suspensions of CNF
4 结 论
1)采用纤维素酶预处理辅助超声空化作用方法制备纳米纤维素,通过单因素试验分析各因素对纤维素纳米产率的影响,采用正交试验进行工艺优化,得到纳米纤维素的最佳制备条件为酶用量 8%、酶解温度 50 ℃、酶解时间10 h、超声时间6 h,纳米纤维素得率高达62.6%。显著性分析结果表明酶解温度对纳米纤维素得率影响最显著(R=23.433),酶解时间的影响较小(R=10.333)。
2)对 CNF进行表征分析可知,制备得到的纳米纤维素呈束状聚集,直径为2~24 nm,长度为50~450 nm;结晶度为73.05%,较竹浆纤维(结晶度为63.70%)有所提高,仍属于纤维素Ⅰ型;化学结构保留了纤维素的基本特征;Zeta电位值达到–32.6 mV,表现出较竹浆纤维(Zeta电位值–8 mV)更强的电负性;CNF胶体为剪切变稀的假塑性流体,胶体黏度随剪切应力增大变化平缓,说明CNF胶体具有较好的稳定性;CNF在热分解结束时仍有高达15.3%的残余率,较竹浆纤维(残余率为3.4%)大得多。
3)纤维素酶预处理辅助超声空化作用下,纤维素的酶解过程在温和条件下进行,对结晶区的破坏力度低,制备得到的纳米纤维素性能好。制备得到的纳米纤维素适于组装功能性稳定的纤维素基纳米材料,在食品、医用包装材料领域均具有潜在的应用价值。
[参 考 文 献]
[1] Klemm D, Kramer F, Moritz S, et al. Nanocelluloses: A new family of nature-based materials[J]. Angewandte Chemie,2011, 50 (24): 5438-5466.
[2] Gray D. Nanocellulose: From nature to high performance tailored material[J]. Holzforschung, 2013, 67(3): 353-353.
[3] Moon R J, Martini A, Nairn J, et al. Cellulose nanomaterials review: structure, properties and nanocomposites [J].Chemical Society Reviews, 2011, 40(42): 3941-3994.
[4] 郭娟丽,周玉生,刘珊,等. 纳米纤维素的制备方法及产业化情况[J]. 材料导报,2014,(增刊1):26-29.Guo Juanli, Zhou Yusheng, Liu Shan, et al. Preparation and industrialization of nanocrystalline cellulose[J]. Materials Review, 2014, (Supp.1): 26-29. (in Chinese with English abstract)
[5] Lin N, Bruzzese C, Dufresne A. Tempo-oxidized nanocellulose participating as crosslinking aid for alginate-based sponges[J].Acs Applied Materials & Interfaces, 2012, 4(9): 4948-4959.
[6] 林凤采,卢麒麟,林咏梅,等. 一步法制备乙酰化纳米纤维素及其性能表征[J]. 化工进展,2016,35(2):559-564.Lin Fengcai, Lu Qilin, Lin Yongmei, et al. Preparation and characterization of acetylated nanocellulose by one-step method[J]. Chemical Industry and Engineering Progress,2016, 35(2): 559-564. (in Chinese with English abstract)
[7] 刘颖,任学宏. 纳米纤维素微晶的制备、改性及其应用[J].材料导报,2015(11):133-137.Liu Ying, Ren Xuehong. Preparetion, modification and application of nano-crytalline cellulose[J]. Materials Review,2015(11): 133-137. (in Chinese with English abstract)
[8] 陈珊珊,陶宏江,王亚静,等. 葵花籽壳纳米纤维素/壳聚糖/大豆分离蛋白可食膜制备工艺优化[J]. 农业工程学报,2016,32(8):306-314.Chen Shanshan, Tao Hongjiang, Wang Yajing, et al. Process optimization of soy protein isolate-based edible films containing nanocrystalline cellulose from sunflower seed hull and chitosan[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016,32(8): 306-314. (in Chinese with English abstract)
[9] 黄彪,卢麒麟,唐丽荣. 纳米纤维素的制备及应用研究进展[J]. 林业工程学报,2016,1(5):1-9.Huang Biao, Lu Qilin, Tang Lirong. Research progress of nanocellulose manufacture and application[J]. Journal of Forestry Engineering, 2016, 1(5): 1-9. (in Chinese with English abstract)
[10] Lu Qilin, Cai Zheng, Lin Fengcai, et al. Extraction of cellulose nanocrystals with a high yield of 88% by simultaneous mechanochemical activation and phosphotungstic acid hydrolysis[J]. Acs Sustainable Chemistry & Engineering,2016, 4(4): 2165–2172.
[11] Lu Qilin, Tang Lirong, Lin Fengcai, et al. Preparation and characterization of cellulose nanocrystals via ultrasonicationassisted FeCl3– catalyzed hydrolysis[J]. Cellulose, 2014, 21(5):3497-3506.
[12] Jeong H D, Yoon C R, Lee J H, et al. Preparation and characterization of cellulose nano-whiskers extracted from microcrystalline cellulose by acid hydrolysis[J]. Toxicon,2010, 45(1): 125–126.
[13] Wulandari W T, Rochliadi A, Arcana I M. Nanocellulose prepared by acid hydrolysis of isolated cellulose from sugarcane bagasse[C]// 10th Joint Conference on Chemistry,2016, 107(1): 1—7.
[14] Mantia F P L, Morreal M. Green composites: A brief review[J]. Composites Part A Applied Science & Manufacturing,2011, 42(6): 579-588.
[15] Siqueira G, Bras J, Dufresne A. Cellulosic bionanocomposites:a review of preparation, properties and applications[J].Polymers, 2010, 2(4): 728-765.
[16] 陈文帅,于海鹏,刘一星,等. 木质纤维素纳米纤丝制备及形态特征分析[J]. 高分子学报,2010,1(11):1320-1326.Chen Wenshuai, Yu Haipeng, Liu Yixing, et al. A method for isolating cellulose nanofibrils from wood and their morphological characteristics[J]. Acta Polymerica Sinica,2010, 1(11): 1320-1326. (in Chinese with English abstract)
[17] Tang Lirong, Huang Biao, Ou Wen, et al. Manufacture of cellulose nanocrystals by cation exchange resin-catalyzed hydrolysis of cellulose[J]. Bioresource Technology, 2011,102(23): 10973-10977.
[18] Shahabi-Ghahafarrokhi I, Khodaiyan F, Mousavi M, et al.Preparation and characterization of nanocellulose from beer industrial residues using acid hydrolysis/ultrasound[J]. Fibers& Polymers, 2015, 16(3): 529-536.
[19] Loranger E, Jradi K, Daneault C. Nanocellulose production by ultrasound-assisted TEMPO oxidation of Kraft pulp on laboratory and pilot scales[C]//Ultrasonics Symposium. IEEE,2013: 953-956.
[20] Niu Fuge, Li Mengya, Huang Qi, et al. The characteristic and dispersion stability of nanocellulose produced by mixed acid hydrolysis and ultrasonic assistance[J]. Carbohydrate Polymers, 2017, 165: 197—204.
[21] Satyamurthy P, Vigneshwaran N. A novel process for synthesis of spherical nanocellulose by controlled hydrolysis of microcrystalline cellulose using anaerobic microbial consortium[J]. Enzyme & Microbial Technology, 2013, 52(1):20-25.
[22] Henriksson M, Henriksson G, Berglund L A, et al. An environmentally friendly method for enzyme-assisted preparation of microfibrillated cellulose (MFC) nanofibers[J].European Polymer Journal, 2007, 43(8): 3434-3441.
[23] 陈珊珊,陶宏江,王亚静,等. 葵花籽壳纳米纤维素制备工艺优化及其表征[J]. 农业工程学报,2015,31(15):302-308.Chen Shanshan, Tao Hongjiang, Wang Yajing, et al. Process optimization of nanocrystalline cellulose from sunflower seed hull and its characterization[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(15): 302-308. (in Chinese with English abstract)
[24] 卓治非,王戈,卢婷婷. 酶解竹子溶解浆制备纳米微晶纤维素的研究[J]. 造纸科学与技术,2014,33(3):6-8.Zhuo Zhifei, Wang Yi, Lu Tingting. Study on preparation of nano-crystalline cellulose from enzymolysis of bamboo dissolving pulp[J]. Paper Science & Technology, 2014, 33(3):6-8. (in Chinese with English abstract)
[25] An Xingye, Wen Yangbing, Cheng Dong, et al. Preparation of cellulose nano-crystals through a sequential process of cellulase pretreatment and acid hydrolysis[J]. Cellulose, 2016,23(4): 2409-2420.
[26] Segal L C, Creely J, Martin A E J, et al. An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J]. Textile Research Journal,1959, 29(10): 786-794.
[27] Deepa B, Abraham E, Cordeiro N, et al. Utilization of various lignocellulosic biomass for the production of nanocellulose: a comparative study[J]. Cellulose, 2015, 22(2):1075-1090.
[28] Agustin M B, Nakatsubo F, Yano H. The thermal stability of nanocellulose and its acetates with different degree of polymerization[J]. Cellulose, 2016, 23(1): 451-464.
[29] 齐香君,苟金霞,韩戌珺,等. 3,5-二硝基水杨酸比色法测定溶液中还原糖的研究[J]. 纤维素科学术,2004(3):17-19.Qi Xiangjun, Gou Jinxia, Han Xujun, et al. Study on measuring reducing sugar by DNS reagent [J]. Journal of Cellulose Science & Technology, 2004(3): 17-19. (in Chinese with English abstract)
[30] 李春喜,王子镐. 超声技术在纳米材料制备中的应用[J].化学通报,2001,64(5):268-267.Li Chunxi, Wang Zigao. Applications of ultrasound in preparing nanosized materials[J]. Chemistry, 2001, 64(5):268-267. (in Chinese with English abstract)
[31] 郭瑞,丁恩勇. 纳米微晶纤维素胶体的流变性研究[J]. 高分子材料科学与工程,2006,22(5):125-127.Guo Rui, Ding Enyong. Rheological characters research on nanocrystalline cellulose colloid[J]. Polymer Materials Science and Engineering, 2006, 22(5): 125-127. (in Chinese with English abstract)
[32] Years I R. An efficient method for cellulose nanofibrils length shearing via environmentally friendly mixed cellulase pretreatment[J]. Journal of Nanomaterials, 2017: 1-12.
[33] Igarashi K, Uchihashi T, Koivula A, et al. Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface[J]. Science, 2011, 333(6047): 1279-1282.
[34] Sandgren M, Gualfetti P J, Paech C, et al. The humicola grisea, Cel12A enzyme structure at 1.2 Å resolution and the impact of its free cysteine residues on thermal stability[J].Protein Science, 2003, 12(12): 2782–2793.
[35] Agustin M B, Nakatsubo F, Yano H. The thermal stability of nanocellulose and its acetates with different degree of polymerization[J]. Cellulose, 2016, 23(1): 451-464.
[36] Abraham E, Deepa B, Pothan L A, et al. Extraction of nanocellulose fibrils from lignocellulosic fibres: a novel approach[J]. Carbohydrate Polymers, 2011, 86(4): 1468-1475.
[37] 李婧,梅宇钊,罗志伟,等. 高结晶度透明微晶玻璃的制备[J]. 中国有色金属学报,2011,21(6):1450-1456.Li Jing, Mei Yuzhao, Luo Zhiwei, et al. Preparation of transparent glass-ceramics with high crystallinity[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(6): 1450-1456. (in Chinese with English abstract)
