热处理方式对苦荞蛋白功能特性的影响
2018-06-01周小理侍荣华周一鸣
周小理,侍荣华,周一鸣,夏 珂,肖 瀛
(上海应用技术大学 香料香精技术与工程学院,上海 201418)
0 引 言
苦荞是一种很有前景的功能性食物,富含多种营养成分,包括蛋白质,纤维素,淀粉,微量元素,维生素,抗氧化剂等[1-4]。苦荞籽粒中的蛋白质含量高于甜荞,营养价值高于大豆、小麦、玉米等作物[5-7]。苦荞蛋白是苦荞中主要的生物活性物质,约占苦荞的15%~17%,具有抗菌、抗肿瘤、降血压、抑制丝氨酸蛋白酶等生理活性,是一种理想的健康食品原料[8]。苦养蛋白主要由清蛋白、球蛋白、谷蛋白及醇溶蛋白4种蛋白组成,且富含18种氨基酸,氨基酸比例平衡,包含人体所需的 8种必需氨基酸。不同区域、不同品种的苦养蛋白其组成有所不同。Thanhaeuser等[9-11]研究表明,苦养蛋白含清蛋白 18%,球蛋白 43%,醇溶蛋白 1%,谷蛋白及其他蛋白含量为38%;王世霞等[12]分析表明,苦养蛋白的组分同小麦粉差别较大,水溶性球蛋白含量最高,达到31.8%~42.3%,谷蛋白含量第二,约为 25.4%~26.1%,醇溶蛋白含量1.7%~2.3%;Kankanamge等[13]研究发现苦养蛋白中清蛋白和球蛋白含量为55.4%,谷蛋白和残基含量为42.8%,酵溶蛋白含量1.8%。通过SDS-PAGE电泳分析表明,几种不同分子量范围(由高到低)的亚基组成了苦养蛋白中的谷蛋白和球蛋白,而清蛋白大多是由低分子量的亚基组成,苦养蛋白的醇溶蛋白组分中包含了中等分子量到低分子量范围的一些亚基。Tomotake等[14]通过研究苦荞蛋白对仓鼠血浆胆固醇、胆囊胆汁组成以及粪便中类固醇排泄量的影响,第一次提出了苦荞蛋白不仅显著可以抑制胆结石形成,还可降低胆囊和肝脏中胆固醇浓度;周小理等[15]通过体外吸附胆酸盐能力的测定证实所提取分离得到的苦荞水溶性蛋白具有一定的降血脂功能。
热处理是食品加工中不可避免的加工方法,目前常用的的热处理方法包括:湿热、干热和微波等加热方法,王晓琳等[16]研究发现,适度热处理能够使花生蛋白发生变性,改变乳化性能,湿热处理容易使蛋白发生聚集沉淀,此外,蛋白质与多糖在干热条件下反应形成蛋白质-多糖复合物,可以大大改善蛋白质的乳化性和起泡性。为了最大限度的保持食品的功能特性,研究不同热处理加工方式对苦荞产品的影响极为重要。本研究拟采用 3种常见的加热手段(湿热、干热和微波加热),研究其对苦荞蛋白营养功能特性的影响,以期获得有利于保持或改善苦荞蛋白各种功能特性的热处理条件,为进一步研究苦荞蛋白在功能食品的应用上提供理论和试验依据。
1 材料与方法
1.1 材料与仪器
苦荞籽粒选取山西黑丰1号作为供试样品。
主要试剂:硫酸铵、水合磷酸二氢钠、十二水合磷酸氢二钠、茚三酮、胆酸钠、脱氧胆酸钠、牛磺胆酸钠、十二烷基硫酸钠、硫酸、铁氰化钾、三氯乙酸、氯化铁、过氧化氢、乙醇、硫酸亚铁、过硫酸钾、水杨酸(CP级化学纯,99%)等购自国药集团上海化学试剂有限公司;胃蛋白酶、胰蛋白酶购自 Sigma公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐购自上海宝曼生物科技有限公司。
主要仪器:M1-211A微波炉(220 V/50 Hz,700 W)购自美的集团;HH-4恒温水浴锅(800 W)购自上海森地科学仪器仪器有限公司;UV-2600紫外可见光分光光度计(185~900 nm)购自岛津企业管理有限公司;X85-2磁力搅拌器(100~1 500 r/min,600 W)购自上海闵行虹浦仪器厂;AL204电子天平(最大称量值210 g,重复性0.1 mg)购自梅特勒-托利多仪器有限公司;PRO 250高速均质机(576 W,10 000~30 000 r/min)购自上海致金仪器设备有限公司;FD-1D-80冷冻干燥机(220 V,50 Hz,1 300 W,< –80 ℃,< 20 Pa)购自北京博医康实验仪器有限公司。
1.2 试验方法
1.2.1 苦荞蛋白的提取[17]
苦荞籽粒(山西黑丰1号)→粉碎、过100目筛→石油醚脱脂→加水溶解(1∶10)→离心取上清液(5 000 r/min,30 min,4 ℃)→调节pH值至等电点(pH值4.5)→离心取沉淀(5 000 r/min,30 min,4 ℃)→真空冷冻干燥(–70 ℃,24 h)。
1.2.2 苦荞蛋白的热处理[18-20]
1)湿热处理。苦荞蛋白与水按照固液比1∶10加水混匀,水浴温度80、100 ℃,处理时间20、40、60 min,得到6个蛋白样品冻干备用。
2)干热处理。将苦荞蛋白平铺在搪瓷盘上,置于烘箱中,温度80、100 ℃,处理时间20、40、60 min,得到6个蛋白样品备用。
3)微波加热处理。将苦荞蛋白置于微波炉中,微波功率700 W,处理时间2、4、6 min,得到3个蛋白样品备用。
1.2.3 苦荞蛋白水化性的测定
参考Molina等[21-22]的方法,分别对苦荞蛋白溶解度和持水性进行测定。
1.2.4 苦荞蛋白乳化活性的测定
参照张维农等[23]的方法,对苦荞蛋白乳化活性进行测定。
1.2.5 苦荞蛋白起泡活性的测定
参照Mirmoghtadaie等[24]的方法,对苦荞蛋白起泡活性进行测定。
1.2.6 苦荞蛋白体外消化率的测定
参照姜瞻梅等[25-26]的方法,对苦荞蛋白体外消化率进行测定。
1.2.7 苦荞蛋白抗氧化性的测定
参照 Osada等[27-29]的方法,分别对苦荞蛋白 ABTS自由基清除能力、·OH清除能力和总还原力进行测定。
1.2.8 胆酸盐吸附能力的测定
参照周小理等[30]的方法,对苦荞蛋白胆酸盐吸附能力进行测定。
1.2.9 数据分析
试验重复3次,采用SPSS20.0对数据进行进行因子方差分析及Ducan’s 多重检验(P<0.05),试验结果以均值±标准差表示,其他数据作图采用Origin9软件处理。
2 结果与分析
2.1 热处理对苦荞蛋白加工特性的影响
2.1.1 热处理对苦荞蛋白水化性质的影响
蛋白质的水化性质是蛋白质最主要的功能特性之一,水化性质的强弱在很大程度上影响着其他功能性质,同时,对于蛋白质的商用及营养价值也具有较大的影响[31]。表1为热处理对苦荞蛋白水化性质的影响。除湿热(100 ℃,60 min)以外,其余湿热处理能够显著提高苦荞蛋白的溶解度(P<0.05)。干热处理会降低苦荞蛋白的溶解度,干热(80、100 ℃)处理60 min时,溶解度分别降至约69.65%和63.29%,长时微波处理(4、6 min)可以明显地改善苦荞蛋白的溶解度,在微波处理6 min时,苦荞蛋白溶解度最大,达到约93.54%,比未处理蛋白增加了18%。在热处理过程中,可溶性小分子蛋白聚集成了大分子蛋白质,从而导致苦荞蛋白溶解度降低;而微波加热过程中可能造成了蛋白质分解,生成可溶性小分子物质。在食品加工过程中,可以适当控制热加工条件,控制大分子聚集物的生成,避免蛋白质的溶解度下降,故可以选择微波加热方式进行加工[32]。经过湿热处理后,苦荞蛋白的持水性高于未处理的苦荞蛋白;干热 100 ℃和短时微波(2 min)处理可以明显地改善苦荞蛋白的持水性,在干热100 ℃处理60 min时,其持水性达到1.341 g/g,比未处理蛋白增加了31%;在微波处理2 min时,苦荞蛋白的持水性最大,达到约1.528 g/g,比未处理蛋白增加51%。这可能是由于热处理会使蛋白质分子热运动加剧,使得水在蛋白质中的分布更加均匀,吸收水分的速度加快。而长时微波导致持水性迅速下降的原因可能是微波加热改变了蛋白质内部的极性基团对水的结合速率和程度。故为了保持或改善苦荞蛋白的持水性,可以选择干热或短时微波加热的方式进行热加工。

表1 热处理对苦荞蛋白水化性质的影响Table 1 Influence of heat treatment on tartary buckwheat protein hydration properties
2.1.2 热处理对苦荞蛋白乳化特性的影响
乳化性在食品的加工过程中具有重要作用,只有具有良好乳化性的食品才会拥有良好的口感。表 2为热处理对苦荞蛋白乳化性质的影响。湿热(100 ℃,20 min)处理时,苦荞蛋白的乳化性最高,为14.54 m2/g,较未处理蛋白升高了 28%,而干热和微波处理会显著降低苦荞蛋白的乳化性(P<0.05)。微波(700 W)处理6 min时,苦荞蛋白的乳化性最低,为4.41 m2/g,较未处理蛋白降低了 62%。苦荞蛋白经过适度的湿热处理,会增大分子的柔顺性,继而导致乳化性的上升,但是热处理过度,可能会导致蛋白质过度变性产生许多聚集体,使分子的柔顺性降低,溶解度降低,而少数蛋白质分子则可以在较短时间内扩散到油水分界面,从而导致其乳化效果明显下降[33]。湿热(80 ℃,20 min)处理时,苦荞蛋白的乳化性稳定性最高,约为32.47 min,较未处理蛋白分别升高了22%,干热处理20 min时,乳化稳定性分别升至约28.73和29.34 min,微波加热对苦养蛋白乳化稳定性的影响剧烈,随着处理时间的增加迅速降低,在6 min时,降至约6.19 min,比未处理蛋白降低了77%。乳化稳定性的改善可能是因为蛋白质展开使分子的柔韧性增强,从而可以更快地吸附在表面。而微波加热可能使蛋白质重新聚合,分子的柔韧性降低,乳化稳定性下降。故为了保持苦荞蛋白的乳化特性,可以选择湿热(80、100 ℃)20 min进行食品加工。

表2 热处理对苦荞蛋白乳化特性的影响Table 2 Influence of heat treatment on tartary buckwheat protein emulsion properties
2.1.3 热处理对苦荞蛋白起泡特性的影响
蛋白质只有可溶解,才可以在水-空气表层形成一种具有良好吸附力的薄层,进而形成泡沫;蛋白质必须具有很大的机械强度以及黏度,才能阻止泡沫的破裂以及结合,具有较好的泡沫稳定性。表 3为热处理对苦荞蛋白起泡特性的影响。湿热(100 ℃)处理20 min时,其起泡性为最高值,达30.33%,和未处理的蛋白质相比较,升高了 22%。干热处理后的起泡性先下降后没有明显变化,而微波加热6 min时,起泡性降低了66%。在湿热(80 ℃)处理 60 min时,蛋白质的泡沫稳定性达最大值,约为54.71%,和未处理的蛋白质相比较,升高了 23%。湿热100 ℃以及干热处理对苦荞蛋白的泡沫稳定性均有显著影响;微波加热的初期,泡沫稳定性并没有明显变化,随着微波时间的增加,便迅速下降,处理6 min时,其泡沫稳定性降低了 54%。蛋白质的起泡性可能与蛋白质分子中游离于表面的疏水性氨基酸数量有联系[34]。热处理一方面可能会增加蛋白质肽链柔软程度,使蛋白质分子在空气-水界面展开吸附并形成网络更加简单;另一方面可以使更多的疏水性氨基酸裸露,提高蛋白质和空气结合的能力[35]。因此从保持其起泡性的角度考虑,可以选择湿热100 ℃,20 min进行加工;而从改善泡沫稳定性的角度考虑,可以选择湿热80 ℃,60 min进行加工。
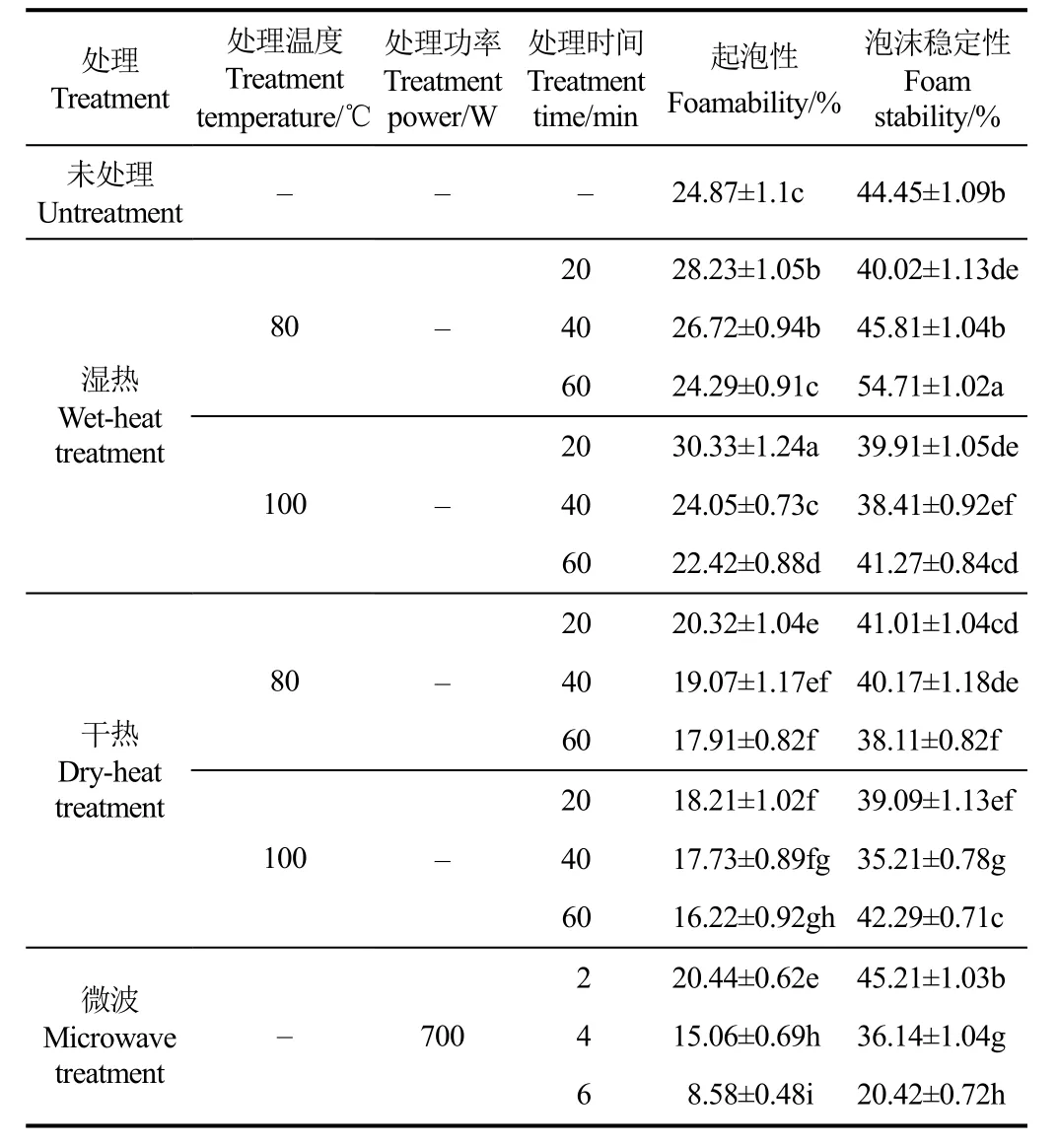
表3 热处理对苦荞蛋白泡沫稳定性的影响Table 3 Influence of heat treatment on tartary buckwheat protein foam stability
2.1.4 热处理对苦荞蛋白体外消化率的影响
鉴于单一的方法已无法对城市固体废弃物中Cl含量进行准确测量,为更准确地测量出城市固体废弃物中的Cl含量,分别采用氧弹燃烧法、艾士卡法、水萃取联合氧弹燃烧法、水萃取联合艾士卡法和XRF对厨余沼渣中Cl的含量进行检测,以期找出较为适用且更能准确量化城市固体废弃物中Cl含量的方法。
加热处理蛋白质后,会改变其结构,从而影响其消化性。Ikeda等[36]通过体外模拟试验,用胃蛋白酶-胰酶对甜荞蛋白质进行水解消化,并探讨了膳食纤维、单宁、植酸和蛋白酶抑制剂对甜荞蛋白消化率的影响。但是热处理对苦荞蛋白消化性的研究报道较少,所以本试验采用胃蛋白酶-胰蛋白酶两步消化的方法对热处理后的苦荞蛋白进行消化试验。热处理后的苦荞蛋白,其消化率均得到不同程度的提高。图 1为热处理对苦荞蛋白消化率的影响。

图1 热处理对苦荞蛋白消化率的影响Fig.1 Influence of heat treatment on tartary buckwheat protein digestion rate
图1a为湿热处理对蛋白质消化率的影响,在胃消化阶段,湿热处理80 ℃时其消化率增长速度很缓慢,在加热60 min时其消化率仅增长了6.73%;在100 ℃处理时,其消化率增长就相对比较明显;而在胰酶消化阶段,其消化率均保持一个较高水平,在湿热 80和 100 ℃处理60 min时,其消化率分别增加了11.52%和22.59%,原因在于热处理不仅使苦荞蛋白暴露出更多的酶切位点,而且使苦荞蛋白中的胰蛋白酶抑制因子失活,加速了胰蛋白酶与苦荞蛋白的反应速率,从而提高了其消化率。
图1b为干热处理对苦荞蛋白消化率影响。由图可知,干热80 ℃处理后的消化率呈现先增加后降低的趋势,在处理60 min时,其消化率数值跟原始蛋白差异不大;100 ℃处理后的苦荞蛋白消化率则持续上升,到60 min时其消化率比未处理蛋白增加了20.01%。可能的原因是适当热处理可以使苦荞蛋白的空间构象发生变化,使更多的酶切位点裸露,使其消化率增加。
图1c为微波加热对苦荞蛋白消化率影响。由图可知,微波加热时间少于4 min时,在胃蛋白酶作用下,其消化率迅速上升,在处理4 min时,其消化率上升了19.15%;而在胰酶作用下,其消化率先迅速上升,后逐渐趋于平缓;在微波加热6 min时,其消化率开始低于原始蛋白,这可能是因为过度的热处理造成了大聚集体的生成,延长了酶作用的时间,从而降低了其消化率。苦荞蛋白的消化率受处理温度和加热时间的影响。若要保持改善苦荞蛋白的消化性,可以选择湿热或干热的传统方式,或是合理控制微波加热的时间。
2.2 热处理对抗氧化活性的影响
表 4为热处理对苦荞蛋白抗氧化性的影响。与未处理的苦荞蛋白相比,其 2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除能力均呈现不同程度的降低。传统湿热(80、100 ℃)以及干热(80、100 ℃)处理对其ABTS自由基清除能力影响较小,微波加热影响最大。适当温度的湿热处理会使苦荞蛋白·OH清除能力增加,而干热和微波加热会不同程度降低其清除能力。在湿热80 ℃的时候,随着时间的增加,其·OH清除能力呈现上升趋势,在60 min时,升至62.92%,与未处理的苦荞蛋白相比,提高了9.75%。说明适量温度与时间的湿热处理,可以增加苦荞蛋白的·OH清除能力,为改善其·OH清除能力,可以选择湿热(80 ℃,40 min)处理的方式。干热80 ℃处理会使苦荞蛋白还原力明显上升,在处理60 min的时候,上升了16.34%;湿热处理使其还原力逐渐下降,说明湿热处理会略微降低苦荞蛋白的还原能力,干热处理则可以不同程度地提高其还原力,长时的微波加热(4、6 min)会明显降低其还原能力,故从保持其还原力的角度,应选择干热(80 ℃,60 min)处理进行加工。短时的微波加热对苦荞蛋白的抗氧化性影响不大,而长时的微波加热会大大降低了苦荞蛋白的抗氧化性。在700 W,6 min的时候,其ABTS自由基清除能力降低了48.79%,·OH清除能力降低了63.49%,还原力降低了49.18%。高于湿热和干热方式对其造成的影响。可见,长时微波加热对苦荞蛋白的抗氧化性具有很大的影响,尤其是对·OH的清除能力。
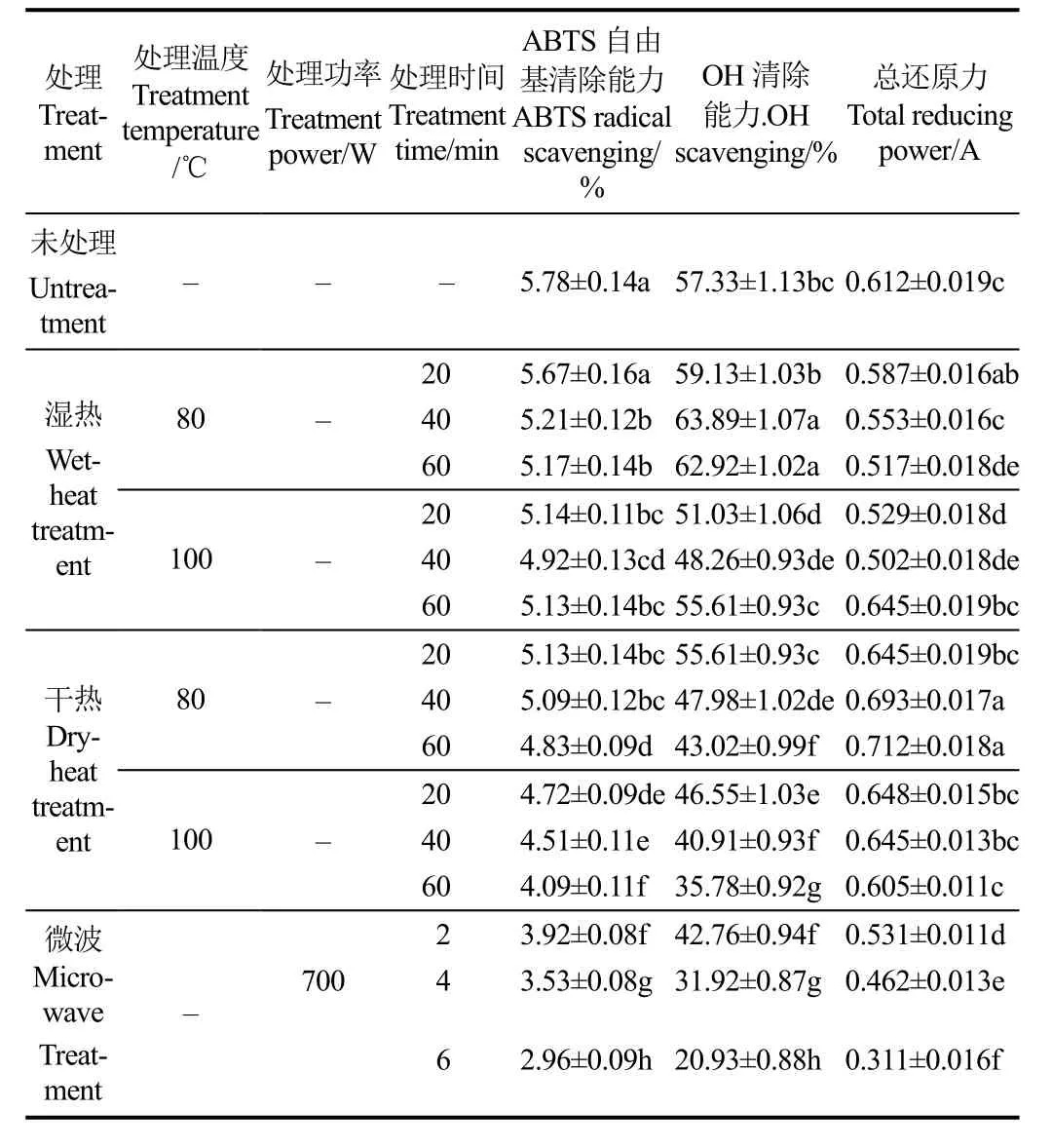
表4 热处理对苦荞蛋白抗氧化性的影响Table 4 Influence of heat treatment on tartary buckwheat protein oxidation resistance
2.3 热处理对苦荞蛋白胆酸盐吸附能力的影响
表 5为热处理对苦荞蛋白胆酸盐吸附能力的影响。胆酸盐是降解胆固醇后的物质,胆酸盐被吸附以后,可以使积累在肝肠循环中的胆酸盐清出体外,达到促进胆固醇代谢,降低胆固醇含量的效果,从而起到降血脂的作用。

表5 热处理对苦荞蛋白胆酸盐吸附能力的影响Table 5 Influence of heat treatment on tartary buckwheat protein bile salts adsorption capacity
3 结 论
1)湿热处理可以提高苦荞蛋白的乳化性、乳化稳定性、起泡性、泡沫稳定性、·OH清除能力、牛磺胆酸钠吸附能力,较未处理的苦荞蛋白分别提高了28%、22%、22%、23%、9.75%、28%。干热处理可以提高苦荞蛋白的持水性和还原力,较未处理的苦荞蛋白分别提高了31%、16.34%。短时微波对苦荞蛋白无明显影响,在微波2 min时,苦荞蛋白持水性提高了51%。
2)长时微波(4、6 min)对苦荞蛋白的功能特性有很强的负面影响,可使其乳化性、乳化稳定性、起泡性、泡沫稳定性分别降低62%,77%,66%,54%,ABTS自由基清除力、·OH清除力、还原力分别降低 48.79%、63.49%和49.18%,胆酸钠、脱氧胆酸钠和牛磺胆酸钠吸附能力也分别降低了64%,55%和41%。
3)为保持苦荞蛋白良好的功能特性,可以选择传统加热方式(湿热和干热)或者严格控制微波时间,避免长时微波加热对苦荞蛋白功能特性的破坏。苦荞蛋白的生产与加工均涉及热处理工艺,虽然苦荞产品的生产规模日益扩大,但产品质量仍然有待提高,造成这一差异的原因可能是热处理加工工艺不同导致的。所以未来可以对苦荞蛋白的热加工工艺进行进一步地探究,对功能性蛋白产品的开发具有很大价值。
[参 考 文 献]
[1] Glavač N K, Stojilkovski K, Kreft S, et al. Determination of fagopyrins, rutin, and quercetin in tartary buckwheat products[J]. LWT-Food Science and Technology, 2017, 79:423—427.
[2] Pongrac P, Potisek M, Frás A, et al. Composition of mineral elements and bioactive compounds in tartary buckwheat and wheat sprouts as affected by natural mineral-rich water[J].Journal of Cereal Science, 2016, 69: 9—16.
[3] Lukšič L, Árvay J, Vollmannová A, et al. Hydrothermal treatment of tartary buckwheat grain hinders the transformation of rutin to quercetin[J]. Journal of Cereal Science, 2016, 72:131—134.
[4] Tao B, Ye W, Li Y, et al. Antioxidant and antidiabetic properties of tartary buckwheat rice flavonoids after in vitro digestion[J]. Biomed & Biotechnol, 2016, 17(12): 941—951.
[5] 李宗杰. 苦荞蛋白的制备、生物活性鉴定及其在猪群中的应用[D]. 南京:南京农业大学,2016.Li Zongjie. Preparation and Bioactive Effects Study of Tartary Buckwheat Protein and Its Application on Swine Breeding Husbandry[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese with English abstract)
[6] Huang X Y, Zeller F J, Huang K F, et al. Variation of major minerals and trace elements in seeds of tartary buckwheat(Fagopyrum tataricum, Gaertn.)[J]. Genetic Resources &Crop Evolution, 2014, 61(3): 567—577.
[7] 廉立坤,陈庆富. 二倍体和四倍体苦荞种子蛋白质含量和黄酮含量比较研究[J]. 种子,2013,32(2):1—5.Lian Likun, Chen Qingfu. A Comparative study of seed protein content and seed flavonoid content between diploid and tetraploid tartary buckwheat[J]. Seed, 2013, 32(2): 1—5.(in Chinese with English abstract)
[8] Zhu F. Chemical composition and health effects of Tartary buckwheat[J]. Food Chemistry, 2016, 203: 231—245.
[9] Thanhaeuser S M, Wieser H, Koehler P. Spectrophotometric and fluorimetric quantitation of quality-related protein fractions of wheat flour[J]. Journal of Cereal Science, 2015,62: 58—65.
[10] Zhu F. Buckwheat starch: Structures, properties, and applications[J]. Trends in Food Science & Technology, 2016,49: 121—135.
[11] Hou S, Sun Z, Linghu B, et al. Genetic diversity of buckwheat cultivars (Fagopyrum tartaricum, Gaertn.) assessed with SSR markers developed from genome survey sequences[J].Plant Molecular Biology Reporter, 2016, 34(1): 233—241.
[12] 王世霞,刘珊,李笑蕊,等. 甜荞麦与苦荞麦的营养及功能活性成分对比分析[J]. 食品工业科技,2015,36(21):78—82.Wangshixia, Liu Shan, Li Xiaorui, et al. A comparative analysis of nutrition components and active ingredient in common and tartary buckwheat[J]. Science and Technology of Food Industry, 2015, 36(21): 78—82. (in Chinese with English abstract)
[13] Kankanamge R, Jeewanthi C, Lee N K, et al. Physicochemical characterization of hydrolysates of whey protein concentrates for their use in nutritional beverages[J]. Food Science &Biotechnology, 2015, 24(4): 1335—1340.
[14] Tomotake H, Shimaoka I, Kayashita J. Physicochemical and functional properties of buckwheat protein product[J]. Agric Food Chem, 2002, 50(7): 2125—2129.
[15] 周小理,黄琳. 荞麦蛋白的组成与功能成分研究进展[J].上海应用技术学院学报(自然科学版),2010,10(3):196—199.Zhou Xiaoli, Huang Lin. The study progress in the composition of buckwheat protein and its functional ingredients[J].Journal of Shanghai Institute of Technology, 2010, 10(3):196—199. (in Chinese with English abstract)
[16] 王晓琳,朱力杰,陈妍婕,等. 不同干热处理对花生蛋白二级结构及乳化性的影响[J]. 食品与发酵工业,2016,42(5):86—90.Wang Xiaolin, Zhu Lijie, Chen Yanjie, et al. The effect on secondary structure and emulsibility of peanut protein under different dry heat treatment[J]. Food and Fermentation Industries, 2016, 42(5): 86—90. (in Chinese with English abstract)
[17] 张英强. 苦荞麦黄酮和蛋白质提取工艺的优化[D]. 西安:西北大学,2016.Zhang Yingqiang. Optimization of Extraction of Flavonoid and Protein from Tartary Buckwheat[D]. Xi’an: Northwest University, 2016. (in Chinese with English abstract)
[18] Gao Z H. The effects of thermal-acid treatment and crosslinking on the water resistance of soybean protein[J].Industrial Crops & Products, 2015, 74: 122—131.
[19] Beck S M, Kai K, Sellahewa J, et al. Effect of different heat-treatment times and applied shear on secondary structure,molecular weight distribution, solubility and rheological properties of pea protein isolate as investigated by capillary rheometry[J]. Journal of Food Engineering, 2017, 208: 66—76.
[20] Iwashita K, Inoue N, Handa A, et al. Thermal aggregation of hen egg white proteins in the presence of salts[J]. Protein Journal, 2015, 34(3): 212—219.
[21] Molina E, Ledward D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food hydrocoll, 2001, 15(3): 263—269.
[22] Rao A, Shallo H E, Ericson A P, et al. Characterization of soy protein concentrate produced by membrance ulteafiltration[J].Journal of Food Science, 2000, 67(4): 1412—1418.
[23] 张维农,刘大川,胡小泓. 花生蛋白产品功能特性的研究[J]. 中国油脂,2002,27(5):60—65.Zhang Weinong, Liu Dachuan, Hu Xiaohong. Study on the functional characteristic of peanut protein[J]. China Oils and Fats. 2002, 27(5): 60—65. (in Chinese with English abstract)
[24] Mirmoghtadaie L, Shojaee A S, Hosseini S M. Recent approaches in physical modification of protein functionality[J].Food Chemistry, 2016, 199: 619—627.
[25] 姜瞻梅. 酶解牛乳酪蛋白制备 ACE抑制肽的研究[J]. 中国食品学报,2007,7(6):39—43.Jiang Zhanmei. Studies on the preparation of ACE inhibitory peptides from enzymic hydrolysate of milk casein[J]. Journal of Chinese Institute of Food Science & Technology, 2007,7(6): 39—43. (in Chinese with English abstract)
[26] 杨文博,张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品,2014(3):88—90.Yang Wenbo, Zhang Yinghua. Study on the determination methods for hydrolysis degree of protein[J]. China Condiment,2014(3): 88—90. (in Chinese with English abstract)
[27] Osada Y, Shbamoto T. Antioxidative activity of volatile extracts from maillard model system[J]. Food Chemistry,2006, 98(3): 522—528.
[28] 李永富. 美拉德反应产物的抗氧化功能[J]. 安徽农业科学,2008,36(32):13936—13937.Li Yongfu. The anti-oxidation function of maillard reaction products[J]. Journal of Anhui Agricultural Sciences, 2008,36(32): 13936—13937. (in Chinese with English abstract)
[29] Delgado-Andrade C, Morales F J. Unraveling the contribution of melanoidins to the antioxidant activity of coffee brews[J].Journal of Agricultural and Food Chemistry, 2005, 53(5):1403—1407.
[30] 周小理,黄琳,周一鸣. 苦荞水溶性蛋白体外吸附胆酸盐能力的研究[J]. 食品科学,2011,32(23):77—81.Zhou Xiaoli, Huang Lin, Zhou Yiming. In vitro binding of bile salts by water-soluble proteins from tartary buckwheat grains[J]. Food Science, 2011, 32(23): 77—81. (in Chinese with English abstract)
[31] 王长远,郝天舒,张敏. 干热处理对米糠蛋白结构与功能特性的影响[J]. 食品科学,2015,36(7):13—18.Wang Changyuan, Hao Tianshu, Zhang Min. Effect of dry heat treatment on structural and functional properties of rice bran protein[J]. Food Science 2015, 36(7): 13—18. (in Chinese with English abstract)
[32] Singh A, Sharma S, Singh B. Effect of germination time and temperature on the functionality and protein solubility of sorghum flour[J]. Journal of Cereal Science, 2017, 76: 131—139.
[33] Zhang S B, Lu Q Y. Characterizing the structural and surface properties of proteins isolated before and after enzymatic demulsification of the aqueous extract emulsion of peanut seeds[J]. Food Hydrocolloids, 2015, 47: 51—60.
[34] Yan Z, Zhang J, Wei S, et al. Effects of heat and high-pressure treatments on the solubility and immunoreactivity of almond proteins[J]. Food Chemistry, 2016, 199: 856—861.
[35] Chen W. Emulsification properties of soy bean protein[J].2014, 6(2): 262—268.
[36] Ikeda k, Kusano T. Isolation and some properties of a trypsin inhibitor from buckwheat grain [J]. Agric Biol Chem. 1978,42(2): 309—314.
