基于模型化合物的糠醇改性大豆蛋白基胶黏剂机理研究
2018-06-01吴志刚梁坚坤张本刚余丽萍杜官本
吴志刚,梁坚坤,张本刚,张 俊,雷 洪※,余丽萍,杜官本
(1. 贵州大学林学院,贵阳 550025;2. 西南林业大学,云南省木材胶黏剂及胶合制品重点实验室,昆明 650224)
0 引 言
以大豆蛋白基胶黏剂为代表的蛋白基胶黏剂已在部分地区成功投入工业化生产[1-5]。但由于组成蛋白成分的复杂性,有关大豆蛋白胶黏剂的制备机理研究还相对较少。Huang等[6]提出顺丁烯二酸酐和聚乙烯亚胺交联改性大豆蛋白时可能发生的反应方式。Liu等[7]受海洋贝类物质的启发,提出3,4-二羟苯丙氨酸与大豆蛋白交联的反应机理。Rogers等[8]提出当用环氧氯丙烷作为大豆蛋白质的交联剂时,它可以与蛋白质分子链上的羟基、氨基反应。以上仅仅是建立在现有化学理论基础之上的推论,而缺乏相应的试验数据支撑,难以为大豆蛋白基胶黏剂工艺改进和实际应用提供进一步的科学指导,也不利于大豆蛋白胶黏剂行业的发展。项目组以蛋白分子的基本组成单位氨基酸为突破口,采用的是模型化合物研究思想,这解决了常规方法解析蛋白胶黏剂机理难度大的问题。研究的整体思路是改性剂与氨基酸、二肽、多肽之间的相互作用层层推进,通过解析蛋白分子模型化合物与改性剂的反应机理,来了解和揭示改性剂改性蛋白胶黏剂的机理[9-10]。
甲醛及甲醛系衍生物氨基树脂、异氰酸酯和环氧树脂是蛋白胶黏剂制备过程中常用且有效的改性剂[11-23]。但以上交联剂都是以石油基为基础,一方面以石化产品为基础的交联剂的大量引入违背了蛋白基胶黏剂的研发初衷,环保方面大打折扣,另一方面诸如甲醛、苯酚、异氰酸酯等有毒物质的引入更大大降低了蛋白胶黏剂的环保优势。为了保持蛋白基胶黏剂的绿色、环保,在考虑交联改性后蛋白胶性能的同时,更多的还要关注交联剂本身的环保性。
糠醇又叫呋喃甲醇,是一种来源于玉米、小麦的可再生生物质材料,由糠醛催化加氢制得,具有很强的防腐性和耐水性,常被用于合成纤维、橡胶等材料[24],也是木材、金属和陶瓷等多孔材料的优良粘结剂[25-27]。有关糠醇-单宁树脂的研究报道较多,Pizzi等[28]研究表明糠醇改性的单宁胶黏剂具有较高的耐水性和耐腐性。糠醇分子中含有丰富的羟甲基,能与单宁A环上的活泼氢发生取代反应,强耐水性的糠醇结构的引入使得糠醇-单宁树脂具有很好的耐水性能[29]。甲醛系化合物之所以能够作为大豆蛋白交联剂,是因为它们含有大量的活性羟甲基,能与大豆蛋白中的基团如游离氨基(-NH2)、酰胺氨基(-CO-NH-或-CO-NH2)、羧基(-COOH)、羟基(-OH)、硫基(-SH)和苄羟基(-Ph-OH)等反应[30]。糠醇和甲醛系化合物在结构上具有相似性,都含有丰富的羟甲基,理论上糠醇分子中的活泼羟甲基能与大豆蛋白残基发生反应。Kumar等[31-32]证实了糠醇在一定条件下能够与大豆蛋白发生交联反应,但也仅仅停留在现有的化学基础理论推导层面,缺乏真正的机理试验验证。因此,选择糠醇作为蛋白胶黏剂的改性剂,对实现蛋白胶黏剂真正意义的环保、提高蛋白胶黏剂的市场竞争力和促进蛋白胶黏剂产业的发展具有重要的意义。
本研究采用模型化合物的思想,以组成大豆蛋白分子的丙谷二肽为起点,以糠醇作为交联剂,借助13C-NMR(C nuclear magnetic resonance)和ESI-MS(electrospray ionization mass spectrometer),等技术研究糠醇交联改性大豆蛋白基胶黏剂的机理,分析大豆蛋白基胶黏剂制备基础理论与实际性能之间的关系,期望为糠醇-大豆蛋白基胶黏剂的制备及应用奠定基础。
1 材料与方法
1.1 试验材料
脱脂大豆粉(蛋白质量分数53.4 %,200目),山东御馨豆业蛋白有限公司;L-丙氨酰-L-谷氨酰胺(丙谷二肽,质量分数98 %),分析纯,Amresco;糠醇(质量分数98.5%,AR),国药集团化学试剂有限公司;其他的化学试剂如甲酸均为分析纯。杨木单板(Populus spp.,含水率 8%~10%),单板幅面 300 mm×220 mm,厚度1.5 mm,购自江苏。
1.2 试验仪器
1.2.1 电喷雾电离质谱仪(electrospray ionization mass spectrometer, ESI-MS)
本研究所用仪器为Waters公司生产的 XEVO-TQS#WAA164型质谱仪,相应参数:离子源:ESI+;质量分析器:低端分辨率/高端分辨率:2.9/14.3;离子能量:0.3 eV;进样速度:5 μg/s。
1.2.2 核磁共振碳谱(C nuclear magnetic resonance,13C-NMR)
Bruker-AVANCE 600超导核磁共振仪。共振频率150 MHz,将 300 μL液体样品与100 μL氘代二甲亚砜溶剂(DMSO-d6)混合均匀作为待测样品。测定条件:弛豫延迟时间6 s;反转门控去耦法;zgig脉冲程序;扫描累加次数为800~1 200次。
1.2.3 热重(thermogravimetry, TG)分析
采用德国NETZSCH TG 209 F3型热重分析仪;测试条件:N2保护,测试温度范围 30~650℃,升温速率10 K/min,样品质量约5 mg。
1.3 模型化合物反应
称量一定量的丙谷二肽和糠醇(两者摩尔比为 1∶3),加入到一定量的蒸馏水中,使得溶液中固体的质量分数达到 30%,混合均匀后,用饱和对甲苯磺酸溶液和20%氢氧化钠溶液分别调体系中pH值为1~3和11~13,组装放入集热式恒温磁力搅拌器中。反应温度控制在75~80 ℃之间。在反应过程中保持溶液的pH值不变,反应1 h后分别取样,得到不同pH值下的产物。
称量一定量的糠醇,加入到一定量的蒸馏水中,使得溶液中固体的质量分数达到 30%。混合均匀后分别用对甲苯磺酸和20%的氢氧化钠溶液调体系中pH值为1~3和11~13。组装放入集热式恒温磁力搅拌器中。反应温度控制在 75~80℃之间。在反应过程中保持溶液的 pH值不变,反应1 h后分别取样,分别得到酸性溶液的糠醇和碱性溶液的糠醇。
1.4 糠醇改性大豆蛋白基胶黏剂的制备
将100 g脱脂大豆粉和300 g水加入装配有冷凝管、温度计和机械搅拌棒的500 mL圆底三口烧瓶中,搅拌溶解均匀后,加入3.0 g NaHSO3,升温至50 ℃,反应40 min,冷却放料,冷却得到大豆蛋白预处理液S。在压制胶合板前,调节大豆蛋白预处理液pH值,之后,加入15%的糠醇,共混搅拌均匀。
1.5 胶合板的制备与性能测试
在实验室中制备3层杨木胶合板,幅面为300 mm×220 mm。制板工艺为:时间:8 min,温度:160 ℃,压力:1.5 MPa,双面施胶量:380 g/m2。单板施胶流平后,闭口陈放15~20 min后进行热压。胶合板胶合强度(温水)参照国标GB/T 17657-1999中4.15的Ⅱ类胶合板的测试方法进行。
2 结果与分析
2.1 ESI-MS结果讨论与分析
本文研究了为糠醇与丙谷二肽在不同酸碱条件下,反应产物ESI-MS测试(正离子检测模式)。根据质谱离子化原理,丙谷二肽中含有的氨基易结合氢离子而离子化,羰基氧也很容易与Na+络合离子化,在ESI-MS中还可以结合 K+离子化,同时还可能出现多分子结构与 Na+络合离子峰,当结构中存在p-π共轭时,甚至还可能出现碳正离子峰。
根据ESI-MS测试结果可知,酸性反应体系中的峰密度要大于碱性,随着反应酸度的增加,反应产物的密集度逐渐增强,在较强酸性条件下,酸催化反应很明显。糠醇与丙谷二肽在酸和碱条件下催化机理不一样,酸性条件下是催化产生糠醇羟甲基碳正离子为反应中间体,酸越强,产生碳正离子的浓度和活性越高,反应越剧烈。碱性条件下,糠醇分子难以形成稳定的反应中间体,丙谷二肽中的酰胺存在 p-π共轭使得氨基氮上的未配位电子密度下降,从而使N-H极性增大,在强碱条件可能释放出氢离子,产生酰胺负离子中间体,亲核性增强。但由于这种酰胺负离子浓度极低,其反应程度可能不高。
在较强酸性条件下,有少量218 Da的峰,其归属于丙谷二肽结构,说明体系中还有游离丙谷二肽。本试验酸性环境是由对甲苯磺酸调节,其分子量为172,在质谱图中可以与糠醇体系络合出现,而糠醇在较强酸性条件可以发生自缩聚反应,293、373和533 Da归属于对甲苯磺酸与糠醇及糠醇缩聚物的络合峰,表明此条件下糠醇发生了一定的自缩聚反应。同时图谱中明显出现了298 Da的峰值,且酸度越大此峰越明显,当pH值增加时,298 Da峰值明显减少,直至彻底消失,而在碱性条件下几乎没有出现,这可能属于H离子归属的糠醇与丙谷二肽共缩聚产物,同时出现的617 Da峰是Na离子归属的2分子缩聚物的络合峰。252和310 Da的峰值可能归属于碳正离子峰,这个结构的产生是由于ESI-MS谱图的测试原理产生的,由于糠醇结构中存在p-π共轭体系,在质谱雾化过程中会脱水形成较稳定的碳正离子峰。
此外,糠醇羟甲基可能来源于糠醇自缩聚过程中产生的少量甲醛,在后面碳谱研究中也显示出在强酸条件下糠醇自缩聚产生了少量的甲醛说明了这一点,其机理如图1。

图1 酸性条件下糠醇自缩聚反应Fig.1 Polycondensation reaction of furfuryl alcohol under acidic conditions
在碱性体系中,糠醇-丙谷二肽体系几乎没有发生反应。218、240、256 Da同属于分别以H离子、钠离子和钾离子归属的丙谷二肽结构,262结构的产生是由于丙谷二肽中的羧基形成羧基钠盐导致(Na离子来源于质谱仪或者体系本身)。435、457、479 Da属于以H离子归属的丙谷二肽络合结构,相差22分子量来源于丙谷二肽中的羧基变成羧基钠的分子量差。同理,501、718、740 Da峰属于以Na离子归属的丙谷二肽络合峰;299、315、318、397、413 Da峰值归属于糠醇络合离子峰。碱性条件下糠醇与丙谷二肽的络合离子峰不明显,但由于质谱分析中各个结构之间电离问题以及存在较多的同分异构现象,对于反应结构的存在与否不能准确下结论,需要借助其他分析手段进一步研究。
2.2 13C-NMR结果讨论与分析
ESI-MS图谱中存在较多的同分异构现象,无法定位反应位点,无法判断各基团的反应活性。核磁共振碳谱中不同化学位移定位不同的结构基团,分辨度高,从而可以推理出可能的反应路径,是一种有效的研究机理方法。
大豆蛋白含有多种氨基酸,糠醇分子上的羟甲基可能与蛋白质氨基和羧基反应。丙谷二肽分子中含有伯胺(RNH2)、酰胺(-(CO)NH-和NH2(CO)-)和羧基,是蛋白质比较理想的模型化合物。图2和图3分别是丙谷二肽化学结构图和碳谱图。丙谷二肽含有 8个碳,结合碳谱测试规律,各碳原子的化学位移分别对应图3中1~8位置,其中1、4和8号位羧基碳吸收峰分别在179.6、178.3和171.5 ppm处,碳谱图中峰型均为单峰,说明此物质纯度较高。

图2 丙谷二肽的结构图Fig.2 Chemical structure of N-(2)-L-alanyl-L-glutamine
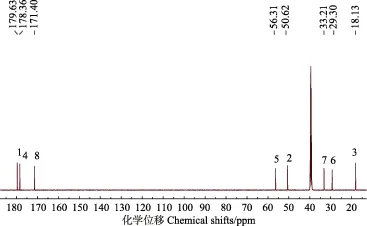
图3 丙谷二肽的碳谱图Fig.3 13C-NMR (C nuclear magnetic resonance) spectra of N-(2)-L-alanyl-L-glutamine
大量研究表明糠醇在强酸性条件下易发生自缩聚反应[33]。参照文献[34],在强酸性条件下,化学位移28~30 ppm为糠醇自缩聚桥键基团,62~64 ppm对应糠醇自缩聚醚键基团,且桥键含量明显多于醚键,说明糠醇在强酸性条件下发生了明显的自缩聚反应,且主要以亚甲基桥键形式连接。同时,文献报道化学位移82.83 ppm属于甲二醇(甲醛的水化物),表明糠醇在强酸性条件下发生了脱羟甲基反应,这是以前文献当中未曾提到的,这也是强酸性条件下是的糠醇图谱上出现甲醛的衍生物峰(46.59、71.48和92.66 ppm)的原因所在。
糠醇与丙谷二肽体系中存在糠醇与丙谷二肽共缩聚和糠醇自缩聚 2个竞争反应,糠醇在强酸性条件下易发生自缩聚反应。本试验重点考察糠醇与丙谷二肽共缩聚的条件,因此试验做了酸碱介质下的反应情况,探索其中共缩聚存在的条件。图 4是糠醇与丙谷二肽在酸性环境下的产物碳谱图。

图4 糠醇与丙谷二肽在酸性条件下产物的碳谱图Fig.4 13C-NMR spectra of furfuryl alcohol and N-(2)-L-alanyl-L-glutamine reacted at acid conditions
由图 4可知,在强酸条件下,化学位移 35.58和35.56 ppm处出现明显的新峰,对于此峰值的归属未见相关文献报道。
图5是糠醇与丙谷二肽反应产物化学位移预测图。根据糠醇与丙谷二肽体系可能的反应,并结合图 5的mestrenove碳谱软件预测发现,端酰胺与糠醇形成的Furan-C H2-NH(CO)-R结构的化学位移在36~37 ppm,脂肪族伯胺与糠醇形成的 R-NH-C H2-Furan的化学位移在43~44 ppm左右,肽键仲酰胺与糠醇形成的Furan-CH2-NR’(CO)-R化学位移在40~41 ppm之间。

图5 糠醇与丙谷二肽产物化学位移预测图Fig.5 13C-NMR prediction spectra of reaction products of furfuryl alcohol and N-(2)-L-alanyl-L-glutamine
理论化学表明脂肪族伯胺的诱导性大于端酰胺,使得脂肪族伯胺与糠醇形成的桥键峰与酰胺与糠醇共缩聚桥键峰相比更趋向于低场;而相比较端酰胺,肽键仲酰胺由于连有诱导性较大的支链结构使得其与糠醇共缩聚峰向低场移动,这与预测的结果吻合。因此,化学位移35.58和35.56 ppm的新峰归属于FA-NH(CO)-R桥键更为合理。可能的机理如图6。

图6 酸性条件下酰胺反应机理Fig.6 Reaction mechanism of amide under acid conditions
在酸性条件下时,丙谷二肽中与糠醇发生反应的位点最有可能在具有亲核性的氨基和羧基羟基氧上,氨基由于存在未配位的电子对使得其亲核性要远大于羧基羟基氧,在反应的选择性上主要是氨基参与亲核取代反应。丙谷二肽分子含有 3个氨基,反应活性如何需要进行进一步分析比较。在糠醇-丙谷二肽体系中,酸催化的反应中间体只有糠醇羟甲基碳正离子,其可能与具有亲核性的各类氨基和本身 5号位碳以及糠醇羟甲基中羟基进行竞争反应。化学位移35.60和43.15 ppm出现明显的吸收峰,且峰值面积前者大于后者,并未出现41 ppm处的新峰。这是因为,强酸性条件下糠醇分子在水溶液中容易形成较稳定的呋喃环甲基碳正离子,可以与具有亲核性的氨基反应;同时体系当中存在与碳正离子同性的氢离子。而在反应性上,由于酰胺存在p-π共轭电子离域现象,导致脂肪族伯胺的亲核性大于酰胺,那么在酸性条件下伯胺优先与氢离子结合,发生质子化,钝化了伯胺的亲核性[33-34]。在反应的竞争性上,由于酰胺的电子离域现象使其不容易质子化,而亲核性增强,在与糠醇碳正离子反应时具有更强的竞争性。肽键的酰胺存在较大的空间位阻,不易与糠醇发生有效碰撞,这与碳谱表现出的现象吻合。
糠醇-丙谷二肽在酸性体系中糠醇自缩聚和糠醇-丙谷二肽共缩聚存在明显的竞争关系。糠醇(pH值≤2)在强酸性条件下会发生剧烈缩聚[35-36],并且剧烈放热,这是由于糠醇碳正离子与本身5号位碳反应活化能较高,需要强酸环境催化,反应放热剧烈说明反应之后的缩聚产物能量较低,在热力学上占优势。而丙谷二肽与糠醇的缩聚反应产物在热力学上劣势于糠醇自缩聚产物;同时强酸性条件下,相比于糠醇,氨基存在更大程度的质子化趋势,反应活性进一步下降,使得在强酸环境中共缩聚结构不占优势。而糠醇与二肽的共缩聚反应程度又正比于糠醇碳正离子的浓度,酸性越大正离子浓度越高,反应活性越大,但酸性pH值一旦低于糠醇大量自缩聚的可能平衡点,共缩聚又会体现出劣势。因此,在本试验中体系处在适当pH值时,自缩聚和共缩聚处在一个相对平衡的位置,两种反应表现出较大的竞争性。但对于有利于最大共缩聚的精细反应条件还需要进一步研究。
图 7是糠醇与丙谷二肽在碱性环境下的反应产物碳谱图。

图7 糠醇与丙谷二肽在碱性条件下产物的碳谱图Fig.7 13C-NMR spectra of furfuryl alcohol and N-(2)-L-alanyl-L-glutamine reacted at alkaline conditions
由图 7可知,碱性条件下并未发现伯胺和肽键酰胺与糠醇共缩聚峰。这是因为糠醇在碱性条件下很稳定,很难形成稳定的反应中间体,所以在谱图中并未发现糠醇自缩聚峰。糠醇在弱碱性条件下形成酰胺负离子较难,即使产生其浓度和活性不足以与糠醇羟甲基碳反应,但碱性足够强时,酰胺可以形成浓度和活性更大的酰胺负离子,而伯胺在碱性条件下很难形成具有反应活性的中间体。相比而言,酰胺负离子是具有更强亲核性的反应位点,而肽键酰胺由于存在较大的空间位阻几乎不反应,这与脲醛树脂碱性条件下反应机理类似。因此,只有在强碱条件下才有一定的缩聚峰。可能的机理如图8。

图8 碱性条件下丙谷二肽与糠醇反应路径Fig.8 Reaction pathway of furfuryl alcohol and N-(2)-L-alanyl-L-glutamine reacted at alkaline conditions
综上所述,碱性条件下,反应中间体酰胺负离子的反应活性相对于酸性碳正离子很弱,反应速率较慢,实现糠醇与丙谷二肽共缩聚的时间太长;酸性条件下,体系在适当pH值时,自缩聚和共缩聚处在一个相对平衡的位置,两种反应表现出较大的竞争性。通过课题组的进一步研究表明,pH值为3是实现糠醇与丙谷二肽最佳共缩聚的条件。
2.3 糠醇改性大豆蛋白胶胶合板性能
不同pH值下,糠醇改性的大豆蛋白胶胶合板耐水强度如表1所示。由表1可知,不添加糠醇改性的大豆蛋白不具有耐水性能,添加糠醇改性的大豆蛋白胶黏剂耐水性能均得到显著提高。其中,pH值为1和pH值为3时耐水强度分别为0.65和0.76 MPa,明显高于其他pH值下大豆蛋白胶黏剂耐水强度。

表1 糠醇改性的大豆蛋白基胶黏剂胶合板性能Table 1 Performance of soy protein-based adhesive crosslinked by furfuryl alcohol
表 1胶合板测试结果与前面的理论分析结果相互印证,由此可以推断,在树脂化阶段,糠醇与大豆蛋白的交联反应和糠醇的自缩聚反应两者具有竞争性,并且都需要较强的酸性来催化,主要发生在pH值为1和pH值为3。pH值为1时,糠醇的自缩聚反应为主导,pH值为3时,糠醇与大豆蛋白的交联反应占优势。总之,这2个阶段糠醇的羟甲基与大豆蛋白分子之间发生了交联反应,增加了大豆蛋白分子的内聚强度及分子之间的交联密度,所以耐水性能有着显著提高。在其他pH值阶段,理论上这两者反应发生的程度并不高,但此时大蛋白胶黏剂耐水强度仍能达到0.4~0.5 MPa,这是因为在热压制备胶合板的过程中(固化阶段),随着温度的升高和水分的挥发,糠醇与大豆的交联反应和糠醇的自缩聚反应仍有一定程度的发生。
2.4 糠醇改性大豆蛋白胶黏剂 TG(Thermogravimetric Analysis)分析
不同pH值下,糠醇改性的大豆蛋白胶黏剂TG曲线如图9所示。由图9可知,在温度650℃,pH值为3和pH值为 13时,改性的大豆蛋白胶黏剂残炭率基本稳定[37-38],显著高于其他pH值下大豆蛋白胶黏剂,残炭率分别为61.97%和23.01%。

图9 糠醇改性的大豆蛋白胶黏剂热重曲线Fig.9 TG(thermogravimetric analysis) curves of soy protein-based adhesive crosslinked by furfuryl alcohol
TG的测试结果同样与前面的理论分析结果相互印证:糠醇与大豆蛋白的交联反应主要发生在酸性阶段,并且所需要的酸性较强,主要集中在pH值为1和pH值为3。pH值为1时,酸性较强,糠醇自缩聚反应程度较大,进而影响糠醇与大豆蛋白的交联反应程度。这是因为糠醇与大豆蛋白的共缩聚反应和糠醇的自缩聚反应两者为竞争关系,均需要较强的酸性催化,且前者低于后者,酸性太强(pH值为1)时糠醇自缩聚占主导,酸性太弱(pH值为5)时产生的糠醇碳正离子浓度和反应活性较弱,不利于自缩聚和共缩聚;在pH值为3时,共缩聚表现出较强的竞争性。此外,只有在强碱性条件下,即pH值为13时,改性的大豆蛋白胶黏剂具有较高的稳定性。这是因为一般碱性条件下糠醇极其稳定,糠醇与大豆蛋白的共缩聚反应和糠醇的自缩聚都不明显,只有在强碱性条件下糠醇可能产生活性稍大的酰胺负离子与大豆蛋白发生一定的交联反应,反应程度相对有限,但自缩聚反应依然不明显。糠醇与大豆蛋白的交联反应程度,影响缩聚产物的内聚强度尤其是体系的交联密度,最终影响产物的热稳定性。因此,pH值为3时,糠醇改性的大豆蛋白胶具有较高的热稳定性。
3 结 论
本文采用模型化合物思想研究大豆蛋白基胶黏剂的交联改性基础理论,以组成蛋白质分子的二肽为起点,以糠醇作为交联剂,采用13C-NMR和ESI-MS分析糠醇交联改性大豆蛋白基胶黏剂的机理。同时通过检测大豆蛋白胶胶合板性能,分析大豆蛋白基胶黏剂制备基础理论与实际性能之间的关系。研究结果表明:
1)糠醇与丙谷二肽的共缩聚反应和糠醇的自缩聚反应,两者是竞争关系。
2)一般碱性条件下糠醇极其稳定,两者都不明显,只有在强碱性条件下糠醇可能产生活性稍大的酰胺负离子与丙谷二肽发生一定的共缩聚,反应速率较慢,实现共缩聚的时间太长,但自缩聚反应依然不明显。
3)糠醇与丙谷二肽的共缩聚反应和糠醇的自缩聚反应都需要较强的酸性,且前者低于后者,酸性太强时糠醇自缩聚占主导,酸性太弱时产生的糠醇碳正离子浓度和反应活性较弱,不利于自缩聚和共缩聚;在pH值为3时,共缩聚表现出较强的竞争性。
4)糠醇与丙谷二肽共缩聚反应和糠醇自缩聚反应主要发生在酸性条件下,糠醇与丙谷二肽发生共缩聚反应位点首先是端酰胺基团,其次是伯胺,而肽键氨基由于存在较大的空间位阻导致几乎不参与反应。
5)糠醇与大豆蛋白模型化合物反应机理与大豆蛋白基胶黏剂实际性能具有较强的对应性,即在pH值为3时,糠醇与大豆蛋白基胶黏剂反应程度较高,表现为较强的耐水性和热稳定性。
[参 考 文 献]
[1] 吴义强,李新功,左迎峰,等. 农林剩余物无机人造板研究进展[J]. 林业工程学报,2016,1(1):8-15.Wu Yiqiang, Li Xingong, Zuo Yingfeng, et al. Research status on the utilization of forest and agricural bimass in inorganic wood-based panel[J]. Journal of Forestry Engineering, 2016,1(1): 8-15. (in Chinese with English abstract)
[2] 吴志刚. 蛋白基胶黏剂交联改性及机理研究[D]. 北京:北京林业大学,2016.Wu Zhigang. Crosslinking Modification of Protein-based Adhesives and Mechanism[D]. Beijing: Beijing Forestry University, 2016. (in Chinese with English abstract)
[3] Guo M R, Wang G R. Milk protein polymer and its application in environmentally safe adhesives[J]. Polymers,2016, 8(9), 324.
[4] Li C C, Li H Y, Zhang S F, et al. Preparation of reinforced soy protein adhesive using silane coupling agent as an enhancer [J]. Bioresources, 2014, 9 (3): 5448-5460.
[5] Jin C N, Zhang S C, Pang J Y, et al. Plywood with soy protein-acrylate hybrid adhesive [J]. Advanced Materials Research, 2014, 884-885, 108-111.
[6] Huang W N, Sun X Z. Adhesive Properties of soy proteins modified by urea and guanidine hydrochloride [J]. Jaocs,2000, 77: 101-104.
[7] Liu Y H, Ruan R S, Lin X Y, et al. Soy based wood adhesive research and development [J]. Journal of Fujian Forest Science and Technology, 2005, 32 (4): 1-5.
[8] Rogers J, Geng X, Li K. Soy-based adhesives with 1,3-dichloro-2-propanol as a curing agent [J]. Wood Fiber Sci. ,2004, 36 (2): 186-194.
[9] Wu Z G, Xi X D, Lei H, et al. Soy-based adhesive cross-linked by phenol formaldehyde glutaraldehyde[J].Polymers, 2017, 9 (5), 169.
[10] Lei H, Wu Z G, Cao M, et al. Study on the soy protein-based wood adhesive modified by hydroxymethyl phenol[J].Polymers, 2016, 8(7): 256-265.
[11] Wu Z G, Lei H, Du G B. Disruption of soy-based adhesive treated by Ca(OH)2and NaOH[J]. Journal of Adhesion Science and Technology, 2013, 27 (20): 1-7.
[12] 吴志刚,杜官本,雷洪,等. UFC和大豆蛋白制备环保型脲醛树脂研究[J]. 林业工程学报,2016,1(1):31-36.Wu Zhigang, Du Guanben, Lei Hong, et al. Preparation of eco-friendly urea-formaldehyde resin by urea-formaldehyde precondensate and soy protein[J]. Journal of Forestry Engineering, 2016, 1(1): 31-36. (in Chinese with English abstract)
[13] Lei H, Wu Z G, Du G B. Cross-linked soy-based wood adhesives for plywood[J]. International Journal of Adhesion& Adhesives, 2014, 50: 199-203.
[14] 顾蓉,穆宝宁,郭康权. 魔芋粉-壳聚糖-聚乙烯醇共混胶黏剂的流变模型[J]. 农业工程学报,2010,26(5):373-378.Gu Rong, Mu Baoning, Guo Kangquan. Rheological model of konjak powder-chitosan-polyvinyl alcohol blending adhesive[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010,26(5): 373-378. (in Chinese withEnglish abstract)
[15] Zeng N, Xie J J, Ding C. Properties of the soy protein isolate/PVAc latex blend adhesives [J]. Advanced Materials Research, 2012, 550-553, 1103-1107.
[16] Gao Q, Shi S Q, Zhang S F, et al. Soybean meal-based adhesive enhanced by MUF resin[J]. Journal of Applied Polymer Science, 2012, 125 (5): 3676-3681.
[17] Li H Y, Li C C, Gao Q, et al. Properties of soybean-flour-based adhesives enhanced by attapulgite and glycerol polyglycidyl ether [J]. Industrial Crops and Products,2014, 59: 35-40.
[18] Li J J, Luo J, Li X N, et al. Soybean meal-based wood adhesive enhanced by ethylene glycol diglycidyl ether and diethylenetriamine [J]. Industrial Crops and Products, 2015,74: 613-618.
[19] Frihart C R, Satori H. Soy flour dispersibility and performance as wood adhesive[J]. Journal of Adhesion Science and Technology, 2013, 27 (18/19): 2043-2052.
[20] Frihart C R, Lorenz, L. Protein Modifiers Generally provide limited improvement in wood bond strength of soy flour adhesives [J]. Forest Products Journal, 2013 b, 63(3/4): 138-142.
[21] Xu F J, Dong Y M, Wei Zhang W, et al. Preparation of cross-linked soy protein isolate-based environmentallyfriendly films enhanced by PTGE and PAM [J]. Industrial Crops and Products, 2015, 67: 373-380.
[22] Wu Z G, Lei H, Cao M, et al. Soy-based adhesive crosslinked by melamine glyoxal and epoxy resin[J]. Journal of Adhesion Science and Technology, 2016, 30 (19): 2120-2129.
[23] Dianika L, Wim J M, Johan P M. Jatropha seed protein functional properties for technical applications [J].Biochemical Engineering Journal, 2011, 53 (3): 297-304.
[24] Pizzi A. Recent developments in eco-efficent bio-based adhesives for wood bonding [J]. Opportunities and issues,2006, 20 (8): 829-846.
[25] Dunlop A P, Peters F N. The Furans [M]. USA: Mayflower Publishing Co, 1953.
[26] Nordstierna L, Lande S, Westin M, et al. Towards novel wood-based materials: Chemical bonds between lignin-like model molecules and poly(furfuryl alcohol) studied by NMR[J]. Holzforschung, 2008, 62(6): 709-713.
[27] 张俊. 黑荆树单宁-糠醇树脂的制备与表征[D]. 北京:北京林业大学,2016.Zhang Jun. The Preparation and Representation on Mimosa Tannin-furanic Resins[D]. Beijing: Beijing Forestry University, 2016. (in Chinese with English abstract)
[28] Pizzi A, Tondi G, Pasch H, Celzard A. MALDI-TOF structure determination of complex thermoset networks—polyflavonoid tannin-furanic rigid foams[J]. J Appl Polym Sci , 2008, 110(3): 1451-1456.
[29] 张俊,杜官本,席雪冬. 单宁树脂砂轮片制备及氧化铝在树脂中的分形分布[J]. 林业工程学报,2016,1(1):88-92.Zhang Jun, Du Guanben, Xi Xuedong. Preparationof tanninbased grinding wheels and fractal distribution of aluminum oxide in the resin[J]. Journal of Forestry Engineering, 2016, 1(1): 88-92. (in Chinese with English abstract)
[30] Liang J K, Wu Z G, Lei H, et al. The Reaction between furfuryl alcohol and model compound of protein [J].Polymers, 2017, 9 (12), 711
[31] Kumar R, Anandjiwala R. Biofilms from soy protein isolate and polyfurfuryl alcohol [J]. Plastics, Rubber and Composites,2012, 41(1): 1-7.
[32] Kumar R. Thermal properties of polyfurfuryl alcohol absorbed/adsorbedon arylated soy protein films[J]. J Therm Anal Calorim. , 2012, 107: 1287-1292.
[33] 曹明,雷洪,李涛洪,等. 三乙酸甘油酯对酚醛树脂固化的影响[J]. 林业工程学报,2017,2(2):16-21.Cao M, Lei H, Li T H, et al. Effects of glyceryl triacetate on curing behavior of phenolic resin[J]. Journal of Forestry Engineering, 2017, 2(2): 16-21. (in Chinese with English abstract)
[34] Li T H, Guo X S, Liang J K, et al. Competitive formation of the methylene and methylene ether bridges in the ureaformaldehyde reaction in alkaline solution: A combined experimental and theoretical study[J]. Wood Science and Technology, 2015, 49, 475-493.
[35] Bertarione S, Bonino F, Cesano F, et al. Furfuryl alcohol polymerization in H-Y confined spaces: Reaction mechanism and structure of carbocationic intermediates[J]. Journal of Physical Chemistry, 2008, 112(9): 2580-2589.
[36] Slonim I, Alekseyeva S, Arshava B, et al. Methods of investigation13C-NMR study of modification of urea formaldehyde resins by furferyl alcohol[J]. Polymer Science,1985, 27(8): 1993-1999.
[37] 孙恩惠,黄红英,武国峰,等. 大豆蛋白基生物质胶黏剂的合成及热力学性能[J]. 林产化学与工业,2015,35(2):147-153.Sun Enhui, Huang Hongying, Wu Guofeng, et al. Synthesis and thermodynamic properties of soy protein-based biomass adhesive[J]. Chemistry and Industry of Forest Products, 2015,35(2): 147-153. (in Chinese with English abstract)
[38] 张亮亮,徐曼,胡新宇,等. EGCG-Cu络合物与牛血清蛋白相互作用研究[J]. 林业工程学报,2017,2(5):46-50.Zhang Liangliang, Xu Man, Hu Xinyu, et al. Study on binding of EGCG-Cu complex to bovine serum albumin[J].Journal of Forestry Engineering, 2017, 2(5): 46-50. (in Chinese with English abstract)
