菲胁迫对鲤鱼的急性毒性和抗氧化酶响应
2018-05-31吕晏锋赵晓祥王俊锋
吕晏锋,赵晓祥,王俊锋
(东华大学 a.环境科学与工程学院; b.国家环境保护纺织污染防治工程技术中心,上海 201620)
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类含有两个或更多苯环连接的一类化合物,泄露在环境中可以通过食物链进入动物和人类体内,并在体内富集,直接对动物和人体造成危害。 多环芳烃主要来源于人类对能源的利用,石油类物质或者木柴的不完全燃烧可以产生多环芳烃。文献[1]研究发现,用燃烧木材的方法干燥玉米谷物,在干燥后的玉米中检测到了多环芳烃。 多环芳烃主要通过废水排放、大气沉降、 地表径流及原油泄露等多种途径进入水体,对水生生物造成不利影响,并通过饮水、皮肤接触及水产品食用等途径危害人体健康[2]。已有报道指出,在长江口水体中长时间检测到了低相对分子质量多环芳烃[3]。 文献[4]研究表明,在2014年采集的虾中检测到芴、菲、荧蒽等多环芳烃。 菲(phenanthrene,PHE,C14H10)是一种由3个苯环链接的低环类多环芳烃,化学结构稳定,具有湾区和K区。文献[5]研究表明菲的致癌性与K区有很大关联。这是因为菲相对分子质量小,所以较其他多环芳烃更容易被生物富集,产生毒性作用[6]。 已有的研究表明,菲在个体水平上不仅对水生物具有急性致死效应[7-8],并且还影响水生物个体发育[9]、生殖[10-11]以及行为[12-13],在细胞、组织和器官水平上引起生物体组织病理学的变化[10]。 此外,在生化酶水平上,菲暴露将引起生物体脂质过氧化损伤[14]和相关抗氧化酶活力变化等氧化应激[15-16]。 国内对水体多环芳烃的研究较晚,目前不少学者对河流、湖泊等水体的来源和分布规律进行了研究[6,17-18],但是对多环芳烃的生物毒性影响研究较少。此外,国家最新的地表水环境质量标准(GB 38380—2002)、海水水质标准(GB 30970—1997)、地下水质量标准(GB /T 14848—93)、农田灌溉水质标准(GB 50840—92)以及渔业水质标准(GB 116070—89)中还未给出多环芳烃的限值要求。
超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)是生物体抗氧化防御系统的重要组成部分。鲤鱼(cyprinus carpio),属鲤形目(cypriniformes)、鲤科(cyprinidae),是中国传统的淡水经济鱼类[19]。 本文通过研究菲胁迫对鲤鱼急性毒性试验以及鲤鱼组织中的SOD和GSH变化,得出菲对鲤鱼的安全浓度和对鲤鱼抗氧化防御系统的影响机理,以期为多环芳烃类物质的环境标准制定和污染的生态风险评价提供理论依据。
1 材料与方法
1.1 主要仪器及试剂
紫外可见分光光度计,MAPADA公司; Hydrolab水质分析仪,HACH公司; 高速冷冻离心机,上海天美; 电子天平,岛津生物科技公司; 漩涡混匀器; 恒温水浴锅,金坛市金城国胜实验仪器厂。
菲(95%),北京百灵威科技有限公司; 总超氧化物气化酶(T-SOD)、谷胱甘肽(GSH)测定试剂盒,南京建成生物工程研究所; 牛血清蛋白(BSA)、考马斯亮蓝,上海生工生物; 其他常用试剂纯度均为分析纯,购于国药集团化学试剂有限公司; 试验用水为超纯水。
1.2 试验材料
试验用鲤鱼购自上海方松街道龙轩水族馆,体长8~10 cm,体重9~11 g,健康活泼,采用连续曝气24 h以上的自来水,并检测记录水温、pH值及溶解氧等常规水质指标,确保试验水质符合渔业水质标准。 将试验用鲤鱼置于玻璃缸内自然条件下驯养两星期,水温为(22±2) ℃,pH为6.8~7.3,溶解氧大于8 mg/L,并在暴露期间持续曝气,保持光照12 h/d,每日投喂饲料两次,并及时清理排泄物,保证驯养期间死亡率低于1%,试验开始前4 d确保不出现鲤鱼死亡。
1.3 试验方法
1.3.1 急性毒性试验
在预试验的基础上,利用概率单位法在水环境中设置菲的等间距对数质量浓度5.01,6.31,7.94,10.00,12.59,15.85,19.95和25.12 mg/L,8个浓度组(配制菲母液,丙酮做助溶剂,助溶剂最终含量小于0.3%),每缸10尾,对鲤鱼进行96 h急性毒性试验,试验期间不喂食,采用半静态暴露方法,每天换水一次。按时观察鱼的中毒症状并及时将死鱼捞出。鉴定死鱼方法:将其置于清水中30 s后,用玻璃棒触其尾部,若无任何肉眼可见的反应(如嘴张开闭合、鳃扇动、尾部摆动)则认定其死亡。记录数据,计算死亡率,得到半致死浓度和安全浓度。
1.3.2 亚急性毒性试验
在急性毒性试验的基础上,设置0.175,0.350,0.700,1.400,2.800和5.600 mg/L(96-LC50的1/61,1/32,1/16,1/8,1/4和1/2浓度)6个菲的质量浓度,并设置空白对照组,进行亚急性毒性试验。 每个浓度组和对照组在暴露后的第1、3、5、7、9 d后分别取样,并取重复样两次。将取得的鲤鱼用生理盐水清洗,用滤纸将表面拭干,解剖。 整个试验过程在冰面上进行。取其鳃、肝脏和脊背上肌肉,在4 ℃的生理盐水中漂洗,用滤纸拭干,准确称取组织质量,剪碎,放入玻璃匀浆器中按鱼组织质量(g)∶生理盐水(mL)为1∶9的比例加入预冷的生理盐水,冰浴匀浆,得到质量分数为10%的匀浆组织。 将制备好的匀浆液在离心机(转速为5 000 r/min)中4 ℃条件下离心15 min,取上清液测定蛋白质质量浓度及T-SOD和GSH活力。
1.3.3 指标测定方法
蛋白质质量浓度测定采用Bradford方法,以BSA为标准蛋白,配置质量浓度为0、20、40、60、80、100 mg/L的BSA溶液,取样1 mL于试管中,加入配置好的考马斯亮蓝G-250染色液(将100 mg G-250溶于50 mL体积分数为95% 的乙醇中,加入100 mL体积分数为85%磷酸,超纯水定容至1 L,过滤)5 mL混匀,静置2 min,在595 nm波长下测定吸光度并绘制标准曲线,样品类同。SOD活力采用黄嘌呤氧化酶法(羟胺法)测定,按照试剂盒要求操作,最后于550 nm波长下比色,记录吸光度。GSH活力测定采用二硫代二硝基苯甲酸与巯基化合物反应生成黄色化合物比色测定,配置0、20、40、60、80、100 μmol/L浓度的GSH标准样品,按照试剂盒要求进行测定,于420 nm波长下测定吸光度并绘制标准曲线,样品类同。计算式为
q=lgc
式中:q为对数浓度;c为菲质量浓度。
死亡率与概率单位换算以及置信区间计算参考急性毒性试验标准(GB 15193.30—94)查表; 蛋白质浓度和GSH活力测定根据标准曲线计算; T-SOD活力按照说明书要求计算。
1.4 数据处理
数据统计结果表示为平均值±标准偏差(SD),
本文采用SPSS 22.0统计软件对数据进行单因素方差分析(one-way ANOVA),用Duncan’s法对均值进行多重比较,其中,a<0.01表示差异极其显著(**),a<0.05表示差异显著(*)。 采用概率单位-浓度对数法计算菲对鲤鱼半致死质量浓度。
2 结果与分析
2.1 急性毒性
在整个急性毒性测试过程中,观察不同浓度菲胁迫下鲤鱼的行为。 鲤鱼在高浓度菲条件下暴露1 h后出现了较强的中毒症状,身体失去平衡,侧卧浮在水面、鳃煽动频率增快,4 h后出现死亡。在菲适中浓度下暴露4 h后鲤鱼出现麻痹症状,游动能力减弱,身体倾斜,轻敲缸壁并没有表现出与对照组相同的应激性,但轻触鱼尾还能做出应激反应,暴露24 h后出现鱼死亡。低浓度组的鲤中毒现象较中和高浓度组晚,但挣扎时间较长,颜色变浅,鱼鳞脱落,侧翻并沉入缸底,呈典型麻痹状态,24 h 后逐渐死亡,96 h 后存活的鲤全部沉在缸底,呼吸微弱。
菲对鲤半致死浓度测定结果见表1所示。 从表1中可以看出,随着菲浓度的升高,鲤鱼的死亡率也升高,两者呈明显的剂量毒性效应,24 h死亡率的概率单位(Y)与对数浓度(X)成线性关系,回归方程为Y=3.970 2X+0.227 5(r2=0.938 8); 96 h的回归方程为Y=0.479 8X+0.30(r2=0.922 9)。 经计算测得鲤鱼24 h半致死浓度为15.926 mg/L(概率单位为5时对应的剂量浓度),95%置信区间为14.675~17.282 mg/L,96 h半致死浓度为11.198 mg/L,95%置信区间为9.950~12.604 mg/L,依据鱼类急性毒性试验毒性分级标准[20]可知,菲对鲤鱼属于高毒性物质。计算菲对鲤鱼的安全浓度(SC)=96 h半致死浓度×0.1=1.120 mg/L。

表1 菲对鲤鱼24和96 h后的半致死质量浓度Table 1 LC50 of cyprinus carp after exposure to phenanthrene for 24 h and 96 h
2.2 菲对鲤鱼鳃、肝脏、肌肉中SOD活力的影响
鲤鱼鳃、肝脏和肌肉在不同菲暴露浓度和时间下T-SOD活力如图1所示。鲤鱼不同组织中T-SOD和GSH活力存在差异,肝脏的T-SOD和GSH活力高于鳃和肌肉,差异极其显著(a<0.01),而鳃的T-SOD活力略高于肌肉,差异不显著(a>0.05)。
从图1(a)可以看出,鲤鱼鳃组织中,与空白对照相比,T-SOD活力总体被诱导。菲质量浓度为0.700 mg/L暴露下鱼鳃中的T-SOD活力在第3 d达到峰值,其余暴露浓度组在在第7 d达到峰值;5.600 mg/L浓度组T-SOD活力在第7 d达到峰值后,第9 d维持在这个活力而其余浓度组开始活力诱导下降,0.700 mg/L 浓度组在第9 d T-SOD活力与对照组差异不显著(a>0.05)。从图1(b)中可以看出,鲤鱼肝脏的T-SOD活力总体趋势表现出低浓度诱导,高浓度抑制-诱导效应。0.175 mg/L浓度组暴露1 d后肝脏T-SOD被诱导差异极显著(a<0.01),活力持续诱导,到第7 d诱导下降并与对照组无显著差异(a>0.05)。肝脏在0.350、0.700和1.400浓度组在暴露5 d后T-SOD活力被诱导达到峰值且差异极其显著(a<0.01)。而在2.800和5.600 mg/L浓度暴露下,肝脏SOD在暴露第1 d先被抑制,而后再被诱导,到第5 d达到峰值后下降。由图1(c)可知,肌肉组织总T-SOD酶活力受到影响较肝脏和鳃晚,高浓度组暴露第3 d肌肉组织的酶活才出现诱导现象且差异极其显著(a<0.01); 5.600 mg/L浓度暴露下,肌肉组织T-SOD活力在第5 d诱导达到峰值。而在其他浓度组的暴露下,活力持续被诱导并且随暴露时间延长和浓度增加呈递增趋势。
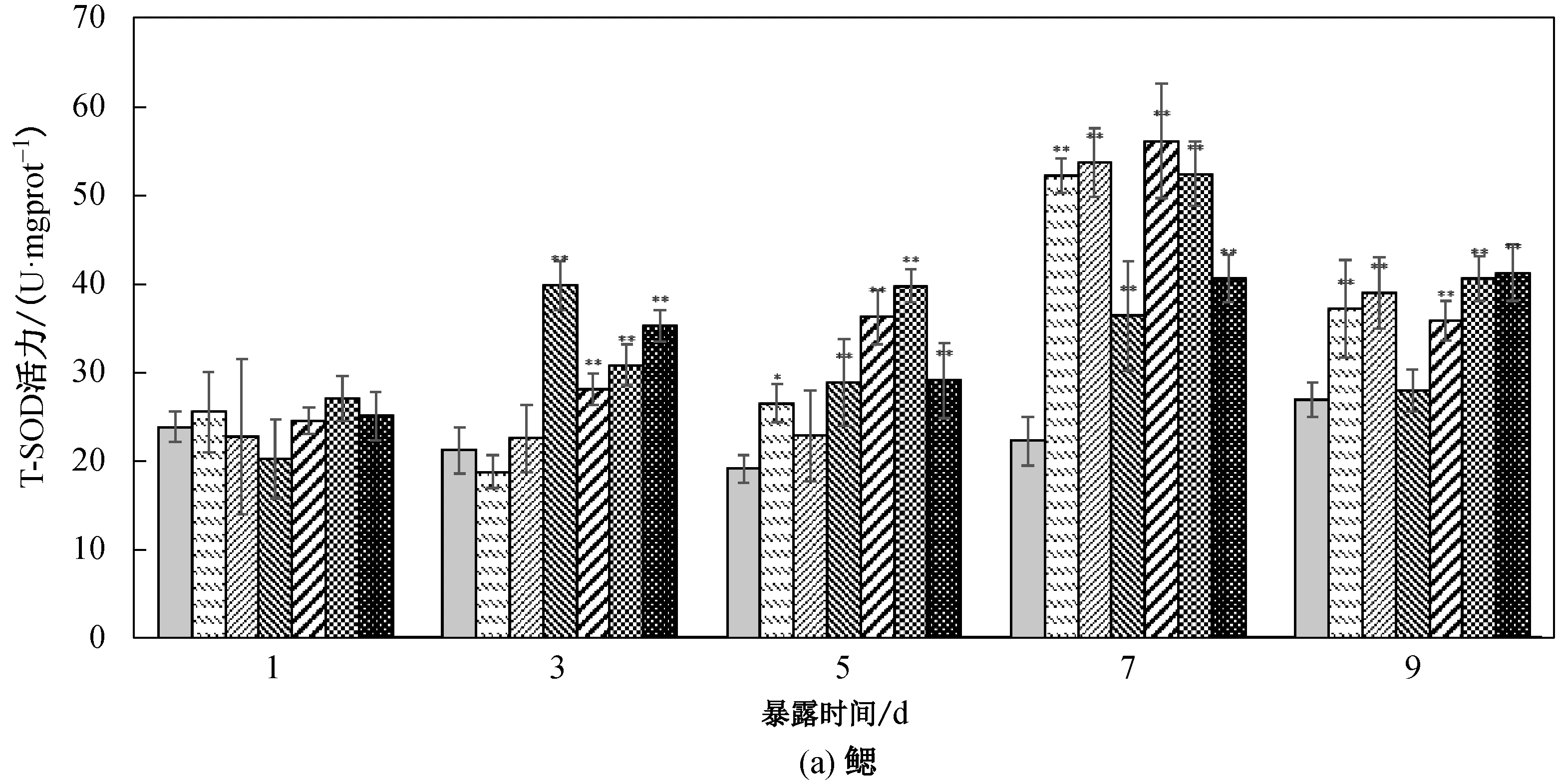
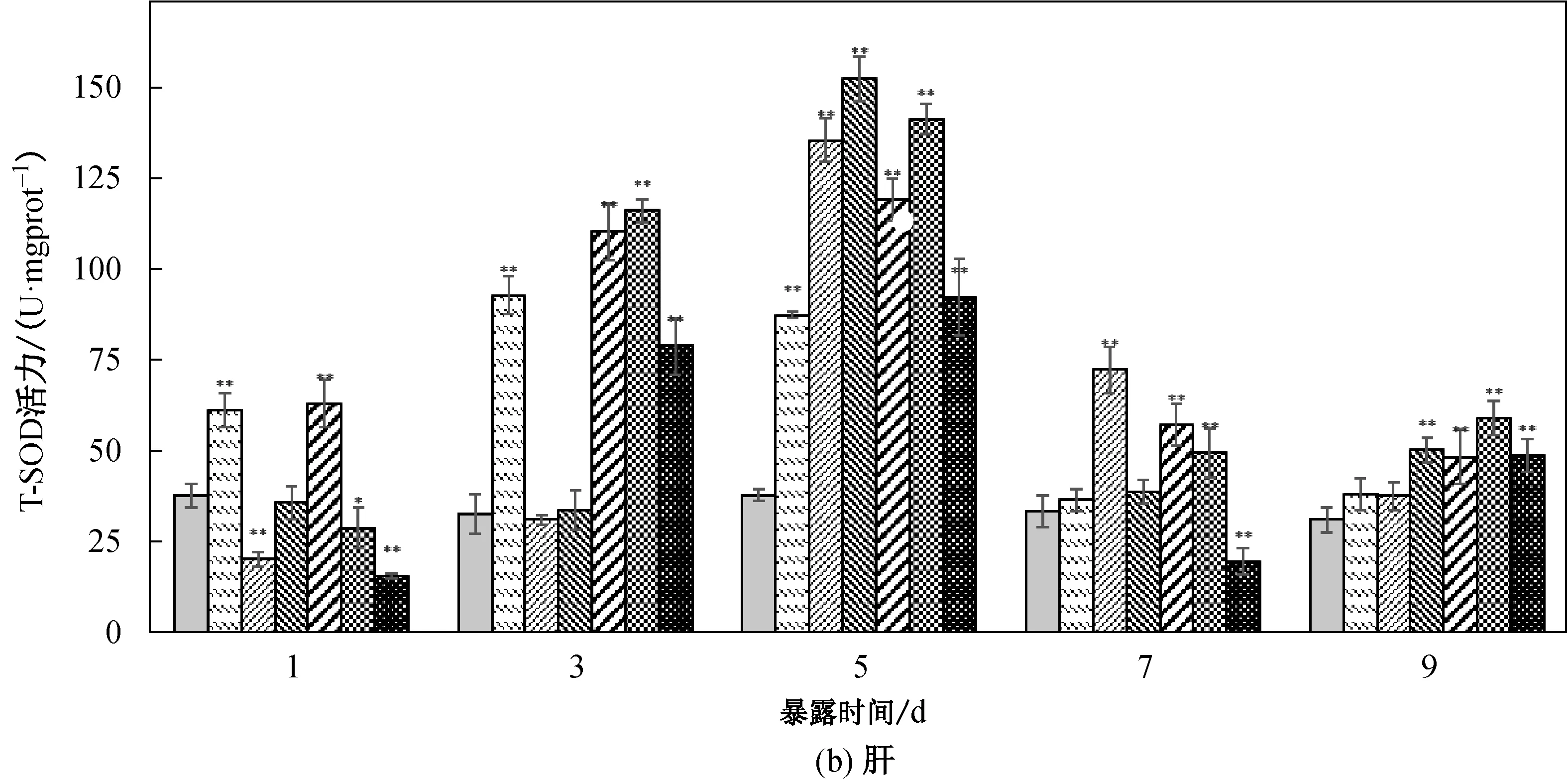

图1 不同浓度菲胁迫对鲤鱼各组织中T-SOD活力影响Fig.1 Effects of T-SOD activity in different tissue of carp under different concentrations of phenanthrene
2.3 菲对鲤鱼鳃、肝脏、肌肉中GSH活性的影响
鲤鱼鳃、肝脏和肌肉在不同菲暴露浓度和时间下GSH活力如图2所示。从图2可以看出,与对照组相比,鲤鱼肝脏中GSH活力最高,鳃其次,肌肉最低,差异极显著(a<0.01)。总体上,菲暴露对鲤鱼各组织器官GSH影响结果与SOD相似。
从图2(a)可以看出:鳃组织的GSH在0.175 mg/L 浓度暴露5 d后诱导达到峰值,差异极显著(a<0.01),然后维持在这个水平; 暴露在其余浓度组1 d后的鲤鱼鳃组织GSH被诱导,差异极显著(a<0.01),随时间推移而持续被诱导,在第7 d达到峰值,第9 d保持活力诱导。从图2(b)可以看出,菲暴露对鲤鱼肝脏GSH总体呈低浓度诱导和高浓度抑制-诱导,且低浓度诱导的程度较鳃和肌肉高。鲤鱼暴露在0.175、0.3500和0.700 mg/L的菲浓度下,其肝组织GSH被诱导,在第3 d达到峰值且差异极显著(a<0.01),GSH在一个比较高的水平下波动。 1.400、2.800、5.600 mg/L浓度暴露下肝脏GSH在第1 d 并没有被诱导,并且1.400和5.600 mg/L浓度下肝脏GSH活力被抑制且差异极其显著(a<0.01),而后随时间推移开始被诱导,随时间推移达到峰值后诱导下降。 从图2(c)中可以看出:在0.175 mg/L浓度菲暴露的鲤鱼第1 d肌肉GSH活力被诱导且差异极显著(a<0.01),活力诱导持续到第7 d而后下降; 0.350 mg/L 浓度组鲤鱼肌肉组织从第3 d开始表现出诱导效应并且诱导达到峰值,差异极显著(a<0.01),而后随时间推移诱导下降,到第9 d与对照组差异不显著(a>0.05);在0.700 mg/L浓度暴露下,肌肉组织的GSH活力在第7 d开始被诱导且差异极其显著(a<0.01),第9 d诱导增强,可能维持在一个新的平衡。
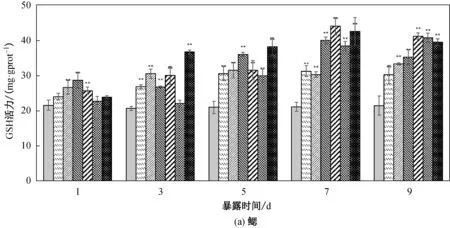

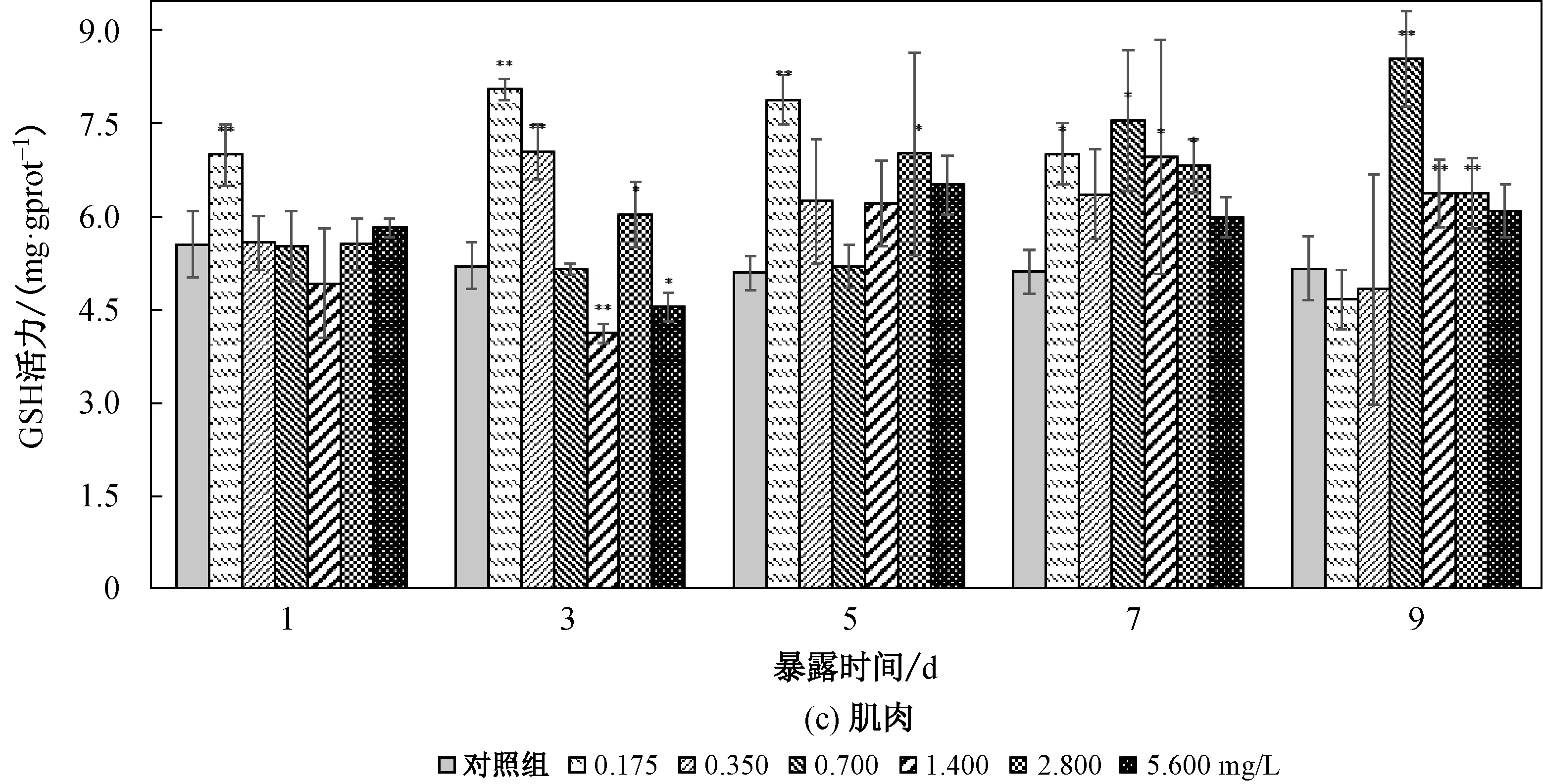
图2 不同浓度菲胁迫对鲤鱼各组织中GSH活力影响Fig.2 Effect of GSH activity in different tissue of carp under different concentrations of phenanthrene
3 讨 论
菲能够在鱼体内被富集,并诱导抗氧化酶的激活,而SOD、GSH这类抗氧化酶被用作多环芳烃对鱼类污染胁迫的生物指标[21]。 水环境中的污染物暴露可能影响鱼类肝脏抗氧化防御系统,且氧化防御系统中应激酶活性的改变与暴露剂量及暴露时间有关[22]。 文献[23]研究指出,不同类型氧化剂的产生和消除是衡量活性氧(reactive oxygen species,ROS)的标准,活性氧的增加能扰乱细胞的代谢和破坏细胞的成分。 污染物进入生物体后,能够直接或间接诱导产生活性氧,主要包括超氧阴离子和过氧化氢等。
菲对鲤鱼暴露后,其肝脏的应激性高于鳃和肌肉,说明菲对鲤鱼肝毒性比较明显。这是因为不同组织的生理功能不同,鳃具有呼吸功能,肌肉提供能量,而肝脏负责解毒,也是主要的靶器官。 在鲤鱼不同组织中出现低浓度诱导和高浓度抑制,这可能是因为低浓度毒物对生物体产生兴奋效应[24-25],而高浓度在暴露初期抑制酶活力的表达,这与文献[26]利用十溴二苯乙烷(DBDPE)对草鱼影响类似。 有些组织并没有出现高浓度抑制-诱导现象,可能是因为此高浓度并没有达到该组织的最大耐受限度,仅仅是组织兴奋产生诱导现象。 文献[12]在试验中发现,幼年期的金头海鲷在低浓度菲的暴露4 d后,其肝脏中的SOD等抗氧化防御酶被显著诱导,生物活性下降。
从菲对鲤鱼的急性毒性可以看出,菲对鲤鱼有明显的剂量-毒性效应。 鱼在严重中毒时,其肝细胞的细胞核固缩、细胞破裂和溶解,细胞功能发生衰退,最终导致组织坏死[27]。 在急性毒性试验中鲤鱼在水环境中失去平衡,活动能力减弱等各种应激性,这些现象与文献[28]使用菲胁迫对红鳍笛鲷急性毒性试验鱼类症状类似。
SOD能够催化超氧阴离子自由基O2-歧化反应转化为H2O2,而H2O2再被过氧化氢酶和氧化物酶转化为水(H2O),从而达到清除细胞内氧自由基,保护细胞的目的[29]。 从图1可以看出,菲暴露随时间推移,鳃和肌肉的SOD活力保持诱导,而肝脏的SOD酶先抑制或诱导不明显,再随时间推移则明显被诱导,而后诱导活力又随时间推移而降低。这可能因为低浓度下,鲤鱼鳃和肌肉组织内的超氧自由基等活性物质及时被清除,并且没有打破该组织内的平衡,而随暴露浓度增加,高浓度菲刺激产生的超氧自由基进一步增多,进而刺激组织SOD酶活力继续上升,而菲在鲤鱼组织中的代谢产物对肝细胞SOD酶的活力产生抑制影响,而后随时推移产生积累刺激肝组织产生大量的SOD,接着SOD酶催化产生的H2O2没有被及时分解,集中在肝脏导致该组织的进一步细胞损伤进而酶活力下降。 文献[30]在用环丙沙星胁迫锦鲤氧化损伤研究中发现,高浓度暴露锦鲤肝脏的SOD和GSH呈现诱导-抑制效应,这说明锦鲤的肝脏组织受到影响。 文献[3]在用菲暴露黄颡鱼发现,较低浓度菲胁迫下,SOD活力被诱导,而较高浓度先抑制后诱导。文献[31]研究发现,罗非鱼暴露在苯并芘后,SOD表现出在暴露初期被迅速抑制,然后被诱导,再被抑制的反应模式。 文献[32]研究菲和芘对蚯蚓的抗氧化酶系的影响,发现蚯蚓体内的SOD活力被不同程度诱导。
GSH在自由基、抗氧化剂与营养素代谢的协调性相互关系中起到极其重要的作用[33]。 文献[34]研究发现,GSH是基体抵御氧化损伤的第一道防线在机体防护氧化损伤中起着重要的作用。从图2(b)中看到,菲暴露对鲤鱼肝脏也出现了低浓度抑制和高浓度诱导现象,而暴露第9 d的GSH活力较第7 d有下降趋势。这说明菲暴露对肝脏GSH活力产生了与SOD类似的效应,也说明GSH 的活力与SOD活力有一定的关联。 文献[35]在利用六溴环十二烷(HBCD)单一暴露大鼠时发现,其肝脏GSH较对照组提高,而将HBCD和多溴联苯醚(DE-71)联合作用时发现,低浓度时GSH提高而高浓度时则降低,降低的原因可能是破坏了其防御系统。 文献[36]研究苯并[a]芘对大弹涂鱼3 d后肝脏和卵巢GSH随污染物暴露浓度增加而增加,可能是污染物诱导自由基的生成,产生氧化胁迫,GSH 发挥作用清除自由基,使其含量降低,而随着污染物浓度升高,组织产生防御反应刺激生成GSH。
4 结 论
(1) 菲暴露对鲤鱼24 h半致死浓度为15.926 mg/L,96 h半致死浓度为11.198 mg/L,安全浓度为1.120 mg/L。
(2) 菲暴露对鲤鱼鳃和肌肉中SOD表现出诱导效应,肝脏组织中表现出低浓度诱导,高浓度抑制-诱导效应; GSH响应趋势与SOD相似。
(3) 菲对鲤鱼各组织中SOD和GSH 影响效果显著性顺序依次为肝脏>鳃>肌肉。
参 考 文 献
[1] LIMA R F D,DIONELLO R G,PERALBA M D C R,et al. PAHs in corn grains submitted to drying with firewood[J]. Food Chemistry,2016,215: 165-170.
[2] 李国莲. 巢湖污染物赋存、来源及风险评价研究[D]. 合肥: 中国科学技术大学环境科学与光电技术学院,2012.
[3] 吴玲玲. 长江口水体中典型有机污染物的分布及其对鱼类的毒性效应[D]. 上海:同济大学环境科学与工程学院,2007.
[4] 汤水粉,钱卓真,罗方方,等. 高效液相色谱法测定水产品中15种多环芳烃[J]. 福建水产,2016,38(5): 394-401.
[5] HARVEY R G. Polycyclic aromatic hydrocarbons : Chemistry and carcinogenicity[M]. London:Cambridge University Press,1991.
[6] MASKAOUI K,ZHOU J L,HONG H S,et al. Contamination by polycyclic aromatic hydrocarbons in the Jiulong River Estuary and Western Xiamen Sea,China[J]. Environmental Pollution,2002,118(1): 109-122.
[7] 陈辉辉,覃剑晖,刘海超,等. 典型重金属、多环芳烃及菊酯类农药对唐鱼的急性毒性效应[J]. 华中农业大学学报,2011,30(4): 511-515.
[8] 米盛景,王立俊,王秀利. 菲、芘、壬基酚对黑褐新糠虾的急性毒性[J]. 河北渔业,2011(8): 5-8.
[9] LOTUFO G R,FLEEGER J W. Effects of sediment-associated phenanthrene on survival,development and reproduction of two species of meiobenthic copepods[J]. Marine Ecology Progress,1997,151(1/2/3): 91-102.
[10] HORNG C Y,LIN H C,LEE W. A reproductive toxicology study of phenanthrene in medaka (oryzias latipes)[J]. Archives of Environmental Contamination & Toxicology,2010,58(1): 131-139.
[11] ZHANG H,PAN L,TAO Y. Toxicity assessment of environmental pollutant phenanthrene in clam Venerupis philippinarum using oxidative stress biomarkers[J]. Environmental Toxicology and Pharmacology,2014,37(2): 697-704.
[12] CORREIA A D,GONÇALVES R,SCHOLZE M,et al. Biochemical and behavioral responses in gilthead seabream (Sparus aurata),to phenanthrene[J]. Journal of Experimental Marine Biology & Ecology,2007,347(1/2): 109-122.
[13] GONÇALVES R,SCHOLZE M,FERREIRA A M,et al. The joint effect of polycyclic aromatic hydrocarbons on fish behavior[J]. Environmental Research,2008,108(2): 205-213.
[14] 杨涛,陈海刚,蔡文贵,等. 翡翠贻贝内脏团抗氧化防御系统对菲胁迫的生物响应[J]. 应用与环境生物学报,2011,17(4): 504-508.
[15] SUN Y Y,YU H X,ZHANG J F. Bioaccumulation,depuration and oxidative stress in fish Carassius auratus under phenanthrene exposure[J]. Chemosphere,2006,63(8): 1319-1327.
[16] HANNAM M L,BAMBER S D,GALLOWAY T S,et al. Effects of the model PAH phenanthrene on immune function and oxidative stress in the haemolymph of the temperate scallop Pecten maximus[J]. Chemosphere,2010,78(7): 779-784.
[17] 唐银健. 黄浦江水体中低环多环芳烃分布规律的研究[D]. 上海: 同济大学环境科学与工程学院,2007.
[18] ZHANG Z L,HONG H S,ZHOU J L,et al. Phase association of polycyclic aromatic hydrocarbons in the Minjiang River Estuary,China[J]. Science of the Total Environment,2004,323(1/2/3): 71-86.
[19] 曹明华. 鲤鱼的生物学特性及养殖方法[J]. 养殖技术顾问,2013(4): 224-224.
[20] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社,2002.
[21] LIMA I,MOREIRA S M,OSTEN J R,et al. Biochemical responses of the marine mussel Mytilus galloprovincialis to petrochemical environmental contamination along the North-western coast of Portugal[J]. Chemosphere,2007,66(7): 1230-1242.
[22] FENG M,LI Y,QU R,et al. Oxidative stress biomarkers in freshwater fish Carassius auratus exposed to decabromodiphenyl ether and ethane,or their mixture[J]. Ecotoxicology,2013,22(7): 1101-1110.
[23] HAN Y,LIU T,WANG J,et al. Genotoxicity and oxidative stress induced by the fungicide azoxystrobin in zebrafish (Danio rerio) livers[J]. Pesticide Biochemistry & Physiology,2016,133: 13.
[24] 龚春梅,庄志雄. 浅议毒物兴奋效应[J]. 中山大学研究生学刊(自然科学与医学版),2007(4): 24-34.
[25] 葛会林,罗金辉,智霞,等. 环境中的抗生素与毒物兴奋效应综述[J]. 热带作物学报,2015,36(9): 1719-1726.
[26] 韩倩,张丽娟,胡国成,等. 十溴二苯乙烷对草鱼幼鱼肝脏和肌肉组织氧化应激效应的影响[J]. 生态毒理学报,2016,11(2): 680-686.
[27] ELSAYED Y,ABDEL-WAHAB A W,NASSER A A,et al. Histopathological alterations in the liver and intestine of Nile tilapia Oreochromis niloticus exposed to long-term sublethal concentrations of cadmium chloride[J]. Chinese Journal of Oceanology and Limnology,2015,33(4): 846-852.
[28] 杨涛,陈海刚,蔡文贵,等. 菲胁迫对红鳍笛鲷急、慢性毒性效应的研究[J]. 水产学报,2011,35(2): 298-304.
[29] MCCORD J M,FRIDOVICH I. Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein)[J]. Journal of Biological Chemistry,1969,244(22): 6049-6055.
[30] 沈洪艳,吴志刚,高吉喜,等. 抗生素药物环丙沙星对锦鲤抗氧化系统的毒性作用[J]. 安全与环境学报,2014,14(3): 328-333.
[31] 黄长江,胡晓蓉,董巧香. 苯并[a]芘对罗非鱼肝脏抗氧化防御系统的影响[J]. 汕头大学学报(自然科学版),2006,21(4): 51-56.
[32] 张薇,宋玉芳,孙铁珩,等. 菲和芘对蚯蚓(Eisenia fetida)细胞色素P450和抗氧化酶系的影响[J]. 环境化学,2007,26(2): 202-206.
[33] 程元恺. 谷胱甘肽的解毒作用与毒性代谢物[J]. 生物化学与生物物理进展,1994,21(5): 395-399.
[34] POTTER D W,TRAN T B. Apparent rates of glutathione turnover in rat tissues[J]. Toxicology & Applied Pharmacology,1993,120(2): 186-192.
[35] 李琳,冀秀玲,谢琳琳. 六溴环十二烷单一及与多溴联苯醚复合暴露对发育期大鼠抗氧化系统的影响[J]. 安全与环境学报,2013(2): 5-8.
[36] 冯涛,郑微云,陈荣. 苯并[a]芘对大弹涂鱼肝脏和卵巢还原型谷胱甘肽含量影响的比较研究[J]. 海洋环境科学,2001,20(1): 12-15.
