猪伪狂犬病病毒灭活疫苗工艺研究
2018-05-31李洪艳巩福丽
李洪艳,巩福丽
(哈药集团生物疫苗有限公司,哈尔滨 150069)
目前,猪伪狂犬病病毒灭活疫苗的生产主要是转瓶细胞培养的传统培养方式,进而增殖猪伪狂犬病病毒[1-2]。但转瓶培养细胞增殖较缓慢且生产过程中对细胞和病毒培养条件,如pH、溶氧、糖耗等难以监控和适时补给,无法提供最佳的培养条件,造成该方法自动化程度低、劳动强度大,并因为转瓶细胞培养环境的不可控性,导致产品质量稳定性不够,批间差较大。另外提高病毒毒价,保证良好的临床效果是解决猪伪狂犬病病毒灭活疫苗产业化的当务之急。而用生物反应器替代转瓶生产疫苗株则克服了上述不足,成为前景最好的猪伪狂犬病病毒灭活疫苗生产技术之一[3-5]。
1 材料与方法
生物反应器:美国Wave Biotech公司WAVE波浪生物反应器;微载体:Cytodex-1(美国通用电气医疗集团生命科学部);猪伪狂犬病病毒:购自中国兽医药品监察所。
1.1 细胞复苏培养
用方瓶培养从液氮罐中复苏的ST细胞,培养条件为:pH 7.2,温度37℃,培养48~72 h,形成良好细胞单层时,用于继续传代或接种于生物反应器中进行微载体悬浮培养。该过程中使用的培养基为MEM,血清为胎牛血清,使用量为8%。
1.2 微载体处理
按培养的终体积称取微载体适量,用无Ca2+、Mg2+-PBS室温浸泡过夜,弃去PBS,再用无Ca2+、Mg2+-PBS洗1次,弃去,最后加入无Ca2+、Mg2+-PBS高压灭菌。115℃、10 psi、15 min。
1.3 微载体培养
用EDTA-胰酶细胞消化液制备细胞悬液,细胞计数后按2×105个·mL-1的密度接种到细胞培养袋中进行培养。培养的方法参数为:微载体浓度为2 g·L-1、DO值50%、温度37℃、摆动角度7°摆动速度16 r·min-1。在培养过程中监控细胞培养袋中葡萄糖的消耗以及乳酸和氨的产生,同时在不同的节点上细胞计数(Cytodex1上的细胞计数先用PBS漂洗2次,经0.1%结晶紫的柠檬酸溶液染色,用血球计数板计数细胞核),当细胞的密度达到1×106~2×106个·mL-1时开始灌注,依据细胞的密度、葡萄糖的消耗以每天灌注0.7~2个工作体积的速度,以维持细胞的生成。
1.3.1 细胞接种密度的确定
当微载体的用量为2 g·L-1,分别以5×104、1×105、2×105、3×105、4×105、5×105、6×105个·mL-1的接种密度接种ST细胞,每天取样分析。不同接种密度细胞生长情况见表1。

表1 不同接种密度细胞生长情况 个·mL-1
由表1可知,当微载体含量相等,不同的接种密度对ST细胞生长影响较大。以5×104、1×105个·mL-1接种时,接种后5 d仍在缓慢生长,没有进入稳定生长期的明显标志;以2×105、3×105、4×105、5×105、6×105个·mL-1接种时,ST细胞在接种后第2 d进入稳定生长期;从表1的数据的可知,随着细胞接种密度的增高,ST细胞生长速度的增加并不与细胞接种密度增加保持同步;当ST细胞接种密度为2×105个·mL-1时,ST细胞在第4和5天后的生长速度要明显高于其他接种密度的生长速度,因此,优选采用2×105个·mL-1的接种量接种ST细胞。
1.3.2 微载体含量的确定
细胞接种密度与微载体含量对细胞生长的影响密切相关,其中重要的标志是接种时要保证合适的细胞密度与载体的比例关系。
在每g微载体接种相同ST细胞数的前提下,考察Cytodex 1含量为1、2、3、4、5、6、7和8 g·L-1时ST细胞生长情况,用来确定合适的载体用量。不同微载体含量细胞生长情况见表2。
由表2可知,随着微载体含量的增加,ST细胞密度会有所增加,但ST细胞扩增倍数有所降低。微载体含量为2 g·L-1时,ST细胞生长较快,培养时间为5 d时,ST细胞密度达到了1.68×107g·L-1,高于其他的微载体的细胞密度;此外,当微载体含量>2 g·L-1时,ST细胞生长的增加速度不显著。因此,在细胞培养袋中培养ST细胞时,所加入的微载体的含量优选为2 g·L-1。因此综合考虑,本试验微载体含量采用2 g·L-1。
1.3.3 摇动条件的确定
以2 g·L-1的含量加入微载体,以2×105个·mL-1密度接种ST细胞,加入细胞培养基培养,摆动角度分别为5、6、7、8、9°;摆动速度分别为12、14、16和18 r·min-1,每d取样,观察微载体上细胞吸附和生长情况,考察摇动条件对细胞培养的影响。不同摇动条件下细胞生长情况见表3。

表2 不同微载体含量细胞生长情况 个·mL-1

表3 不同摇动条件下细胞生长情况 个·mL-1
由表3可知,整个培养过程,摇动条件对细胞的密度影响较大。结果表明,当摇动条件为摆动角度7°、摆动速度16 r·min-1时,在此摇动条件下细胞的生长速度要远高于其他的摇动条件。因此,摇动条件优选为摆动角度7°、摆动速度16 r·min-1。
1.4 病毒液的增殖
当细胞培养到达第4天时沉降微载体,排出细胞培养袋中液体,加入PBS洗涤细胞,重复洗涤3次,加入病毒维持液并接种猪伪狂犬病病毒,其中病毒接种剂量为3%、病毒增殖的培养基为含1%血清的MEM,pH 7.4,温度35℃。接毒后每隔一定时间取生物反应器中的微载体,用显微镜观察细胞病变情况,并检测样品TCID50,当微载体上的细胞大部分脱落,停止培养,收获病毒液,于-20℃冻融两次,得到猪伪狂犬病病毒液。
1.4.1 病毒含量的测定
利用TCID50方法进行病毒含量的测定。病毒TCID50测定时,以MEM培养液将培养得到的猪伪狂犬病毒液作连续10倍稀释,即10-1、10-2……10-8,每个稀释度取100 μL加入96孔细胞培养板的孔中,随后加入经胰蛋白酶-EDTA消化分散的ST细胞悬液,每孔100 μL(细胞含量约3×105·mL-1为宜),每个稀释度作8个重复,并设正常细胞培养对照,置5%CO2培养箱中,37℃培养,逐日观察细胞病变和对照,共观察2~4 d,并记录细胞病变的孔数,Reed-Muench法计算病毒的TCID50。同时以相同的方法对用转瓶培养的猪伪狂犬病毒液进行TCID50测定。以此作为对照组。
2 试验结果
2.1 猪伪狂犬病病毒病毒含量
猪伪狂犬病病毒病毒含量见表4。
由表4可知,利用生物反应器培养的猪伪狂犬病毒液病毒含量不小于转瓶培养的猪伪狂犬病毒液病毒含量。由此可见利用生物反应器培养的病毒要明显优于转瓶培养的病毒。
2.2 病毒维持液血清浓度的确定
分别选择0.5%、1%、1.5%、2%血清浓度维持液,培养结束后,分别对含毒细胞培养液的病毒含量进行测定,以确定最佳血清浓度的维持液。不同血清浓度维持液对病毒增值的影响见表5。

表4 猪伪狂犬病病毒含量
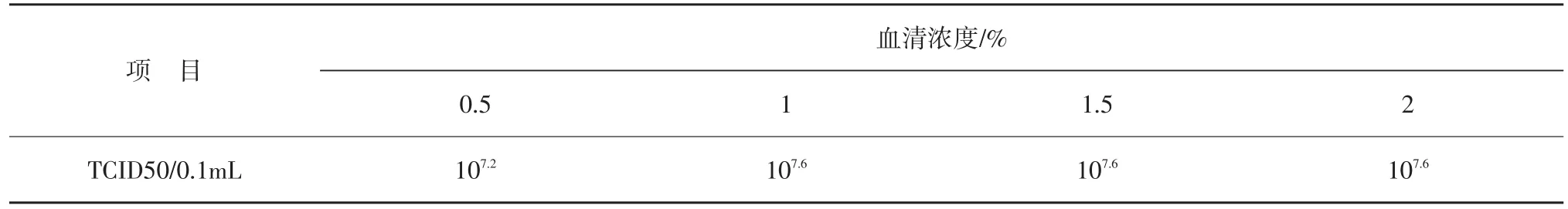
表5 不同血清浓度维持液对病毒增殖的影响
由表5可知,血清浓度对病毒的增值有一定影响,当血清浓度为1%时,病毒含量为107.6TCID50/0.1 mL,明显高于血清浓度为0.5%时的病毒含量。因此选择血清浓度为1%的维持液培养病毒。
2.3 病毒液灭活及乳化制成疫苗
收获病毒液用二乙烯亚胺(BEI)灭活,BEI终浓度0.03%,30℃灭活72 h。灭活后的猪伪狂犬病毒液加入常规油性佐剂,搅拌混匀,制得油乳剂疫苗。
2.4 疫苗的安全性试验
试制3批疫苗,接种约18 g小白鼠10只,接种0.3 mL·只-1,观察14 d;接种初生仔猪、断奶仔猪及妊娠母猪,2 mL·头-1,超剂量接种10 mL·头-1,接种后未见对生殖功能有任何影响,体温、进食、配种、妊娠、产仔均正常。试验结果表明,灭活疫苗安全性良好。
2.5 疫苗免疫原性比较
取猪伪狂犬病毒血清中和抗体阴性的断奶仔猪30头,分为3组,10头·组-1,组1免疫接种试制猪伪狂犬病灭活疫苗,肌肉注射,3 mL·头-1;组2免疫接种传统转瓶制备的猪伪狂犬病灭活疫苗,肌肉注射,3 mL·头-1。组3为非免疫对照。接种疫苗后观察6个月,分别于接种疫苗后的7、14、21、30、90、120、150及180 d,采血,测定血清中猪伪狂犬病毒中和指数,比较两种疫苗的抗体消长规律及免疫持续时间。接种疫苗后猪伪狂犬病毒血清抗体中和指数测定结果见表6。

表6 接种疫苗后猪伪狂犬病毒血清抗体中和指数测定结果
免疫接种6个月后,3个试验组均用相同剂量的猪伪狂犬病病毒强毒株攻击,灭活疫苗对猪伪狂犬病病毒强毒攻击的免疫保护力见表7。
由表7可知,反应器苗免疫猪血清中和抗体于免疫后14 d>316,于30 d>1 000,之后抗体水平开始下降,于180 d进行强毒攻击,保护率为100%;转瓶苗免疫猪血清中和抗体于免疫后21 d>316,于30 d<1 000,于180 d进行强毒攻击,保护率为80%,由此可以得出,反应器所制备的灭活疫苗对于猪有良好的免疫保护效果,且免疫保护效力要显著优于传统转瓶制备的灭活疫苗对猪的免疫保护效力。

表7 灭活疫苗对猪伪狂犬病病毒强毒攻击的保护力
[1] 陈焕春,金梅林,何启盖,等.猪伪狂犬病油乳剂灭活疫苗的制备及安全性与免疫性试验[J].畜牧兽医学报,2001,32(1):44-51.
[2] 潘洁,何锡忠,张婉华,等.猪伪狂犬病油乳剂灭活疫苗免疫效力试验[J].上海畜牧兽医通讯,2014(4):61.
[3] 龙晓婷.伪狂犬病毒在潜伏感染猪体内的组织分布[D].武汉:华中农业大学,2007.
[4] 位玉玲.唾液中猪伪狂犬病毒荧光定量PCR和ELISA检测方法的建立与初步应用[D].杭州:浙江农林大学,2017.
[5] 赵丽,崔保安,陈红英,等.实时荧光定量PCR检测伪狂犬病病毒方法的建立与初步应用[J].中国兽医学报,2009,29(4):433-436.
