鸡源大肠杆菌中耐药基因blaCTX-M的水平转移研究
2018-05-31张冬冬王红宁
张冬冬,王红宁
(四川大学生命科学学院,四川省动物疫病预防与食品安全四川省重点实验室,“985工程”西南资源环境与灾害防治科技创新平台,生物资源与生态环境教育部重点实验室,四川 成都 610064)
禽致病性大肠杆菌是规模化鸡场中最常见的病原菌之一,大多数易引起感染性疾病如大肠杆菌性败血症、大肠杆菌肉芽肿(Hjarre氏病)、腹膜炎、气囊病(慢性呼吸道病,CRD)、肿头综合症、输卵管炎、滑膜炎、卵黄囊感染等,最终导致家禽死亡[1]。规模化鸡场中,β-内酰胺类抗生素是治疗肠杆菌引起的感染性疾病的主要药物,由于长期的不规范用药,造成了大量耐药菌的形成。其中,超广谱β-内酰胺酶(ESBLs)是近年来最常见的可以为大肠杆菌提供多种β内酰胺类抗生素耐药性的一类水解酶,分为CTX-M、SHV和TEM等多种变异型。近年来,产CTXM型ESBLs的细菌不仅在畜禽中大量分离出来,在人医临床上造成的耐药性问题也十分突出[2]。blaCTX-M基因通常由质粒携带,因此blaCTX-M基因很容易随着耐药质粒的移动在种内甚至是不同种属细菌间广泛散播,即耐药性的水平传播。
本研究对29株从四川省规模化鸡场中分离到的产CTX-M型ESBLs的大肠杆菌进行了接合试验,并对接合子进行耐药表型和基因型检测,探究产ESBLs鸡源大肠杆菌中耐药基因blaCTX-M的水平转移情况,为临床预防ESBLs的传播提供理论依据。
1 材料与方法
1.1 菌株 29株产ESBLs鸡源大肠杆菌,从四川省内5个规模化鸡场中分离筛选得出;耐利福平的受体菌是大肠杆菌C600,为复旦大学华山医学院王明贵教授惠赠,对其他药物敏感。
1.2 主要试剂 OXOID药敏纸片,LB液体培养基,MH 琼脂,2×Taq Plus PCR MasterMix,GoldView 染料,琼脂糖,DNA Marker 2000 plus,孔径 0.22μm 滤膜,利福平,头孢噻肟干粉。
1.3 产ESBLs鸡源大肠杆菌中blaCTX-M基因的检测 采用煮沸法提取大肠杆菌DNA为模板,按参考文献[3]中blaCTX-M基因检测引物序列(blaCTX-M-1group:F-GGTTAAAAAATCACTGCGTC,R-TTGGTGACGAT TTTAGCCGC;blaCTX-M-9group:F-ATGGTGACAAAGA GAGTGCA,R-CCCTTCGGCGATGATTCTC;blaCTX-M-2group:F-ATGATGACTCAGAGCATTCG,R-TGGGTT ACGATTTTCGCCGC)合成引物,PCR反应体系为25μL:2×Taq Plus PCR MasterMix12.5μL,模板 2μL,去离子水 8.5μL,引物 F、R(10μM)各 1μL。PCR扩增反应条件为:95℃、4min;95℃、30s,55~56℃、30 s,72℃、1min,32次循环;72℃延伸 10min;12℃保存。取5μL PCR产物用1%琼脂糖凝胶电泳检测,将阳性PCR产物送成都擎科公司测序。测序结果利用NCBI的Blast搜索软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析,以确定blaCTX-M的基因亚型。
1.4 接合试验 首先,将29株供体菌接种在含利福平(400μg/mL)的TSA平板上,检测供体菌的利福平抗性。若供体菌有利福平抗性,则不能进行接合转移试验。参考滤膜接合法[4]进行质粒接合转移试验:将筛选出的供体菌和受体菌分别在含头孢噻肟(4μg/mL)和利福平(400μg/mL)的TSA平板上划线,37℃恒温培养过夜;次日挑取供体菌及受体菌的单菌落接种于LB液体培养基中,37℃培养4.5h后,分别用生理盐水稀释1000倍,取50μL受体菌与50μL供体菌于1.5mL离心管中混合;取混合物置于TSA平板内的0.22μm滤膜中央,37℃孵育15h;将滤膜移至5mL无菌离心管中,加入2mL生理盐水,使用振荡器清洗膜上的细菌;取100μL菌悬液涂双抗(头孢噻肟4μg/mL和叠氮钠400μg/mL)TSA平板,同时稀释1000倍涂无抗TSA平板,37℃培养过夜,次日计算菌株接合效率。接合效率=(接合子数目×103)/(0.5×无抗平板菌落数目×106)。
挑取双抗平板上的接合子单菌落,接种于含双抗的LB液体培养基中(含头孢噻肟2μg/mL和叠氮钠200μg/mL),37℃ 180r/min培养过夜,用于后续试验。
1.5 供体菌和接合子的耐药表型及blaCTX-M基因型比较 根据CLSI 2013年的标准,采用K-B纸片扩散法对供体菌和接合子进行10种抗菌药的耐药表型检测,分别为:头孢噻肟(CTX)、阿莫西林-棒酸(AMC)、头孢他啶(CAZ)、阿米卡星(AK)、庆大霉素(CN)、多粘菌素 B(PB)、复方新诺明(SXT)、环丙沙星(CIP)、多西环素(DO)、氟苯尼考(FFC)。接合子blaCTX-M基因的检测方法同1.3。
2 结果与分析

表1 29株产ESBLs大肠杆菌中blaCTX-M基因亚型
2.1 产ESBLs鸡源大肠杆菌中blaCTX-M基因的检测 使用超广谱β-内酰胺酶基因(blaCTX-M-1群、blaCTX-M-9群、blaCTX-M-2群)引物对29株产ESBLs鸡源大肠杆菌的基因组DNA进行PCR扩增,结果(见表1)显示:29株大肠杆菌中,CTX-M型ESBLs的检出率为100%;经测序比对,29株菌中共检测出7种CTX-M基因亚型,其中blaCTX-M-65亚型的数量最多(8个),分离率为27.6%;其次为 blaCTX-M-55(7 个)、blaCTX-M-14(5 个)、blaCTX-M-79(5个)、blaCTX-M-27(2个)、blaCTX-M-15(1个)、blaCTX-M-123(1个)。
2.2 blaCTX-M基因阳性鸡源大肠杆菌质粒的接合试验 试验结果显示,受体菌和供体菌在双抗选择培养基上均无菌落生长。29株产ESBLs鸡源大肠杆菌与大肠杆菌C600接合,经TSA双抗平板(400 μg/mL利福平和4μg/mL头孢噻肟)筛选,共获得11株接合子,接合转移发生率为37.9%(11/29);29株菌的接合效率均在10-5~10-3之间(见表2)。
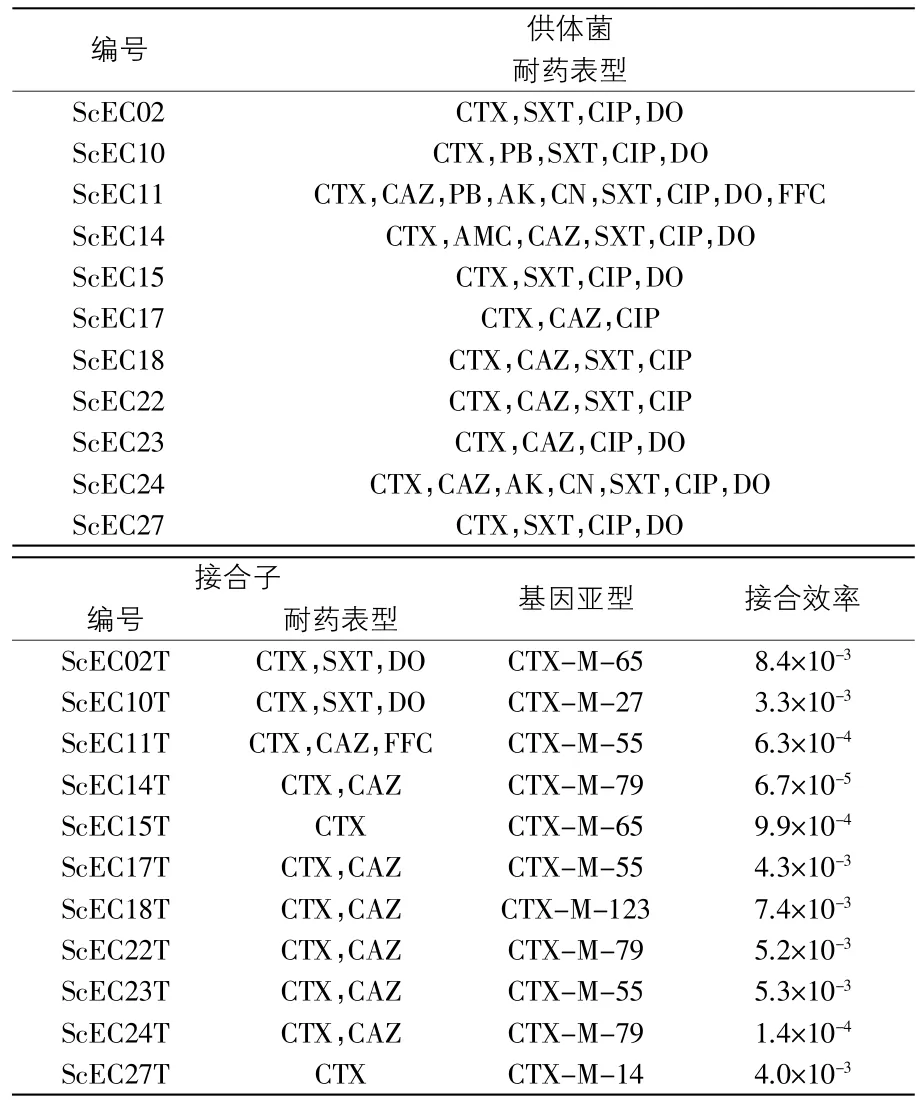
表2 供体菌和接合子的耐药表型及blaCTX-M基因型比较、接合效率
2.3 供体菌和接合子的耐药表型及blaCTX-M基因型比较 对11株接合成功的大肠杆菌进行10种抗菌药物的耐药表型检测,结果显示:所有的接合子均对头孢噻肟(CTX)有耐药性,部分接合子对头孢他啶(CAZ)、复方新诺明(SXT)、多西环素(DO)、氟苯尼考(FFC)中的一种或几种具有耐药性;11株接合子中有3株接合子为多重耐药菌;与供体菌相比,100%接合子的耐药谱变窄(表2)。
以筛选出的接合子总DNA为模板,对耐药基因blaCTX-M进行PCR扩增、测序比对,结果显示:接合子的CTX-M基因型与相应供体菌一致,表明该耐药基因确实是通过质粒转移水平传播的。
3 讨论
近年来畜牧养殖业中超广谱β-内酰胺类抗菌药的大量使用已成为普遍现象[5],食品动物源产ESBLs的革兰氏阴性菌大量增加。目前CTX-M是全球分布最广泛的ESBL,不仅在人类,而且在动物和环境中都广泛流行。本研究从四川各地规模化鸡场分离到29株产ESBLs的大肠杆菌,均为blaCTX-M基因阳性,绝大部分属于4种基因亚型:blaCTX-M-65型、blaCTX-M-55型、blaCTX-M-14型和 blaCTX-M-79型。
接合转移是DNA水平传播的最主要的机制之一,在耐药基因的传播中具有重要作用。本研究中11株鸡源大肠杆菌的blaCTX-M耐药基因可以通过接合水平转移,导致耐药基因传播,而且接合成功率和接合效率均较高。另外18株菌不能通过接合传递,表明这些耐药基因可能存在于染色体上,也可能存在于某些不能在同种或不同种属细菌间接合转移的质粒上。由药敏试验结果可知,11株接合子中有3株为多重耐药菌,对其他类型抗菌药也表现出了耐药性,提示耐这些药物的基因也随着含有blaCTX-M的接合性质粒而传递,这些耐药基因很可能位于同一质粒上。
在规模化鸡场,用于治疗大肠杆菌引发呼吸道感染的抗菌药中,只有氨基糖苷类抗菌药和β-内酰胺类抗菌药中的头孢菌素能有效治疗。用于治疗大肠杆菌感染的抗菌药种类有限,必然会对鸡体内的大肠杆菌长期施加相对单一的抗生素选择压力,进而导致大肠杆菌分离株中出现大量的抗β-内酰胺类药物的菌株。近几年产blaCTX-M菌株的分离率逐渐升高,就是由于blaCTX-M可以通过接合在不同菌株间传播,以及β-内酰胺类抗生素的选择压力所致。动物源耐药菌的增多,不仅增加了临床上治疗用药的难度,而且有传播到人类呼吸道及肠道的潜在威胁。因此,对质粒介导耐药基因的水平传播进行监测,对于严格规范抗菌药使用、减少多重耐药菌出现具有重要意义。
[1]李永清,甘孟侯.禽大肠杆菌病防制研究进展[J].中国兽医学报,2000,20(4):414-416.
[2]常洪美.2005~2008年临床常见细菌耐药性分析[J].现代预防医学,2009,36(19):3718-3720.
[3]Eckert C,Gautier V,Saladin-Allard M,et al.Dissemination of CTX-M-type β-lactamases among clinical isolates of Enterobacteriaceae in Paris,France[J].Antimicrobial Agents and Chemotherapy,2004,48(4):1249-1255.
[4]Clewell D B,An F Y,White B A,et al.Sexpheromones and plasmid transfer in Streptococcus faecalis:apheromone,cAM373,which is also excreted by Staphylococcus aureus[J].Basic Life Sciences,1985,30(5):489-503.
[5]应永飞.滥用兽药是自毁养殖“长城”——畜禽产品的兽药残留问题及其解决对策[J].中国动物保健,2008(3):21-26.
