高活性云芝α-半乳糖苷酶发酵培养基的优化*
2018-05-31吴亚召张文隽王贺祥
雷 萍,吴亚召,张文隽,杜 芳,**,王贺祥
(1.陕西省微生物研究所,陕西 西安710043;2.农业生物技术国家重点实验室,中国农业大学生物学院,北京 100193)
α-半乳糖苷酶(α-Galactosidase,α-Gal)又称蜜二糖酶、α-半乳糖苷键水解酶,可水解非还原性末端以α-1,6键结合的半乳糖苷健,因此可水解含有α-半乳糖苷键的杂多糖和棉籽糖、水苏糖、蜜二糖等低聚糖[1]。α-半乳糖苷酶可以降解不溶性低聚糖,提高豆类制品的代谢能力,消除胀气,还可改造并改变药物理化性质,增加药物稳定性等,因此被广泛应用于饲料业、食品业、制药业和科学研究等领域[2]。
α-半乳糖苷酶普遍存在于人、动物、植物和微生物中,其中由于微生物具有分布广、种类多、生长快等优点成为生产α-半乳糖苷酶的主要目标[3]。上世纪70年代末期我国学者对微生物产α-半乳糖苷酶及其酶学特性开始进行研究,目前已筛选出多株产α-半乳糖苷酶活性的微生物菌种,并制备分离出越来越多的纯化酶,取得了较大进展。有研究学者从多种大型真菌子实体和发酵液中检测并分离到高活性的α-半乳糖苷酶[4]。云芝(Coriolus versicol-or)是珍贵的药用真菌,具有提高免疫、抗肿瘤、降血糖等药用价值。我们在云芝子实体中检测到高活性α-半乳糖苷酶的存在,但是子实体生成周期较长,提取成本增加,因此利用发酵法生产云芝α-半乳糖苷酶成为1种有效途径。本研究拟对云芝发酵生产高活性α-半乳糖苷酶的诱导剂和发酵培养基进行研究,为更进一步开发应用α-半乳糖苷酶提供试验理论依据。
1 材料和方法
1.1 供试菌株
云芝菌种由陕西省微生物研究所微生物资源中心第三研究室提供。
1.2 培养基
1.2.1 母种培养基
综合PDA培养基。
1.2.2 液体种子培养基
豆粕粉2%、磷酸二氢钾0.1%。
1.2.3 诱导物筛选基础培养基
蛋白胨2%、磷酸二氢钾0.5%,去离子水100mL。
1.2.4 液体发酵基础培养基
豆粕粉6%、磷酸二氢钾0.1%、硫酸镁0.1%。
1.2.5 液体发酵培养基
豆粕粉2%、半乳糖1%、磷酸二氢钾0.05%、硫酸镁0.1%。
1.3 方法
1.3.1 种子液制备
按1.2.2配方配制种子液培养基,采用250 mL三角瓶装入50 mL种子液,加入10粒~15粒玻璃珠,高压灭菌后接入云芝试管菌种,于摇床培养6d,培养条件为振荡频率180 r·min-1,温度26℃。
1.3.2 诱导物筛选试验
在诱导物筛选基础培养基中分别添加葡萄糖2%、蔗糖2%、半乳糖2%、棉籽糖2%、豆粕粉6%、玉米粉6%,高压灭菌后接入云芝试管菌种,于摇床培养,振荡频率180 r·min-1,温度26℃。每天取样进行发酵液中α-半乳糖苷酶活性的测定。
1.3.3 碳源筛选试验
在液体基础发酵培养基中分别加入0.5%、1%、2%三个含量的葡萄糖、蔗糖、半乳糖、玉米粉、棉籽糖,高压灭菌后接入3%的种子培养液,于摇床培养,振荡频率180 r·min-1,温度26℃。重复3次,以基础培养基为对照。
1.3.4 氮源筛选试验
在液体基础发酵培养基中分别加入4%、6%、8%三个含量的蛋白胨、酵母粉,0.4%、0.8%、1.2%三个含量的硝酸钠、硝酸铵、硫酸铵,高压灭菌后接入3%的种子培养液,于摇床培养,振荡频率180r·min-1,温度26℃。重复3次,以基础培养基为对照。
1.3.5 无机盐筛选试验
在只含有6%豆粕粉的液体基础发酵培养基中分别加入0.05%、0.1%和0.2%三个含量的硫酸镁、磷酸二氢钾、氯化钙、硫酸铁,高压灭菌后接入3%的种子培养液,于摇床培养,振荡频率180 r·min-1,温度26℃。重复3次,以基础培养基为对照。
1.3.6 正交优化试验
根据单因素筛选试验结果,对筛选出的豆粕粉(A)、半乳糖(B)、硫酸镁(C)和磷酸二氢钾(D)进行四因素三水平正交优化试验,见表1。
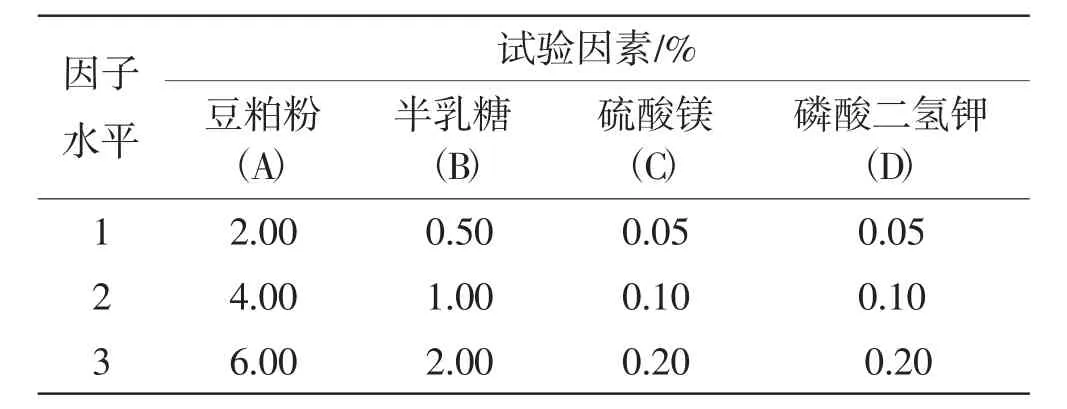
表1 L9(34)正交试验的因素及水平Tab.1 Factors and their levels in L9(34)orthogonal test
1.3.7 α-半乳糖苷酶活性的测定
吸取0.1 mL适当稀释后的粗酶液,再加入同体积的10 mmol·L-1对硝基苯基α-D-吡喃半乳糖苷作为底物,在40℃恒温条件下振荡反应10 min,再加入0.5 mol·L-1Na2CO3溶液0.8 mL振荡混匀,在405nm波长处测定吸光值。
酶活力单位定义:在一定条件下,每分钟生成1 μmol对硝基苯酚的酶量为一个酶活力单位[5]。
2 结果与分析
2.1 不同诱导物对云芝发酵液产酶的影响
不同诱导物对云芝发酵产α-半乳糖苷酶的影响情况见图1。
由图1可以看出,以豆粕粉为诱导物时,培养至第7天在发酵液中检测到α-半乳糖苷酶,酶活性为38.78 U·mL-1,第13天时酶活性迅速增至180.71 U·mL-1,培养至第14天酶活性达到最大值213.73 U·mL-1;以玉米粉为诱导物时,发酵初期检测不到α-半乳糖苷酶的活性,培养至第11天时检测到酶活性仅为28.17 U·mL-1,继续发酵到第15天时酶活性达到最大值73.98 U·mL-1;以棉籽糖为诱导物时,培养至第14天时才检测到α-半乳糖苷酶的活性,为32.82 U·mL-1,第 16 天时酶活性为 83.94 U·mL-1;以葡萄糖、半乳糖和蔗糖为诱导物时,直至发酵至第16天时才检测到α-半乳糖苷酶,但活性均较低,分别为 9.21 U·mL-1、13.38 U·mL-1和 8.24 U·mL-1。因此,云芝发酵生产α-半乳糖苷酶的最佳诱导物为豆粕粉。
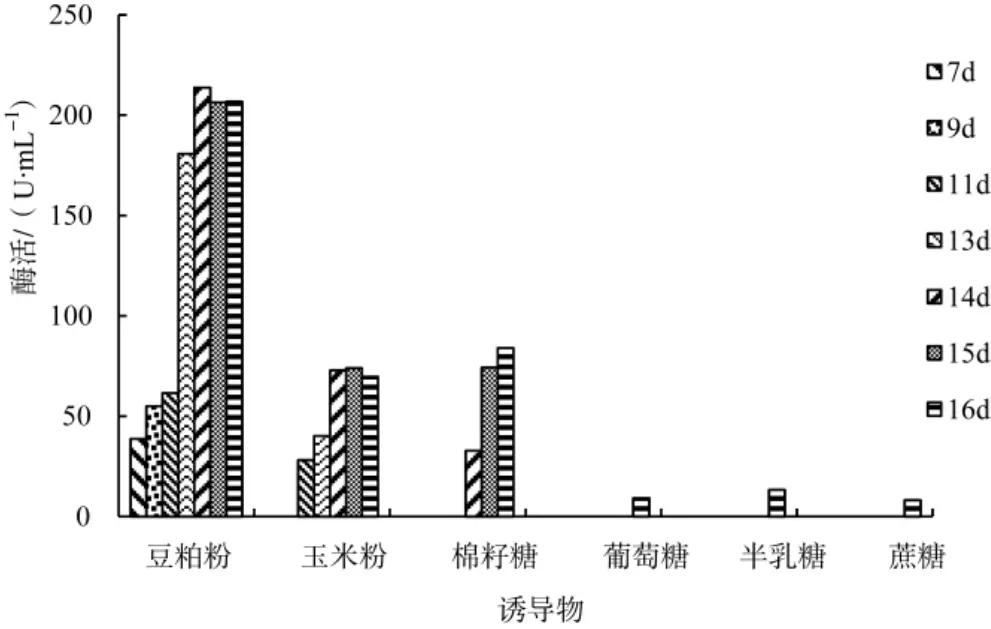
图1 诱导物对α-半乳糖苷酶发酵的影响Fig.1 Effect of different inducer sources on the α-galactosidase fermentation
2.2 不同碳源对云芝发酵液产酶的影响
不同碳源对云芝发酵产α-半乳糖苷酶的影响情况见图2。

图2 碳源对α-半乳糖苷酶发酵的影响Fig.2 Effect of different carbon sources on the α-galactosidase fermentation
从图2可以看出,添加0.5%半乳糖对发酵液中α-半乳糖苷酶活性的影响最大,酶活性达到259.40 U·mL-1,高于对照培养基(222.50 U·mL-1),添加0.5%蔗糖时发酵液中酶活性为212.00 U·mL-1,低于对照培养基;随着半乳糖和蔗糖浓度的增加,酶活均随之降低;添加葡萄糖、棉籽糖和玉米粉对发酵产α-半乳糖苷酶没有促进作用。因此,云芝发酵生产α-半乳糖苷酶的最佳碳源为半乳糖。
2.3 不同氮源对云芝发酵液产酶的影响
不同氮源对云芝发酵产α-半乳糖苷酶的影响情况见图3。
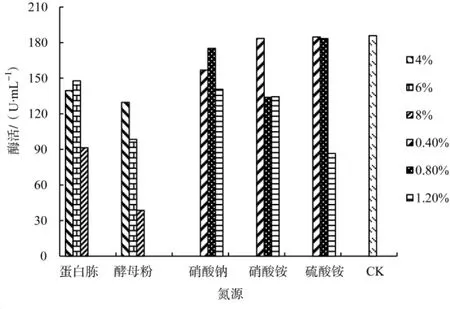
图3 氮源对α-半乳糖苷酶发酵的影响Fig.3 Efect of different nitrogen sources on the α-galactosidase fermentation
从图3可以看出,添加的几种氮源均使发酵液中α-半乳糖苷酶酶活性低于对照培养基(185.9 U·mL-1),尤其是添加8%酵母粉时酶活性降至38.67 U·mL-1,而且同一种氮源随着浓度的升高,产α-半乳糖苷酶的能力也随之降低。因此,云芝发酵生产α-半乳糖苷酶的培养基中不需要额外添加氮源,诱导物豆粕粉在诱导α-半乳糖苷酶产生的同时,也作为有机氮源为其生长提供营养。
2.4 不同无机盐离子对云芝发酵液产酶的影响
不同无机盐离子对云芝发酵产α-半乳糖苷酶的影响情况见图4。

图4 无机盐离子对α-半乳糖苷酶发酵的影响Fig.4 Effect of different ions on the α-galactosidase fermentation
从图4可以看出,添加0.05%MgSO4和0.1%KH2PO4对发酵液中α-半乳糖苷酶的产生有促进作用,酶活均高于对照培养基(187.96 U·mL-1),分别为197.26 U·mL-1和196.93 U·mL-1,且差异不明显;添加任何浓度的CaCl和FeSO4均不利于α-半乳糖苷酶的产生,酶活性均低于对照培养基。因此,云芝发酵生产α-半乳糖苷酶的无机盐应选取硫酸镁和磷酸二氢钾。
2.5 正交试验优化培养基的结果与直观分析
L9(34)正交试验优化培养基的结果分析见表2。
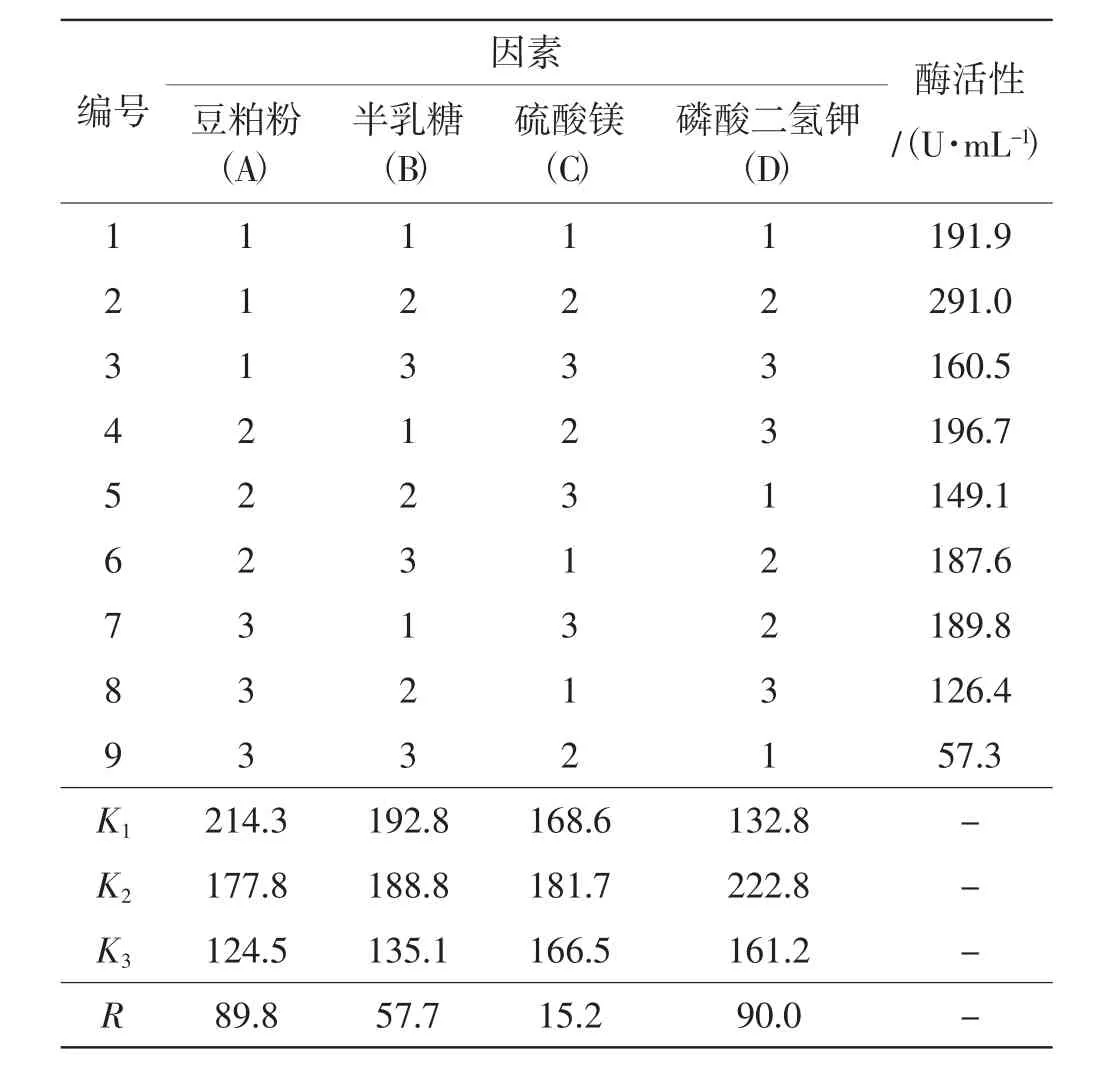
表2 L9(34)正交试验结果直观分析表Tab.2 Intuitive analysis table for the result of L9(34)orthogonal test
从极差分析结果可以看出,各因素影响云芝发酵产α-半乳糖苷酶能力的顺序依次为:D>A>B>C,其中影响最为显著的是MgSO4,其次是豆粕粉和半乳糖,KH2PO4影响不显著。从表中还可以看出,正交试验优水平组合A1B1C2D2为最优组合,即优化后的云芝发酵培养基为:豆粕粉2%、半乳糖0.5%、KH2PO40.1%、MgSO40.1%。以优化获得的培养基进行发酵培养8 d,重复3次,发酵液中α-半乳糖苷酶的酶活性平均值为301.6 U·mL-1,表明此配方合理,达到了优化培养基的目的。
3 结论
通过单因素筛选试验确定了云芝发酵产α-半乳糖苷酶的最佳诱导物为豆粕粉,以其作为发酵培养基固定组成,进一步试验发现发酵产酶的最佳碳源为半乳糖,诱导物豆粕粉起到氮源的作用为其生长提供营养,不需要额外添加氮源物质,无机盐宜选取 MgSO4和 KH2PO4。
通过L9(34)正交试验优化云芝发酵产α-半乳糖苷酶的培养基,确定最优培养和组合为:豆粕粉2%、半乳糖0.5%、KH2PO40.1%、MgSO40.1%,发酵培养8 d,酶活性可达301.6 U·mL-1。
参考文献:
[1]杜芳.鸡枞菌和云芝中α-半乳糖苷酶的研究[D].北京:中国农业大学,2014.
[2]杨冠东,刘芳,李荷.饲用α-半乳糖苷酶的研究进展概况[J].现代食品科技,2006,22(3):275-179.
[3]郝桂娟,张凯,王学智,等.α-半乳糖苷酶的研究进展[J].中国畜牧兽医,2013,40(3):149-154.
[4]Ramalingam,Saraswathy N,Sadasivam S,et al.Purification and properties of alpha-galactosidase from white-rot fungus Pleurotus florida [J].Indian Journal of Biochemistry&Biophysics,2007,44(2):76-81.
[5]Rezessy-Szabó JM,Nguyen QD,Hoschke Á,et al.A novel thermostable α-galactosidase from the thermophilic fungus Thermomyces lanuginosus CBS 395.62/b:Purification and characterization[J].Biochimica Et Biophysica Acta General Subjects,2007,1770(1):55-62.
