三孢布拉霉产β-胡萝卜素的抗氧化活性动力学研究
2018-05-30王莹曲蕙名赵博纪晓彤刘可春楚杰
王莹,曲蕙名,赵博,纪晓彤,刘可春,楚杰,*
(1.齐鲁工业大学(山东省科学院)山东省科学院生物研究所,山东济南250103;2.山东师范大学生命科学院,山东济南250014)
体内自由基在信号传导等方面具有一定功能,但过多的自由基易导致人体细胞损伤,从而引发癌症、肿瘤等疾病[1-3]。β-胡萝卜素广泛存在于蔬菜、水果中[4],可以清除人体内的自由基,是一类重要的天然抗氧化剂,能够有效提高机体的免疫功能[5-8]。三孢布拉霉发酵法是目前国际上大规模生产天然β-胡萝卜素的最佳方法,改进发酵和提取工艺能够有效提高β-胡萝卜素含量[9-12]。目前,对来源于微生物发酵β-胡萝卜素的主要研究集中在提高产量方面,缺乏对其抗氧化动力学的系统研究,而动力学研究是对β-胡萝卜素抗氧化活性机理研究的前提基础[13]。因此,对三孢布拉霉产β-胡萝卜素抗氧化活性动力学研究具有重要意义。
本文采用DPPH法测定从三孢布拉霉菌株中提取的β-胡萝卜素清除自由基的活性,进而通过计算获得相应动力学参数,确定不同质量浓度的β-胡萝卜素在不同的反应温度和反应时间条件下清除DPPH自由基能力的变化,为下一步对β-胡萝卜素抗氧化活性的研究奠定基础。
1 材料与方法
1.1 材料与试剂
三孢布拉霉(Blakeslea trispora)正(+)菌株、负(-)菌株:山东省科学院生物所工业微生物科室保藏。
β-胡萝卜素标准品:Sigma公司;1,1-二苯基-2-三硝基苯肼(DPPH):梯希爱(上海)化成发展有限公司;无水乙醇、石油醚等试剂均为国产分析纯;试验用水为超纯水。
种子培养基:玉米粉2.5%,黄豆粉5%,VB10.000 5%。发酵培养基:玉米粉1.8%,葡萄糖0.48%,黄豆粉3.00%,玉米浆粉0.075%,MgSO4·7H2O 0.10%,KH2PO40.2%,植物油5%。
1.2 仪器与设备
UNICO UV-2100紫外分光光度计:上海贺德实验设备有限公司;CS601电热恒温水浴锅:上海博迅实业有限公司;LE204E/02电子天平:梅特勒托利多集团;N-1110V-WD旋转蒸发仪:东京理化器械株式会社;FD-1冷冻干燥机:北京德天佑科技发展有限公司;HZQ-QX温控摇床:哈尔滨市东联电子技术开发有限公司;DNP-9082恒温恒湿培养箱:上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 三孢布拉霉菌株发酵产β-胡萝卜素
在无菌条件下,从斜面保存的三孢布拉霉原始正、负菌株取一定大小的菌苔,分别置于内装25 mL种子培养基的灭菌后的250 mL锥形瓶中,27℃,180 r/min,摇床培养,其中负菌培养60 h,正菌培养48 h。而后,将正负菌株同时转接到内装50 mL发酵培养基的500 mL锥形瓶中,转接正、负菌株菌种比例为1∶4,27℃,180 r/min,摇床培养120 h。
1.3.2 β-胡萝卜素提取及含量测定
将β-胡萝卜素标准品溶解于乙酸乙酯,分别配制浓度为 0、1、2、4、8、16、32、64 μg/mL 样品,使用分光光度计于450 nm处测定吸光值,绘制标准曲线。
收集发酵菌液,离心去除上清,菌体蒸干水分,准确称量,按照参考文献[14]方法进行提取,测定450 nm吸光值,通过标准曲线计算β-胡萝卜素含量,备用。
1.3.3 β-胡萝卜素抗氧化活性动力学参数测定
配制质量浓度分别为 80、100、120、140、160 μg/mL的β-胡萝卜素溶液,并称取DPPH 0.019 7 g,用无水乙醇溶解并定容至50 mL作储备液。取DPPH储备液10 mL稀释成100 μmol/L DPPH自由基工作液(现配现用)。将1 mL样品与3 mL 100 μmol/L DPPH自由基工作液混匀,分别在37℃和25℃下反应不同时间,于517 nm波长处测定吸光度。以DPPH自由基清除率(α)和半数效应浓度EC50评估β-胡萝卜素样品清除自由基的能力,按下式计算DPPH自由基清除率。
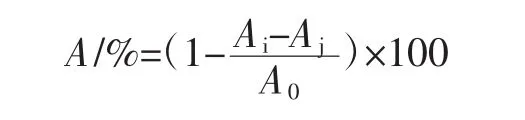
式中:A为DPPH自由基清除率,%;Ai为加入β-胡萝卜素时溶液的吸光度;Aj为β-胡萝卜素溶液在测定波长处的吸光度;A0为未加β-胡萝卜素时溶液的吸光度。
1.3.4 数据处理
运用SPSS软件进行统计分析,所有试验均重复3次。
2 结果与讨论
2.1 三孢布拉霉菌株发酵产β-胡萝卜素
三孢布拉霉,有正菌和负菌两种菌,负菌产β-胡萝卜素能力强,正菌产β-胡萝卜素能力弱,正菌和负菌一起融合后,产生三孢酸,诱导β-胡萝卜素合成。负菌为主要的生产菌,而正菌在β-胡萝卜素合成过程中起着一定的诱导作用。相对正菌,负菌更容易退化。因此,以三孢布拉霉负菌为出发菌株,进行定向传代选育。
将待筛选的三孢布拉霉负菌与正菌进行混合培养,摇瓶发酵,生产β-胡萝卜素。通过分步提取,获得纯度较高的β-胡萝卜素。通过标准曲线测定β-胡萝卜素含量,计算所得产量,如表1所示。

表1 不同菌株β-胡萝卜素产量对比Table 1 The yield of β-carotene from different strains
根据试验结果,4号菌株菌体干重为66.23 g/L,β-胡萝卜素生物合成量为2.44 g/L,在筛选菌种中为最优,因此挑选三孢布拉霉负菌4号菌株为最终目标菌株,与正菌混合培养发酵。同时,优化发酵条件,通过加入不同剂量的植物油使菌株菌丝分散,加速菌株生长繁殖。确定最终种子培养基和发酵培养基配方,获得菌株后,通过提取,获得β-胡萝卜素,取部分样品进行含量测定,其余备用。
2.2 反应温度及β-胡萝卜素质量浓度对β-胡萝卜素抗氧化活性的影响
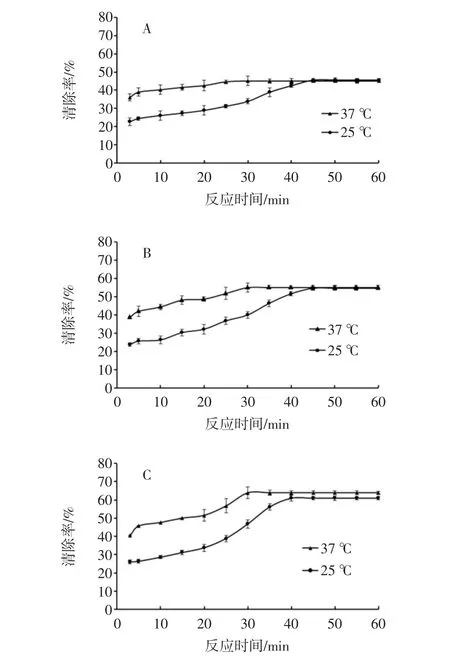
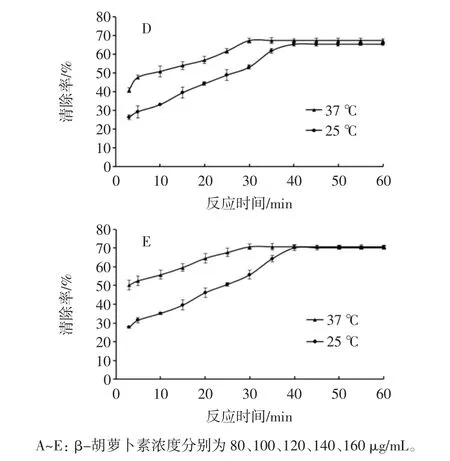
图1 温度对β-胡萝卜素清除DPPH自由基的影响Fig.1 Effect of temperature on the kinetics of scavenging DPPH radical by β-carotene
使用提取的β-胡萝卜素进行试验,以对DPPH自由基清除率为抗氧化活性指标。结果如图1所示,A~E分别表示 β-胡萝卜素质量浓度为 80、100、120、140、160 μg/mL时,反应温度分别在37℃和25℃条件下,β-胡萝卜素清除DPPH自由基清除率曲线。
图2中A、B分别表示反应温度分别为37℃和25 ℃时,不同质量浓度(80、100、120、140、160 μg/mL)的β-胡萝卜素清除DPPH自由基的清除率曲线。

图2 β-胡萝卜素质量浓度对清除DPPH自由基的影响Fig.2 Effect of concentration on the kinetics of scavenging DPPH radical by β-carotene
由图1、图2可见,温度和初始质量浓度都对β-胡萝卜素清除DPPH自由基有影响。同一质量浓度的β-胡萝卜素在不同温度下,反应达到平衡的时间不同。37℃时,反应达到平衡的时间约为30 min,而25℃时,(45±2)min时反应结束;温度对β-胡萝卜素清除DPPH自由基的速率(k)影响显著(P<0.05),而对清除率(α)无显著影响。同一反应温度下,随着β-胡萝卜素质量浓度的不断提高,其清除DPPH自由基的能力逐渐加强,表明在一定范围内β-胡萝卜素清除DPPH自由基的能力与其浓度呈明显的量效关系。因此要探讨初始质量浓度和反应温度对β-胡萝卜素清除DPPH自由基活性的变化规律。
2.3 β-胡萝卜素清除DPPH自由基活性半数效应浓度的测定
不同反应温度下β-胡萝卜素对DPPH自由基的清除曲线见图3。

图3 不同反应温度下β-胡萝卜素对DPPH自由基的清除曲线Fig.3 Scavenging curves of DPPH radical by β-carotene under different reaction temperatures
如图3所示,不同反应温度下,80μg/mL~160μg/mL范围内随着β-胡萝卜素浓度的升高,清除率均增大。当反应进行到30 min时,37℃下反应达到平衡,最大清除率达到70.77%;25℃下反应尚未结束,最大清除率为55.80%。表2为不同反应温度条件下反应进行到30 min时,β-胡萝卜素清除DPPH自由基动力学的回归方程及EC50,由表2可以得出反应温度对EC50影响显著(P<0.05),且EC50(37℃) 表2 β-胡萝卜素清除DPPH自由基动力学的回归方程及EC50Table 2 Regression equation and EC50of scavenging kinetics of DPPH radical by β-carotene 假设β-胡萝卜素在不同温度下清除DPPH自由基的速率符合一级或二级反应动力学模型,将所测定的消除数据进行分析[15]。以160 μg/mL组为例,分别以ln(1-α)-t和1/(1-α)-t作图,结果如图4所示。 图4 一级、二级反应动力学方程拟合结果Fig.4Kinetic curves of ln(1-α)-t and 1/(1-α)-t 由图4可知,在反应温度37℃和25℃条件下,ln(1-α)-t拟合曲线的 R2分别为 0.995 6 和 0.990 7;1/(1-α)-t拟合曲线的R2分别为0.977 8和0.977 0。ln(1-α)-t拟合曲线的R2高于1/(1-α)-t拟合曲线的R2,即一级动力学模型拟合的线性相关性较好。同时,其余4组浓度均可得出相同结论。由此可见,β-胡萝卜素清除DPPH自由基的反应动力模型符合一级反应,可由公式 ln(1-α)=-kt求得反应速率常数k,式中:α表示DPPH自由基清除率,t为反应时间,min;k为拟一级反应速率常数,mg/(mL·min)。 根据阿仑尼乌斯公式 k=K0·exp(-Ea/RT),式中:k为反应速率常数;K0为方程常数;Ea为表观活化能,kJ/mol;R为气体常数,8.314 dm3·kPa/(K·mol);T为绝对温度,K[16],对方程两边同时取对数,得到公式lnk=-Ea/RT+lnK0。以lnk对1/T绘制曲线,通过曲线的斜率和截距即可得到Ea的值,见表3。 表3 β-胡萝卜素抗氧化动力学参数Table 3 Parameters for antioxidant kinetics of β-carotene 随反应温度的升高,反应速率常数k增大,说明温度升高,反应速度加快,升温有利于反应的进行;不同质量浓度的Ea差异不显著,说明Ea不受初始质量浓度C0的影响。 本研究通过培养发酵三孢布拉霉菌株生产β-胡萝卜素,并对β-胡萝卜素进行提取,以其为研究对象,采用DPPH法测定β-胡萝卜素自由基清除率,考察了不同温度条件下,不同浓度的β-胡萝卜素抗氧化活性的不同,为充分开发利用这一天然资源提供科学依据。结果表明,相同浓度下,β-胡萝卜素在37℃抗氧化活性达到平衡的时间为30 min,短于25℃时45 min的平衡时间,说明温度越高,反应速度越快;在相同温度下,β-胡萝卜素浓度越高,抗氧化活性越强,当浓度达到160 μg/mL时,能够达到70.77%的清除效率。同时,通过计算可得,随反应温度的升高,反应速率常数K增大,说明反应温度对β-胡萝卜素抗氧化活性有较大影响,温度升高,反应速度加快,升温有利于反应的进行,但不同质量浓度的Ea稳定在31 kJ/mol左右,没有显著性差异,说明β-胡萝卜素起始浓度对抗氧化活性没有显著影响。β-胡萝卜素具有优良的清除自由基的能力,在保健食品和医药工业等方面应用前景广阔,此研究为β-胡萝卜素功能产品的研究和开发提供理论基础,可以进一步深入系统的进行探讨。 [1]Mc Auley MT,Mooney KM.LDL-C levels in older people:Cholesterol homeostasis and the free radical theory of ageing converge[J].Med Hypotheses,2017,104:15-19 [2]Salar RK,Purewal SS,Sandhu KS.Bioactive profile,free-radical scavenging potential,DNA damage protection activity,and mycochemicals in Aspergillus awamori(MTCC 548)extracts:a novel report on filamentous fungi[J].3 Biotech,2017,7(3):164 [3]Ullah F,Iqbal N,Ayaz M,et al.DPPH,ABTS free radical scavenging,antibacterial and phytochemical evaluation of crude methanolic extract and subsequent fractions of Chenopodium botrys aerial parts[J].Pakistan Journal of Pharmaceutical Sciences,2017,30(3):761-766 [4]Guo C,Zhao L,Wang F,et al.β-Carotene from yeasts enhances laccase production of pleurotus eryngii var.ferulae in co-culture[J].Front Microbiol,2017,8:1101 [5]袁磊,刘晓庚,唐瑜.不同类胡萝卜素清除自由基能力的比较[J].包装与食品机械,2015,33(2):7-11 [6]钱明雪,李胜立,李凡,等.6种石斛多糖抗亚急性酒精性肝损伤作用的比较[J].中国药学杂志,2015,50(24):2117-2123 [7]Chang HT,Chang YQ,Han RM,et al.Singlet fission reaction of light exposed β-carotene bound to bovine serum albumin.A novel mechanism in protection of light exposed tissue by dietary carotenoids[J].J Agric Food Chem,2017,65(29):6058-6062 [8]Praud C,Al Ahmadieh S,Voldoire E,et al.Beta-carotene preferentially regulates chicken myoblast proliferation withdrawal and differentiation commitment via BCO1 activity and retinoic acid production[J].Exp Cell Res,2017,358(2):140-146 [9]顾秋亚,余晓斌,解书怀.三孢布拉霉异性菌株接合孢子的形成与β-胡萝卜素合成关系的研究[J].食品工业科技,2008,29(3):73-75 [10]刘星,刘姗姗,殷海松,等.三孢布拉霉高产β-胡萝卜素菌株选育[J].饲料工业,2016,37(10):47-50 [11]Li J,Shen J,Sun Z,et al.Discovery of several novel targets that enhance β-Carotene production in Saccharomyces cerevisiae[J].Front Microbiol,2017,6(8):1116-1119 [12]闫兴,向梦雄,王常高,等.代谢调节剂对三孢布拉氏霉菌发酵的影响[J].湖北工业大学学报,2016,31(1):85-88 [13]Jimenez Escrig A,Jimenez Jimenez I,Sanchez Moreno C,et al.E-valuation of free radical scavenging of dietary carotenoids by the stable radical 2,2-diphenyl-1-picrylhydrazyl[J].Journal of the Science of Food&Agriculture,2000,80(11):1686-1690 [14]郑春红,徐昌平,李晓梅,等.耐辐射动球菌类胡萝卜素提取物的抗氧化活性研究[J].核农学报,2017,31(2):280-287 [15]李翠勤,郭苏月,王鹏翔,等.脂肪二胺桥联受阻酚清除DPPH·自由基的活性及动力学研究[J].化学通报,2015,78(9):810-814 [16]冯学珍,伍善广,韦啟球,等.网地藻多糖清除DPPH·自由基活性的动力学研究[J].广西植物,2017,37(5):647-652
2.4 β-胡萝卜素抗氧化动力学参数分析


3 结论
