荧光标记的米糠多糖及其细胞摄入研究
2018-05-30潘显虎虞鸿玉吴淑恒刘梁
潘显虎,虞鸿玉,吴淑恒,刘梁
(武汉轻工大学生物与制药工程学院,湖北武汉430023)
米糠作为稻米加工的副产物,是一类具有广泛开发潜力的高附加值资源,近些年来受到国内外研究学者的广泛关注[1]。从米糠中提取出来的多糖,由于其结构的特殊性,使其具有多种生物活性[2]。如增强免疫、抗肿瘤、抗病毒、抗氧化等活性,可用于药品、功能型食品的开发[3]。但由于米糠多糖的分子量较大,水溶性较差等导致我国对其功能的研究和开发相对不足。本研究通过对米糠多糖进行荧光标记,得到米糠多糖-罗丹明 B(Rice Bran Polysaccharide-Rhodamine B,RBPRh B)和米糠多糖-异硫氰酸荧光素(Rice Bran Polysaccharide-Fluorescein isothiocyanate,RBP-FITC)两种荧光标记物,解决米糠多糖本身缺少易于检测发光基团的难题,为进一步研究多糖的生物学活性提供一种新型可靠的辅助手段。
1 材料与方法
1.1 仪器与试剂
Lambda 25型紫外分光光度计:PerkinElmer公司;NICOLET iS10红外分光光度计:美国赛默飞世尔公司;970CRT荧光分光分光光度计:上海天美科学仪器有限公司;DF-1CD磁力搅拌油浴锅:金坛市亿能实验仪器厂。
米糠多糖:制药工程实验室自制并纯化;95%乙醇、无水乙醇、乙醚、浓硫酸、苯酚、葡萄糖、酒石酸钾钠、碳酸氢钠、磷酸氢二钠、磷酸二氢钠、氰基硼氢化钠、溴化钾(均为分析纯):国药集团化学试剂有限公司;罗丹明 B(Rhodamine B,Rh B):天津市北联细化学品开发有限公司;酪胺(2-(4-Hydroxyphenyl)ethylamine,Tyr):上海笛柏化学品技术有限公司;异硫氰酸荧光素(Fluorescein isothiocyanate,FITC):山东西亚化学工业有限公司;DMEM/HIGH GLUCOSE(DMEM培养基)、磷酸盐缓冲液(Phosphate Buffered Saline,PBS):HyClone公司;胰蛋白酶-EDTA溶液(胰酶)、Penicillin-Streptomycin(双抗):百替生物公司;人宫颈癌细胞Hela:华中师范大学农药与化学生物学教育部重点实验室惠赠。
1.2 方法
1.2.1 米糠多糖总糖含量测定
米糠多糖中总糖含量采用硫酸-苯酚法测定[4-5]。称取葡萄糖0.04 g加蒸馏水定容于500 mL容量瓶中,得到0.08 mg/mL的葡萄糖标准溶液,分别取葡萄糖标准溶 液 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 mL 于 试管中,补水至2 mL,依次加入1 mL6%苯酚溶液和5 mL浓硫酸,反应5 min后置于沸水浴中反应20 min,取出待冷至室温时用紫外分光光度计测定490 nm处的吸光度值A1,以不加葡萄糖溶液的试管为空白组,测得吸光度值A0。以葡萄糖溶液的浓度梯度为横坐标,对应的吸光度值A1-A0为纵坐标绘制葡萄糖标准曲线。取一定浓度的米糠多糖溶液代替葡萄糖溶液测得吸光度值A,计算出米糠多糖中总糖的含量。
1.2.2 RBP-Rh B和RBP-FITC的制备
1.2.2.1 RBP-Rh B复合物的制备
RBP-Rh B复合物的制备采用张中北等[6]的方法,精确称取米糠多糖与罗丹明B各20 mg,溶于10 mL蒸馏水,在避光的条件下搅拌反应24 h,将反应后的样品避光流水透析7 d,在透析后的溶液中加入3倍量体积的无水乙醇,溶液中出现暗红色沉淀物质,静置使沉淀完全。沉淀分别用95%乙醇、无水乙醇、各洗涤一次,干燥后得到RBP-Rh B复合物。
1.2.2.2 RBP-FITC的制备
米糠多糖的胺化[7-8],称取米糠多糖0.5 g溶于15 mL的0.2mol/L的PBS(pH8.0),分别加入400 mg酪胺与150 mg氰基硼氢化钠,在37℃的条件下搅拌反应96 h,将反应后溶液离心取其上清液,将离心后的溶液用自来水透析2 d,在透析后的溶液中加入3倍量体积的无水乙醇,溶液中出现红棕色沉淀物质,静置使沉淀完全。沉淀分别用95%乙醇、无水乙醇、各洗涤1次,干燥后得到米糠多糖-酪胺(RBP-Tyr)复合物。
RBP-FITC的制备[9-10],将RBP-Tyr加水溶解,用0.5 mol/L的NaHCO3溶液调pH至8.5,加入FITC在室温条件下避光搅拌反应12 h,将反应后的样品避光流水透析7 d,在透析后的溶液中加入3倍量体积的无水乙醇,溶液中出现黄绿色沉淀物质,静置使沉淀完全。沉淀分别用95%乙醇、无水乙醇、各洗涤1次,干燥后得到RBP-FITC复合物。
1.2.3 RBP-Rh B和RBP-FITC的表征
1.2.3.1 理化性质分析
取少量的RBP-Rh B和RBP-FITC固体,加蒸馏水溶解,分别取一滴溶液于载玻片上,室温避光干燥,将干燥后的样品置于荧光显微镜下观察[7]。
1.2.3.2 红外光谱分析
取米糠多糖、罗丹明B、FITC、RBP-Rh B和RBPFITC粉末与溴化钾压成薄片[11],用红外分光光度计扫描测定。
1.2.3.3 紫外光谱分析
紫外光谱分析确定反应成功[12]。称取米糠多糖、罗丹明B、FITC、RBP-Rh B和RBP-FITC粉末1 mg溶于蒸馏水并定容至10 mL,得到0.1 mg/mL的样品溶液。以水为空白对照,用紫外分光光度计对各样品进行200nm~700 nm范围扫描。
1.2.3.4 荧光光谱分析
称取罗丹明B、FITC、RBP-Rh B和RBP-FITC粉末1 mg溶于蒸馏水并定容至10 mL,得到0.1 mg/mL的样品溶液。选择罗丹明B和FITC紫外光谱的最大吸收峰处作为荧光扫描的激发波长,用荧光分光光度计对各样品进行扫描。其中罗丹明B和RBP-RhB的激发波长(Ex)562 nm,发射波长(Em)扫描范围 350 nm~700 nm;FITC和RBP-FITC的激发波长495 nm,发射波长扫描范围450 nm~700 nm[13]。
1.2.4 荧光取代度的测定
1.2.4.1 紫外分光光度法
参照文献[12]的方法,取配制好的0.01 mg/mL的RhB 溶液 20、40、80、120、160、200 μL 于试管中,加水至5 mL,用紫外分光光度计测定554 nm处的吸光度值A1。以RhB的浓度为横坐标,A1为纵坐标得到标准曲线。取一定浓度的RBP-Rh B溶液测定其吸光度A,计算出RBP-Rh B的荧光取代度。
取配制好的0.01 mg/mL的FITC溶液10、20、30、40、50 μL于试管中,加水至5 mL,用紫外光分光光度计测定495 nm处的吸光度值A1。以FITC的浓度为横坐标,A1为纵坐标得到标准曲线[14]。取一定浓度的RBPFITC溶液测定其吸光度值A,计算出RBP-FITC的荧光取代度。
1.2.4.2 荧光分光光度法
称取1 mg的罗丹明B,加水溶解至浓度为0.01 mg/mL的储液,分取罗丹明B溶液0.05、0.1、0.2、0.3、0.4、0.5 mL于试管中,补水至5 mL,用荧光分光光度计在Ex=562 nm,Em=610 nm条件下测定其荧光强度F1。以RhB的浓度为横坐标,F1为纵坐标得到标准曲线[9,15]。取一定浓度的RBP-Rh B溶液测定其荧光强度F,计算出RBP-Rh B的荧光取代度。
称取1.0mg的FITC,加水溶解至浓度为0.01mg/mL的储液,分取 FITC 溶液 5、10、15、20、25 μL 于试管中,补水至5 mL,用荧光分光光度计在Ex=495 nm,Em=550 nm条件下测定其荧光强度F1。以FITC的浓度为横坐标,F1为纵坐标得到标准曲线[16-17]。取一定浓度的RBP-FITC溶液测定其荧光强度F,计算出RBP-FITC的荧光取代度。
1.2.5 细胞摄取
1.2.5.1 细胞培养
在试验期间将Hela细胞培养在含有10%FBS、1%双抗的DMEM培养基中,放入37℃、5%CO2的恒温培养箱中培养,待细胞达到80%~90%汇合度时,吸去培养基,用PBS润洗后加入胰酶消化,将消化下来的细胞进行传代处理[18]。待细胞传至3代~4代后可以进行细胞试验。
1.2.5.2 细胞毒性试验
取汇合度达到80%~90%的细胞,用胰酶消化分散后,均匀的铺于96孔板中,使得各孔细胞数约为1.5×104个,置于37℃,5%CO2的条件下培养24 h。用DMEM培养基将米糠多糖、RBP-Rh B和RBP-FITC溶解成浓度为 0、0.1、0.2、0.3、0.4 和 0.5 mg/mL 溶液,将96孔板中的细胞在此浓度梯度下处理24 h,向每孔中加入10 μL浓度为5 mg/mL的MTT,继续培养4 h后,吸除培养液,用DMSO溶解生成的晶体,并用酶标仪测定570 nm处的吸光值,以未加样品处理的孔作为空白对照组,计算细胞存活力[18]。
1.2.5.3 细胞摄取试验
对文献的方法进行改进[19-21],分别称取RBP-Rh B和RBP-FITC粉末10 mg,加水溶解定容至10 mL,得到1 mg/mL的储液备用。待细胞达到80%~90%汇合度时,对细胞进行胰酶消化处理,将胰酶消化处理的细胞均匀铺到24孔培养板中,保证每孔细胞数为105个,在37℃,5%CO2条件下培养24 h,吸去培养基,用PBS润洗2遍后,每孔加入400 μL DMEM培养基,向各孔中加入100 μL RBP-Rh B溶液,并与37℃,5%CO2条件下培养,以不加样品孔作为空白对照。分别在培养 1、2、3、4、5 h 后,取其中 3 个孔用 PBS 洗去含有样品的培养基,用胰酶消化后转入黑色96孔板中,用酶标仪检测Ex=562.0 nm,Em=610.0 nm处的荧光强度F,待荧光强度达到稳定后,将其余的孔置于荧光显微镜下拍照[22]。RBP-FITC的检测方法同RBP-Rh B,其Ex=495 nm,Em=550 nm。
2 结果与讨论
2.1 米糠多糖的总糖含量测定
葡萄糖的标准曲线绘制见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
标准曲线的回归方程为Y=6.365 88X+0.104 67(R2=0.999 7),米糠多糖中的总糖含量为42%。
2.2 RBP-Rh B和RBP-FITC的表征
2.2.1 理化性质分析
RBP-Rh B和RBP-FITC的荧光显微镜图片如图2所示。

图2 荧光图片Fig.2 Fluorescent picture
图A1和A2分别是RBP-Rh B在自然光和激发光下的图片,RBP-Rh B在绿色激发光下发射出红色荧光;图B1和B2分别是RBP-FITC在自然光和激发光下的图片,RBP-FITC在蓝色激发光下发射出绿色荧光。证明米糠多糖成功地标记上这两种荧光物质。
2.2.2 红外结果分析
红外光谱图见图3。
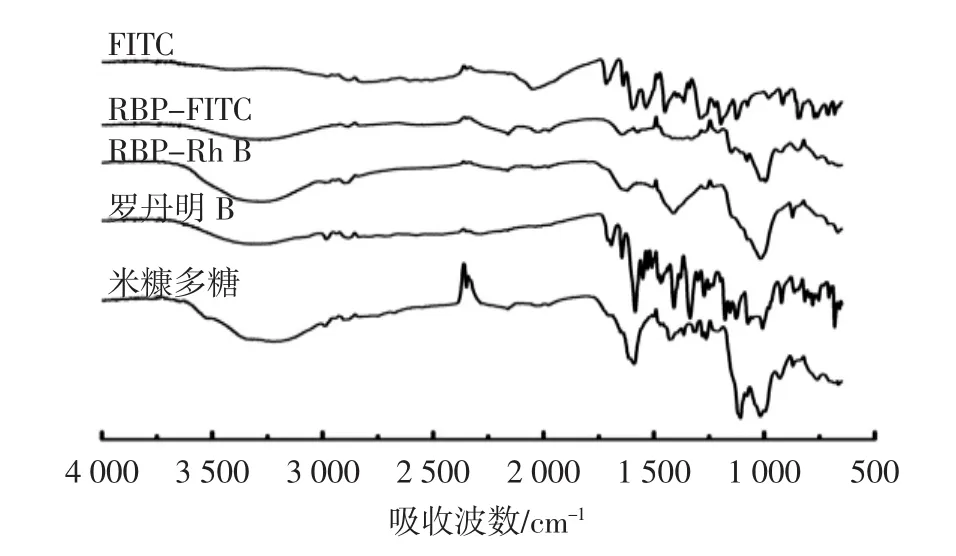
图3 样品的红外光谱图Fig.3 IR spectrum of samples
由图3可知,RBP-Rh B的红外光谱图中在1 621 cm-1处出现明显的特征吸收峰,该处是由米糠多糖还原性末端与罗丹明B活泼的氨基发生反应形成的C-N键伸缩振动峰[6,23],说明米糠多糖成功修饰上荧光物质罗丹明B;RBP-FITC的红外光谱图中在1 644 cm-1和1 210 cm-1处出现特征吸收峰,1 644 cm-1是米糠多糖还原性末端的半缩醛基通过还原胺化反应与酪胺的氨基共价偶联形成的C-N键变形振动峰,1 210 cm-1是RBP-Tyr中酪胺引入的仲氨基通过与FITC进行亲核反应生成的C-N键伸缩振动峰[24-25],这两处的特征峰说明了米糠多糖成功修饰上荧光物质FITC。
2.2.3 紫外结果分析
紫外吸收光谱见图4。

图4 紫外吸收光谱Fig.4 UV absorption spectrum
由图4可以看出,罗丹明B和FITC两种荧光染料分别在553 nm和490 nm处有吸收峰,米糠多糖在400 nm~700 nm范围内无特征吸收峰,而RBP-Rh B和RBP-FITC分别在553 nm和490 nm处出现吸收峰,说明米糠多糖上均成功的修饰了罗丹明B和FITC这两种荧光染料。
2.2.4 荧光结果分析
荧光光谱图见图5。
由图5可以看出,罗丹明B和FITC两种荧光染料的最大发射波长分别在590 nm和550 nm处,而RBP-Rh B和RBP-FITC分别在590 nm和550 nm左右出现荧光吸收,说明米糠多糖成功修饰上罗丹明B和FITC这两种荧光染料。
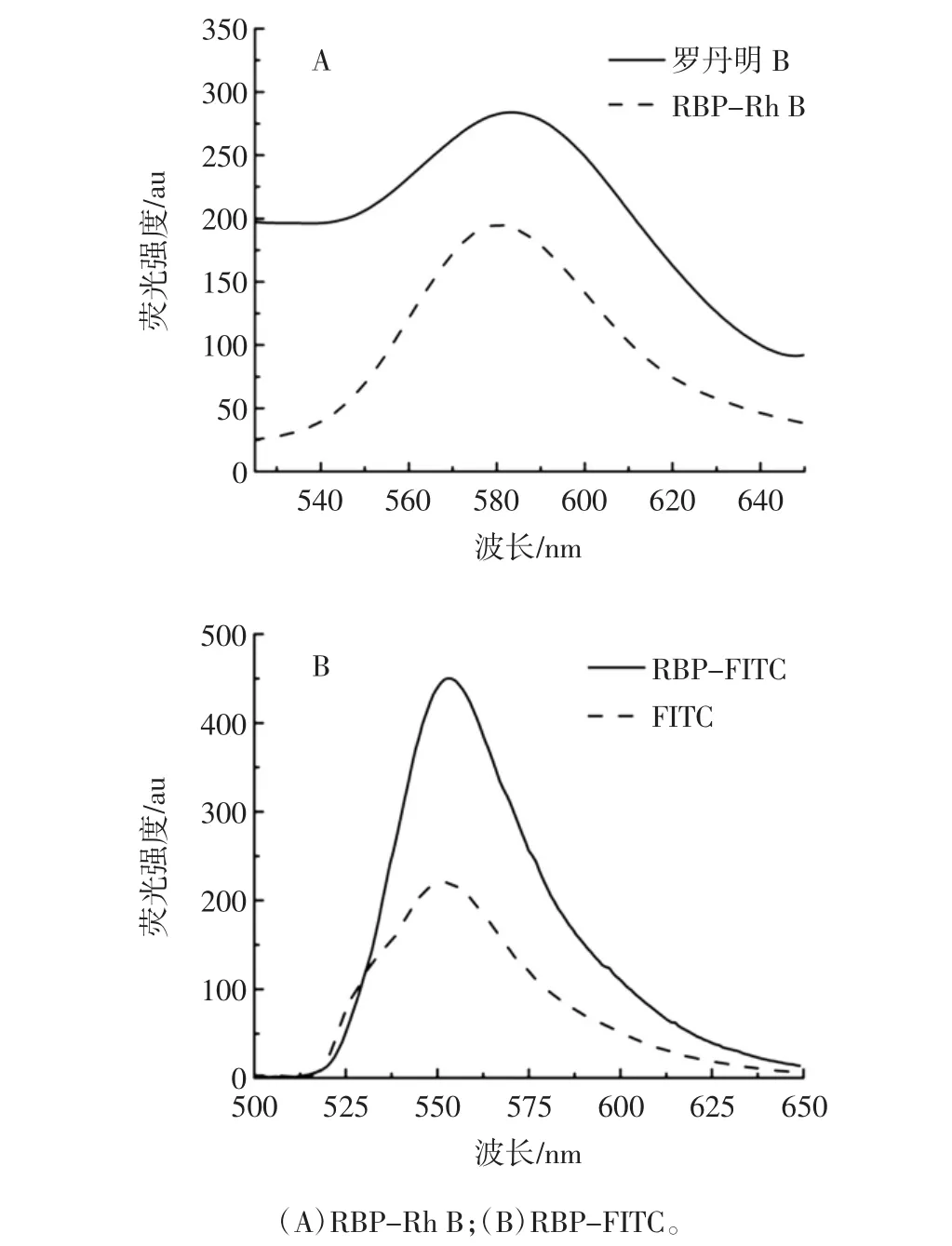
图5 荧光图谱Fig.5 Fluorescence absorption spectrum
2.3 荧光取代度的测定
2.3.1 紫外法
选择554nm为罗丹明B含量测定的波长,罗丹明B的浓度在0~0.04 μg/mL范围内的标准曲线如图6(A),其回归方程为Y=0.5847X+0.0001(R2=0.9962),测得RBP-Rh B中的罗丹明B的含量为0.7%;选择495 nm为FITC含量测定的波长,FITC的浓度在0~0.1 μg/mL范围内的标准曲线如图6(B),其回归方程为Y=0.46X+0.045(R2=0.994 4),测得 RBP-FITC 中 FITC 的含量为0.2%。


图6 紫外标准曲线Fig.6 UV standard curve
2.3.2 荧光法
选择Ex=562 nm,Em=610 nm为罗丹明B荧光测定的波长,罗丹明B的浓度在0~1 μg/mL范围内的标准曲线如图7(A),其回归方程为Y=111.6X+10.215(R2=0.994 8),测得RBP-Rh B的荧光取代度为1%;选择Ex=495 nm,Em=550 nm为FITC荧光测定的波长,FITC的浓度在0~0.05 μg/mL范围内的标准曲线如图7(B),其回归方程为 Y=3 129.7X+13.121(R2=0.998 1),测得RBP-FITC的荧光取代度为0.3%。

图7 荧光标准曲线Fig.7 Fluorescence standard curve
2.4 细胞毒性结果分析
样品的细胞毒性结果如图8所示。
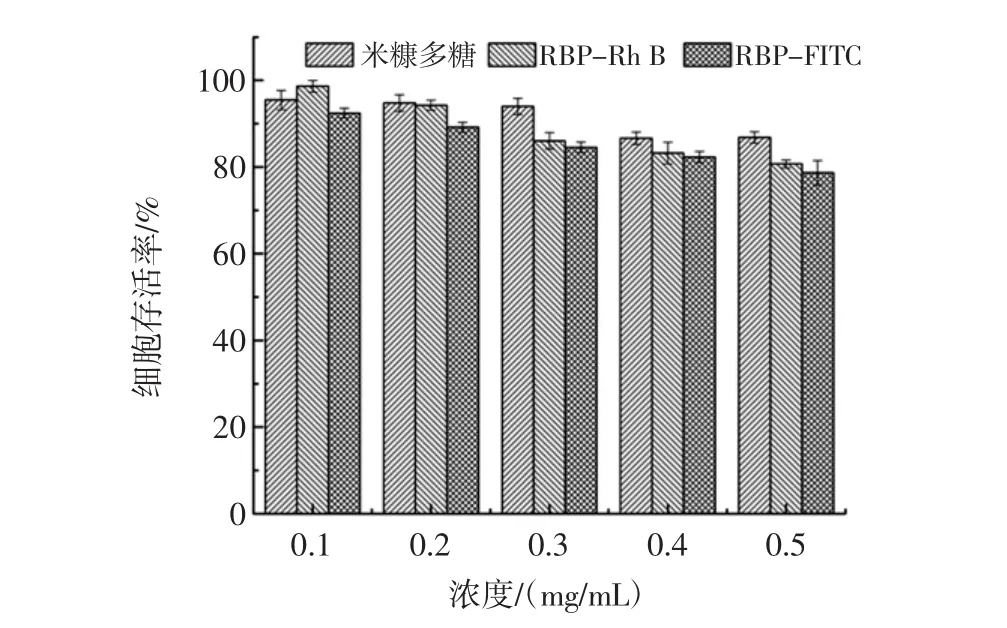
图8 样品的细胞毒性评价Fig.8 Cytotoxicity evaluation of samples
在0~0.5 mg/mL的浓度范围内,均有80%以上的细胞活力,说明米糠多糖、RBP-Rh B和RBP-FITC均具有很低的细胞毒性。与米糠多糖相比,荧光标记物标记后存在轻微的细胞毒性,几乎不会对细胞试验结果造成影响。
2.5 细胞摄取结果
Hela细胞对RBP-Rh B和RBP-FITC的摄取情况见图9。

图9 Hela细胞对RBP-Rh B和RBP-FITC的摄取情况Fig.9 Hela cells uptake of RBP-Rh B and RBP-FITC
图9的荧光图片可以看出,罗丹明B标记的米糠多糖在绿光激发下使细胞发射出红光,FITC标记的米糠多糖在蓝光激发下使细胞发射出绿光,表明了两种荧光物质标记的米糠多糖均可以被Hela细胞所摄取。RBP-Rh B和RBP-FITC的细胞摄取结果见图10。
图10的荧光值则表明了随时间的延长,Hela细胞对这两种荧光物质标记的多糖摄取量也逐渐增大,最终在4 h左右达到摄取的最大值。
3 结论

图10 RBP-Rh B和RBP-FITC的细胞摄取结果Fig.10 Cell uptake of RBP-Rh B and RBP-FITC
用荧光物质标记米糠多糖的制备工艺简单,紫外分光光度法测得罗丹明B和FITC对于米糠多糖的标记率分别为0.7%和0.2%,荧光分光光度法测得罗丹明B和FITC对于米糠多糖的标记率分别为1.0%和0.3%。虽然这两种荧光物质对米糠多糖的标记率不高,但它们在极低的浓度下均含有很高的荧光值,所以用这两种荧光物质进行标记可以很容易的观察到细胞摄取情况。本试验结果表明了米糠多糖可以很好的被Hela细胞所摄取且摄取时间较短,并且荧光标记物修饰后几乎没有细胞毒性,为将来进一步的开发和研究米糠多糖及其米糠多糖修饰物提供理论依据。
[1]陈正行,王韧,王莉,等.稻米及其副产品深加工技术研究进展[J].食品与生物技术学报,2012,31(4):355-364
[2]李哲,肖志刚,杨庆余,等.米糠多糖功能性与开发应用[C].2013中国农业工程学会农产品加工及贮藏工程分会学术年会暨辽宁省首届食品安全论坛论文集,2013
[3]陈新,刘梁,赵玲.农产品活性物质研究与开发[J].食品研究与开发,2015(8):5
[4]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279
[5]钟方晓,任海华,李岩.多糖含量测定方法比较 [J].时珍国医国药,2007,18(8):1916-1917
[6]张中北,杨颜铭,王丽娜,等.罗丹明B标记树舌多糖的条件[J].菌物研究,2016,14(4):233-238
[7]丁涛.灰树花多糖的FITC荧光标记及Caco-2细胞模型对其的吸收与转运研究[D].徐州:江苏师范大学,2014
[8]唐惠玲,陈涛,王莹,等.虫草多糖荧光标记的方法学研究[J].药学与临床研究,2010,18(3):279-281
[9]苏玲,李雨婷,王再林,等.树舌荧光多糖的制备及其在人大肠癌细胞SWWC1116中的定位[J].吉林大学学报(理学版),2013,51(1):140-144
[10]Kai Shao,Baoqin Han,Wen Dong,et al.Pharmacokinetics and biodegradation performance of a hydroxypropyl chitosan derivative[J].Journal of Ocean University of China,2015,14(5):888-896
[11]袁成甜.灵芝与薏苡仁多糖在口服薏苡仁组分微乳构建中的作用及机制探讨[D].镇江:江苏大学,2015
[12]苏玲,胡静,李雨婷,等.树舌荧光多糖的制备及在小鼠脾淋巴细胞中的定位[J].中国农业大学学报,2013,18(1):147-152
[13]Li Pengli,Li Chunxia,Xue Yiting,et al.Preparation,characterization and pharmacokinetics of fluorescence labeled propylene glycol alginate sodium sulfate[J].Journal of Ocean University of China,2014,13(4):683-690
[14]Yunjia Wang,Xihong Zu,Guobin Yi,et al.Gap-plasmon of Fe3O4@Ag core-shell nanostructures for highly enhanced fluorescence detection of Rhodamine B[J].Journal of Wuhan University of Technology-Mater Sci Ed,2017,32(2):264-271
[15]MA Yu-Xing,ZHONG Rui-Bo,GUO Jun,et al.A facile method for studying interaction of rhodamine B and bovine serum albumin:Towards physical-binding mediated fluorescence labeling of proteins[J].Nuclear Science and Techniques,2015(6):106-109
[16]吕志华.海洋多糖药物PS916的荧光标记及其药代动力学研究[D].青岛:中国海洋大学,2008
[17]唐华丽.枸杞多糖的结构分析及代谢组学研究[D].南京:东南大学,2016
[18]王国慧,赵颜忠,谭娟,等.纳米羟基磷灰石的精氨酸修饰及其基因转染活性[J].中国有色金属学报,2015,25(2):490-496
[19]韩艳萍,赵鲁杭,吴海明.壳寡糖激活巨噬细胞的机制[J].浙江大学学报(医学版),2006,35(3):265-272
[20]刘世东,郑飞云,杨孝军,等.脉冲电场促进宫颈癌HeLa细胞摄取光敏剂的实验研究[J].中国全科医学,2011,14(9):987-990
[21]杨文智.疏水改性普鲁兰多糖及其自组装载药纳米粒的研究[D].北京:北京协和医学院,2009
[22]F Zhou,J Wang,H Zhang,et al.Evaluation of three tracers for labeling distal cerebrospinal fluid-contacting neurons[J].Neurosci Bull,2013,29(5):576-580
[23]Qing-Jiao Luo,Yong-Xin Li,Meng-Qian Zhang,et al.A highly sensitive,dual-signal assay based on rhodamine B covered silver nanoparticles for carbamate pesticides[J].Chinese Chemical Letters,2017(2):345-349
[24]李福川,耿美玉,李英霞,等.海洋硫酸多糖911的荧光标记研究[J].高等学校化学学报,2002,23(9):1704-1708
[25]张雪梅,胡志宇.异硫氰酸荧光素在荧光标记领域的应用[J].昆明学院学报,2015(6):56-59
