高表达血管紧张素转化酶2的内皮祖细胞降低野百合碱诱导的大鼠肺动脉高压
2018-05-30刘珍君肖梦媛余丽琴魏文燕彭子健陈建英
刘珍君,魏 晶,肖梦媛,余丽琴,魏文燕,彭子健,陈建英
(广东医科大学附属医院 心血管内科, 广东 湛江 524001)
肺动脉高压(pulmonary arterial hypertension,PAH)是一组由不同原因引起的以肺血管阻力进行性增加为特征的临床病理生理综合征。血管内皮细胞受损是PAH发生发展过程中的启动环节[1],提示内皮细胞的损伤修复可能是PAH干预的新靶点之一。内皮祖细胞(endothelial progenitor cells,EPCs)是能定向增殖分化为成熟血管内皮细胞的前体细胞[2],其在维持血管自稳态中扮演着重要角色[3]。补充EPCs也许是修复PAH血管内皮细胞损伤的可行措施之一。同时,肾素-血管紧张素系统(renin-angiotensin system, RAS)在血管内皮功能受损中发挥着重要的作用。血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)及其参与的ACE2-Ang-(1-7)-Mas轴是RAS的新成员,ACE2可通过水解血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ) 生成血管紧张素1-7[angiotensin-(1-7),Ang1-7 ],从而发挥拮抗经典肾素-血管紧张素轴的作用[4]。为此,肺组织RAS中具有血管保护作用的ACE2-Ang(1-7)-Mas轴亦可能成为PAH治疗的新靶点[5]。本研究中,ACE2慢病毒载体感染EPCs,制备出能稳定过表达ACE2的ACE2-EPCs,旨在观察其对野百合碱(monocrotaline, MCT)诱导的肺动脉高压大鼠的治疗作用,为PAH的临床治疗提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂:EGM-2培养基(LONZA公司)、大鼠骨髓淋巴细胞分离液(天津灏洋生物制品有限公司);胎牛血清(Life Technology 公司);大鼠纤维连接蛋白(Biocoat公司);Dil-Ac-LDL、FITC-Bs-Lectin、兔抗小鼠ACE2单克隆抗体(Santa Cruz公司);慢病毒原液(苏州吉玛基因有限公司);CCK-8(碧云天公司);InVitroAngiogenesis Assay Kit(Millipore公司)。
1.1.2 动物:SPF级8周龄雄性SD大鼠28只,250~300 g(广东省医学实验动物中心,许可证号:SCXK 粤 2008-0002)。
1.2 方法
1.2.1 大鼠骨髓内皮祖细胞的培养及鉴定:使用大鼠骨髓淋巴细胞分离液分离提取骨髓内皮祖细胞(EPCs),将细胞用含10%胎牛血清的EGM-2完全培养液置于37 ℃、5% CO2的细胞孵育箱内培养。培养1周后,选择增殖良好的EPCs进行形态学观察,采用Dil 标记的Di-LDL与 FITC 标记的Bs-Lectin1对EPCs进行免疫荧光染色鉴定。
1.2.2 制备慢病毒感染内皮祖细胞模型:取培养1周、增殖态势良好的EPCs,将携带含有绿色荧光蛋白(GFP)ACE2基因的慢病毒及携带空载体的慢病毒分别转染EPCs,72 h内观察GFP的表达时间及表达强度,从而确定慢病毒载体对EPCs的感染情况。用EPCs终浓度为1 mg/L的嘌呤霉素筛选阳性细胞,获得体外高表达ACE2基因的稳定EPCs(ACE2-EPCs)以及空载体转染的EPCs(null-EPCs)备用。
1.2.3 Western blot检测内皮祖细胞ACE2蛋白表达:用含1%蛋白酶抑制剂的细胞裂解液提取各组EPCs的蛋白,BCA法蛋白溶液浓度测定细胞蛋白浓度,电泳、转膜、显色。一抗为ACE2(1∶1 000),选用β-actin(1∶2 000)作为内参蛋白。
1.2.4 内皮祖细胞感染前后增殖、成管功能的检测:CCK-8法检测内皮祖细胞增殖,按说明书操作,在96孔板中分别接种EPCs、null-EPCs、ACE2-EPCs,置于37 ℃、5% CO2细胞培养箱中培养。分别于细胞培养的24、48、72和96 h,每孔板中加入含CCK-8的培养基,并设置空白对照和底物孔。各组酶标板在长度为450 nm波长的酶标仪中读取吸光度值。
内皮祖细胞小管功能的检测:按照试剂盒说明书操作,于96 孔板中加入按不同浓度稀释的ECM液体,制定标准曲线,将铺好的培养板置于培养箱中30 min温浴成胶;每孔加入150 μL原代EPCs悬液,置于37 ℃、5% CO2培养箱中培养15 h,倒置显微镜下观察各组EPCs的管腔形成情况。
1.2.5 动物分组与处理:腹腔注射野百合碱复制肺动脉高压,按照随机原则分为4组:对照组(0.5 mL 0.9%氯化钠溶液)、PAH组(0.5 mL 0.9%氯化钠溶液)、EPCs组[0.5 mL 0.9%氯化钠溶液重悬的EPCs(1×106个)]以及lenti-ACE2-EPCs组[0.5 mL 0.9%氯化钠溶液重悬的慢病毒转染ACE2的EPCs(1×106个)]。每组7只大鼠。PAH造模成功后第2、9、16天分别尾静脉注射相应试剂及剂量。
1.2.6 各组大鼠平均肺动脉压力(mPAP)及右心室肥厚指数(RV/LV+S)测定:干预处理3周后,测定每只大鼠肺动脉压力及右心室肥厚指数。腹腔注射7%水合氯醛溶液(5 mL/kg)进行麻醉,接压力换能器至 Medlab 生理记录仪,聚苯乙烯微导管法测心室+室间隔(LV+ S),电子天平称重,计算右心室肥厚指数RVHI=RV/LV+S。将部分肺组织、右心室置于10%甲醛溶液中固定24 h后,石蜡包埋固定,用于病理切片。
1.2.7 各组大鼠肺组织标本的HE染色:取石蜡包埋好的肺组织切片行苏木精-伊红染色,光镜下观察肺组织血管分布及炎性细胞浸润情况。用计算机图像分析系统(Leica TCS SP5Ⅱ)(光镜,×200)测量100 μm左右的肺小动脉壁厚度指数(thickness index,TI)及管腔面积指数(area index,AI)(每张切片随机选取5个横断面),TI=1-血管内径/血管外径,AI=1-管腔面积/血管总面积。
1.2.8 Western blot检测各组大鼠肺组织中ACE2蛋白表达:用含1%蛋白酶抑制剂的细胞裂解液提取大鼠肺组织的总蛋白,进行BCA定量、电泳、转膜、显色(按试剂盒说明书)。一抗为ACE2(1∶1 000),选用β-actin(1∶2 000)作为内参蛋白。ACE2吸光度值/β-actin吸光度值表示ACE2蛋白相对表达量。
1.3 统计学分析

2 结果
2.1 大鼠骨髓内皮祖细胞的形态学观察
3 d后可见少数细胞呈集落样贴壁,细胞体积较小,形态不均一(图1A);约第7天时细胞数量显著增多,形态均一,以纺锤形和多角形细胞为主(图 1B);约第10天时细胞相互汇合成铺路石状或鹅卵石状(图1C)。
2.2 大鼠骨髓内皮祖细胞免疫荧光双染色法鉴定结果
显示绿色荧光的为FITC-UEA-1阳性细胞(图2A);显示红色荧光的为Dil-Ac-LDL阳性细胞(图2B),这些细胞是正在分化的内皮祖细胞。
2.3 感染ACE2的内皮祖细胞(EPCs)绿色荧光蛋白表达情况
成功感染绿色荧光蛋白(GFP)的细胞呈现绿色荧光(图3)。感染72 h,MOI=100时,感染效率最高,且细胞增殖状态最佳。
2.4 Western blot检测EPCs中ACE2表达
lenti-ACE2-EPCs组可见ACE2蛋白表达,而另外两组则未见其表达(图4)。
2.5 感染ACE2的内皮祖细胞(EPCs)增殖及成管功能检测结果
细胞培养96 h,感染ACE2的EPCs组增殖能力较EPCs组及空载体的EPCs组明显增强(P<0.01)(图5A)。

A.morphological characteristics of EPCs primary culture in the third day; B.morphological characteristics of EPCs in the seventh day; C.morphological characteristics of EPCs in the tenth day
图1大鼠骨髓EPCs培养不同时期的形态学特征
Fig1Morphologicalcharacteristicsofrats’bonemarrowEPCs(×40)

A.FITC-UEA-1 positive cells showed green fluorescence; B.Dil-Ac-LDL positive cells showed red fluorescence

图3 转导ACE2的内皮祖细胞(EPCs)绿色荧光蛋白表达情况Fig 3 Expression of green fluorescent protein in endothelial progenitor cells (EPCs) transduced with ACE2(×40)
细胞培养20 h,感染ACE2的EPCs组形成小管的能力较EPCs组及空载体的EPCs组明显增强(P<0.01)(图5B)。
2.6 各组大鼠平均肺动脉压力(mPAP)及右心室肥厚指数(RV/LV+S)检测结果
PAH组的mPAP、RV/LV+S均较对照组显著升高(P<0.01);lenti-ACE2-EPCs组的mPAP、RV/LV+S均较PAH组明显下降(P<0.01);EPCs组的mPAP、RV/LV+S均较PAH 组下降(P<0.01),但仍高于对照组及lenti-ACE2-EPCs组水平(图6)。
2.7 各组大鼠肺小动脉管壁厚度(TI)及管腔面积(AI)检测结果
PAH组肺小动脉(100~200 μm)壁明显增厚,管腔明显狭窄;lenti-ACE2-EPCs组大鼠肺小动脉管壁厚度明显改善,管腔增大;EPCs组肺小动脉壁轻度增厚,管腔狭窄(图7A)。
PAH组肺小动脉厚度指数(TI)及面积指数(AI)均较对照组显著升高(P<0.01);lenti-ACE2-EPCs组TI及AI均较PAH组明显下降(P<0.01);EPCs组TI及AI较PAH组下降,但高于对照组和lenti-ACE2-EPCs组(P<0.05)(图7B)。
2.8 Western blot检测各组大鼠肺组织中ACE2蛋白表达水平结果
PAH组ACE2蛋白表达水平较对照组显著降低(P<0.01);lenti-ACE2-EPCs组ACE2蛋白表达水平较PAH组明显增加(P<0.01)(图8)。

*P<0.01 compared with EPCs and null-EPCs group图4 Western blot检测各组内皮祖细胞ACE2蛋白表达水平Fig 4 The expression of ACE2 protein in endothelial progenitor cells detected by Western n=3)


图5转导ACE2的内皮祖细胞(EPCs)增殖及成管能力检测
Fig5ProliferationabilityandtubeformationinEPCstransducedwithACE2
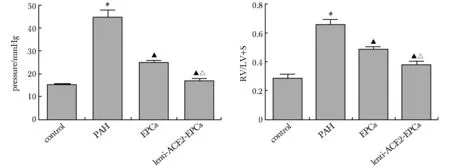
#P<0.01 compared with control group;▲P<0.01 compared with PAH group;△P<0.01 compared with EPCs group
图6各组大鼠平均肺动脉压力和右心室肥厚指数

3 讨论
尽管近年来有关肺动脉高压的基础及临床研究取得了一些进展,但仍是全球各国突出的公共卫生问题之一。肺血管重构、收缩及原位血栓形成是肺动脉高压发生发展过程中的重要病理生理基础,其中肺血管重构是最突出、最致命的病理特点,为此,恢复肺血管内皮细胞结构与功能的完整性, 逆转肺血管重构将是治疗肺动脉高压的关键环节[7]。

A.HE staining of pulmonary arterioles in rats of each group(×400); B.statistical graphs of pulmonary arteriolar thickness index (TI) and area index (AI) in rats of each group;#P<0.01 compared with control group;▲P<0.05 compared with PAH group;△P<0.01 compared with EPCs group
图7各组大鼠肺小动脉HE染色、厚度指数(TI)及面积指数(AI)
Fig7HEstaining,thicknessindexandareaindexofpulmonaryarteriolesinratsofeachgroup

▲P<0.01 compared with control group; #P<0.01 compared with PAH group
本研究中发现,EPCs组大鼠与PAH组比较,大鼠的mPAP、RV/LV+S、TI及AI均有明显下降,但仍高于对照组及lenti-ACE2-EPCs组,提示骨髓EPCs可一定程度改善肺动脉高压大鼠的异常肺血管的血流动力学,减轻肺血管狭窄及重构,其保护作用与文献报道相符[3],可能与EPCs分化为内皮细胞,参与修复受损血管内皮有关。据研究报道,骨髓是血管新生过程中EPCs的主要来源[8],而研究显示尾静脉注射骨髓来源的EPCs可部分逆转野百合碱诱导的PAH大鼠的肺血管重构,修复其微循环异常[9]。
研究报道,肾素-血管紧张素系统(RAS)的平衡在内皮功能受损及血管重构中亦发挥着重要的作用,PAH患者肺组织内皮细胞血管紧张素转化酶(ACE)活性增加,血管紧张素1型受体(AT-1)表达增高[10],提示PAH患者RAS局部失衡,ACE-Ang-Ⅱ-AT1轴被激活。与此同时,作为RAS中ACE-Ang-Ⅱ-AT1轴的拮抗轴,ACE2-Ang1-7-Mas轴在PAH发生发展过程中亦扮演着重要的角色[11]。ACE2是近年来人类发现的第一个ACE的同系化合物,是一种锌离子依赖性的金属蛋白酶,人类完整的ACE2由805个氨基酸组成[12]。研究发现,通过激活ACE2,可改善内皮细胞功能、调节炎性细胞因子与抗炎细胞因子间的平衡,从而抑制野百合碱诱导的肺动脉高压的形成[13]。ACE2表达水平的升高具有抗血管收缩、抗纤维化及抗增殖的作用[14]。目前认为,ACE2所发挥的保护作用可能是通过降低Ang Ⅱ的表达同时增加Ang1-7的表达而实现[15]。
本研究中,lenti-ACE2-EPCs组的mPAP、RV/LV+S、TI及AI均较PAH组和EPCs组明显下降。另外,lenti-ACE2-EPCs组大鼠肺组织中ACE2蛋白表达水平较PAH组明显增加。上述结果提示高表达ACE2基因的大鼠EPCs能有效降低PAH大鼠平均肺动脉压力,较大程度上改善肺血管与右心室重构以及调节肺组织RAS平衡,且治疗作用明显优于单纯EPCs干预处理组。这可能与ACE2-EPCs既发挥出内皮祖细胞分化为内皮细胞,参与修复受损血管内皮的直接作用,同时又发挥出外源性基因ACE2调节RAS平衡的间接作用相关。然而,高表达ACE2基因的大鼠内皮祖细胞虽能有效改善PAH大鼠的预后,但其具体作用机制、信号通路仍未明确,有待进一步的研究去证实和完善。
:
[1] Yuan YM,Luo L,Guo Z,etal. Activation of renin-angiotensin-aldosterone system (RAAS) in the lung of smoking-induced pulmonary arterial hypertension (PAH) rats[J]. J Renin Angiotensin Aldosterone Syst,2015,16:249-253.
[2] Tagawa S,Nakanishi C,Mori M,etal. Determination of early and late endothelial progenitor cells in peripheral circulation and their clinical association with coronary artery disease [J]. Int J Vasc Med,2015,2:1-7.
[3] Li X,Chen C,Wei L,etal. Exosomes derived from endothelial progenitor cells attenuate vascular repair and accelerate reendothelialization by enhancing endothelial function [J]. Cytotherapy,2016,18:253-262.
[4] Alghamri MS,Weir NM,Anstadt MP,etal. Enhanced angiotensin Ⅱ-induced cardiac and aortic remodeling in ACE2 knockout mice [J]. J Cardiovasc Pharmacol Ther,2013,18:138-151.
[5] Breitling S,Krauszman A,Parihar R,etal. Dose-dependent therapeutic potential of angiotensin-(1-7) for the treatment of pulmonary arterial hypertension [J]. Pulm Circ,2015,5:649-657.
[6] Chen JY,An R,Chen YF,etal.Therapeutic effects of mesenchymal stem cellderived microvesicles on pulmonary arterialhypertension in rats [J].Acta Pharmacologica Sinica,2014,35: 1121-1128.
[7] Hoeper MM,Bogaard HJ,Condliffe R,etal. Definitions and diagnosis of pulmonary hypertension [J]. J Am Co Cardiol,2013,62: 42-50.
[8] Tang JJ,Meng QY,Cai ZX,etal. Transplantation of VEGFl65-overexpressing vascular endothelial progenitor cells relieves endothelial injury after deep vein thrombectomy[J]. Thromb Res,2016,137:41-45.
[9] Loon RL,Bartelds B,Wagener FA,etal. Erythropoietin attenuates pulmonary vascular remodeling in experimental pulmonary arterial hypertension through interplay between endothelial progenitor cells and heme oxygenase[J]. Front Pediatr,2015,3:1024-1031.
[10] Chen J,Xiao X,Chen JY,etal. Angiotensin-converting enzyme 2 priming enhances the function of endothelial progenitor cells and their therapeutic efficacy [J]. Hypertension,2013,61:681-689.
[11] Chen YS,Lu B,Wang JJ,etal.Circulating CD133+CD34+progenitor cells and plasma stromal-derived factor-1alpha: predictive role in ischemic stroke patients[J].J Stroke Cerebrovasc Dis,2015, 24: 319-326.
[12] Rigamonti N,Kadioglu E,Keklikoglou I,etal. Role of angiopoietin-2 in adaptive tumor resistance to VEGF signaling blockade[J].Cell Rep,2014,8:696-706.
[13] Li G,Liu Y,Zhu Y,etal. ACE2 activation confers endothelial protection and attenuates neointimal lesions in prevention of severe pulmonary arterial hypertension in rats [J]. Lung,2013,191:327-736.
[14] Haga S, Tsuchiya H,Hirai T,etal. A novel ACE2 activator reduces monocrotaline-induced pulmonary hypertension by suppressing theJAK/STAT and TGF-β cascades with restored caveolin-1 expression [J]. Exp Lung Res,2015,41:21-31.
[15] Qi YF,Zhang J,Colleen T,etal. Diminazene aceturate enhances Angiotensin-converting enzyme 2 activity and attenuates ischemia-induced cardiac pathophysiology[J].Hypertension,2013,62:746-752.
