NO供体V-PYRRO/NO抑制大鼠肝脏I/R损伤早期LTC4S基因表达
2018-05-30苏湾英贺长生魏志萍邵亚兰杨美雯洪芬芳杨树龙
苏湾英,贺长生,魏志萍,邵亚兰,杨美雯,洪芬芳,杨树龙*
(1.井冈山市检验检测中心, 江西 井冈山 343603; 2.南昌大学 基础医学院 生理教研室,江西 南昌 330006;3.南昌大学 抚州医学院 2014级高护7班,江西 抚州 344000; 4.南昌大学 医学实验教学中心, 江西 南昌 330031)
肝脏缺血再灌注(ischemia reperfushion, I/R)损伤普遍存在于临床有关创伤、重建血管外科、肝移植和肝切除手术等发病机制[1]。不断增加的证据提示半胱氨酸白三烯(Cys-LTs)与肝脏I/R损伤有关[2]。白三烯C4(leukotriene C4,LTC4)是由肝微粒体白三烯C4合酶(leukotriene C4 synthase, LTC4S)催化 LTA4和GSH结合而成。NF-κB在I/R损伤炎性反应相关基因的转录调控中有重要作用,已证明NF-κB在热/冷I/R损伤中被激活。有报道脂多糖(LPS)在单核吞噬细胞中通过NF-κB介导机制减少Cys-LTs的释放和下调LTC4S基因的表达[5]。一氧化氮(NO)作为内皮源性血管扩张剂可拮抗内皮素的缩血管作用,改善肝脏微循环,抑制白细胞的黏附[6]。Cys-LTs和NO的相关性已被研究证实[7]。NO供体硝普钠(SNP)通过抑制NF-κB的活性来下调LTC4S mRNA表达,此过程不涉及IκB降解[8]。有报道特异性NO供体V-PYRRO/NO下调LTC4S mRNA的表达[9]。但其对LTC4S mRNA表达的潜在影响是否与NF-κB的活性有关尚不清楚。
1 材料与方法
1.1 材料
清洁级雄性SD大鼠,体质量230~250 g[南昌大学实验动物中心提供,动物合格证:南昌大学实验动物中心,编号SCXK(赣),2008- 0001]。V-PYRRO/NO(Cayman Chemical公司)。 Trizol试剂和MMuLV反转录酶(Gibco公司)。还原型谷胱甘肽和Taq DNA聚合酶(上海生物工程公司)。大鼠LTC4S cDNA引物由生命科技公司(卡尔斯巴德公司)合成。 NF-κB p50、IκB和β-actin兔多克隆抗体和NF-κB p65小鼠单克隆抗体(Santa Cruz公司)。增强型辣根过氧化物酶化学发光检测试剂盒(以色列生物公司)。 PVDF膜(Millipore公司)。免疫组织化学DAB染色试剂盒、辣根过氧化物酶联羊抗兔和羊抗鼠二抗(北京中山生物有限公司)。
1.2 方法
1.2.1 大鼠分组及处理:将大鼠随机分为3组:1)假手术组;2)I/R组:用小动脉夹夹闭肝左中叶的动脉造成肝左中叶缺血1 h后,再灌注5 h。3)V-PYRRO/NO组缺血前15 min至再灌注5 h由颈外静脉输注V-PYRRO/NO[1.06 μmol/(kg·h)]。再灌注5 h后,取肝中叶组织固定在10%甲醛,用于免疫组织化学。肝左叶迅速冻存于液氮,储存在-80 ℃,用于mRNA和蛋白表达分析。
1.2.2 RT-PCR检测LTC4S mRNA表达:根据说明书用Trizol试剂从肝组织分离总RNA,在260 nm波长下通过紫外分光光度计测定组织RNA浓度。取1 μL肝脏总mRNA,用特异性反转录引物和200 U MMuLV反转录酶合成cDNA一链。大鼠β-actin和LTC4S PCR引物序列参照文献[7- 8](表1)。1.5 μL cDNA中分别加入各引物和1.5 U DNA聚合酶, 在梯度PCR仪(Eppendorf公司)内以适当的循环次数扩增。反应物循环条件为95 ℃ 45 s,55.8 ℃/58 ℃ 45 s,72 ℃ 45 s。将得到的PCR产物用1.5%溴化乙锭染色的琼脂糖凝胶电泳分离,并通过紫外透射仪观察。每个条带的强度由生物成像分析仪(Bio-Rad公司)测定,并使用4.2.2版本的Quantity One软件进行分析定量。用β-actin作为扩增产物的参照,对这些基因扩增产物的mRNA相对表达程度进行比较。

表1 用于RT-PCR分析的LTC 4S和β-actin基因的寡核苷酸引物Table 1 Oligonucleotide primers used for the analysis of LTC 4S and β-actin genes by RT-PCR
1.2.3 Western blot检测NF-κB p50、P65或 IκB的蛋白表达:有关NF-κB p50、P65或 IκB的蛋白表达按本实验室前期报道方法[8]进行检测。冻存的肝组织样品在含150 mmol/L NaCl、50 mmol/L Tris-HCl pH 7.5、1% NP- 40、0.25%脱氧胆酸盐、0.1% SDS的裂解液中裂解,同时加入蛋白酶抑制剂PMSF、胃蛋白酶抑制剂亮抑酶肽和肽酶。蛋白浓度用 Lowry法测定。将等量的肝组织裂解物(100 μg)或核提取物(50 μg)在12% SDS/PAGE凝胶中上样电泳,并电转印到PVDF膜上。转印效率可通过预染标准蛋白分子质量观察判断。然后将膜在25 ℃、5%(w/v)脱脂奶粉浸泡1 h。随后将PVDF膜在特异性抗人NF-κB p50、P65、IκB和β-action的多克隆或单克隆抗体中4 ℃下孵育过夜,抗体1∶500或1∶1 000稀释。洗膜后,用含辣根过氧化物酶联兔或山羊抗小鼠的二抗在0.1% TTBS(1∶5 000稀释)和5%(W/V)脱脂奶粉中室温孵育1 h。重复洗膜步骤,并根据说明书用增强的ECL化学发光液检测各实验组肝脏中上述蛋白表达情况。
1.2.4 免疫组化检测肝组织NF-κB p65的分布:用间接免疫过氧化物酶方法,根据免疫组化检测试剂和DAB试剂盒说明书,用二步法检测对照组、I/R组和V-PYRRO/NO组大鼠石蜡包埋组织切片中的NF-κB p65蛋白定位情况。将切片脱蜡、水化,在3% H2O2甲醇溶液中浸泡20 min使内源性过氧化物酶而失活。待抗原修复后,将切片用含有10%正常小牛血清的PBS液中封闭30 min,后用小鼠NF-κB p65单克隆抗体在4 ℃下孵育过夜(该单克隆抗体用含0.5%牛血清白蛋白的磷酸缓冲液进行1∶100稀释)。PBS液冲洗3次,将切片在含有羊抗小鼠IgG-HRP二抗溶液中孵育1 h。最后将切片先用二氨基联苯胺染色,后用苏木精复染。
1.3 统计学分析
2 结果
2.1 RT-PCR检测大鼠肝脏LTC4S mRNA的表达
I/R组肝脏组织中LTC4S mRNA的表达显著高于假手术组(P<0.05),而V-PYRRO/NO 干预后,LTC4S mRNA的表达则明显回降(P<0.05)(图1)。
2.2 免疫印迹分析大鼠肝脏NF-κB p50、 p65 和IκB蛋白表达变化
肝脏I/R损伤期间,I/R 组肝细胞核蛋白NF-κB p65 和p50的表达显著高于假手术组(P<0.01),然而,其在细胞质中的表达明显低于假手术组(P<0.01);与I/R组相比,V-PYRRO/NO 组大鼠核提取物中NF-κB p65和P50蛋白表达水平明显降低(P<0.05),而在胞质裂解物中则明显升高(P<0.01,P<0.05)。但IκB蛋白表达水平在各组之间差异不明显(图2)。
2.3 免疫组化染色分析大鼠肝脏切片中NF-κB p65表达变化
在正常大鼠肝脏中,胞质和胞核内NF-κB p65几乎不着色; I/R组大鼠肝脏组织中,胞质和胞核NF-κB p65表达强阳性; V-PYRRO/NO 组大鼠肝脏组织中NF-κB p65阳性反应较I/R组明显减少(图3)。

A.hepatic mRNA expression of LTC4S in the sham, I/R and V-PYRRO/NO groups; B.densitometric analysis of PCR products of LTC4S in the sham, I/R and V-PYRRO/NO groups;*P<0.05 compared with sham;#P<0.05 compared with I/R
图13组肝脏组织LTC4SmRNA的表达
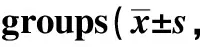

A.hepatic protein expressions of NF-κB p65, p50 and IκB in the sham, I /R and V-PYRRO/NO groups; B.protein relative expression of NF-κB p65, p50 and IκB in the sham, I/R and V-PYRRO/NO groups;*P<0.01 compared with sham;#P<0.05,##P<0.01 compared with I/R
图23组肝脏NF-κBp65、p50和IκB蛋白表达

3 讨论
不少文献报道在肝脏I/R的发病机制中涉及白三烯[2]。LTC4S是生物机体合成半胱氨酰白三烯(LTC4、LTD4和LTE4)的重要催化酶。研究表明内源性NO是心血管系统、神经系统和免疫系统的关键信使分子,在肝I/R过程中发挥重要作用[1,6]。已有研究均显示Cys-LTs和NO之间存在相关性[7]。本实验进一步研究了特异性肝脏一氧化氮供体V-PYRRO/NO能否调节大鼠LTC4S的基因表达。结果表明V-PYRRO/NO可以完全反转大鼠肝脏I/R导致的LTC4S基因表达的增加。
有关NO能否激活NF-κB 信号通路尚不完全清楚。据报道在单核吞噬细胞中,LPS可以通过激活NF-κB抑制LTC4S基因表达和Cys-LTs释放[10]。NF-κB 激活的主要途径取决于IκK复合物的活化,其导致IκB丝氨酸残基磷酸化和通过泛素蛋白酶复合体系统降解IκB[11]。本课题组前期研究表明硝普钠(SNP)通过抑制NF-κB的激活来下调LTC4S的mRNA表达并不依赖于IκBα的降解[8]。
本实验通过免疫印迹方法检测了肝脏细胞核提取物和胞质中NF-κB p50、p65和 IκB蛋白表达水平。

A.immunohistochemical staining for NF-κB p65 in sham liver with few cytoplasm and nuclei staining; B.immunohistochemical staining for NF-κB p65 in I/R liver with strong cytoplasm and nuclei staining (arrows); C.immunohistochemical staining for NF-κB p65 in V-PYRRO/NO + I/R liver with slight cytoplasm and nuclei staining(arrows)
图33组大鼠肝脏细胞质和细胞核NF-κBp65染色情况
Fig3ThecytoplasmicandnuclearstainingforNF-κBp65insham,I/RandV-PYRRO/NOgroups(×200)
发现在大鼠肝脏I/R早期,V-PYRRO/NO明显减少了细胞核提取物中NF-κB p65和p50的蛋白水平,而肝脏胞质中的NF-κB p65 和p50蛋白水平则明显增加,但IκB蛋白的表达在各实验组中没有明显差别。为了进一步评估NF-κB在肝组织中的分布定位改变,本实验采用免疫组化法观察肝组织切片中NF-κB p65在细胞质和胞核内的表达分布情况。结果显示在正常肝组织中细胞质和细胞核NF-κB p65几乎未见阳性反应,I/R肝组织中细胞质和细胞核NF-κB p65表达强阳性,而V-PYRRO/NO+I/R组肝脏组织细胞质和胞核中NF-κB p65阳性反应明显减弱。这些结果表明,在大鼠肝脏I/R损伤中外源性NO受体V-PYRRO/NO抑制了NF-κB的激活,且不依赖于IκBα的降解。结合上述LTC4S基因表达结果,可以推断V-PYRRO/NO通过不依赖于IκBα降解途径抑制NF-κB激活,进而下调LTC4S 的mRNA表达。此结果与之前的报道相似,该报道表明在I/R损伤中NF-κB的激活通过依赖c-Src的IκBα而非I-κBβ酪氨酸磷酸化途径,这个过程是在缺乏I-κBα依赖的泛素化降解的情况下发生的[5, 8]。然而,V-PYRRO/NO能否通过NF-κB信号通路由c-Src依赖酪氨酸磷酸化的I-κBα来调节LTC4S的基因表达有待进一步的研究证实。本研究将为临床应用NO供体治疗与肝脏I/R损伤有关疾病提供新的实验理论依据。
:
[1] Zhu J, Zhu F, Song W,etal. Altered miR- 370 expression in hepatic ischemia-reperfusion injury correlates with the level of nuclear kappa B (NF-kappaB) related factors[J]. Gene, 2017,607:23- 30.
[2] Hong F, Yang S. Ischemic preconditioning decreased leukotriene C4 formation by depressing leukotriene C4 synthase expression and activity during hepatic I/R injury in rats[J]. J Surg Res,2012,178:1015- 1021.
[3] Tsoulfas G, Geller DA. NF-κB in transplantation: friend or foe? [J]. Transpl Infect Dis, 2001,3:212- 219.
[4] Fan C, Li Q, Ross D,etal. Tyrosine phosphorylation of I kappa B alpha activates NF kappa B through a redox-regulated and c-Src-dependent mechanism following hypoxia/reoxygenation[J]. J Biol Chem, 2003,278:2072- 2080.
[5] Demirbilek S, Karaman A, Gurunluoglu K,etal. Polyenylphosphatidylcholine pretreatment protects rat liver from ischemia/reperfusion injury[J]. Hepatol Res, 2006,34:84- 91.
[6] Liu H, Li Q, Wang Y,etal. Elevated nitric oxide levels associated with hepatic cell apoptosis during liver injury[J]. Hepatol Res, 2016, doi:10.1111/hepr.12783.
[7] Yang SL, Lou YJ. Sodium nitroprusside decreased leukotriene C4 generation by inhibiting leukotriene C4 synthase expression and activity in hepatic ischemia-reperfusion injured rats[J]. Biochem Pharmacol, 2007,73:724- 735.
[8] Yang SL, Chen LJ, Kong Y,etal. Sodium nitroprusside regulates mRNA expressions of LTC4 synthesis enzymes in hepatic ischemia/reperfusion injury rats via NF-kappaB signaling pathway[J]. Pharmacology, 2007,80:11- 20.
[9] Hong FF, He CS, Tu GL,etal. Nitric oxide donor regulated mRNA expressions of LTC4 synthesis enzymes in hepatic ischemia reperfusion injury rats//Li S, Jin Q, Jiang X,etal. Frontier and future development of information technology in medicine and education lecture notes in electrical engineering, Vol 269[M]. Dordrecht:Springer Science+Business Media, 2014:3359- 3366.
[10] Serio KJ, Johns SC, Luo L,etal. Lipopolysaccharide down-regulates the leukotriene C4 synthase gene in the monocyte-like cell line, THP- 1[J]. J Immunol, 2003,170:2121- 2128.
[11] Mercurio F, Zhu H, Murray BW,etal. IKK- 1 and IKK- 2: cytokine-activated I-KB kinases essential for NF-KB activation[J]. Science,1997,278:860- 866.
