丁烯基多杀菌素高产菌株的诱变选育及培养基优化
2018-05-30张晓琳张云鹏李金萍
陈 爽, 赵 晨, 黎 琪, 王 超, 张晓琳, 张云鹏, 李金萍, 方 俊
(1.湖南农业大学生物科学技术学院,湖南长沙 410128; 2.国家粮食局科学研究院,北京 100037; 3.北京市植物保护站,北京 100029)
丁烯基多杀菌素(butenyl-spinosyns)[1-3]是由土壤放线菌须糖多孢菌(Saccharopolysporapogona)代谢产生的一类与多杀菌素结构类似、杀虫机制相同的大环内酯类杀虫剂[4-5]。其杀虫谱比多杀菌素更为广泛,对多杀菌素无法控制的烟青虫[6]、苹果蠹蛾、马铃薯甲虫等均有较好的杀虫活性[7-9]。其杀虫机制与多杀菌素相同,通过作用于昆虫的神经系统,致其非功能性的肌肉收缩、衰竭,并伴随颤抖和麻痹,最终导致死亡[10-12]。此外,丁烯基多杀菌素比多杀菌素具有更多的衍生物,到目前为止,已检测到30多种丁烯基多杀菌素衍生物[1],丁烯基多杀菌素作为一种新型的生物农药在防治害虫方面有良好的应用价值和广阔的市场前景。
通过理化诱变筛选丁烯基多杀菌素高产菌株和培养基优化是提高其发酵产量的主要方法[13]。目前,常规的诱变选育方法仍然是获得高产菌株的有效手段之一[14-15],其中亚硝基胍(nitroso-guanidin,简称NTG)是一种超诱变剂,应用广泛,能与1个或几个核酸碱基反应,引起DNA复制时碱基配对的转换而发生遗传变异[16]。本研究利用NTG对前期筛选到的ASAGF58菌株进行诱变,拟筛选丁烯基多杀菌素稳定高产突变株,并通过单因素试验和正交试验对高产突变株的发酵培养基进行优化,以期获得高产丁烯基多杀菌素的配方。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 须糖多孢菌(S.pogona)ASAGF58由国家粮食局科学研究院发酵生物技术实验室筛选和保藏。
1.1.2 生测幼虫 埃及伊蚊(Aedesaegypti)由中国疾病预防控制中心提供。
1.1.3 培养基 产孢培养基:10.00 g/L葡萄糖,5.00 g/L酪蛋白胨,5.00 g/L酵母提取物,5.00 g/L牛肉膏,0.74 g/L CaCl2·2 H2O,15.00 g/L琼脂,pH值为7.2。诱变种子培养基:30.0 g/L胰蛋白大豆肉汤,3.0 g/L酵母提取物,2.0 g/L MgSO4,10.0 g/L葡萄糖,pH值为7.2。诱变发酵培养基:64.80 g/L 葡萄糖,54.60 g/L糊精,15.00 g/L酵母膏,9.00 g/L 酵母提取物,15.00 g/L胨化牛奶,1.20 g/L(NH4)2SO4,3.00 g/L NaCl,0.05 g/L FeSO4,1.00 g/L K2HPO4,pH值为7.2。种子培养基:10.0 g/L糊精,30.0 g/L酪蛋白胨,3.0 g/L酵母提取物,2.0 g/L MgSO4·7H2O,0.5 g/L KH2PO4,pH值为7.2。发酵培养基:60.00 g/L葡萄糖,20.00 g/L玉米浆干粉,5.00 g/L NaCl,5.00 g/L CaCO3,1.02 g/L MgSO4·7H2O,pH值为7.2。以上培养基均于 115 ℃ 灭菌25 min。
1.1.4 主要试剂与仪器 CH3OH、CH3CN均为色谱纯,均购自德国Merck公司;碳源均为分析纯,均购自国药集团化学试剂北京有限公司;氮源均为分析纯,均购自英国Oxoid公司。
Waters 515/2487型高效液相色谱仪,购自美国Waters公司;全自动移液工作站epMotion 5070,购自德国Eppendorf公司;ISF12X恒温恒湿摇床,购自瑞士Adolf Kuhner公司;HPS400生化培养箱,购自哈尔滨市东联电子技术开发有限公司;离心机,购自德国Eppendorf公司;96孔细胞培养板,购自美国BD公司。
1.2 试验方法
1.2.1 制备孢子悬浮液 将出发菌株在产孢培养基上于 28~30 ℃ 培养6~8 d,用0.08%葡萄糖溶液冲洗斜面,用无菌竹签将成熟孢子轻轻刮下,将孢子液移入含有玻璃珠的三角瓶中,振荡。打散后的孢子液于孢子过滤器中进行过滤,收集孢子悬浮液在28~30 ℃孵育8 h,孢子萌发后用血球计数板计数,孢子悬浮液浓度约控制在108个/mL。
1.2.2 NTG诱变 取萌发好的孢子悬浮液分别分装于含有2、3、4、5 mg/mL NTG溶液的Eppendorf管中,充分混匀,分别处理10、20、30、40、50、60 min后,于4 000 r/min离心10 min,收集菌体,用生理盐水洗涤3次后,取100 μL孢子悬浮液进行10倍梯度稀释涂平板,每个梯度设3个重复;取未经NTG诱变的孢子悬浮液进行稀释涂布,每个稀释度设置3个重复,作为对照组。将平板置于29 ℃培养6~8 d,形成单菌落。
1.2.3 生测初筛 向96孔板发酵液中加入2倍体积的甲醇浸提丁烯基多杀菌素,振荡,4 000 r/min离心15 min,取 100 μL 上清液于新的96孔板中,避光条件下将有机溶剂挥发干净,每孔加入100 μL去离子水复溶丁烯基多杀菌素,再向每孔加入5~8头埃及伊蚊幼虫,每隔1 h观察记录1次试验结果。每组试验设置3个重复[17]。
1.2.4 培养条件 96孔板种子培养:接种量为15%,温度为29 ℃,摇床转速为280 r/min,一级种子培养60 h,二级种子培养48 h。96孔板发酵培养:接种量为15%,温度为29 ℃,摇床转速为280 r/min,培养8~10 d。种子摇瓶培养:300 mL三角瓶接种量为10%,温度为29 ℃,摇床转速为240 r/min,培养48 h。发酵摇瓶培养:300 mL三角瓶接种量为10%,温度为29 ℃,摇床转速为240 r/min,培养7 d。
1.2.5 发酵液测定方法 丁烯基多杀菌素发酵产量的测定:取2 mL发酵液,加入4 mL甲醇浸提15 min,振荡混匀,4 000 r/min 离心15 min,取1 mL上清液,12 000 r/min离心15 min,取上清液进行高效液相色谱(high performance liquid chromatography,简称HPLC)分析。HPLC分析条件:Waters515型高效液相色谱仪,安捷伦XDB-C18反向色谱柱,流动相中甲醇、乙腈、水的体积比为45 ∶45 ∶10(0.05%乙酸铵用水溶解后与有机试剂混合组成流动相),流速 1.0 mL/min,检测波长为244 nm。根据积分面积,计算产量。
生物量测定:取8 mL发酵液,4 000 r/min离心15 min,计算固体沉淀占发酵液的质量分数。
1.2.6 发酵培养基优化 单一碳源:以葡萄糖、乳糖、蔗糖、麦芽糖、甘露醇、糊精、甘油、可溶性淀粉等作为单一碳源,添加量均为60 g/L,基础发酵培养基中其他组分不变。复合碳源:60 g/L葡萄糖分别与10、20、30、40、50 g/L可溶性淀粉、糊精、甘露醇等搭配。速效氮源:玉米浆干粉、胨化牛奶、酵母膏、牛肉膏;迟效氮源:以棉籽蛋白、大豆饼粉、大豆蛋白胨、酪蛋白胨、酵母提取物、乳清蛋白等作为单一氮源,添加量均为20 g/L,其他组分不变。复合氮源:20 g/L玉米浆干粉分别与20 g/L棉籽蛋白、大豆饼粉、乳清蛋白等搭配。正交试验:将葡萄糖、糊精、玉米浆干粉、棉籽蛋白等进行4因素4水平正交试验。
1.2.7 数据处理 数据采用Excel、Origin 8.0、SPSS 16.0 for Windows等软件进行分析。
致死率=[(诱变前总菌落数-诱变处理后的总菌落数)/诱变前总菌落数]×100%;突变率=正突变率+负突变率。
2 结果与分析
2.1 NTG诱变对须糖多孢菌的作用
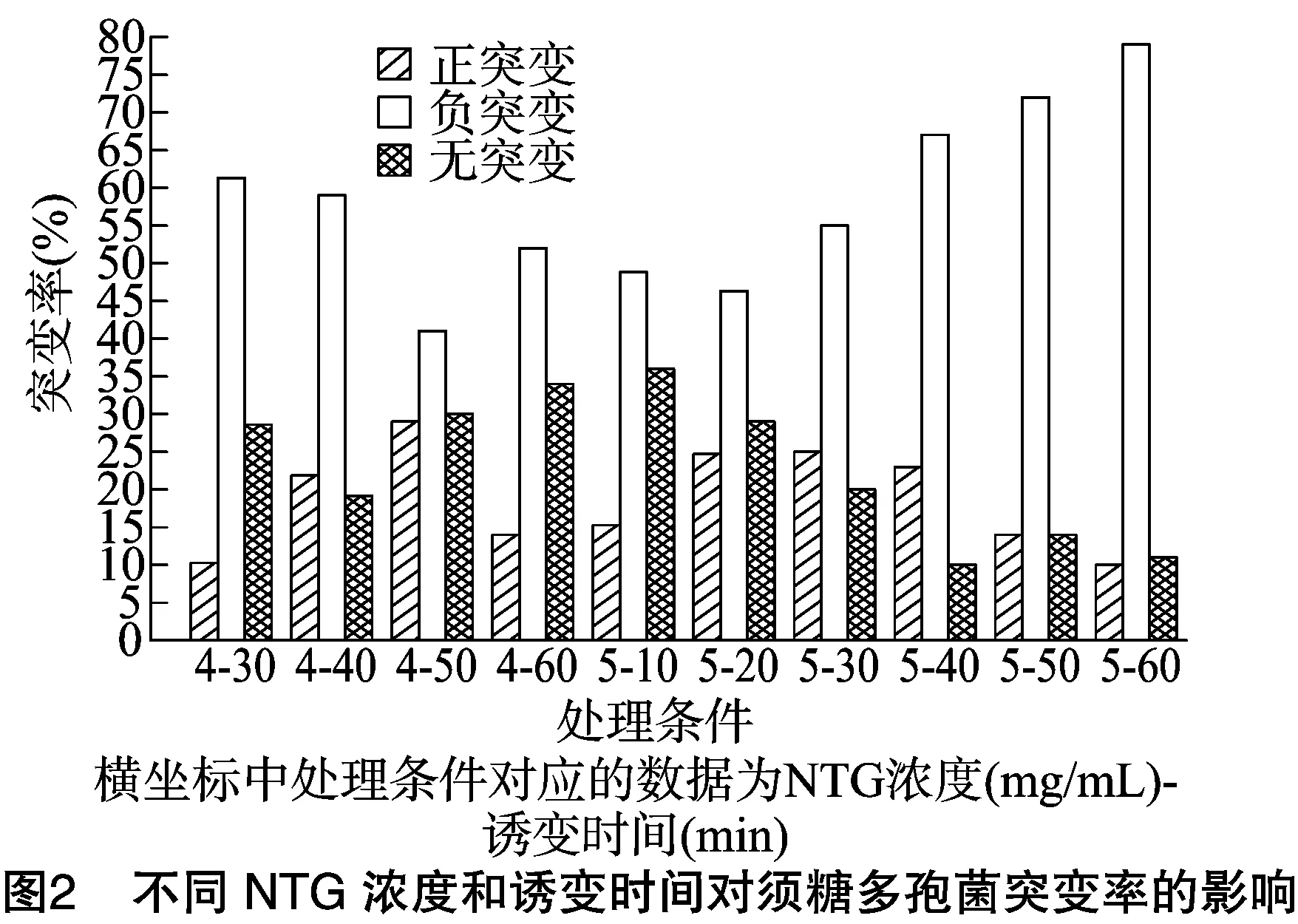
2.1.1 NTG对ASAGF58菌株的诱变效应 由图1可知,不同浓度的NTG对ASAGF58菌株的致死率均随着诱变时间的延长而增大,其中高浓度的NTG诱变效果明显强于低浓度。据报道,致死率为80.0%~90.0%时,正突变菌株较多,致死率为90.0%~99.9%时,负突变菌株较多[14]。NTG浓度为2、3 mg/mL时,最大致死率不足50%,因此不进行统计分析。对ASAGF58菌株的正负突变率进行分析,由图1、图2可知,当NTG浓度为4 mg/mL时,诱变50 min时致死率为85%,此时正突变率最大,为29%;当NTG浓度为5 mg/mL时,诱变30 min时致死率为88%,此时正突变率最大,为25%,这与何新舟等的研究结果[14]一致。挑取1 500株单菌落经初筛、复筛后,得到28株丁烯基多杀菌素产量提高20%以上的突变菌株,7株产量提高30%以上的突变菌株。其中,7株高产菌株对应不同的NTG浓度和时间,说明NTG诱变对丁烯基多杀菌素产量的影响是随机的。
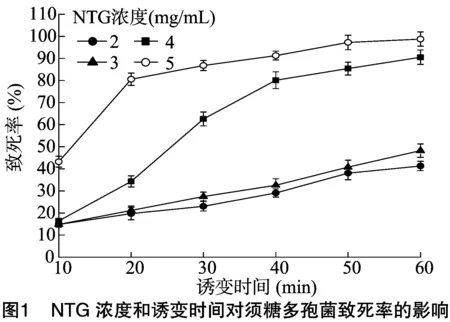
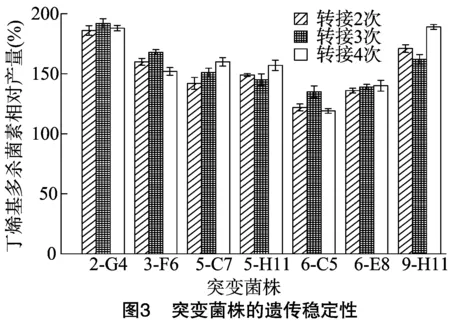
2.1.2 高产菌株遗传稳定性验证 由于突变菌株自身携带修复机制以及遗传不稳定性等特点,在进行菌种转接过程中可能会出现表型延迟现象,导致突变株发酵产量下降[18]。因此,须要对筛选出的7株高产突变菌株进行遗传稳定性验证。由图3可知,2-G4突变株转接3、4次后丁烯基多杀菌素发酵产量与转接2次相比,分别提高3.2%、1.08%;与转接2次相比,9-H11突变株在转接3次时产量下降5.3%,转接4次时产量提高 10.53%,产量变化幅度超过10%,表明9-H11菌株的遗传稳定性较差;此外,其余5个菌株与2-G4菌株相比相对产量较低。ASAGF58菌株经NTG诱变后筛选出1株发酵产量较高,且遗传稳定的突变菌株2-G4(5 mg/mL NTG诱变50 min),与出发菌株相比,其丁烯基多杀菌素产量提高86.7%。
2.2 发酵培养基优化
2.2.1 碳源筛选 碳源、氮源是培养基的重要组成部分,同时严重影响菌丝体生长及微生物次级代谢产物的产量。以高产菌株2-G4作为出发菌株,前期预试验结果显示,除葡萄糖、甘露醇外,突变菌株2-G4在其余几种单一碳源培养基中丁烯基多杀菌素的产量均为0,而以葡萄糖作为单一碳源时,丁烯基多杀菌素发酵产量和生物量都优于甘露醇。因此,选择葡萄糖作为碳源进行下一步的优化试验。由表1可知,培养7 d后菌体的生物量均有所增加,尤其当葡萄糖与 30 g/L 糊精搭配时生物量达到最大值,为 6.53%;同时,大部分复合碳源发酵后均有利于丁烯基多杀菌素产生,其中当糊精加入量为50 g/L时,相对产量达到最大值,为111.6%,其次是糊精加入量为40 g/L时。可能是葡萄糖作为速效碳源,前期容易被菌体很好地吸收利用,而作为迟效碳源的糊精在发酵过程中缓慢分解成葡萄糖被利用。因此,选择60 g/L葡萄糖和50 g/L糊精进行下一步培养基优化试验。
2.2.2 氮源筛选 由表2可知,大多数单一有机氮源的添加均有利于2-G4突变菌株产丁烯基多杀菌素,特别是含有玉米浆干粉的培养基,突变菌株经发酵后丁烯基多杀菌素的相对产量最高,为110%,胨化牛奶作为氮源时次之。从菌体生长情况来看,以胨化牛奶作为单一氮源时所获得的菌体生物量最高,为6.4%,玉米浆干粉次之。考虑到培养基成本等因素,发酵培养基中添加20 g/L玉米浆干粉对丁烯基多杀菌素的生成有明显的促进作用。
由图4可知,玉米浆干粉与棉籽蛋白、大豆饼粉搭配时,丁烯基多杀菌素的相对产量明显高于它与乳清蛋白、胨化牛奶搭配时的产量。可能因为玉米浆干粉与棉籽蛋白、大豆饼粉搭配作氮源时,其氨基酸的种类及含量更适合丁烯基多杀菌素的产生。2-G4突变菌株在含棉籽蛋白的培养基中丁烯基多杀菌素的相对产量比含大豆饼粉的高8%,因此,选择玉米浆干粉和棉籽蛋白作为复合氮源。
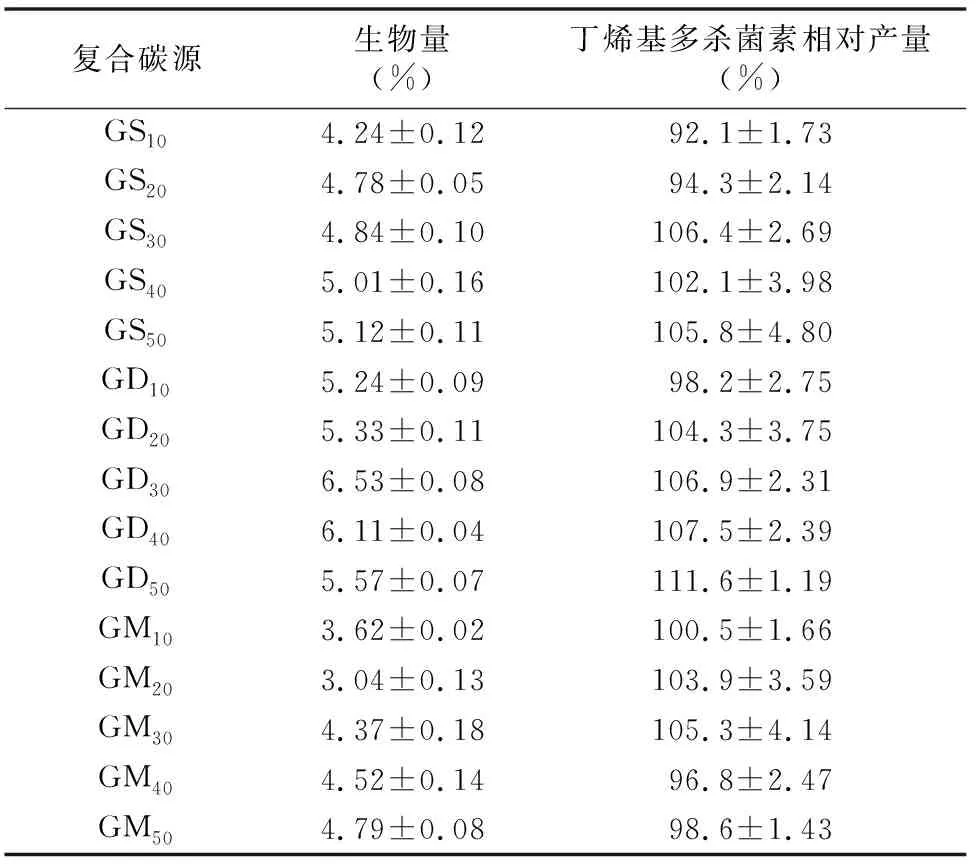
表1 不同碳源对菌体生长和丁烯基多杀菌素合成的影响
注:G代表60 g/L葡萄糖;S代表可溶性淀粉;D代表糊精;M代表甘露醇;字母下标数字代表相应的碳源含量,单位为g/L。以2-G4菌株在以葡萄糖作为单一碳源时丁烯基多杀菌素的产量作为100%。
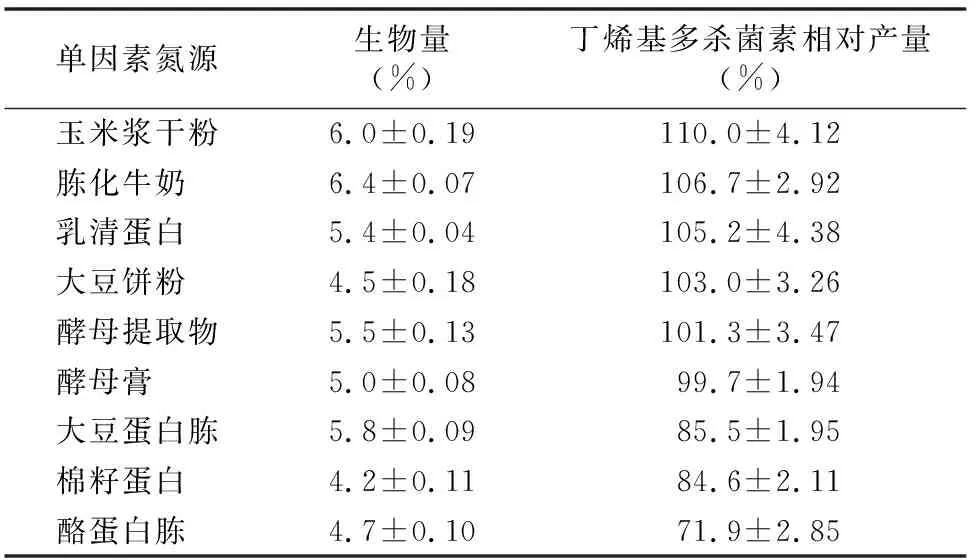
表2 单一有机氮源对菌体生长和丁烯基多杀菌素合成的影响
注:以2-G4菌株在60 g/L葡萄糖、50 g/L糊精为碳源的基础培养基中丁烯基多杀菌素的产量作为100%。
2.2.3 正交试验 根据单因素试验结果,设计4因素4水平的正交试验。由表3可知,各因素对丁烯基多杀菌素生成的影响表现为C(玉米浆干粉用量)>A(葡萄糖用量)>B(糊精用量)>D(棉籽蛋白用量)。通过方差分析可知,突变菌株2-G4产丁烯基多杀菌素的发酵培养基最佳碳源、氮源组合为A3B2C1D4,即100 g/L葡萄糖、50 g/L糊精、20 g/L玉米浆干粉、80 g/L棉籽蛋白。验证试验表明,突变菌株在该培养基中丁烯基多杀菌素的产量比优化前提高52.1%。
3 讨论
以ASAGF58作为出发菌株进行不同NTG浓度(2、3、4、5 mg/mL)和不同作用时间(10、20、30、40、50、60 min)的诱变,通过96孔板发酵培养结合生物检测进行初筛、摇瓶复筛后,丁烯基多杀菌素产量提高30%以上的突变株有7株,经遗传稳定性验证后最终获得1株高产菌株2-G4(5 mg/mL NTG诱变50 min),与出发菌株相比,其丁烯基多杀菌素产量提高86.7%。其中,5 mg/mL NTG比其他浓度的致死率高,负突变率也相对较高,而正突变率偏低,但筛选出的高产菌株大多数来自该浓度,表明诱变效果与致死率、突变率无明显相关性。说明NTG对丁烯基多杀菌素产量的影响是随机的。
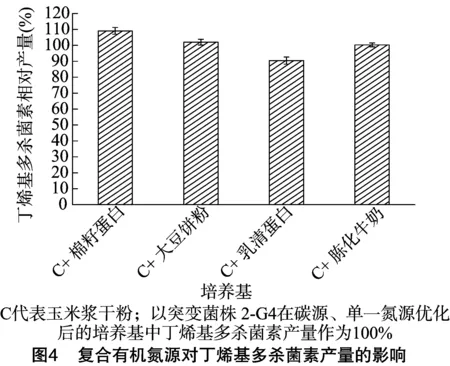
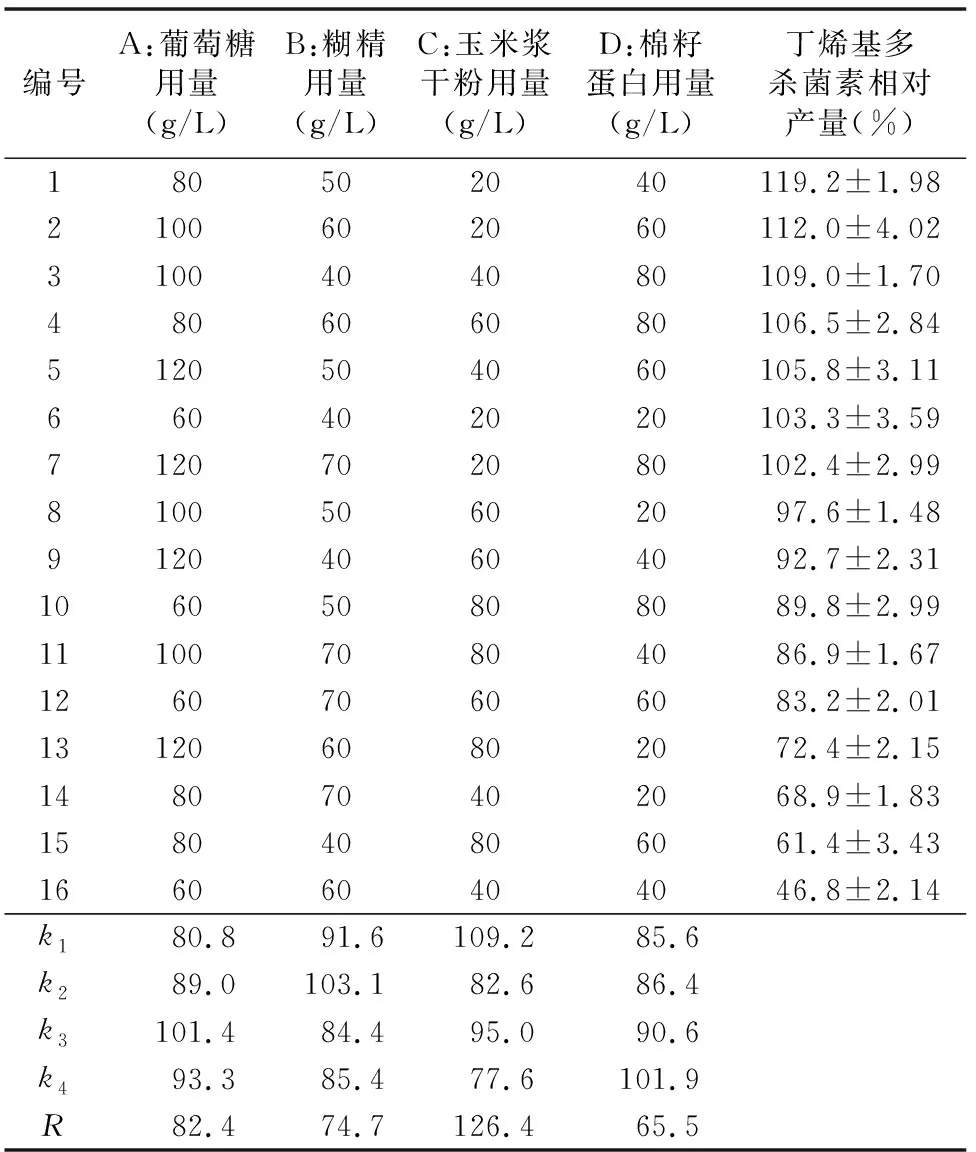
表3 正交试验结果
注:以2-G4菌在优化后的培养基中发酵产量为100%。
以突变菌株2-G4为出发菌株,进行碳源、氮源单因素优化试验,结果显示,当培养基中加入葡萄糖、糊精、玉米浆干粉、棉籽蛋白时均能有效促进突变菌株的生长和丁烯基多杀菌素产量的提高。其中,葡萄糖作为速效碳源能被迅速分解利用参与生长代谢,糊精作为迟效碳源易被菌体水解为单糖后再利用,用于维持菌体代谢和产物合成;玉米浆干粉含有较为丰富的蛋白质和生长因子,作为速效氮源能有效促进菌体生长,而棉籽蛋白的添加更有利于生产丁烯基多杀菌素。在此基础上进行4因素4水平正交试验,得到优化后的发酵培养基配方为100.00 g/L葡萄糖、50.00 g/L糊精、20.00 g/L玉米浆干粉、80.00 g/L棉籽蛋白、5.00 g/L NaCl、5.00 g/L CaCO3、1.02 g/L MgSO4·7H2O,pH值为7.2。突变菌株2-G4在优化后的培养基中丁烯基多杀菌素的产量比优化前提高52.1%。
:
[1]Lewer P,Hahn D R,Karr L L,et al. Discovery of the butenyl-spinosyn insecticides:novel macrolides from the new bacterial strainSaccharopolysporapogona[J]. Bioorganic and Medicinal Chemistry,2009,17(12):4185-4196.
[2]Hahn D R,Gustafson G,Waldron C,et al. Butenyl-spinosyns,a natural example of genetic engineering of antibiotic biosynthetic genes[J]. Journal of Industrial Microbiology & Biotechnology,2006,33(2):94-104.
[3]Hahn D R,Jackson J D,Bullard B S,et al. Biosynthetic genes for butenyl-spinosyn insecticide production:WO02079477[P]. 2002-03-28.
[4]Huang K X,Xia L,Zhang Y,et al. Recent advances in the biochemistry of spinosyns[J]. Applied Microbiology and Biotechnology,2009,82(1):13-23.
[5]Chio E H. Spinosyn insecticides:part Ⅰ. Blockbuster products from a remarkable discovery[J]. Formosan Entomol,2011,31(1):1-13.
[6]刘 佳,王 毅,郭线茹,等. 棉铃虫与烟青虫雌性信息素合成进展[J]. 农药,2016,10(55):703-706,780.
[7]殷怀生,张文军. 苹果蠹蛾绿色防治药剂筛选试验[J]. 中国园艺文摘,2017,33(2):64-65.
[8]Millar N S,Denholm I. Niotinic acetylcholine receptors:targets for commercially important insecticides[J]. Invertebrate Neuroscience,2007,7(1):53-66.
[9]寿佳丽,裘娟萍. 新型生物农药——丁烯基多杀菌素[J]. 农药,2011,50(4):239-243,272.
[10]Raymond-Delpech V,Matsuda K,Sattelle B M,et al. Ion channels:molecular targets of neuroactive insecticides[J]. Invertebrate Neuroscience,2005,5(3/4):119-133.
[11]Kirst H A. The spinosyn family of insecticides:realizing the potential of natural products research[J]. The Journal of Antibiotics,2010,63(3):101-111.
[12]华乃震. 绿色环保生物杀虫剂多杀霉素和乙基多杀菌素的述评[J]. 农药,2015,54(1):1-5.
[13]邬 洋,徐 妙,罗林根,等. 丁烯基多杀菌素高产菌株的巴龙霉素抗性筛选[J]. 中国生物防治学报,2015,31(1):106-114.
[14]何新舟,查东风,黄汉峰,等. 亚硝基胍诱变丙酸杆菌选育高产抑菌物质菌株[J]. 安徽农业科学,2016,44(2):18-20.
[15]李 丽. 多杀菌素高产菌株的诱变育种和发酵工艺优化[D]. 天津:天津科技大学,2009.
[16]雷肇祖,钱志良,章 健. 工业菌种改良述评[J]. 工业微生物,2004,34(1):39-51.
[17]陈 园,熊 犍,王 超,等. 多杀菌素高产菌株快速筛选方法的研究[J]. 粮油食品科技,2013,21(4):99-102.
[18]郭伟群,邹球龙,陈 园,等. 多杀菌素高产菌株的诱变选育及代谢曲线初步研究[J]. 中国抗生素杂志,2014,39(4):245-248.
