养殖水产品中磺胺类药物的检测方法及残留分析研究进展
2018-05-30余丽梅陈家长
余丽梅, 宋 超, 张 聪, 陈家长,
(1.南京农业大学无锡渔业学院,江苏无锡 214081; 2.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081;3.农业部水产品质量安全环境因子风险评估实验室,江苏无锡 214081; 4.农业部长江下游渔业生态环境监测中心,江苏无锡 214081)
中国是水产养殖大国,据中国统计年鉴报道,2013年我国水产品总产量达6 172万t,而人工养殖所占比例高达 92.4%[1]。中国是抗菌药物生产和使用大国[2]。抗菌药物在水产品养殖过程中主要用于多种细菌性疾病的预防和治疗、促进水生动物的生长和发育以及降低某些营养物质的需求量等[3]。但抗菌药物在使用过程中常常出现乱用和滥用现象[4],导致污染问题严重。养殖废水中残留的抗菌药物可能对水生环境造成污染[5],破坏水生环境的生态系统平衡性;而水产品是与人类生活息息相关的食物之一,抗菌药物药物的不合理使用导致水产品中药物残留,能够直接或者间接地通过环境、食物链等对人体产生毒副作用,引起细菌耐药性的增加、触发过敏反应等[6],从而对人类健康构成威胁。
磺胺类抗菌药物是一种具有基本官能团“对氨基苯磺酞胺”的一类药物的总称[7],也是应用得最多最早的一类人工合成的抗菌药物[8]。它能够干扰大多数革兰氏阳性菌和阴性菌的生长繁殖,对鱼类烂鳃病、细菌性竖鳞病、疖疮、弧菌病、肠炎赤鳍病、鞭毛虫病等也都有良好的防治效果[9-10];并且性质稳定、高效、低毒、抗菌谱广、价格低廉,因此在水产养殖中被广泛使用,例如作为动物饲料添加剂、促生长剂[11]、预防和治疗各种细菌性鱼病等,对于降低水产品的发病率、改善水产品品质[9]和提高经济效益方面均具有显著效果。
然而,磺胺类抗菌药物不合理使用可能逐渐成为一种新型的有机污染物,对环境和人体健康都存在潜在的威胁,因此其在养殖水产品中的残留情况日益受到关注。本研究主要对磺胺类抗菌药物在水产养殖中的应用情况、检测方法以及在养殖水产品中的残留情况作简要综述,并指出了一些不足和需要进一步探究的方向,对深入了解磺胺类抗菌药物在养殖水产品中的残留情况,及时采取危害防治措施、保护人类健康和生态系统稳定都具有重要意义。
1 水产品中的磺胺类抗菌药物的来源和危害
1.1 水产品中的磺胺类抗菌药物的来源
水产品中的磺胺类抗菌药物主要来源于2个方面:养殖水体和养殖本身的投加。养殖水体是水生生物的集聚场所,具有颗粒悬浊物多、水色深、组成多样、生物密度高、抗菌药物组成复杂等特点。水中抗菌药物的存在直接会引发水产品中的抗菌药物残留量蓄积,在给人们健康带来极大隐患的同时也严重阻碍了我国水产品进出口贸易的发展[12]。养殖水体中的抗菌药物主要来源于以下3个方面:地表水、地下水及应用水等水资源的污染;土壤、底泥等沉积物的抗菌药物残留;水产养殖管理者人为的添加。动物粪便中已有多种磺胺类抗菌药物检出[13],而在许多地区,动物粪便作为有机肥料被广泛施用于田间,造成水体和土壤污染,污染的土壤经雨水淋滤、地表径流等作用又间接地污染了地表水和地下水,它们之间又通过补给关系造成交叉污染[14]。养殖水体中残留的抗菌药物易被底泥吸附,这又进一步加深了养殖水体中抗菌药物污染的情况。何秀婷等在大亚湾、阳江等6个养殖区的沉积物中均能检出磺胺类抗菌药物的残留,其中磺胺嘧啶的检出率高达82.7%[15]。以饲料添加剂的形式应用于水产养殖是另一种抗菌药物直接进入水产品中的方式。早在20世纪70年代,我国平均每年就有约6 000 t的抗菌药物用作饲料添加剂[16]。抗菌药物饲料添加剂的作用机理可以概括为:(1)杀灭病原微生物,抑制病原菌增殖,使动物的养分增加,促进动物的顺利生长;(2)使动物的肠壁变薄,加强养分的吸收;(3)延长饲料在动物体消化吸收的时间;(4)提高机体的免疫能力,增强对外界环境变化的适应能力;(5)刺激机体的免疫系统,使得机体的各种生理活动加强加速,从而促进机体的生长发育。
1.2 水产品中的磺胺类抗菌药物的危害
1.2.1 诱导抗药性细菌的产生 低浓度的抗菌药物环境会使长期生长于其中的菌类的抗药性(抗药性是指生物,尤指病原微生物对抗菌药物产生的耐受和抵抗能力)增强,进而破坏人、动物和环境三者之间微生物系统的平衡性[14]。菌株的抗药性变异一经产生,就可以代代相传,因此携带抗药性基因的菌株可能成为了一种新型污染物;它们还可以感染原来没有抗药性的敏感菌,使抗药菌逐年增加。磺胺类抗菌药物的滥用已经导致了大量抗药性菌株的产生,给临床用药带来了很大的挑战,造成了一些细菌感染性疾病几乎无药可治的现状[17-19]。越南北部水环境中已经检测到25种抗药性菌属[20]。
1.2.2 对水产养殖业的危害 随着国家的发展,人们的生活水平不断提高,对水产品的需求量越来越大,水产养殖业的规模也在不断地扩大。但由于中国近几年的水产品生产主要为高密度、多品种、集约化的养殖模式,使得养殖过程中产品疾病率上升,很多养殖场为了预防和治疗各种疾病,加快水产品生长发育,提高产量和减少经济损失,而选择加大用药甚至盲目用药,导致饲料添加剂超标使用。磺胺类抗菌药物因具有高效、廉价、低毒且抗菌谱广的优点而成为目前水产养殖中用得最多、最广的抗菌药物之一[7],对鱼类的疖疮病、烂鳃病、肠炎病、弧菌病、细菌性败血病等疾病[8]具有良好的疗效。然而,投加的抗菌药物只有部分被利用,剩余的抗菌药物大多残留在水体、沉积物以及水生生物体内,这使得水产养殖过程中药物残留的问题更加严峻。养殖环境的污染、渔药与饲料添加剂的滥用、养殖及贮运过程中一些不规范的操作等造成了水产品养殖环境中理化污染、微生物病害及物理危害等现象,严重影响了水产品的质量安全[21];而且低浓度的抗菌药物环境会对长期生活于其中的水生生物有毒害作用,进而影响生态系统的稳定性[22]。有研究显示:抗菌药物可通过食物链进行传递,并通过食物链的传递作用进一步影响高级生物,以致破坏整个生态系统平衡[23]。

1.2.3 对人体的危害 水产品主要成分是水、蛋白质、脂肪、磷脂和维生素、无机盐等,其中尤以丰富的蛋白质含量(15%~25%)而被人类公认为是营养又美味的食品,是与人类生活息息相关的食物之一。但是,磺胺类抗菌药物在水产养殖过程中的不合理使用,极易产生药物残留,人类经常食用有磺胺类药物残留的动物性食品,就可能引起磺胺类药物在体内蓄积,对人体的消化系统、造血系统、肾脏等产生不良影响,具有潜在致突变、致畸、致癌等严重风险[17,45],磺胺二甲基嘧啶就存在使小鼠致癌的可能[46]。此外,磺胺类抗菌药物还易使人产生过敏反应、变态反应以及激素样作用[14]。
2 磺胺类抗菌药物残留的检测分析方法
抗菌药物污染问题已经受到各界的高度关注,水产品作为人们日常主要的食物之一,其质量安全也日益受到关注。水产品中的抗菌药物残留具有提取净化难、污染浓度低的特点,能快速准确地检测水产品中多种药物残留的检测及分析方法急需被研发。目前抗菌药物残留的检测技术有很多种,最常用的有免疫分析法、微生物法、毛细管电泳法和仪器分析法等。
2.1 免疫学分析法
免疫方法的基本原理是利用抗原抗体特异性结合反应来检测各种物质(药物、激素、蛋白质、微生物等)的分析方法。常见的主要有酶联免疫分析法(enzyme-linked immunosorbent assay,ELISA)、放射免疫分析法(radioimmunoassay,RIA)、荧光免疫分析(fluorescence immunoassay,FIA)、免疫亲和色谱(immunoaffinity chromatography,ICA)等。其中ELISA法由于特异性强、操作简便的特点成为最为常用的方法之一[47]。用于筛查水中磺胺类抗菌药物污染的ELISA法已经被Shelver等建立,且检出限<0.04 μg/L[48];多种磺胺药物的快速ELISA检测方法已经建立,并已初步应用于动物样品药物残留的检测工作中,对磺胺类药物表现了较高的敏感性[49]。免疫学分析方法虽具有操作简便、经济、灵敏度高等优点,适合现场对大量样品的快速筛检工作,但是在操作上也存稳定性不高的缺点,导致易出现假阳性的问题,不适合作确证性试验。
2.2 微生物法
微生物方法是应用较为广泛的一种检测方法,它的基本原理是利用特定菌株与药物的作用来检测样品中抗菌药物的种类和含量。微生物检测方法主要有分为亮黑还原法、纸片法、TTC法等[50]。该方法具有直观性强、成本低、操作简便等优点,但它的灵敏度和特异性相对较低且操作费时,已经逐渐不能满足当下各种抗菌药物残留的检测工作[51]。
2.3 毛细管电泳法(capillary electrophoresis,CE)

2.4 仪器分析法
仪器分析法是依据样品物质的各种表征特性,包括物理上、化学上的以及生理性质等方面的实验现象,再通过探头或传感器、放大器、分析转化器等转换成人体可直接感受的已认识的关于物质成分、含量、分布或结构等信息的分析方法。在抗菌药物残留检测分析领域,国内外目前应用得最多最广的仪器是各种色谱和质谱,如气相色谱、液相色谱、高效液相色谱、四极杆质谱仪(Q)、离子阱质谱仪(IT)、三重四级杆质谱仪以及液质联用仪等。
2.4.1 气相色谱法(gas chromatography,GC) 气相色谱法(GC)是色谱法的一种,根据固定相的不同,分为用固体吸附剂作固定相的气固色谱和用涂有固定液的单体作固定相的气液色谱。自James和Martin在1952年提出气液相色谱法后,磺胺类抗菌药物残留分析实验应用气相色谱法的较为广泛,主要采用的检测器为电子捕获检测器(ECD)。气相色谱法在1993年被规定为检测磺胺类抗菌药物残留的国家标准检测方法。但由于ECD的灵敏度较高,易受多种杂质的影响,使得对样品前处理、净化等过程要求较高,对操作人员的专业性要求也比较强,使得气相色谱法的应用不具有普遍性,且随着液相色谱法的发展,该方法己逐步被淘汰[56]。
2.4.2 液相色谱法(liquid chromatography,LC)和超高效液相色谱法(ultra performance liquid chromatography,UPLC) 液相色谱检测技术(LC)就是以液体作为流动相的色谱法,主要检测器配有:紫外可见光检测器(UV)、二级阵列检测器(diode array detector,DAD)、各种质谱仪(MS)等;色谱柱主要选用C8或C18;流动相分为高比例有机相和高比例水相,常用的有乙腈-甲酸、乙腈-乙酸、甲醇-乙酸、甲醇-乙酸铵等。 液相色谱法是获得国际公认分析磺胺类抗菌药物残留的方法,具有测定范围广、专一性强、灵敏度高等优点;此外,液相色谱流动相组成、比例以及酸碱度等均可根据待测物质灵活调节,辅助待测物质分离,能够使许多难挥发、强极性化的待测物质得以测定,弥补了气相色谱法不能准确检测分析这些化合物的缺点。但是同样存在对样品前处理要求较高的缺点,且仪器化程度高,分析周期长,不适宜进行药物残留的快速检测,所以目前主要用于一些药物的确证分析[18]。液相色谱法的色谱图不能直接给出未知物质的定性结果,必须在有已知标准作对照的前提下才能定性,当没有已知标准对照时,定性鉴定就很困难,这时需借助红外法、化学法、质谱法等配合;另外大多数金属盐类和热稳定性差的物质还不能分析,此缺点可用高效液相色谱法克服。
高效液相色谱(high performance liquid chromatography,HPLC)法是色谱法的另一个重要分支,也是以液体为流动相,不同的是采用高压输液系统,将缓冲液、不同极性的单一溶剂或者不同比例的混合溶剂等液体流动相泵入装有特定固定相的色谱柱中,各成分在柱内被分离后,进入检测器进行检测,从而实现对样品的检测分析。超高效液相色谱法(UPLC)是在高效液相色法的基础上,通过增加色谱峰容量、分析通量以及提高仪器灵敏度等,使得在其他条件相同的情况下,UPLC能分离的色谱峰量是HPLC的2倍以上。UPLC由于具有分析范围广泛、分离效率高、检测限低、分析时间短、自动化程度高等优点,在现代分析实验中得到了广泛应用。Xu等运用液相色谱-荧光检测器检测了食品中5种磺胺类抗菌药物的残留情况,检测限范围0.018~0.033 μg/kg[57]。Blackwell等应用高效液相色谱-紫外检测器检测地下水及地表水中的磺胺氯哒嗪、泰乐菌素、土霉素等抗菌药物的残留情况,其中磺胺氯哒嗪检出限低至0.25 μg/L[58];Casetta等应用高效液相色谱串联质谱法测定了蜂蜜中磺胺类抗菌药物残留情况[59]。
2.4.3 液质联用技术的发展 液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)是以液相色谱作为分离系统,质谱作为检测系统的一种结合方法:样品物质在液相色谱中经分离并离子化后,被质谱的质量分析器将离子化的碎片按质荷比分开,再经检测器检测得到质谱图。液质联用充分地利用了色谱和质谱各自的优势,使得色谱对复杂样品的高分离能力与质谱的高灵敏度、高选择性及能准确定性完美结合起来,提高了对复杂样品的分离分析能力。近些年色谱和质谱技术都在飞速地进步,如高效液相色谱(HPLC)、超高效液相色谱(UPLC)、高分离度快速液相色谱(RRLC)及超快速液相色谱(UFLC)等高性能技术的应用使检测分析更加高效;不同质谱配有不同的质量分析器,如常用四极杆质谱仪(Q)、离子阱质谱仪(IT)、飞行时间质谱仪(TOF)等。它们的联合应用使得检测分析更加准确可靠。目前,色谱-质谱联用技术已经被广泛地应用到抗菌药物的多残留检测之中。如陈莹等建立了同时检测鳗鱼中25种药物的超高效液相色谱串联质谱法,包括磺胺类、喹诺酮类和大环内酯类等抗菌药物,检测限均在0.1~0.2 μg/kg的范围内[60];赵春晖建立了鲈鱼、鳗鲡、对虾、河蟹等组织样品中抗生素多残留的液相色谱串联质谱法,检测限低于0.3 μg/kg[10]。
液质技术的发展使抗生素残留检测分析研究进入了一个全新阶段,但同时也存在不足,如对样品前处理要求较高、对操作人员的专业性较强、质谱谱库不健全和基质效应问题等。如何对简化样品的前处理步骤、如何减小样品的基质效应、如何提高灵敏度以及减少分析时间,从而建立可同时高效、快速、准确地检测分析多种类兽药残留的方法是今后研究的重点、热点和难点。
3 磺胺类抗菌药物在水产品中的残留情况
近些年水产养殖业中抗菌药物残留问题引起了广泛关注,目前市场上大多数水产养殖系统采用高密度、多品种、集约化的养殖模式,导致抗菌药物的不合理使用,这不仅可能对水生生物造成不利影响[61],还可能增加病原菌的抗药性[62]。不仅如此,这些抗菌药物的残留可能聚集在养殖水产品中,通过食物链进行传递,可能最终会威胁到人类的健康[61,63-64]。然而,水产品由于其高的营养价值和美味的口感,被认为是人类主要的也是最受欢迎的食物之一,这就使水产品中抗菌药物残留问题的研究更加棘手。虽然水产品中抗菌药物残留的问题日益受到关注,但是关于水产品中抗菌药物残留的研究和报道还相对较少。建立高效、快速、准确检测水产品中抗菌药物残留的方法和进行客观科学的健康残留风险估测等研究急需开展。
3.1 水产品中磺胺类抗菌药物的残留分析
水产品中抗菌药物残留的问题近些年由于水生环境的严重污染逐渐受到关注,再加上检测分析仪器设备精密度的限制,对于水产品中抗菌药物残留的探究相对较少。目前我国关于水产品中磺胺类抗菌药物的残留研究主要集中在广州地区,且主要集中在海水养殖区;而像长江下游等主要淡水养殖区,这方面的研究还未展开。表1显示,广州地区的水产品肌肉中一些常用磺胺类抗菌药物的残留量均在最高残留限量(100 μg/kg)[65]以下,而其肝脏中的抗生素残留量则相对较高,部分已超出100 μg/kg,这可能要引起高度重视。
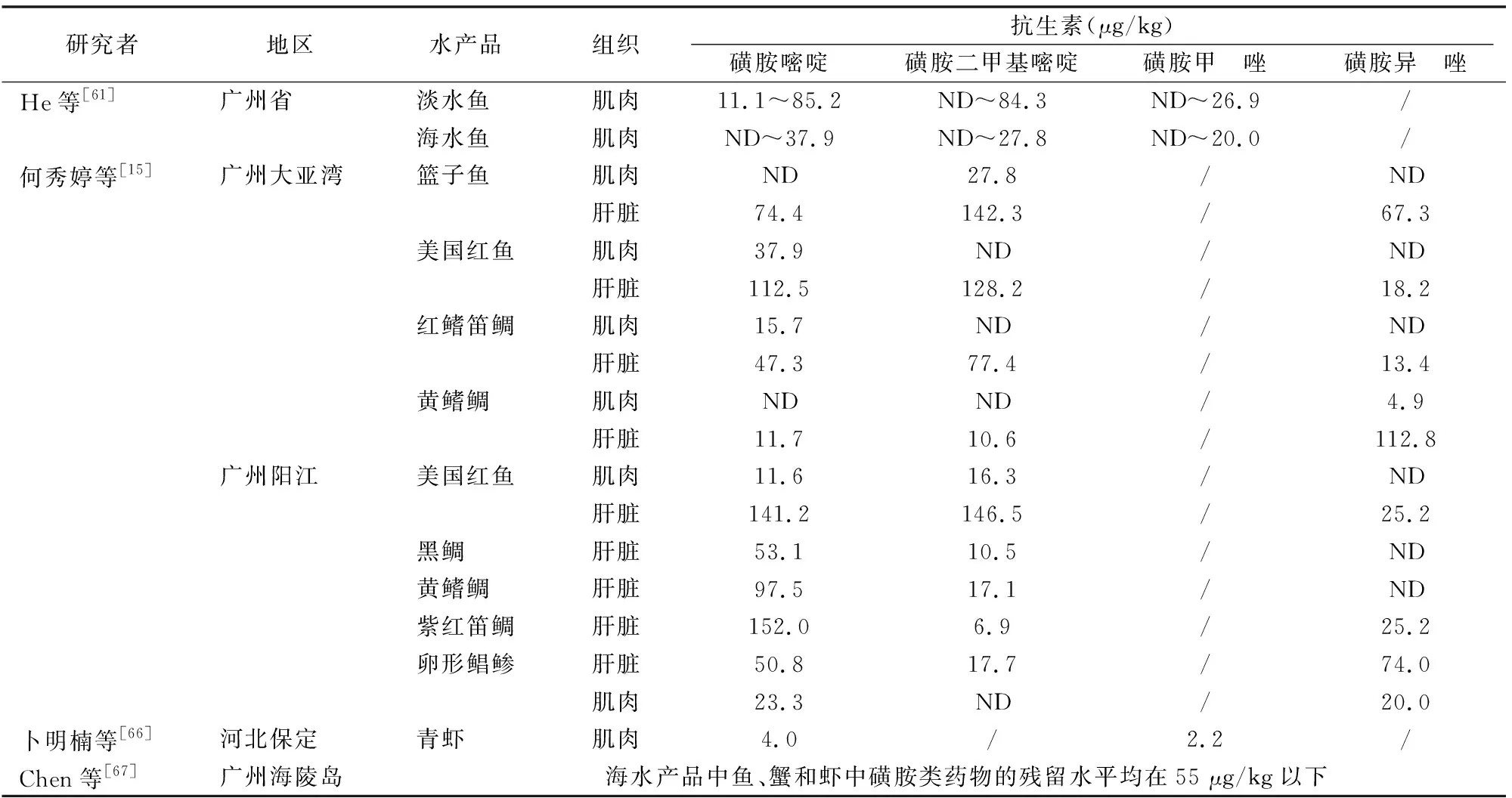
表1 不同地区水产品中磺胺类抗生素的残留情况
3.2 最高残留限量(maximum residue limits,MRLs)
最高残留限量指的是食品动物在用药后产生的存在于食品表面或者食品内部所允许该兽药残留的最高量。许多国家及国际组织已经对不同基质(如猪、牛、羊、水产等)中的兽药残留规定了最高允许残留限量(MRLs),如欧盟MRLs的兽药和添加剂种类为121种,CAC为57种,美国为87种[68-69],加拿大为85种,中国为134种,日本多达231种。美国以及欧盟的一些国家明确规定动物组织中磺胺类药物总含量的MRLs不得超过0.1 mg/kg[70];日本的“肯定列表制度”中规定,部分磺胺类药物的残留量需严格执行“一律标准”为 0.01 mg/kg[71];中国农业部第235号公告中也规定动物性食品中磺胺类药物的MRLs不得超过100 μg/kg[65]。
3.3 人体健康风险评价的方法
目前,国外环境风险评价方面的研究主要集中在人体健康风险评价和生态风险评价2个方面,一系列的评价规范、准则等的制定,使得一个科学的风险评价体系已经基本形成。其中人体健康风险评价的方法已经基本定型。1983 年美国科学院公布了化学物质的人体健康风险评价4步法:(1)危害鉴别:主要包括鉴定风险源的性质及强度;(2)暴露评价:指的是对人群或者生态系统暴露风险因子时的方式、频率、强度及时长的描述及评估;(3)剂量-反应分析:暴露与暴露所导致的人群健康或生态系统影响下的因果关系;(4)风险表征:就是利用前3步所获得的数据,估算某化学物质在不同暴露途径下所可能产生的健康风险概率、强度以及可接受的风险水平等。统计显示,较常见的风险在10-6~10-3的范围。人们生活中食入食品和饮水等引起某种危害的水平在 10-9~10-5的范围。对于人体健康风险评价,美国环境保护局(USEPA)认可的致癌物的可接受风险阈值为10-5/年,若人的平均寿命按70岁算,则人一生最大可接受致癌风险为 7×10-4;对于非致癌性化学污染物,英国皇家协会、瑞典环境保护局及荷兰建设环境部等推荐的化学污染物对人体健康危害的最大可接受风险水平为10-6/年,即终生最大可接受风险为7×10-5。人类通过膳食从水产品中摄入的抗菌药物含量可通过膳食暴露风险评估对其进行粗略的估测,但由于有限的毒理学数据和待商定的各种标准,估测人类通过膳食水产品而引起的抗菌药物残留量安全的潜在风险仍然是一个挑战。目前最常引用的参数标准是最大无作用剂量(maximal no-effective level,MNEL)、最小有作用剂量(minimal effective level,MEL)、每日容许摄入量(acceptable daily intake,ADI)和每日摄入量评估值(estimated daily intake,EDI)等。
3.3.1 最大无作用剂量(MNEL)和最小有作用剂量(MEL) MNEL指在一定时间内按一定途径或方式,某种外源化学物与机体接触后,用当前认识水平下的最灵敏的试验方法和观察指标,未能观察到对机体造成任何损害或使机体出现异常反应的最高该化学物的剂量。MEL也称之为中毒阈值(toxic threshold value)或中毒阈剂量(toxic threshold level),它指的是一种外源性化学物在一定时间内按一定方式或途径与机体接触后使某项灵敏的观擦指标开始出现异常或使机体开始出现损害现象的最低剂量
3.3.2 每日容许摄入量(ADI) ADI是指人或动物每日直接或间接地摄入某种化学物质后,如食品添加剂、抗生素、农药等,对人体健康无任何已知不良效应的剂量。ADI值越高,说明该化学物质的毒性越低。ADI=NOEL(最大无作用剂量)/SF(安全因子),SF一般取100、200;单位一般是mg/kg或g/kg,以相当于人或动物1 kg体质量的毫克数或克数来表示。摄入该化学物质如果在ADI剂量下,则终身不会对其健康造成任何可测量的损害;根据ADI计算出的每种食品中某些化学物的安全添加剂量,保证随着食品进入人体的化学物质总量低于ADI;例如某化学物质对人体的ADI值为 2 mg/kg,体质量按60 kg算,则人体每日摄入该化学物质在 120 mg 以内是安全无害的。
3.3.3 每日摄入量评估值(EDI) EDI 表示ADI值的百分比,由粮食及农业组织和世界卫生组织推荐使用。根据实验内容不同,计算方法上有些许差异,如He等采用的计算方法是EDI=C×K/BW,C代表水产品抗生素残留的平均浓度,K代表平均每人每天食用的水产品量,BW代表人体平均体质量[61];Chen等采用的计算方法是EDI=Cbiota×Mbiota,Cbiota表示的是所检测的抗菌药物在水产品中的最大浓度,Mbiota表示的是一个特定的年龄层的群体每人每天食用的水产品量[72]。
4 展望
当前国内外对整个生态环境中如地下水、地表水、养殖水、废水、土壤、底泥等的抗菌药物污染开展了许多研究,但是对水生生物体中抗菌药物污染的研究还相对较少,无论是检测方法上还是分析方法上都还不成熟:检测方法上,水产品中抗菌药物污染大多数是微量甚至是痕量的,这就要求仪器具有更高的灵敏度、更低的检测限和更准确的定性定量;分析方法方面,现有的方法还不够完善,在检测分析上缺少谱库,存在一些中间代谢产物无法辨别等问题。我国是水产大国,水产品中抗菌药物污染检测分析以及治理技术上的探索仍处于初级阶段,保证绿色健康的水产品质量,建立高效准确快速的抗菌药物检测分析方法,作出科学健康的膳食风险评估是每个科研工作者应尽的责任,这些问题的解决和系统完善仍需要广大学者不断地研究解决。
:
[1]王 萍,曾 凡,李 苑,等. 超声萃取-HPLC-MS/MS分析鱼肉中磺胺抗生素[J]. 广州化工,2015,43(11):119-121,138.
[2]Zheng Q,Zhang R,Wang Y,et al. Occurrence and distribution of antibiotics in the Beibu Gulf,China:impacts of river discharge and aquaculture activities[J]. Marine Environmental Research,2012,78(8):26-33.
[3]胡梦红. 抗生素在水产养殖中的应用、存在的问题及对策[J]. 水产科技情报,2006,33(5):217-221.
[4]卢保锋. 养殖场使用抗生素的几个误区[J]. 养禽与禽病防治,2013(11):5.
[5]聂湘平,何秀婷,杨永涛,等. 珠江三角洲养殖水体中喹诺酮类药物残留分析[J]. 环境科学,2009,30(1):266-270.
[6]贾久满,要瑞莉,朱莲英,等. 我国动物性产品中抗生素残留问题的现状及对策[J]. 安徽农业科学,2007,35(5):1368-1370.
[7]赵海香,邓 维,尚艳芬,等.基于低毒溶剂的MSPD/HPLC法同时测定鱼肉中8种磺胺类药物残留[J]. 食品科学,2009,30(4):178-181.
[8]徐维海,林黎明,朱校斌,等. 水产品中14种磺胺类药物残留的HPLC法同时测定[J]. 分析测试学报,2004,23(5):122-124.
[9]巢 磊. 磺胺类药物在水产养殖中的应用[J]. 水利渔业,2002,22(3):50-51.
[10]赵春晖. 水产品中五类药物多残留检测方法的建立及应用[D]. 北京:中国农业科学院,2014.
[11]Long A R,Hsieh L C,Malbrough M S,et al. Multiresidue method for the determination of sulfonamides in pork tissue[J]. Journal of Agricultural & Food Chemistry,1990,38(2):423-426.
[12]孟 勇,张美琴,王 静,等. 高效液相色谱法测定水产品中7种兽药残留量[J]. 理化检验-化学分册,2012,48(5):543-546.
[13]Li Y,Zhang X,Li W,et al. The residues and environmental risks of multiple veterinary antibiotics in animal faeces[J]. Environmental Monitoring and Assessment,2013,185(3):2211-2220.
[14]祁彦洁,刘 菲. 地下水中抗生素污染检测分析研究进展[J]. 岩矿测试,2014,33(1):1-11.
[15]何秀婷,王 奇,聂湘平,等. 广东典型海水养殖区沉积物及鱼体中磺胺类药物的残留及其对人体的健康风险评价[J]. 2014,35(7):2728-2735.
[16]魏建英,张 然,丁 胜,等. 抗生素类饲料添加剂在畜牧业中的使用[J]. 内蒙古农业科技,2004(4):52-53.
[17]Ko E,Song H,Park J H. Direct competitive enzyme-linked immunosorbent assay for sulfamethazine[J]. Journal of Veterinary Medical Science,2000,62(10):1121-1123.
[18]段振娟,张鸿雁,王 硕. 动物性食品中磺胺类药物残留分析研究进展[J]. 食品研究与开发,2007,28(6):149-152.
[19]郭根和,潘 藏,苏德森,等. 高效液相色谱法测定对虾中五种磺胺类药物残留[J]. 现代科学仪器,2005(1):70-72.
[20]Hoa P T,Managaki S,Nakada N,et al. Antibiotic contamination and occurrence of antibiotic-resistant bacteria in aquatic environments of Northern Vietnam[J]. Science of the Total Environment,2011,409(15):2894-2901.
[21]成 黎,谭 锋. 中国水产品质量安全现状及改善和控制措施[J]. 食品科学,2009,30(23):465-469.
[22]Sanderson H,Brain R A,Johnson D J,et al. Toxicity classification and evaluation of four pharmaceuticals classes:antibiotics,antineoplastics,cardiovascular,and sex hormones[J]. Toxicology,2004,203(1):27-40.
[23]Michele T M,Ko C,Bishai W R. Exposure to antibiotics induces expression of theMycobacteriumtuberculosissigFgene:implications,for chemotherapy against mycobacterial persistors[J]. Antimicrobial Agents & Chemotherapy,1999,43(2):218-225.
[24]Tang J,Shi T,Wu X,et al. The occurrence and distribution of antibiotics in lake Chaohu,China:seasonal variation,potential source and risk assessment[J]. Chemosphere,2015(122):154-161.
[25]Tamtam F,Mercier F,Le B B,et al. Occurrence and fate of antibiotics in the Seine River in various hydrological conditions[J]. Science of the Total Environment,2008,393(1):84-95.
[26]Jiang L,Hu X,Yin D,et al. Occurrence,distribution and seasonal variation of antibiotics in the Huangpu River,Shanghai,China[J]. Chemosphere,2011,82(6):822-8.
[27]Li W,Gao L,Shi Y,et al. Occurrence,distribution and risks of antibiotics in urban surface water in Beijing,China[J]. Environmental Sciences Processes & Impacts,2015,17(9):1611-1619.
[28]Minh T B,Leung H W,Loi I H,et al. Antibiotics in the Hong Kong metropolitan area:Ubiquitous distribution and fate in Victoria Harbour[J]. Marine Pollution Bulletin,2009,58(7):1052-1062.
[29]Zou S,Xu W,Zhang R,et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay,China:impacts of river discharge and aquaculture activities[J]. Environmental Pollution,2011,159(10):2913-2920.
[30]Fick J,Söderström H,Lindberg R H,et al. Contamination of surface,ground,and drinking water from pharmaceutical production[J]. Environmental Toxicology and Chemistry,2009,28(12):2522-2527.
[31]López-Serna R,Jurado A,Vázquez-Sué E,et al. Occurrence of 95 pharmaceuticals and transformation products in urban groundwaters underlying the metropolis of Barcelona,Spain[J]. Environmental Pollution,2013(174):305-315.
[32]Standley L J,Rudel R A,Swartz C H,et al. Wastewater-contaminated groundwater as a source of endogenous hormones and pharmaceuticals to surface water ecosystems[J]. Environmental Toxicology and Chemistry,2008,27(12):2457-2468.
[33]Teijon G,Candela L,Tamoh K,et al. Occurrence of emerging contaminants,priority substances (2008/105/CE) and heavy metals in treated wastewater and groundwater at Depurbaix facility (Barcelona,Spain)[J]. Science of the Total Environment,2010,408(17):3584-3595.
[34]Rosal R,Rodríguez A,Perdigón-Melón J A,et al. Occurrence of emerging pollutants in urban wastewater and their removal through biological treatment followed by ozonation[J]. Water Research,2010,44(2):578-588.
[36]Yiruhan,Wang Q J,Mo C H,et al. Determination of four fluoroquinolone antibiotics in tap water in Guangzhou and Macao[J]. Environmental Pollution,2010,158(7):2350-2358.
[37]Christian T,Schneider R J,Färber H A,et al. Determination of Antibiotic Residues in Manure,Soil,and Surface Waters[J]. Clean-Soil,Air,Water,2003,31(1):36-44.
[38]Blackwell P A,Kay P,Ashauer R,et al. Effects of agricultural conditions on the leaching behaviour of veterinary antibiotics in soils[J]. Chemosphere,2009,75(1):13-19.
[39]Pei R,Kim S C,Carlson K H,et al. Effect of river landscape on the sediment concentrations of antibiotics and corresponding antibiotic resistance genes (ARG)[J]. Water Research,2006,40(12):2427-2435.
[40]Zhou L J,Ying G G,Liu S,et al. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China[J]. Science of the Total Environment,2013,444(2):183-195.
[41]Gao P,Mao D,Luo Y,et al. Occurrence of sulfonamide and tetracycline-resistant bacteria and resistance genes in aquaculture environment[J]. Water Research,2012,46(7):2355-2364.
[42]李俊锁,邱月明. 兽药残留分析[M]. 上海:上海科学技术出版社,2002:228-232.
[43]张永生,南海娟,魏新军. 动物源性食品中磺胺类药物多残留检测方法研究进展[J]. 畜牧与饲料科学,2009,30(3):35-36.
[44]Sangjarusvichai H,Dungchai W,Siangproh W,et al. Rapid separation and highly sensitive detection methodology for sulfonamides in shrimp using a monolithic column coupled with BDD amperometric detection[J]. Talanta,2009,79(4):1036-41.
[45]Dixonholland D E,Katz S E. Competitive direct enzyme-linked immunosorbent assay for detection of sulfamethazine residues in swine urine and muscle tissue[J]. Journal-Association of Official Analytical Chemists,1988,71(6):1137-1140.
[46]林海丹,谢守新,冯德雄,等. 动物源性食品中磺胺类药物残留的固相萃取-高效液相色谱法测定[J]. 分析测试学报,2003,22(1):94-96.
[47]胡昌勤. 酶联免疫吸附法新进展[J]. 生物化学与生物物理进展,1993,20(2):85-88.
[48]Shelver W L,Shappell N W,Franek M,Ruhio F R. ELISA for sulfonamides and its application for screening in water contamination[J]. Agricultural and Food Chemistry,2008,56(15):6609-6615.
[49]郑志高,江红星,吕 芳,等. 磺胺类药物的多残留酶联免疫法检测[J]. 检验检疫学刊,2006,16(1):19-22.
[50]沈永聪,李守军,杨 林. 牛奶中抗生素残留检测技术进展[J]. 畜牧兽医科技信息,2006,(5):87-89.
[51]赵书景,贺绍君,罗国琦,等. 动物性食品中磺胺类药物残留检测方法的研究进展[J]. 中国畜牧兽医,2009,36(8):60-63.
[52]Frazier R A. Recent advances in capillary electrophoresis methods for food analysis[J]. Electrophoresis,2005,22(19):4197-4206.
[53]Ackermans M T,Beckers J L,Everaerts F M,et al. Determination of sulphonamides in pork meat extracts by capillary zone electrophoresis[J]. Chromatograph. A,1996,592(1):101-109.
[54]Lamba S,Sanghi S K,Asthana A,et al. Rapid determination of sulfonamides in milk using micellar electrokinetic chromatography with fluorescence detection[J]. Analytica Chimica Acta,2005,552(1/2):110-115.
[55]Wen Y,Li J,Zhang W,et al. Dispersive liquid-liquid microextraction coupled with capillary electrophoresis for simultaneous determination of sulfonamides with the aid of experimental design[J]. Electrophoresis,2011,32(16):2131-2138.
[56]甘宾宾,杨玉霞,唐 健,等. 动物性食品中抗生素和激素残留污染及检测[J]. 中国公共卫生,2006,22(8):1014-1015.
[57]Xu X,Su R,Zhao X,et al. Ionic liquid-based microwave-assisted dispersive liquid-liquid microextraction and derivatization of sulfonamides in river water,honey,milk,and animal plasma[J]. Analytica Chimica Acta,2011,707(1):92-99.
[58]Blackwell P A,Lützhøft H C,Ma H P,et al. Fast and robust simultaneous determination of three veterinary antibiotics in groundwater and surface water using a tandem solid-phase extraction with high-performance liquid chromatography-UV detection.[J]. Journal of Chromatography A,2004,1045(1/2):111-117.
[59]Casetta B,Cozzani R,Cinquina A L,et al. Sulfamethazine,sulfothiazole and albendazole residue dosage in food products determined by liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry,1996,10(12):1497-1503.
[60]陈 莹,陈 辉,林谷园,等. 超高效液相色谱串联质谱法对鳗鱼中大环内酯类、喹诺酮类和磺胺类兽药残留量的同时测定[J]. 分析测试学报,2008,27(5):538-541.
[61]He X,Deng M,Wang Q,et al. Residues and health risk assessment of quinolones and sulfonamides in cultured fish from Pearl River Delta,China[J]. Aquaculture,2016(458):38-46.
[62]Rico A,Satapornvanit K,Haque M M,et al. Use of chemicals and biological products in Asian aquaculture and their potential environmental risks:a critical review[J]. Reviews in Aquaculture,2012,4(2):75-93.
[63]Gao L,Shi Y,Li W,et al. Occurrence,distribution and bioaccumulation of antibiotics in the Haihe River in China[J]. Journal of Environmental Monitoring,2012,14(4):1248-1255.
[64]Pernille B,Bak S A,Erland B,et al. Abiotic degradation of antibiotic ionophores[J]. Environmental Pollution,2013,182(6):177-183.
[65]中华人民共和国农业部公告第235号[Z]. 北京:中华人民共和国农业部,2002.
[66]卜明楠,石志红,康 健,等. QuEChERS结合LC-MS/MS同时测定虾肉中72种兽药残留[J]. 分析测试学报,2012,31(5):552-558.
[67]Chen H,Liu S,Xu X R,et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island,South China:Occurrence,bioaccumulation and human dietary exposure[J]. Marine Pollution Bulletin,2015,90(1-2):181-187.
[68]Yamada R,Kozono M,Ohmori T,et al. Simultaneous determination of residual veterinary drugs in bovine,porcine,and chicken muscle using liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Bioscience,Biotechnology,and Biochemistry,2006,70(1):54-65.
[69]Regulation H A T. Council regulation (EEC) No 2377/90 of 26 June 1990 laying down a community procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal origin[J]. Official JL,1990(224):1-8.
[70]Food and drug regulation[M]. Ottawa:Canada Gazette,1991(125):1478-1480.
[71]刘佳佳,佘永新,刘洪斌,等. 高效液相色谱伟联质谱法同时测定动物源性食品中24种磺胺类药物残留[J]. 分析试验室,2011,30(2):9-13.
[72]Chen H,Liu S,Xu X R,et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island,South China:occurrence,bioaccumulation and human dietary exposure[J]. Marine Pollution Bulletin,2015,90(1/2):181-187.
