水稻幼苗酵母双杂交cDNA文库的构建及鉴定
2018-05-30朱佳慧徐秋芳袁平平倪海平周益军蒋选利杜何为
朱佳慧, 徐秋芳, 袁平平, 倪海平, 周益军, 蒋选利, 杜何为
(1.长江大学生命科学学院,湖北荆州 434025; 2.江苏省农业科学院植物保护研究所,江苏南京 210014;3.贵州大学农学院,贵州贵阳 550025)
水稻黑条矮缩病是一种重要的水稻病毒病害,病原为水稻黑条矮缩病毒(rice black streaked dwarf virus,RBSDV),主要通过介体灰飞虱以持久增殖型方式传播。水稻感染RBSDV后的典型症状为病株矮缩、叶色浓绿、叶片僵直,茎秆、叶背和叶鞘处出现瘤状突起。该病害自20世纪60年代和90年代在我国流行危害后,曾一度销声匿迹,2006年以来由于灰飞虱虫量上升和带毒率提高,水稻黑条矮缩病在江苏、浙江、安徽等地麦轮作区的水稻上普遍发生,2009年仅江苏省的发病面积达3.33×105hm2,造成巨大的经济损失[1-2]。当前生产上栽培的水稻品种对黑条矮缩病的抗性较差,大部分为感病品种,尚未鉴定到高抗品种[3-4]。
水稻不同生育期对RBSDV的敏感性存在差异,3~4叶期幼苗最易感病[5]。苗期感病后,植株矮小、心叶短小而僵直,不能抽穗,严重的则出现枯死现象。分蘖期和抽穗期发病,出现包穗,部分分蘖能抽穗,但穗小或包穗,结实差[6]。水稻感染黑条矮缩病毒后细胞壁结构发生改变[7],病毒感染后引起的矮缩症状可能与纤维素合成酶及类纤维素合成酶基因及木质素相关基因表达有关[8-9],病毒影响水稻育性可能是由于病毒的P7-1蛋白的表达抑制了花药中木质素合成,导致植株花药开裂异常,不能结实[9]。然而,病毒如何影响寄主植物因子进而表现症状的机制还不是非常清楚。
酵母双杂交系统是由Fields等于1989年首次提出并建立的[10],是筛选已知蛋白互作因子的有效系统。为解析RBSDV与寄主水稻的互作机制,筛选水稻中与病毒互作的寄主蛋白,本研究以易感RBSDV的水稻品种日本晴为材料,取水稻敏感生育期3~4叶时的组织样本构建酵母双杂交cDNA文库,为病毒致病相关寄主因子的筛选提供基础。
1 材料与方法
1.1 材料
水稻品种日本晴(OryzasativaL.japonica. cv. Nipponbare)于实验室光照培养箱中培养至3~4叶期,取除根外的组织样品作为试验材料。试验取样时间为2014年8月,地点为江苏省农业科学院植物保护研究所。
Trizol、CloneMiner Ⅱ cDNA Library Construction Kit、LR ClonaseTMⅡ Enzyme Mix、载体pDONRTM222、pDEST22、FastTrack®MAG mRNA isolation Kit均购自Invitrogen(USA);载体pGADT7-DEST购自Clontech(USA)。
1.2 方法
1.2.1 总RNA提取 用液氮研磨水稻幼苗样品,按照0.1 g样品加入1 mL Trizol的比例提取总RNA,具体操作方法参照Trizol试剂说明书进行。采用Nanodrop 2000核酸分析仪检测总RNA的质量及浓度,用1%琼脂糖凝胶电泳检测总RNA的完整性。
1.2.2 mRNA分离纯化 利用FastTrack®MAG mRNA isolation Kit分离并纯化总RNA中的mRNA,具体步骤参照其说明书进行。分离纯化后的mRNA采用1%琼脂糖凝胶电泳检测其质量。
1.2.3 cDNA初级文库构建 cDNA初级文库的构建试验方法参照CloneMiner Ⅱ cDNA Library Construction Kit文库构建说明书进行。取分离纯化后的mRNA,加入Biotin-attB2-Oligo(dT) Primer 和SuperScript Ⅲ RT酶进行反转录,合成cDNA第1条链,再以cDNA第1条链为模板,在大肠杆菌(Escherichiacoli) DNA Ligase、大肠杆菌DNA Polymerase Ⅰ、大肠杆菌RNase H以及T4DNA Polymerase的作用下合成cDNA第二链。将双链cDNA与三框attB1重组接头连接后,进行cDNA分级分离并且收集。纯化后的cDNA通过重组反应连入pDONR222载体,反应产物电转化大肠杆菌DH10B后,加入SOC培养基,置于37 ℃,225~250 r/min摇床培养 1 h。培养结束后,取10 μL菌液用于库容量鉴定,剩余培养物加入甘油至终浓度为20%存于 -80 ℃,此即为初级文库菌液。
1.2.4 酵母双杂交cDNA文库构建 将初级文库菌液接种至100 mL含有卡那霉素(Kan)的LB(LB/Kan)培养基中,采用PureLink®HiPure Plasmid Filter Midiprep Kit(Invitrogen)提取初级文库质粒,稀释至300 ng/μL,在LR ClonaseTMⅡ Enzyme Mix的作用下与pGADT7-DEST(Invitrogen)载体进行重组反应。重组反应体系为:1 μL文库质粒(300 ng/μL)、1 μL p GADT7-DEST(300 ng/μL)、4 μL LR Clonase II Mix、14 μL ddH2O,混匀后置于25 ℃恒温培养箱中反应16~20 h。反应结束后电转化DH10B感受态细胞,加入3 mL SOC培养基培养,获得酵母双杂交cDNA文库菌液。取10 μL菌液鉴定库容量,其余菌液加甘油至终浓度为20%,-80 ℃保存。
1.2.5 文库重组率、文库滴度和插入片段大小分析
1.2.5.1 文库滴度分析方法 将10 μL文库菌液稀释1 000倍后,从中取出50 μL涂布含有相应抗性的LB平板,过夜培养后计算1 mL文库菌液中的库容量,即文库滴度=平板上的克隆数/平板上涂布菌液的体积(μL)×稀释倍数×1 000 μL。
1.2.5.2 重组率和插入片段长度分析 在鉴定库容量的平板上随机挑取24个克隆进行菌落PCR,初级文库的PCR引物为pDNOR222载体2端的通用引物M13正向引物(5′-GTAAAACGACGGCCAG-3′)及M13反向引物(5′-CAGGAAACAGCTATGAC-3′)。酵母cDNA文库的PCR所用引物为pGADT7载体的通用引物T7(5′-TAATACGACTC ACTATAGGGCGAGCGCCGCCATG-3′)和3′AD(5′-GTGA ACTTGCGGGGTTTTTCAGTATCTACGATT-3′)。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃ 退火30 s,72 ℃ 延伸90 s,35个循环;72 ℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR产物,分析扩增片段大小和扩增得到的基因片段数,计算重组率。
1.2.6 候选基因筛选水稻幼苗cDNA酵母文库 利用RBSDV编码的非结构蛋白P7-1作为候选基因筛选本研究所构建的水稻幼苗cDNA酵母文库,以检测cDNA文库质量。pGADT7-RBSDV P7-1诱饵载体由实验室构建保存,文库筛选方法和步骤参照Clontech文库筛选说明书进行。
2 结果与分析
2.1 总RNA的提取及mRNA的分离纯化
采用Trizol提取水稻幼苗总RNA后测定浓度并进行质量分析,结果显示,总RNA浓度为1 921.7 ng/μL,D260 nm/D280 nm=2.08(图1)。总RNA经1%凝胶电泳分离可以看到3条清晰的条带,分别为28S、18S和5S。28S亮度高于18S,且5S条带清晰,没有弥散,表明提取的RNA质量完好,没有降解(图2-A)。
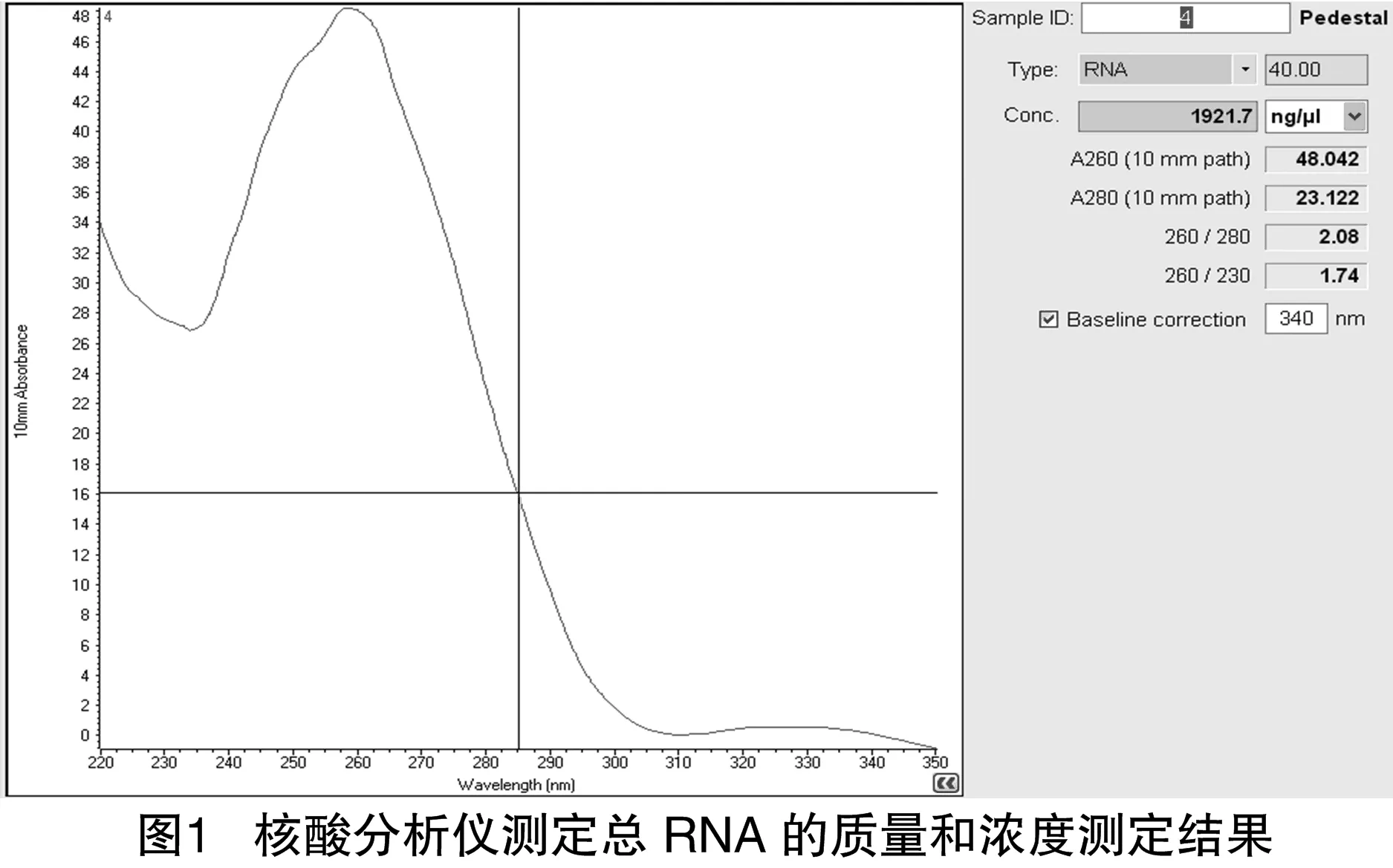
利用试剂盒FastTrack®MAG mRNA isolation Kit分离纯化并获得mRNA。电泳结果显示纯化所得的mRNA是一条弥散的条带,条带最亮部分的范围在较大的分子量范围内(1~3 kb)(图2-B),表明分离纯化的mRNA未发生降解,可用于cDNA文库构建。

2.2 cDNA初级文库的构建及分析
取10 μL初级文库菌液稀释1 000倍后,从中取出50 μL涂布LB/Kan平板,37 ℃培养过夜并计数平板上克隆数(图 3-A)。根据“初级文库滴度(CFU/mL)=平板上的克隆数/平板上涂布菌液的体积(μL)×稀释倍数×1 000 μL,文库容量(库容)=CFU/mL×文库菌液总体积(mL)”的计算公示,得初级文库滴度为6.6×106CFU/mL,库容为1.9×107CFU。随机挑取24个克隆进行菌落PCR鉴定,检测文库重组率和cDNA插入片段大小,根据重组率=(有插入片段的反应个数/反应总数)×100%,计算得初级文库重组率>95%,插入片段大小除有2个克隆大小在650~850 bp外,其余克隆插入片段大小都在1 kb以上(图3-B),符合初级文库的高质量需求。

2.3 酵母双杂交cDNA文库的构建与分析
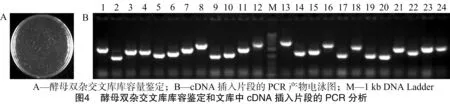
提取初级文库质粒后,将初级文库质粒与载体pGADT7-DEST进行LR重组反应,重组后转化DH10B,获得酵母双杂交cDNA文库。取10 μL文库菌液稀释1 000倍后,分别取出50 μL涂布LB/Amp(氯苄西林)平板,37 ℃培养过夜并计数平板上克隆数(图4-A)。结果显示,文库滴度为4.5×106CFU/mL,库容为1.3×107CFU。从文库中随机挑选24个克隆,用pGADT7载体的通用引物T7和3′AD进行PCR扩增,分析插入不同大小片段。凝胶电泳结果显示,24个单克隆均可扩增到1个单一的条带,重组率>95%,其中23个克隆插入片段大小>1 kb(图4-B)。以上结果表明,构建的cDNA酵母文库的库容、重组率和插入片段大小达到标准cDNA文库要求,可用于病毒互作基因的筛选。
2.4 筛选文库鉴定
为进一步分析所构建的水稻幼苗cDNA文库是否可用于筛选互作蛋白,以RBSDV编码的非结构蛋白P7-1为诱饵,筛选本试验所构建的cDNA文库。将诱饵载体pGADT-P7-1转化酵母菌AH109后,制备感受态,提取cDNA文库质粒后进行转化,涂布SD/-His/-Leu/-Trp平板,挑选生长良好的酵母菌落至SD/-His/-Leu/-Trp-Ade/X-α-Gal培养基培养,可筛选获得变蓝的酵母菌落(图5),表明本研究所构建的水稻日本晴幼苗cDNA文库能用来筛选RBSDV与水稻互作的蛋白。
3 讨论与结论
酵母双杂交技术能在真核细胞状态下检测蛋白质之间的互作,具有操作简便、灵敏度高等特点,已成为研究蛋白质之间相互作用的有效手段。该技术可用于检测已知蛋白质之间的互作、建立基因组编码蛋白间的相互作用图谱、筛选药物作用位点,还可以从cDNA文库中以某个已知蛋白为诱饵进行大规模筛选,寻找与已知蛋白相互作用的未知蛋白,在多个研究领域中均有广泛应用[11]。
在植物与病毒互作机制研究方面,以病毒蛋白为诱饵筛选寄主植物cDNA文库,对于快速获取寄主植物体内的互作蛋白,进而研究互作蛋白在病毒致病过程中的功能具有重要意义。以水稻矮缩病毒与水稻的互作研究为例,Zhu等以水稻矮缩病毒外壳蛋白P2为诱饵筛选cDNA文库时发现,P2蛋白能够与水稻体内赤霉素合成途径关键酶贝壳杉烯氧化酶发生互作,导致赤霉素合成量下降,植物出现矮缩症状[12]。P2蛋白还能与水稻中生长素通路Aux/IAA家族蛋白OsIAA10相互作用,通过与OsIAA10的互作阻断OsIAA10与OsTIR的互作,抑制26S蛋白酶体介导的OsIAA10降解,使OsIAA10蛋白的稳定和积累量增多,导致生长素通路响应受阻,进而有利于RDV的复制侵染[13]。此外,RDV非结构蛋白Pns11筛选水稻cDNA文库发现, Pns11能与OsSAMS1互作,增强OsSAMS1的活性,导致乙烯含量增加,进而有利于病毒侵染[14]。此外,酵母双杂交系统还用于研究植物蛋白与病毒的运动蛋白、病毒复制酶类蛋白等之间的互作研究。本研究以高感RBSDV的水稻品种日本晴为材料,取RBSDV最为敏感的3~4叶期组织构建了高质量酵母双杂交cDNA文库,并用RBSDV P7-1进行筛选可获得阳性克隆,为研究水稻黑条矮缩病毒与水稻的互作奠定了基础。
高质量cDNA文库是进行有效筛选互作蛋白的基础。评价cDNA文库质量有2个重要指标,即cDNA文库的代表性和重组序列的完整性[15-16]。文库的代表性即文库中含有的cDNA种类的完整性,可反映来源组织中表达信息(即mRNA)的完整性程度,是体现文库质量的重要指标,可用库容来衡量。库容是指cDNA文库中所包含的独立重组子克隆数量。当文库滴定浓度达到1.7×105CFU/mL时,即可认定为有效文库,当文库滴定浓度达到1×106CFU/mL时,可以满足低丰度mRNA筛选要求[17]。本研究对提取的总RNA以及分离纯化的mRNA进行了质量评价,所提总RNA和mRNA完整性好,未发生降解,构建的酵母cDNA文库库容为1.3×107CFU,滴度为4.5×106CFU/mL,表明所构建的cDNA文库中所含基因信息丰富,可满足常规文库筛选要求,可用于进一步筛选与病毒互作相关重要基因。
重组cDNA片段序列的完整性可从重组率及插入片段长度2个方面来评价。重组率反映的是文库中所有克隆的阳性率,即文库中含有重组cDNA片断克隆的比率。平均插入片断长度即将随机的菌落PCR得到的产物片断长度取平均值,其体现了文库中重组的cDNA片断的序列完整性。只有重组cDNA片段足够长,才更有可能从文库中分离获得目的基因的完整序列。本研究构建的文库重组率>95%,插入片段大小各异,平均插入片段在1 000 bp以上,表明所建文库符合高质量文库要求。用RBSDV的候选基因P7-1筛选所构建的酵母cDNA文库可以筛选到阳性克隆,也说明所构建文库可以用作病毒互作蛋白筛选。
:
[1]陈声祥,张巧艳. 我国水稻黑条矮缩病和玉米粗缩病研究进展[J]. 植物保护学报,2005,32(1):97-103.
[2]季英华,任春梅,程兆榜. 江苏省近年来新发生的一种水稻矮缩病害病原初步鉴定[J]. 江苏农业学报,2009,25(6):1263-1267.
[3]卢百关,秦德荣,方兆伟,等. 苏北地区水稻黑条矮缩病暴发流行原因及防控对策[J]. 江苏农业科学,2009(4):148-149.
[4]温以斌,王宝祥,刘 艳,等. 水稻品种对黑条矮缩病和灰飞虱抗性的关联性分析[J]. 江苏农业科学,2016,44(6):222-225.
[5]Wang H D,Chen J P,Wang A G,et al. Studies on the epidemiology and yield losses from rice black-streaked dwarf disease in a recent epidemic in Zhejiang Province,China[J]. Plant Pathology,2009,58(5):815-825.
[6]刘 艳,秦德荣,徐大勇. 水稻黑条矮缩病研究进展[J]. 江苏农业科学,2010(3):152-154.
[7]Zhou Y,Xu Z N,Duan C X,et al. Dual transcriptome analysis reveals insights into the response to rice black-streaked dwarf virus in maize[J]. Journal of Experimental Botany,2016,67(15):4593-4609.
[8]Jia M,Li Y,Lei L,et al. Alteration of gene expression profile in maize infected with a double-stranded RNAFijivirusassociated with symptom development[J]. Phytopathology,2011,13(3):251-262.
[9]Sun F,Yuan X,Xu Q F,et al. Overexpression of rice black-streaked dwarf virusP7-1 inArabidopsisresults in male sterility due to non-dehiscent anthers[J]. PLoS One,2013,8(11):e79514.
[10]Fields S,Song O K. A novel genetic system to detect protein-protein interactions[J]. Nature,1989,340(6230):245-246.
[11]王 婷,葛怀娜,郭 宏. 酵母双杂交技术应用进展[J]. 生物技术进展,2015,5(5):392-396.
[12]Zhu S F,Gao F,Cao X S,et al. The Rice dwarf virus P2 protein interacts with ent-kaurene oxidasesinvivo,leading to reduced biosynthesis of gibberellins and rice dwarf symptoms[J]. Plant Physiology,2005,139(4):1935-1945.
[13]Jin L,Qin Q Q,Wang Y,et al. Rice dwarf virus P2 protein hijacks auxin signaling by directly targeting the rice OsIAA10 protein,enhancing viral infection and disease development[J]. PLoS Pathogens,2016,12(9):e1005847.
[14]Zhao S S,Hong W,Wu J G,et al. A viral protein promotes host SAMS1 activity and ethylene production for the benefit of virus infection[J]. eLife,2017,6:e27529.
[15]Gao X H,Jia R Y,Wang M S,et al. Construction and identification of a cDNA library for use in the yeast two-hybrid system from duck embryonic fibroblast cells post-infected with duck enteritis virus[J]. Molecular Biology Reports,2014,41(1):467-475.
[16]陈 宏. 基因工程[M]. 2版.北京:中国农业出版社,2011:142-148.
[17]Clarke L,Carbon J. A colony bank containing synthetic CoI EI hybrid plasmids representative of the entireE.coligenome[J]. Cell,1976,9(1):91-99.
