沉默单羧酸转运体4对宫颈癌Hela、Siha细胞增殖、侵袭迁移及凋亡的影响
2018-05-30郭振江刘宗文郑瑞锋楚阿兰刘耀河尚丰阔
郭振江,刘宗文,郑瑞锋,宋 锐,张 艳,楚阿兰,柴 婷,刘耀河,侯 歌,尚丰阔
1)郑州大学第二附属医院放射治疗科 郑州 450014 2)武警河南省总队医院肿瘤血液科 郑州 450052 3)郑州大学基础医学院药理学教研室 郑州 450001 4)中国人民解放军69223部队 新疆阿克苏 842300
宫颈癌是常见的妇科恶性肿瘤,在亚洲人群中发病率非常高,日益成为威胁女性生命健康的严重问题[1]。宫颈癌致死的主要原因是部分患者在确诊时已经达到晚期,并且在治疗过程中对放疗、化疗产生耐受和抵抗,甚至产生转移,因此亟需寻找一种新的治疗方法。肿瘤细胞对于葡萄糖的利用优先选择有氧糖酵解的方式进行代谢,产生大量的乳酸[2];另外,肿瘤细胞异常利用谷氨酰胺也会导致乳酸的生成增加[3]。为避免酸中毒,肿瘤细胞通过膜蛋白将乳酸外排入其微环境,造成微环境的酸化,而这将促进肿瘤多种恶性生物学行为的产生,包括组织侵袭、转移、新生血管的生成[4],并抑制宿主局部抗癌免疫力[5]。已经有越来越多的证据表明靶向肿瘤能量代谢重编程可以为肿瘤提供一种有效的治疗方法[6-9]。单羧酸转运体(monocarboxylate transports,MCTs)家族包括了参与乳酸和其他单羧酸盐转运的质膜蛋白[10],通常认为乳酸/H+的细胞外流主要由MCT4介导[11]。MCT4的表达与细胞高度糖酵解有关,肿瘤中MCT4的高表达与多种类型肿瘤的不良预后相关[12],包括宫颈癌[13];越来越多的研究[14-16]表明抑制MCT4的表达或功能可以抑制肿瘤的生长。本研究拟通过特异性沉默宫颈癌Hela、Siha细胞中MCT4的表达,研究其对细胞增殖、迁移、侵袭和凋亡等细胞生物学行为的影响。
1 材料与方法
1.1材料与主要试剂人宫颈癌腺癌细胞系Hela和人宫颈癌鳞癌细胞系Siha(郑州大学第二附属医院消化研究所馈赠)。DMEM高糖培养基(HyClone公司),胎牛血清(BI公司),RIPA蛋白质裂解液(强)、SDS-PAGE凝胶配制试剂盒和CCK-8试剂盒(上海碧云天生物技术有限公司),BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),鼠抗人单抗MCT4(Santa Cruz公司),兔抗人β-actin多克隆抗体、羊抗兔二抗(Proteintech公司),siRNA(上海生工生物工程有限公司),Opti-MEM(Gibco公司),Matrigel 基质胶(BD公司),Transwell小室(Corning公司),Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司),乳酸定量试剂盒(南京建成生物科技有限公司)。
1.2细胞培养与siRNA转染人宫颈癌细胞Hela、Siha在含体积分数10%胎牛血清的DMEM 培养基上于37 ℃、含体积分数5% CO2的条件下培养。取对数生长期的细胞进行实验。将细胞分为4组,分别为空白对照组(Ctrl组)、阴性对照组(siNC组)、实验组1(siMCT4#1组)和实验组2(siMCT4#2组),每组均设3个复孔。将细胞以2 ×105个/mL的密度接种于6 孔板内,常规条件下培养。待细胞生长接近50%~60%融合时参照Lipofectmine 3000试剂盒说明书进行siRNA转染,将siRNA(siNC、siMCT4#1和siMCT4#2)及脂质体Lipofectamine 3000分别用无血清Opi-MEM培养基稀释,室温静置5 min,再分别将上述稀释后的siRNA和稀释后的Lipofectmine 3000混合均匀,室温孵育20 min 后转移至6 孔板中,并用无血清的Opi-MEM补充至每孔2 mL,使siMCT4#1、siMCT4#2终浓度都为100 nmol/L。在转染后不同时间点根据实验需要分别进行相关指标的检测(siRNA序列见表1)。

表1 特异性siRNA序列
1.3Westernblot检测siRNA的沉默效果转染96 h后加入RIPA 蛋白裂解液抽提蛋白,BCA法进行蛋白定量,按照凝胶试剂盒说明配制分离胶及浓缩胶并上样。浓缩胶中以90 V恒压电泳至分离胶后改为恒压120 V电泳直至溴酚蓝跑至凝胶底部。转膜后以恒流300 mA电转60~100 min。取出PVDF膜,置于50 g/L脱脂奶粉液中室温封闭2 h。抗体孵育:将PVDF膜封入含一抗(MCT4,按1200稀释;β-actin,按11 000稀释)的杂交袋中,4 ℃过夜。取出后室温复温30 min,用含吐温的TBST洗膜30 min,再加入羊抗兔二抗(按110 000稀释),室温充分孵育2 h,TBST摇洗30 min。加入ECL化学发光液,于全自动凝胶成像仪下曝光。用Image J软件对图像进行灰度值分析,计算MCT4/β-actin灰度比值。
1.4乳酸试剂盒检测Hela、Siha细胞外基质中乳酸含量细胞转染培养96 h后,按1.2分组将各组中的培养液转移至EP管中,根据乳酸定量试剂盒步骤测定乳酸含量。用酶联免疫检测仪(Bio-Rad公司,美国)在530 nm波长处分别测定各管中液体的吸光度(A值),然后按照试剂盒内公式计算出各组培养液中的乳酸含量。
1.5CCK-8检测Hela、Siha细胞的增殖情况分别于转染后24、48、72和96 h检测Hela、Siha细胞的增殖情况。于超净台环境内每孔加入10 μL CCK-8,37 ℃避光温育2 h,于450 nm波长下应用酶联免疫检测仪(美国Bio-Rad公司)测定各孔A值。
1.6划痕实验检测Hela、Siha细胞的迁移率转染后96 h于显微镜下观察细胞贴壁情况,如贴壁良好且铺满皿底,用枪头垂至于皿底的水平横向划5条线。用PBS轻柔漂洗细胞3次,去除漂浮的细胞,加入无血清的DMEM培养液,放入37℃、体积分数5%CO2培养箱培养。在划痕实验开始24 h之内,选取固定视野拍照分析并计算迁移率,迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.7Transwell实验检测Hela、Siha细胞的侵袭性
在Transwell 小室上层中铺70 μL 稀释后的Matrigel胶(Matrige胶DMEM=16),37 ℃孵育过夜,之后加入70 μL DMEM 无血清培养基并在37 ℃孵育箱中活化1 h。取经转染处理96 h的Hela、Siha细胞,配制成1×106个/mL的细胞悬液,每个小室中加100 μL 细胞悬液,均匀地铺于Transwell小室中,下层加600 μL 含体积分数20% FBS的完全培养基,37 ℃孵箱培养24 h,取出Transwell 小室,用棉签轻轻地拭去小室上层的细胞,PBS 洗2 遍,每孔中加入500 μL甲醇浸泡小室30 min,最后用结晶紫染色30 min,分别用PBS漂洗2遍[17]。在倒置显微镜下选取5 个视野拍照,用酶联免疫检测仪检测A值。
1.8流式细胞术检测Hela、Siha细胞的凋亡率转染96 h 后用无EDTA的胰蛋白酶消化细胞,并用完全培养基混悬细胞,2 000 r/min离心5 min,弃上清。用PBS洗涤细胞2次,2 000 r/min离心5min,收集细胞,加入500 μL的Binding Buffer,轻柔吹打,重悬细胞。加入5 μL Annexin V-FITC,混匀后,孵育15 min,之后加入5 μL碘化丙啶(PI),混匀后避光、室温孵育5~15 min,于1 h内用流式细胞仪检测,用BD Accuri C6软件分析结果。
1.9统计学处理采用SPSS 21.0进行分析。应用单因素方差分析和LSD-t检验比较各组Hela、Siha细胞外液中乳酸浓度、细胞增殖、迁移能力、侵袭能力和凋亡的变化,检验水准α=0.05。
2 结果
2.1Westernblot检测siRNA的沉默效果见图1、表2。与Ctrl组相比,沉默MCT4 96 h后,siMCT4#1组和siMCT4#2组Hela、Siha细胞中MCT4蛋白表达含量均下降,差异有统计学意义(P<0.001)。由表2可知,siMCT4#2沉默Hela、Siha细胞中的MCT4效果更好,因此选用siMCT4#2进行后续实验。
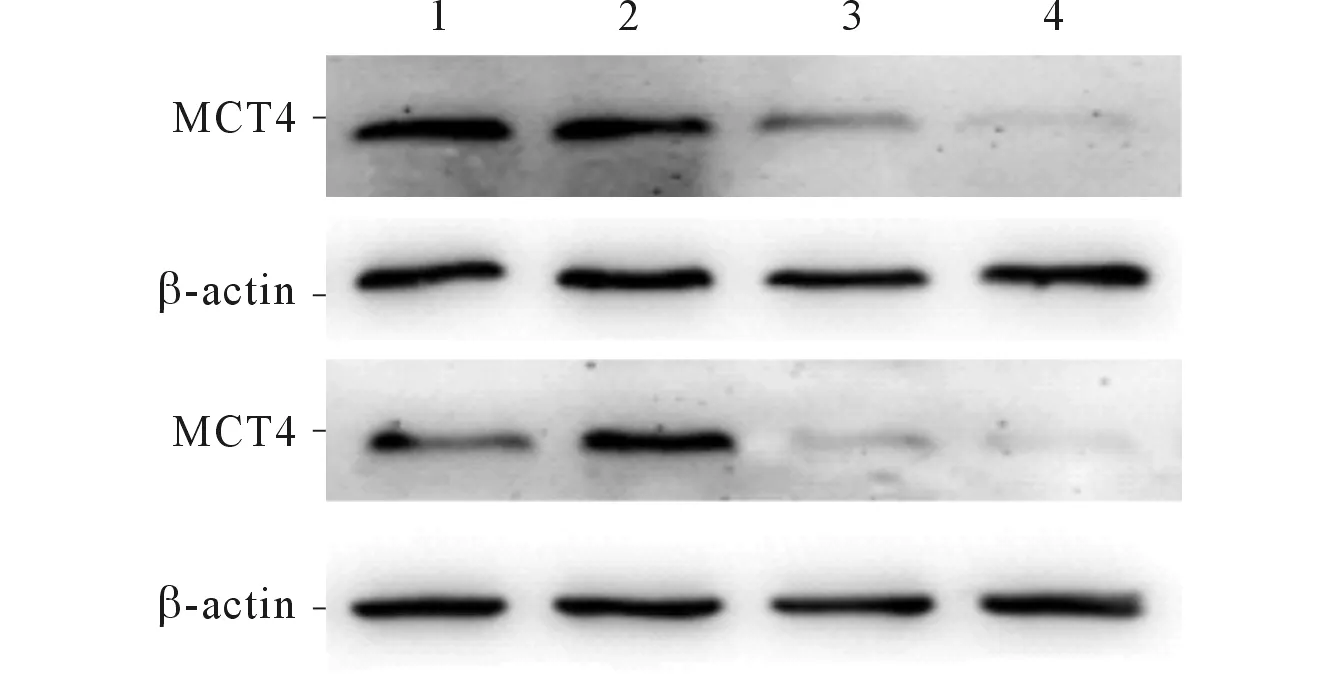
1:Ctrl组;2:siNC组;3:siMCT4#1组:4:siMCT4#2组图1 各组Hela(上)、Siha(下)细胞中MCT4蛋白的表达
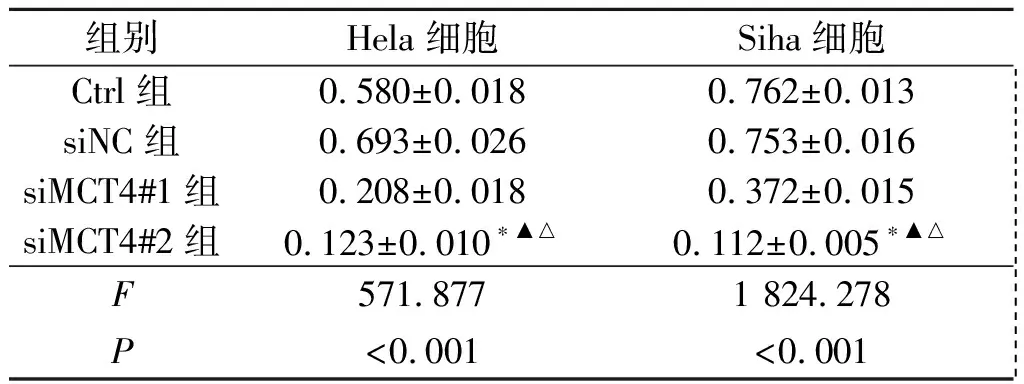
表2 各组Hela、Siha细胞中MCT4蛋白表达的比较(n=3)
*:与Ctrl组相比,P<0.05;▲:与siNC组相比,P<0.05;△:与siMCT4#1组相比,P<0.05
2.2沉默MCT4对宫颈癌细胞外乳酸浓度的影响
见表3。
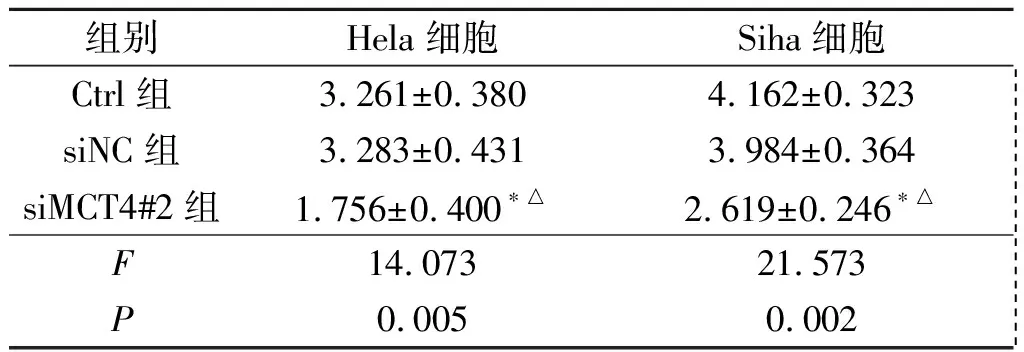
表3 各组Hela、Siha细胞外液中乳酸浓度的变化(n=3) mmol/L
*:与Ctrl组相比,P<0.05;△:与siNC组相比,P<0.05
2.3沉默MCT4对宫颈癌细胞增殖的影响见图2。由图2可知,沉默MCT4后,Hela、Siha细胞增殖受到抑制的效果一直持续到96 h。
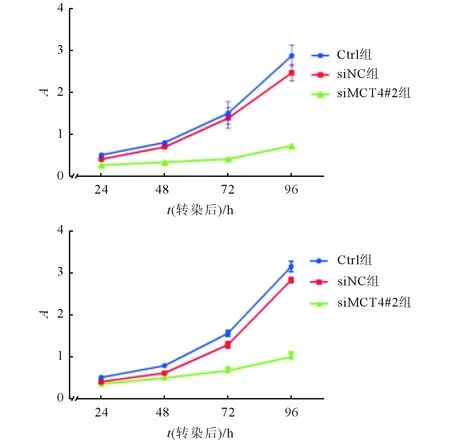
图2 沉默MCT4对宫颈癌Hela(上)、Siha(下)细胞增殖的影响
2.4沉默MCT4对宫颈癌细胞迁移能力的影响见图3、表4。
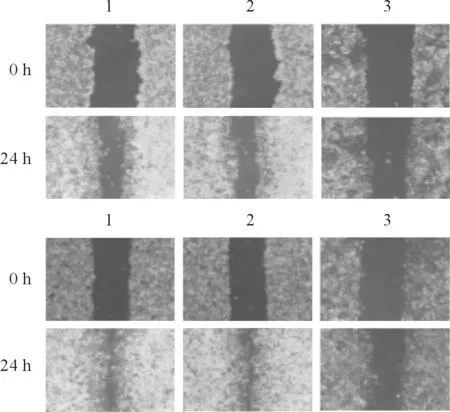
1:Ctrl组;2:siNC组;3:siMCT4#2组图3 沉默MCT4对宫颈癌Hela(上)、Siha(下)细胞迁移能力的影响

表4 各组Hela、Siha细胞迁移率的变化(n=3)
*:与Ctrl组相比,P<0.05;△:与siNC组相比,P<0.05
2.5沉默MCT4对细胞侵袭能力的影响见图4、表5。

1:Ctrl组;2:siNC组;3:siMCT4#2组图4 沉默MCT4对宫颈癌Hela(上)、Siha(下)细胞侵袭能力的影响

表5 各组Hela、Siha细胞相对侵袭率的变化(n=3)
*:与Ctrl组相比,P<0.05;△:与siNC组相比,P<0.05
2.6沉默MCT4对宫颈癌细胞凋亡的影响见表6。流式细胞术检测结果显示沉默MCT4基因可以促进Hela和Siha细胞的早期凋亡。
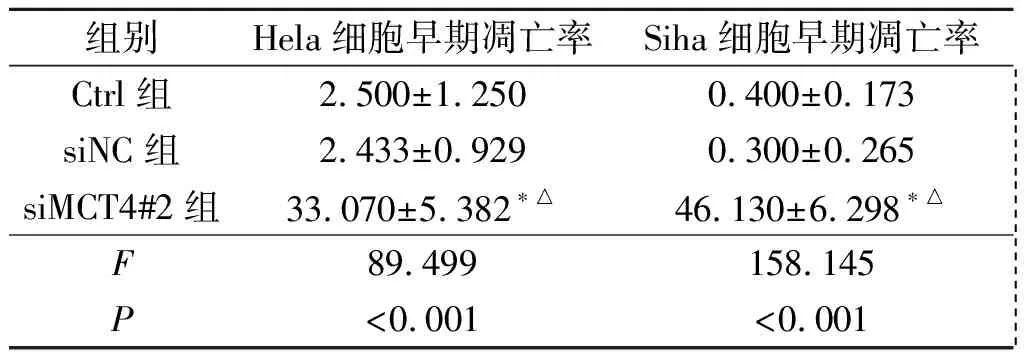
表6 各组Hela、Siha细胞凋亡率的变化(n=3) %
*:与Ctrl组相比,P<0.05;△:与siNC组相比,P<0.05
3 讨论
大多数肿瘤依靠高速有氧糖酵解的方式产能,这将导致细胞内大量的乳酸生成,为了防止细胞酸中毒和保证细胞糖酵解的高速进行,肿瘤细胞将大量乳酸排到胞外[4,6,9]。外排的乳酸导致肿瘤酸性微环境的形成,从而为肿瘤增殖、侵袭、转移、局部免疫抑制以及一些化疗药物抵抗创造了条件[5-8]。在负责乳酸外排的胞膜蛋白中,MCT4发挥着重要的作用。MCT4是单羧酸转运体家族中的重要一员,主要存在于进行糖酵解的组织和一些肿瘤细胞中,作用就是将细胞内产生的大量乳酸排到胞外,调节细胞内外的pH值[11]。已有研究[14-16]发现,MCT4在多种恶性肿瘤(如肺癌、乳腺癌、胃癌、前列腺癌)中表达,并且和多种恶性肿瘤的不良预后相关。Pinheiro等[13]报道,在宫颈鳞癌和腺癌组织中均存在MCT1 和MCT4的高表达,并且MCT1 和MCT4 在CD147 阳性病例中更富于表达;此外,CD147 和MCT1 的共表达与宫颈腺癌的淋巴结转移和远处转移相关。还有研究[18]发现,与人类乳头瘤病毒(HPV)阴性侵袭性宫颈癌组织相比,HPV 阳性宫颈癌病变中MCT1 和MCT4 的表达更多见。
已经有越来越多的研究[14-16]表明,通过siRNA特异性沉默MCT4可以抑制肿瘤细胞的侵袭迁移等恶性行为的产生,提示MCT4可以作为潜在的治疗靶点。基于MCT4在Hela和Siha细胞中的表达,本研究通过转染siRNA特异性沉默Hela和Siha细胞中的MCT4基因,结果表明下调MCT4蛋白可以显著地抑制Hela和Siha细胞的增殖,表明特异序列的siRNA可作为潜在的治疗药物。本研究结果显示,下调MCT4表达后,可有效地抑制Hela和Siha细胞的迁移和侵袭能力。流式细胞术检测结果显示:转染96 h 后实验组细胞的早期凋亡率高于空白对照组和阴性对照组,表明可以通过抑制乳酸的外排来干扰细胞内葡萄糖有氧糖酵解的代谢通路,诱导其发生凋亡。
但MCT4下调后抑制Hela和Siha增殖、迁移和侵袭以及其他肿瘤生物学行为的机制需要进一步研究。作者认为可以使用FDG-PET作为代谢示踪剂,以确定宫颈癌细胞在体内受到MCT4治疗之后葡萄糖的摄取是否受到影响[14];或者使用稳定的同位素标记的代谢物,如13C-葡萄糖,用于更全面地评估沉默MCT4后葡萄糖代谢的指标变化情况[19-20]。另外,也可以考虑与目前常用于治疗宫颈癌的化疗药相结合来提高疗效,或者与其他葡萄糖代谢调节剂(如二甲双胍[21]或线粒体抑制剂)联合来更完全地封锁肿瘤细胞对葡萄糖的利用。
综上所述,特异性沉默MCT4基因可抑制Hela、Siha细胞的增殖、迁移和侵袭,并且促进其凋亡的发生,提示MCT4可作为宫颈癌潜在的治疗靶点。
[1] CHEN W, ZHENG R, BAADE PD, et al.Cancer statistics in China, 2015 [J].CA Cancer J Clin ,2016, 66(2):115
[2] WARBURG O. On respiratory impairment in cancer cells[J]. Science, 1956, 124(3215): 269
[3] KOOCHEKPOUR S, MAJUMDAR S, AZABDAFTARI G, et al. Serum glutamate levels correlate with gleason score and glutamate blockade decreases proliferation, migration, and invasion and induces apoptosis in prostate cancer cells[J]. Clin Cancer Res ,2012, 18(21):5888
[4] WEBB BA, CHIMENTI M, JACOBSON MP, et al. Dysregulated pH: a perfect storm for cancer progression[J]. Nat Rev Cancer ,2011, 11(9):671
[5] CHOI SY, COLLINS CC, GOUT PW, et al.Cancer-generated lactic acid: a regulatory, immunosuppressive metabolite?[J]. J Pathol ,2013, 230(4):350
[6] HANAHAN D, WEINBERG RA.Hallmarks of cancer: the next generation[J]. Cell ,2011, 144(5):646
[7] PARKS SK, CHICHE J, POUYSSÉGUR J. Disrupting proton dynamics and energy metabolism for cancer therapy[J]. Nat Rev Cancer, 2013, 13(9): 611
[8] KROEMER G, POUYSSEGUR J. Tumor cell metabolism: cancer’s Achilles’ heel[J]. Cancer Cell, 2008, 13(6): 472
[9] GATENBY RA, GILLIES RJ.Why do cancers have high aerobic glycolysis?[J]. Nat Rev Cancer,2004, 4(11):891
[10]HALESTRAP AP, WILSON MC.The monocarboxylate transporter family:role and regulation[J]. IUBMB Life,2012, 64(2):109
[11]DIMMER KS, FRIEDRICH B, LANG F, et al. The low-affinity monocarboxylate transporter MCT4 is adapted to the export of lactate in highly glycolytic cells[J]. Biochem J, 2000, 350(Pt 1): 219
[12]BOVENZI CD, HAMILTON J, TASSONE P, et al. Prognostic Indications of elevated MCT4 and CD147 across cancer types: a meta analysis[J]. BioMed Res Int, 2015, 2015:1. DOI:10.1155/2015/242437
[13]PINHEIRO C, LONGATTO-FILHO A, PEREIRA SM, et al. Monocarboxylate transporters 1 and 4 are associated with CD147 in cervical carcinoma[J]. Dis Markers,2009, 26(3):97
[14]CHOI SY, XUE H, WU R, et al. The MCT4 gene: a novel, potential target for therapy of advanced prostate cancer[J]. Clin Cancer Res,2016, 22(11):2721
[15]LEE JY, LEE I, CHANG WJ, et al. MCT4 as a potential therapeutic target for metastatic gastric cancer with peritoneal carcinomatosis[J]. Oncotarget, 2016, 7(28): 43492
[16]BAENKE F, DUBUIS S, BRAULT C, et al. Functional screening identifies MCT4 as a key regulator of breast cancer cell metabolism and survival[J]. J Pathol, 2015, 237(2): 152
[17]杜培培,刘宗文,张艳,等.儿茶素对胃癌细胞SGC-7901和MGC-803迁移及侵袭的影响[J].郑州大学学报(医学版),2016,51(1):51
[18]PINHEIRO C, LONGATTO-FILHO A, FERREIRA L, et al. Increasing expression of monocarboxylate transporters 1 and 4 along progression to invasive cervical carcinoma[J].Int J Gynecol Pathol,2008,27(4):568
[19]GRAVEL SP, HULEA L, TOBAN N, et al. Serine deprivation enhances antineoplastic activity of biguanides[J]. Cancer Res, 2014, 74(24): 7521
[20]GRAVEL SP, ANDRZEJEWSKI S, AVIZONIS D, et al. Stable isotope tracer analysis in isolated mitochondria from mammalian systems[J]. Metabolites,2014, 4(2):166
[21]王涛,王峰,何炜等.二甲双胍对人食管癌KYSE450细胞系增殖和凋亡的影响[J].郑州大学学报(医学版),2015,50(3):305
