青蒿素调控NF-κB信号通路介导阿尔茨海默病炎症反应细胞模型的研究
2018-05-30王海英李慧源罗红月张慧予姜扬郭利晴陶蕾孙晓红
王海英,李慧源,罗红月,张慧予,姜扬,郭利晴,陶蕾,孙晓红
(中国医科大学附属第四医院神经内科,沈阳 110032)
阿尔茨海默病 (Alzheimer’s disease,AD) 是痴呆最常见的原因,是一个日益增长的全球健康问题,对个人和社会造成巨大的经济负担[1]。AD的病理学标志包括老年斑细胞外沉积,细胞内神经纤维元缠结和胆碱能神经元的损伤以及大脑皮层、海马和认知功能所必需的其他脑区域中的突触改变。目前研究[2-5]可知多种因素,如炎症反应、细胞凋亡、细胞自噬、氧化应激、兴奋毒性和能量代谢稳态紊乱,都可推动AD的进展。目前尚无确定的能逆转认知功能缺损的药物,针对AD发病机制不同靶点的药物开发尚处于试验阶段。而关于青蒿素 (artemisinin,ART) 在AD中的抗炎作用研究较少,故本研究拟探讨ART对AD细胞模型的抗炎作用,分析ART对AD的干预作用及其机制。
1 材料与方法
1.1 主要试剂与仪器
ART标准品购自大连美仑生物技术有限公司,BV2 小鼠小胶质细胞购自中国医学科学院基础医学研究所基础医学细胞中心,DMEM培养基、0.25%胰酶购自美国Hyclone公司,胎牛血清购自德国Sera Pro公司,A β25-35购买自北京博奥森生物技术有限公司,CCK8试剂购自中国Biosharp公司,RIPA buffer裂解缓冲液、BCA试剂盒购自碧云天生物技术研究所,PMSF 购自中国Roche公司,ECL超敏发光液购自北京普利莱基因技术公司,抗体均购自万类生物技术有限公司。
1.2 BV2小胶质细胞培养
BV2 小鼠小胶质细胞在含 10%胎牛血清,10%青霉素 (100 U/mL) 和链霉素 (0.1 mg/mL) 的DMEM中培养,放入37 ℃、5 % CO2的孵箱中。每2 d 换液1次,当细胞铺满瓶底的80%~90%时传代进行。将处于对数生长期时细胞用于实验。
1.3 A β25-35的处理
二甲基亚枫 (dimethyl sub-maple,DMSO) 溶解人工合成的A β25-35晶体,用高压灭菌的双蒸水稀释至母夜浓度 (100 μ mol/L) 。37 ℃、7 d后老化为A β25-35纤维体。制作完成后-40 ℃保存备用。
1.4 BV2小胶质细胞炎症反应细胞模型的建立
取处于对数生长期的BV2小胶质细胞以5×103/mL于96孔板中培养,将A β25-35依照浓度梯度 (10 μ mol/L、20 μ mol/L和40 μ mol/L) 加入培养基中。24 h后进行CCK8法检测细胞活力,选取最佳A β25-35浓度,根据选定的浓度进行后续实验。
1.5 ART对BV2细胞的毒性反应实验
BV2细胞以5×103/mL接种于96孔板中,每孔100 μ L,培养24 h后,加入不同浓度的ART (0.01、0.1、1、10、20、40、60、80 μ mol/L) 继续培养24 h,采用CCK8法检测ART对BV2细胞的毒性。每次实验设3个复孔,重复3次。
1.6 Western blotting检 测ART对BV2细 胞NF-κB信号通路蛋白表及炎症诱导酶表达的影响
BV2细胞以5×105个/孔密度接种于6孔板中,培养24 h后,使用A β25-35诱导细胞前加入不同浓度的青蒿素预处理1 h,A β25-35终浓度为10 μ mol/L。继续培养24 h后,弃掉6孔板中旧培养基,用预冷的PBS洗3遍,加入RIPA裂解液 (加入1% PMSF) ,冰上裂解20 min后,用移液枪吹打细胞后移至1.5 mL EP管中,4℃,12 000 g离心15 min。BSA法测定蛋白浓度,之后进行凝胶电泳,转膜,4 ℃一抗过夜,二抗孵育1 h后,进行ECL显影,计算灰度值。
1.7 实时PCR检测促炎性因子白细胞介素1 β (interleukin 1 β,IL-1 β) ,肿瘤坏死因子α (tumor necrosis factor α,TNF-α) 的mRNA表达水平
收集生长状态良好的细胞,用RNA提取试剂盒提取细胞总mRNA。应用反转录试剂盒将RNA逆转录为cDNA。反应在实时 PCR仪上进行,最终数据用2-△△Ct法进行相对定量分析。
1.8 统计学分析
采用GraphPad统计软件进行统计学分析,计量资料结果用x-±s表示,P < 0.05为差异有统计学意义。
2 结果
2.1 ART、A β25-35对BV2小胶质细胞活力的影响
通过CCK8法检测到ART剂量范围为0.01~10 μ mol/L时,对细胞不具有显著的毒性反应,因此选择ART最低和最高有效浓度 (0.01和10 μ mol/L) 用于进一步的实验。而A β25-35≤10 μ mol/L时细胞活力无显著变化,因而选择10 μ mol/L作为A β25-35的有效作用浓度。因此实验分组为空白对照组 、模型组、ART低浓度组 (ART 0.01 μ mol/L) 和ART高浓度组 (ART 10 μ mol/L) ,见图1。
2.2 ART对炎症诱导酶一氧化氮合成酶 (nitric oxide synthase,iNOS) 和环氧合酶2 (cyclooxygenase-2,COX-2) 蛋白表达的影响
与对照组相比,10 μ mol/L A β25-35处理BV2细胞24 h,iNOS和COX-2表达量显著增加。而通过ART预处理BV2细胞iNOS和COX-2表达呈剂量依赖性降低,见图2。
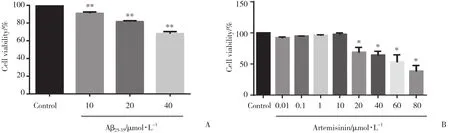
图1 不同浓度的 A β25-35、ART对BV2细胞活力的影响Fig.1 Effects of different concentrations of A β25-35 and ART on the viability of BV2 cells
2.3 ART对NF-κB通路蛋白表达的影响
通过免疫印迹分析,证明ART可调控BV2细胞中NF-κB活化。ART预处理BV2小胶质细胞,P-P65、p-IKB α的蛋白表达量呈明显下降趋势,P65、IKB α的表达量呈明显上升趋势,见图3。
2.4 ART对炎性因子mRNA表达的影响
实时PCR结果表明,ART可减弱A β25-35诱导的促炎细胞因子如TNF-α和IL-1 β mRNA的表达,并可促进抑炎因子 (IL-10) mRNA的表达。见图4。
3 讨论
目前AD发病机制尚不明确,现有研究证明,炎症反应参与AD的发生发展过程。A β25-35激活的神经胶质细胞通过NF-κB通路活化分泌许多促炎细胞因子,如IL-1 β、TNF-α[6],并且NF-κB通路活化的信号传导对于NALP3炎症小体的激活是必需的[7]。

图2 不同实验组iNOS 和 COX-2蛋白的表达Fig.2 The expression of iNOS and COX-2
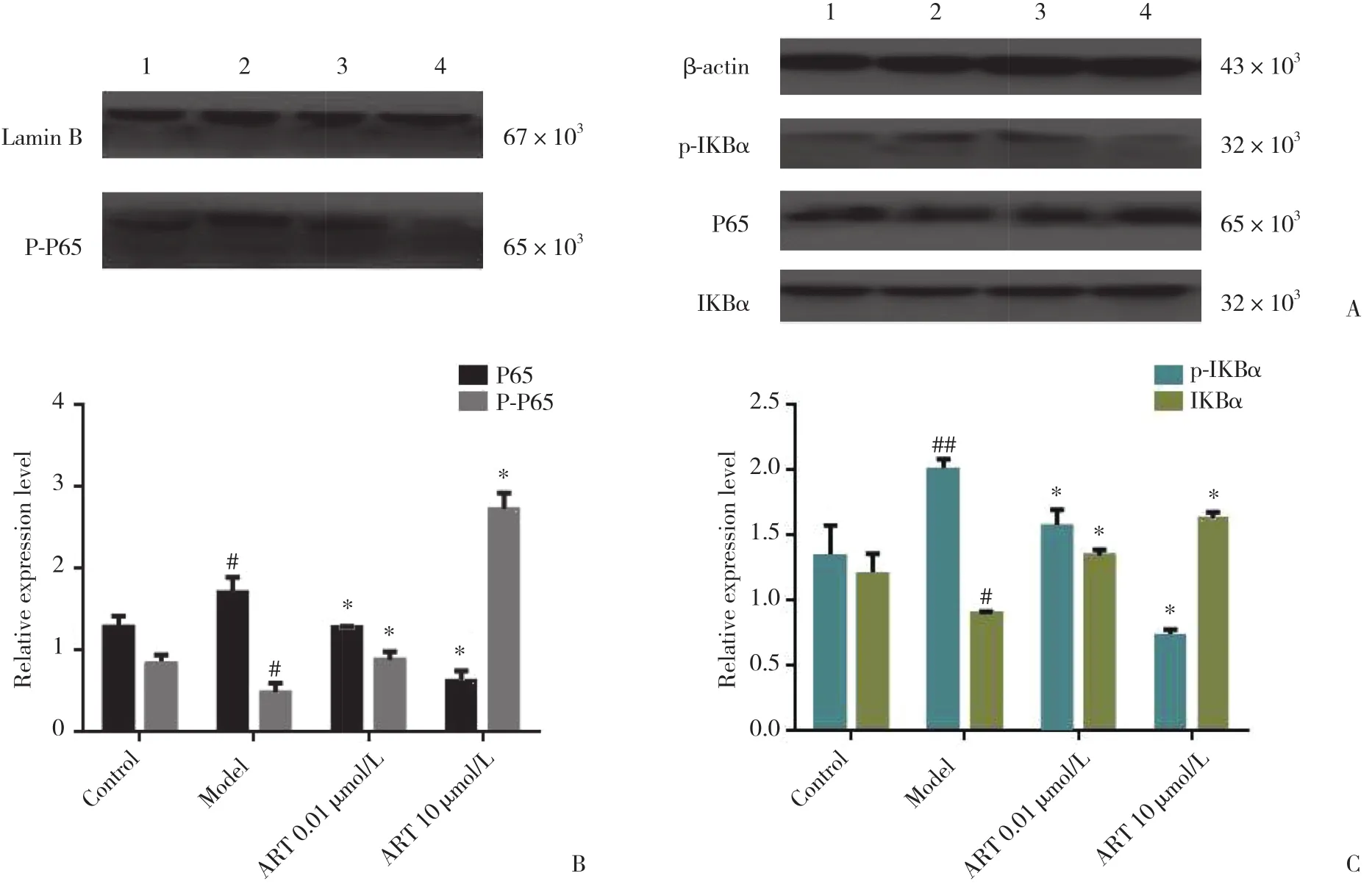
图3 不同实验组对NF-κB通路活化的影响Fig.3 Effects of different experimental groups on activation of NF-κB pathway

图4 不同实验组TNF-α、IL-1 β、IL-10 mRNA表达结果Fig.4 Expression of TNF-α,IL-1 β,IL-10 mRNA in different experimental groups
ART除了具有抗疟作用外[8],还具有抗肿瘤、免疫调节、抗真菌等作用。通过APP/PS1双转基因小鼠体内实验研究[9]发现,ART还具有以下作用:(1) 减少神经炎斑块负荷; (2) 通过抑制β分泌酶活性调节APP生成;(3) 通过NF-κB通路抑制APPswe/PS1dE9双转基因小鼠NALP3炎症小体的激活。
NF-κB信号通路主要参与机体防御反应、组织损伤和应激、细胞分化和调亡以及肿瘤生长抑制过程等的信息传递。NF-κB在细胞质中与抑制性蛋白质结合形成无活性的复合物。当TNF等作用于相应受体后,可通过第二信使激活此系统,而病毒感染、脂多糖、活性氧中间体、双链RNA等则可直接激活NF-κB。激活过程是通过磷酸化抑制性蛋白使其构象改变,从而使得NF-κB得以活化。活化的NF-κB进入细胞核,与DNA接触,并启动或抑制有关基因的转录。本研究结果显示,在没有受到刺激的BV2小胶质细胞中,大部分的NF-κB二聚体通过与IKB α结合而以无活性的状态存在,当细胞受到刺激后,可使IKB α发生磷酸化,并从NF-κB上解离出来,NF-κB因此具有转录活性。 NF-κB途径是神经炎症关键介质之一。本研究支持ART对A β25-35介导的NF-κB活化具有抑制作用。
AD炎症进展的一个中心特征是活化的小胶质细胞聚集在聚集A β肽斑块周围。小胶质细胞激活表明持续的慢性炎症过程。小胶质细胞刺激通过释放一氧化氮,iNOS,COX-2,IL-1 β,TNF-α等因子而发挥神经毒性作用,从而导致炎症的发生。一氧化氮是主要产物,其产生受iNOS的调控,iNOS在激活的巨噬细胞中高度表达,引起炎性和自身免疫疾病中的器官破坏。而COX-2在前列腺素E2生成中起关键酶作用,同时导致炎性细胞因子释放和形成脑水肿。许多研究[10-12]通过抑制激活的BV2细胞中的iNOS和COX-2来进行抗炎调节。同样地,本研究显示,ART可抑制A β25-35诱导活化的BV2细胞中的iNOS和COX-2炎症介质的表达。
ART可显著抑制NF-κ B通路活化,导致促炎细胞因子 (TNF-α,IL-1 β) 生成减少、抑炎因子 (IL-10)的表达增加,并抑制炎症诱导酶表达。本研究首先证明了ART在AD细胞模型中的抗炎作用。
总而言之,本研究揭示了ART抑制AD炎症反应细胞模型的作用。ART抑制NF-κB通路蛋白磷酸化进而调控炎性细胞因子及炎症酶表达减少炎症反应的发生,表明ART可能是治疗AD的潜在治疗药物。今后应进一步探讨其疗效和安全性。
[1] APOSTOLOVA LG. Alzheimer disease [J]. Minneap Minn,2016,22(2) :419-434. DOI:10.1212/CON.0000000000000307.
[2] LIN XY,BAI G,LIN L,et al. Vaccination induced changes in pro-inflammatory cytokine levels as an early putative biomarker for cognitive improvement in a transgenic mouse model for Alzheimer disease[J]. Hum Vaccin Immunother,2014,10 (7) :2024-2031. DOI:10.4161/hv.28735.
[3] WANG XJ,CAO Q,ZHANG Y,et al. Activation and regulation of caspase-6 and its role in neurodegenerative diseases [J]. Annu Rev Pharmacol Toxicol,2015,55 (5) :53-72. DOI:10.1146/annurev-pharmtox-010814-124414.
[4] GASIOROWSKI K,BROKOS B,LESZEK J,et al. Insulin resistance in Alzheimer disease:p53 and microRNAs as important players[ J].Curr Top Med Chem,2017,17( 12) :1429-1437. DOI:10.2174/1568 026617666170103161233.
[5] VALLE A,LECARPENTIER Y,GUILLEVIN R,et al. Reprogramming energetic metabolism in Alzheimer’s disease[ J]. Life Sci,2018,15( 193) :141-152. DOI:10.1016/j.lfs.
[6] RAHA S,LEE HJ,YUMNAM S,et al. Vitamin D2 suppresses amyloidβ- 25-35 induced microglial activation in BV2 cells by blocking the NF-κB inflammatory signaling pathway[ J]. Life Sci,2016,15(161) :37-44. DOI:10.1016/j.lfs.
[7] CHO MH,CHO K,KANG HJ,et al. Autophagy in microglia degrades extracellular β-amyloid fibrils and regulates the NLRP3 inflammasome[ J]. Autophagy,2014,10( 10) :1761-1775. DOI:10.4161/auto.29647.
[8] TAMBO E,KHATER EI,CHEN JH,et al. Nobel prize forthe artemisinin and ivermectin discoveries:a great boost towards elimination of the global infectious diseases of poverty[ J]. Infect Dis Poverty,2015,28( 4) :58. DOI:10.1186/s40249-015-0091-8.
[9] SHI JQ,ZHANG CC,SUN XL,et al. Antimalarial drug artemisinin extenuates amyloid ogenesis and neuroinflammation in APPswe/PS-1dE9 transgenic mice via inhibition of nuclear factor-κB and NLRP3 inflammasome activation[ J]. CNS Neurosci Ther,2013,19( 4) :262-268. DOI:10.1111/cns.12066.
[10] CAI Z,HUSSAIN MD,YAN LJ,et al. Microglia,neuroinflammation,and beta-amyloid protein in Alzheimer’s diseas[eJ]. Int J Neurosci,2014,124 ( 5) :307-321. DOI:10.3109/00207454.2013.833510.
[11] SKLYAROV AY,PANASYUK NB,FOMENKO IS,et al. Role of nitric oxide-synthase and cyclooxygenase/lipooxygenase systems in development of experimental ulcerative colitis[ J]. J Physiol Pharmacol,2011,62( 1) :65-73.
[12] BOZIC I,SAVIC D,LAKETA D,et al. Benfotiamine attenuates inflammatory response in LPS stimulated BV-2 microglia[ J]. PLoS One,2015,10( 2) :e0118372. DOI:10.1371/journal.pone.0118372.eCollection 2015.
