儿科患者血培养常见病原菌分布及耐药性特点分析
2018-05-30岳冬梅佟雅洁杨凡
岳冬梅,佟雅洁,杨凡
(中国医科大学附属盛京医院儿科,沈阳 110004)
儿童机体抵抗力弱,免疫系统发育尚不成熟,皮肤表面正常菌群极易进入血液引起感染[1-2],严重者会出现菌血症或败血症,病情危急,严重影响预后。然而细菌感染临床表现不典型,缺乏特异性,临床上通过血培养检出病原菌明确诊断,同时根据药敏试验结果选用抗菌药物来提高患儿治愈率[3]。儿科重症监护病房 (pediatrics intensive care unit,PICU)患儿病情重,体质弱,插管等介入治疗手段造成的医源性感染较普通病房及门诊 (非PICU) 多见,感染风险亦高[4-5]。本研究回顾性分析2016年我院PICU与非PICU患儿血培养的病原菌分布及耐药性特点,旨在为感染患儿合理使用药物提供参考依据。
1 材料与方法
1.1 一般资料
收集2016年1月至12月期间我院住院及门诊就诊的血培养阳性患儿的临床资料,共914例,其中PICU患儿101例,非PICU患儿813例。
1.2 病原菌检测及耐药菌鉴定
对怀疑血液感染的患儿在使用抗菌药物前或者患儿发热时,局部严格消毒后采集静脉血液标本(新生儿采集1.5 mL,儿童采集5~10 mL) 并分别注入需氧和厌氧血培养瓶中,混合均匀后送我院检验科。根据《全国临床检验操作规程》的要求对标本进行培养,采用法国梅里埃公司Vitek2 Compact全自动微生物鉴定分析系统对病原菌进行分离与鉴定,采用美国西门子公司Walkaway药敏分析仪对药物敏感性进行分析,结果判断依据2016年美国临床和实验室标准协会标准执行。同一患者相同细菌标本类型计为1株。
1.3 统计学分析
采用SPSS 19.0软件对数据进行统计分析处理,计数资料以百分比或率表示,组间比较采用 χ2检验。P < 0. 05为差异有统计学意义。
2 结果
2.1 PICU与非PICU病原菌分布比较
结果显示,PICU共送检了2 171份血培养标本,分离出病原菌101株,阳性率4.65%;非PICU共送检了11 320份血培养标本,分离出病原菌813株,阳性率7.18%。PICU与非PICU中革兰阳性菌均以表皮葡萄球菌和人葡萄球菌多见;革兰阴性菌均以大肠埃希菌和肺炎克雷伯菌多见。肺炎链球菌、肺炎克雷伯菌、流感嗜血杆菌、摩式摩根菌、阴沟肠杆菌以及白假丝酵母菌分布上2组比较具有统计学差异(均P < 0.05) 。见表1。
2.2 PICU与非PICU表皮葡萄球菌、人葡萄球菌药敏试验结果比较
结果显示,血培养阳性标本中分离出的2种主要革兰阳性菌分别为表皮葡萄球菌和人葡萄球菌。PICU与非PICU比较,表皮葡萄球菌对左氧氟沙星、环丙沙星、庆大霉素、利福平耐药率差异存在统计学意义 (均P < 0.05);人葡萄球菌耐药率差异均无统计学意义 (均P > 0.05) 。见表2。
2.3 PICU与非PICU大肠埃希菌、肺炎克雷伯菌药敏试验结果比较
结果显示,分离出的主要革兰阴性菌分别为大肠埃希菌和肺炎克雷伯菌。PICU与非PICU比较,大肠埃希菌对头孢噻肟、头孢他啶、左氧氟沙星、美洛培南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦以及亚胺培南的耐药率差异存在统计学意义 (均P < 0.05);肺炎克雷伯菌对头孢呋辛酯、头孢唑林、头孢曲松、头孢呋辛、头孢孟多、四环素、庆大霉素的耐药率差异存在统计学意义 (均P < 0.05) 。见表3。
3 讨论
儿童自身免疫功能与成人不同,很容易发生血流感染,血流感染患儿病情进展迅速,易引起全身性感染[6-7]。有研究[8-9]显示,严重感染患儿常起病急骤,病情危急,预后不良,及时有效治疗可显著改善预后。了解本地区患儿血流感染常见病原菌及耐药性特点,是重症感染初期患儿缺乏病原学证据时经验性治疗的关键。本研究结果显示,儿科患者血培养以革兰阳性菌 (60.28%) 为主,表皮葡萄球菌和人葡萄球菌最多见,与国内外相关报道一致[10-13],表皮葡萄球菌和人葡萄球菌均属于凝固酶阴性葡萄球菌 (coagulase-negative staphylococci,CoNS) ,这类病原菌属于人体皮肤黏膜定植菌[14-15],儿童由于皮肤黏膜发育尚未完全成熟,定植菌容易入血引起血流感染。革兰阴性菌占36.21%,以大肠埃希菌和肺炎克雷伯菌多见,真菌 (3.39%) 较少见。PICU与非PICU病原菌分布结果显示,肺炎克雷伯菌、肺炎链球菌、流感嗜血杆菌、摩式摩根菌、阴沟肠杆菌以及白假丝酵母菌分布两者具有统计学差异 (均P <0.05) ,但除肺炎克雷伯菌外,其余病原菌检出的菌株数较少,可能存在一定的误差。
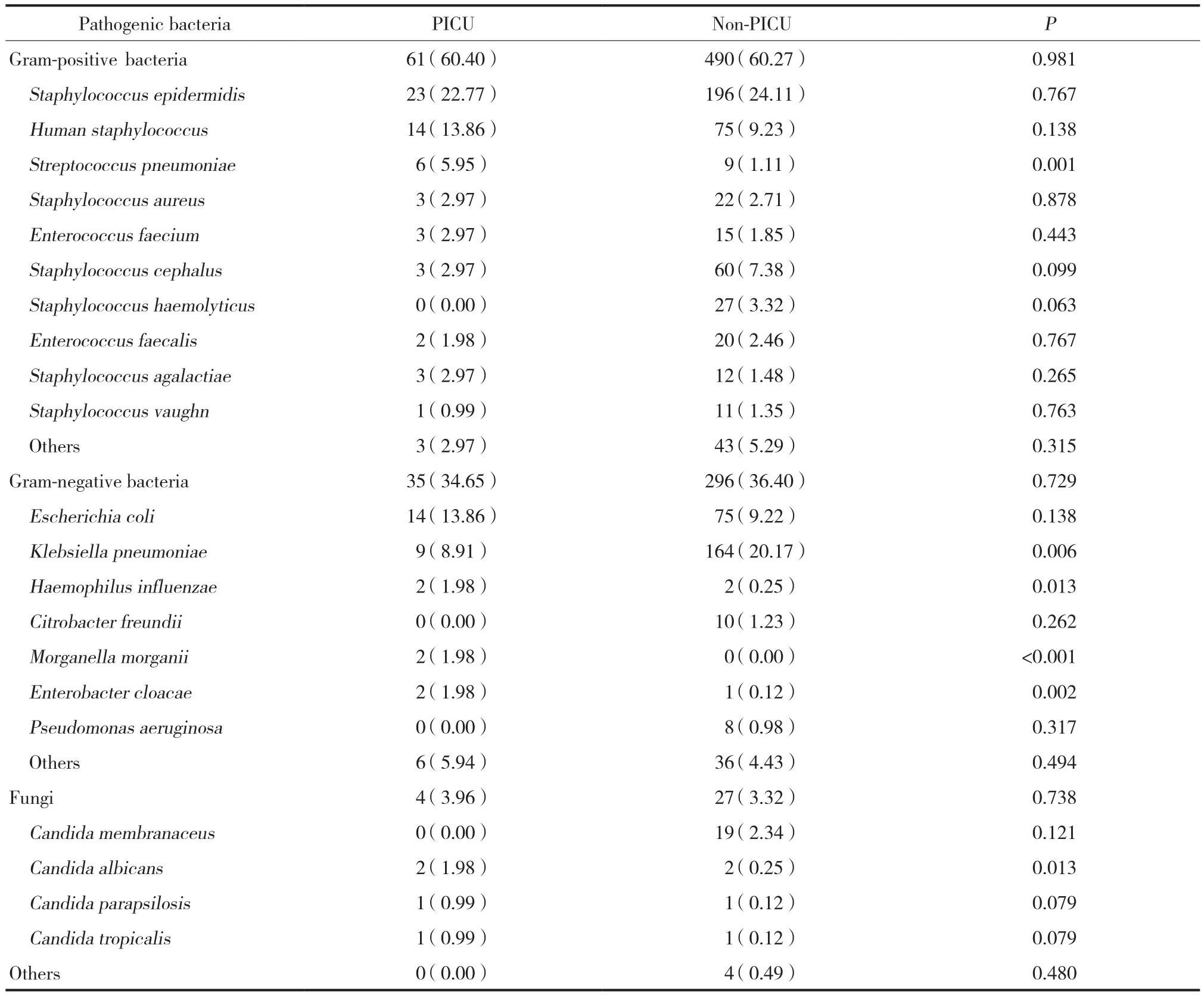
表1 PICU与非PICU血培养病原菌分布 [n (%) ]Tab.1 Distribution of pathogens in the PICU and non-PICU with blood culture [n (%) ]
药敏试验结果显示,革兰阳性菌中,PICU中分离的表皮葡萄球菌对青霉素G全部耐药,非PICU中分离的表皮葡萄球菌对青霉素G的耐药率高达90%以上;PICU、非PICU分离出的表皮葡萄球菌对红霉素和苯唑西林的耐药率分别为90%以上、70%~90%,两者差异无统计学意义 (P > 0.05) ,说明我院患儿感染的表皮葡萄球菌已对青霉素G、红霉素和苯唑西林高度耐药,不适合早期经验性抗感染治疗。PICU、非PICU分离出的表皮葡萄球菌对喹诺酮类抗生素 (左氧氟沙星、环丙沙星、莫西沙星) 、氨基糖苷类抗生素 (庆大霉素) 、磺胺类(复方新诺明) 、克林霉素和利福平的耐药率分别为11.11%~66.67%、5.85%~58.67%,因 此,这 些 可根据临床实际情况作为经验性治疗药物。PICU与非PICU比较,表皮葡萄球菌对左氧氟沙星、环丙沙星、庆大霉素、利福平耐药率存在统计学差异 (均P < 0.05) 。此外,2组表皮葡萄球菌对糖肽类抗生素(万古霉素、替考拉宁)、人工合成的噁唑烷酮类抗菌药 (利奈唑胺)、硝基呋喃类合成抗菌药 (呋喃妥因) 以及甘氨酰环素类抗生素 (替加环素) 均敏感,可考虑作为早期经验性治疗药物,但应避免反复应用。PICU中分离的人葡萄球菌对红霉素全部耐药,对青霉素G的耐药率在90%以上,非PICU中分离的人葡萄球菌对青霉素G和红霉素的耐药率均达90%以上,均不适用于经验性抗感染治疗;2组人葡萄球菌对苯唑西林、克林霉素、喹诺酮类抗生素 (左氧氟沙星、环丙沙星、莫西沙星) 、磺胺类药物 (复方新诺明) 以及四环素的耐药率在20%~80%之间,可根据实际药敏情况选择用药;2组分离的人葡萄球菌对庆大霉素以及利福平均敏感,但因其药物的不良反应在儿童中应用受到限制;如果应用需要注意不能长期使用,以免产生耐药菌株[16]。

表2 PICU与非PICU主要革兰阳性菌对常用抗菌药物耐药率 (%)Tab.2 Drug resistance rates of the main Gram-positive bacteria to commonly used antimicrobials in the PICU and non-PICU (%)
革兰阴性菌中,PICU分离的大肠埃希菌对第二代头孢菌素类抗生素 (头孢呋辛酯) 耐药,对广谱半合成青霉素类 (氨苄西林、哌拉西林) 以及第一、三代头孢菌素类抗生素 (头孢唑林、头孢曲松) 耐药率均达80%以上;对阿米卡星、美洛培南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、亚胺培南均敏感,应注意避免耐药菌株的产生。上述药物均不适用于早期经验性抗感染治疗。2组在对头孢噻肟、头孢他啶、左氧氟沙星、美洛培南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦以及亚胺培南的耐药率存在统计学差异 (P < 0.05) 。PICU分离的肺炎克雷伯菌对广谱半合成青霉素(氨苄西林) 耐药,对头孢菌素类抗菌药物,对阿米卡星、厄他培南、头孢西丁、左氧氟沙星均敏感。非PICU分离的肺炎克雷伯菌对广谱半合成青霉素 (氨苄西林、哌拉西林) 以及第三代头孢菌素类抗生素(头孢噻肟) 耐药。2组在对头孢呋辛酯、头孢唑林、头孢曲松、头孢呋辛、头孢孟多、四环素、庆大霉素的耐药率存在统计学差异 (P < 0.05) 。
综上所述,儿科患者血培养分离的病原菌分布广泛,耐药性严峻。其中主要以CoNS、大肠埃希菌和肺炎克雷伯菌多见。肺炎链球菌、肺炎克雷伯菌、流感嗜血杆菌、摩式摩根菌、阴沟肠杆菌以及白假丝酵母菌分布上PICU与非PICU比较有统计学差异。2组病原菌对部分抗菌药物耐药性存在差异。临床上应加强抗菌药物使用的监管,在有效控制感染基础上延缓耐药菌株的产生。
[1] GILMAN KH,JONATHAN HK,NG TK,et al. Performance evaluation of the verigene Gram-positive and Gram-negative blood culture test fordirect identification of bacteria and their resistance determinants from positive blood cultures in Hong Kong [J]. PLoS One,2015,10 (10):e0139728. DOI:10.1371/journal.pone.0139728.
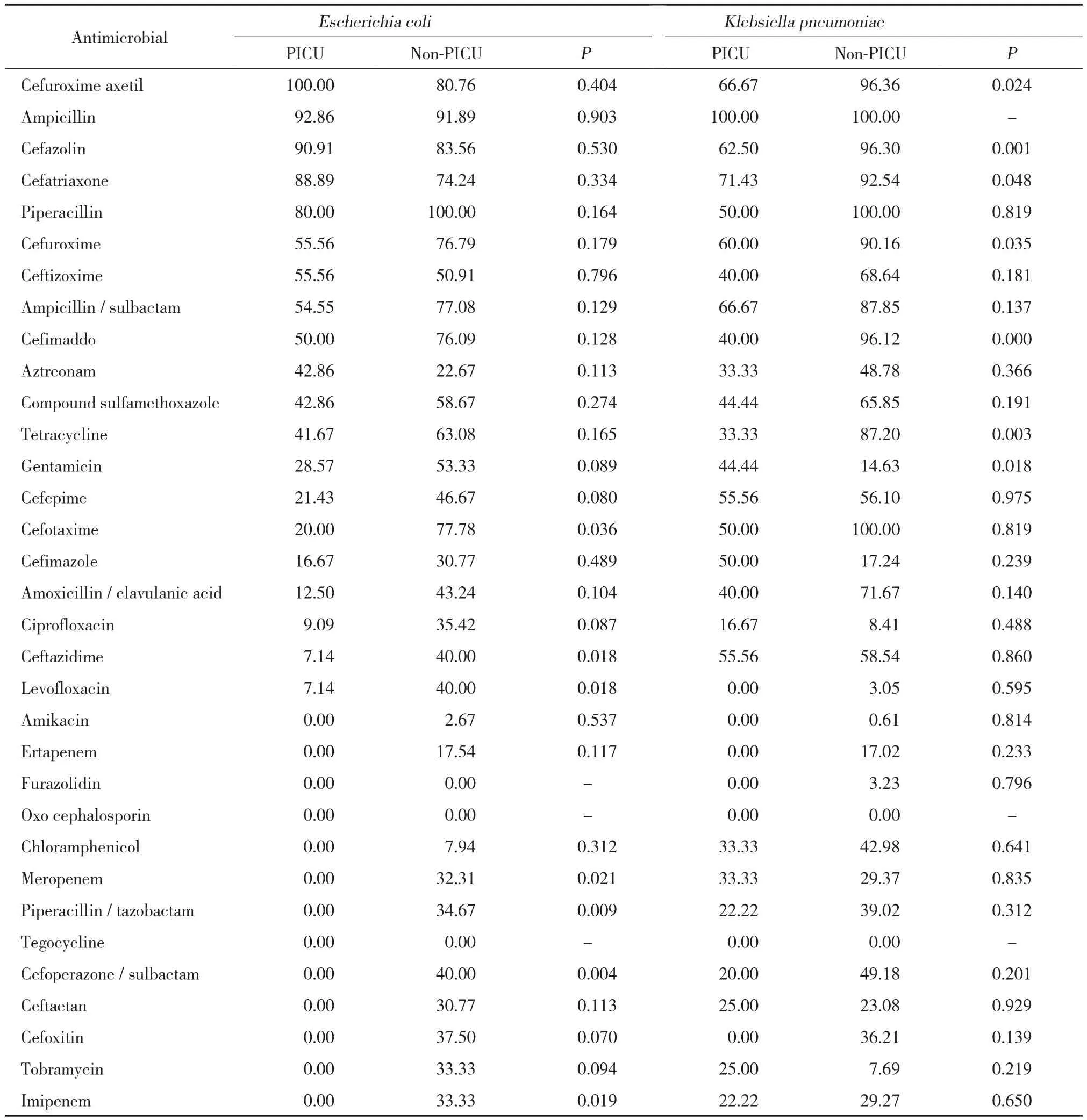
表3 PICU与非PICU主要革兰阴性菌对常用抗菌药物的耐药率 (%)Tab.3 Drug resistance rates of the main Gram-negative bacteria to commonly used antimicrobials in the PICU and non-PICU (%)
[2] DONG H,CAO H,ZHENG H. Pathogenic bacteria distributions and drug resistance analysis in 96 cases of neonatal sepsis [J]. BMC Pediatr,2017,17 (1):44. DOI:10.1186/s12887-017-0789-9.
[3] PETTERSEN VK,MOSEVOLL KA,LINDEMANN PC,et al. Coordination of metabolism and virulence factors expression of extraintestinal pathogenic escherichia coli purified from blood cultures of patients with sepsis [J]. Mol Cell Proteomics,2016,15 (9):2890-2907.DOI:10.1074/mcp.M116.060582.
[4] AMANATI A,KARIMI A,FAHIMZAD A,et al. Incidence of ventilator-associated pneumonia in criticallyⅢchildren undergoing mechanical ventilation in pediatric intensive care unit [J]. Children,2017,4(7):56. DOI:10.3390/children4070056.
[5] LIMA A,MUNIZ VM,ZANDONADE E,et al. Performance of the pediatric index of mortality 2 in a pediatric intensive care unit [J].Rev Bras Ter Intensiva,2014,26 (1):44-50. DOI:10.1007/s00134-012-2580-6.
[6] EYADHY AA,TEMSAH MH,ALHABOOB AN,et al. Asthma changes at a pediatric intensive care unit after 10 years:observational study[J]. Ann Thorac Med,2015,10 (4):243-248. DOI:10.4103/1817-1737.165302.
[7] YAO JF,LI N,JIANG J. Clinical characteristics of bloodstream infections in pediatric acute leukemia:a single-center experience with 231 patients [J]. Chin Med J (Engl) ,2017,130 (17):2076-2081. DOI:10.4103/0366-6999.213411.
[8] NEGUSSIE A,MULUGETA G,BEDRU A,et al. Bacteriological profile and antimicrobial susceptibility pattern of blood culture isolates among septicemia suspected children in selected hospitals Addis Ababa,Ethiopia [J]. Int J Biol Med Res,2015,6 (1):4709-4717.DOI:10.1155/2014/153747.
[9] LABI AK,OBENG-NKRUMAH N,BJERRUM S,et al. Neonatal bloodstream infections in a Ghanaian Tertiary Hospital:are the current antibiotic recommendations adequate? [J]. BMC Infect Dis,2016,16:598. DOI:10.1186/s12879-016-1913-4.
[10] WEISS SL,FITZGERALD JC,PAPPACHAN J,et al. Global epidemiology of pediatric severe sepsis:the sepsis prevalence,outcomes,and therapies study [J]. Am J Respir Crit Care Med,2015,191 (10):1147-1157. DOI:10.1164/rccm.201412-2323OC.
[11] 周维,向慧,刘国生.儿童血培养结果阳性标本的病原菌分布情况及耐药性分析[J].湖北民族学院学报 (医学版) ,2017,34 (3):36-38. DOI:10.13501/j.cnki.42-1590/r.2017.03.012.
[12] 吕春兰,刘开琴,陈莹莹,等. 儿童患者血培养分离菌的分布与耐药性[J].中国感染与化疗杂志,2016,16( 5):644-647. DOI:10.16718/j.1009-7708.2016.05.021.
[13] HEYER NJ,DERZON JH,WINGES L,et al. Effectiveness of practices to reduce blood sample hemolysis in EDs:a laboratory medicine best practices systematic review and meta-analysis[J]. Clin Biochem,2012,45:999-1011. DOI:10.1016/j.clinbiochem.2012.08.002.
[14] ALTINDIS M,KOROGLU M,DEMIRAY T,et al. A multicenter evaluation of blood culture practices,contamination rates,and the distribution of causative bacteria[ J]. Jundishapur J Microbiol,2016,9( 1):e29766. DOI:10.5812/jjm.29766.
[15] SENG R,KITTI T,THUMMEEPAK R,et al. Biofilm formation of methicillin-resistant coagulase negative staphylococci ( MR-CoNS)isolated from community and hospital environments[ J]. PLoS One,2017,12( 8):e0184172. DOI:10.1371/journal.pone.0184172.
[16] BETHELL C,GOMBOJAV N,SOLLOWAY M,et al. Adverse childhood experiences,resilience and mindfulness-based approaches:common denominator issues for children with emotional,mental,or behavioral problems[ J]. Child Adolesc Psychiatr Clin N Am,2016,25( 2):139-156. DOI:10.1016/j.chc.2015.12.001.
