基于适配体的功能化纳米探针在食品安全检测中的应用进展
2018-05-29周迎卓刘宝林
周迎卓,王 欣,刘宝林
(上海理工大学医疗器械与食品学院,上海 200093)
近年来,食品安全问题愈演愈烈,使消费者对食品安全忧虑重重。要保障“舌尖上的安全”,就离不开可靠的食品安全检测技术,尤其是新型的高灵敏度、高特异性的食品安全快速检测方法。
传统的食品安全检测方法如气相色谱(GC)、高效液相色谱(HPLC)、液相色谱-质谱联用(HPLC-MS)、气相色谱-质谱联用(GC-MS)[1]、荧光偏振免疫测定(FPIA)[2]、免疫吸附(ELISA)[3]等虽特异性好、精度高、灵敏性佳,但均对分析条件有比较高的要求,前处理相对复杂,在快速检测方面仍有一定欠缺[4-5]。
生物传感器具有特异性好、分析速度快、成本低等优点,在食品安全检测中有较好的应用前景。近年来,一方面核酸适配体的出现为生物传感器提供了一种特异性好,灵敏度高的新型生物识别元件;另一方面,利用纳米粒子独特的光学和物理特性可进一步放大检测信号,使检测更灵敏、选择性增强,从而为食品危害因子的检测提供一种新型、高效和快速的检测分析平台。
对2007~2016年web of science库中发表在国际期刊上的分别以适配体(aptamer)、纳米粒子(nanoparticle)、适配体+纳米粒子(aptamer+nanoparticle)为关键词的学术论文进行归纳(图1)可以发现,围绕适配体和纳米粒子进行的研究数量有大幅增加,表明这两个研究领域有较快发展;而“适配体+纳米粒子”的研究仍相对较少,说明此领域仍相对较新,有待于深入研究。
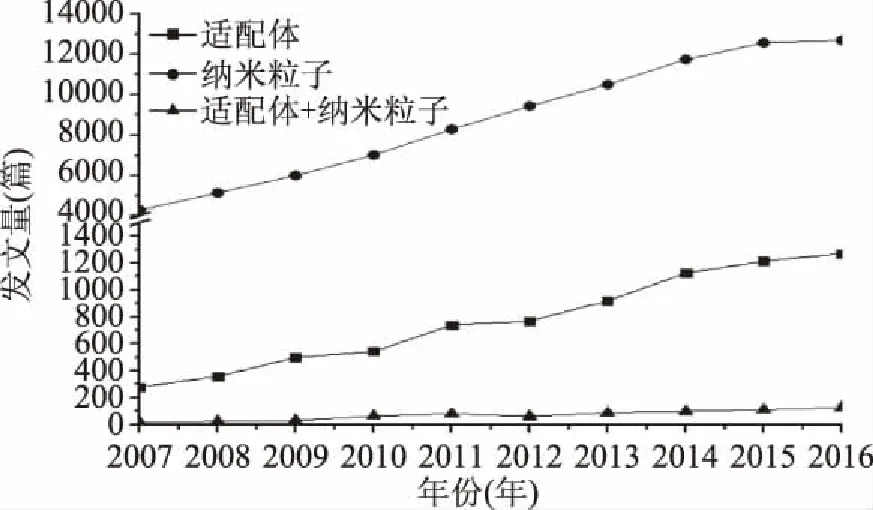
图1 Web of science中适配体与纳米微粒相关文献的调研分析
因此,本文在对文献梳理总结的基础上,先对各类基于适配体的纳米传感器的检测原理和存在的问题进行了分析,进而综述了基于适配体的纳米传感器在食品安全因子检测方面的应用进展,旨在为此类传感器后续在食品安全检测领域的研究与应用提供参考。
1 基于适配体的纳米传感器的检测原理
基于适配体的纳米传感器按照信号表达方式的不同,可分为光学、磁弛豫、电化学和其他类型4类,其基本原理分述见下文。
1.1 光学传感器
1.1.1 比色传感器 纳米粒子表面性质的改变会引起其表观颜色的变化,以此为基础可建立纳米比色传感器[6],其中,基于纳米金优良的高摩尔吸光率和尺寸依赖的光学性质的纳米金比色分析技术是当前的研究热点之一。Wang等[7]将核酸适配体与纳米金比色传感器相结合对氧化乐果(omethoate)定量分析。使氧化乐果的核酸适配体通过配位作用而随机缠绕在纳米金颗粒表面,增大了纳米粒子间的静电斥力而使纳米金颗粒的间距增大,从而在较高盐浓度下仍分散良好;当加入氧化乐果后,目标物与核酸适配体优先结合,从纳米金表面解离,导致纳米金表面势能和静电斥力降低,发生团聚,颜色由红色变为蓝色,该变化很容易被紫外分光光度计捕捉,从而可实现对氧化乐果的定量分析。
当然,也有研究者尝试了试纸条形式的适配体纳米金比色传感器,Wang等[8]构建了一种可检测赭曲霉毒素A(Ochratoxin A,OTA)的纳米金生物传感器。该传感器以纳米金为核,表面修饰适配体及一段A碱基。在硝酸纤维素膜上构建2个探针,其中,探针1由适配体的一段互补链组成,探针2由一段T碱基组成。当不存在赭曲霉毒素A时,探针1和探针2分别通过适配体或碱基与纳米金结合,此时试纸条为两道杠;当加入赭曲霉毒素A时,赭曲霉毒素A优先与探针1的适配体结合,而探针2与纳米金结合,试纸条仅出现一道杠,由此可间接进行赭曲霉毒素A的定性检测。
以Wang等[9]设计的一种可定量分析Hg2+浓度的生物传感器为例(图2),其核心部分为Fe3O4@Au-适配体纳米粒子,当溶液中不存在Hg2+时,通过杂交链式反应(Hybrid ChainReaction,HCR),HCR探针1、2会在Fe3O4@Au的表面上形双链DNA链,产生较多的亚甲蓝(MB)吸附位点,使游离的亚甲蓝减少;加入Hg2+后会阻断DNA双链的延伸,使MB吸附位点减少,游离的MB相对增多,经磁分离后,检测溶液的UV-vis吸收信号变化即可间接反映体系中Hg2+的浓度。

图2 基于比色法的Fe3O4@Au纳米粒子检测Hg2+
适配体纳米金比色分析技术具有简单、快速、灵敏等优点,但纳米金对离子强度比较敏感,易产生非特异的纳米金溶液颜色变化;适配体与靶标的结合易受体系pH的干扰,而食品、环境、血液等样品基质都比较复杂,pH变化较大,有可能对检测结果产生影响。
1.1.2 荧光传感器 适配体纳米荧光传感器主要是指用荧光基团标记核酸适配体后,由于目标物和适配体互补链会竞争结合适配体,因此,目标物存在时,适配体结构发生改变,导致荧光信号的改变[10],从而实现对目标物的分析。基于荧光法的纳米适配体检测法以其选择性好,灵敏度强,稳定性高等而倍受关注。如图3所示,Qin等[11]基于氧化石墨烯(Graphene oxide,GO)比表面积大,具有优良导电性,可作为一种高效的荧光猝灭剂的特性,设计了一种可检测β-内酰胺酶含量的荧光适配体纳米传感器。当溶液中不存在β-内酰胺酶时,适配体被吸附在GO的表面,导致荧光猝灭,溶液的荧光强度较低;加入β-内酰胺酶后,目标物优先与核酸适配体特异性结合,使核酸适体构型改变并从石墨烯表面解离,溶液荧光强度增大,根据荧光强度与β-内酰胺酶浓度间的关系,可间接测量出β-内酰胺酶的浓度。
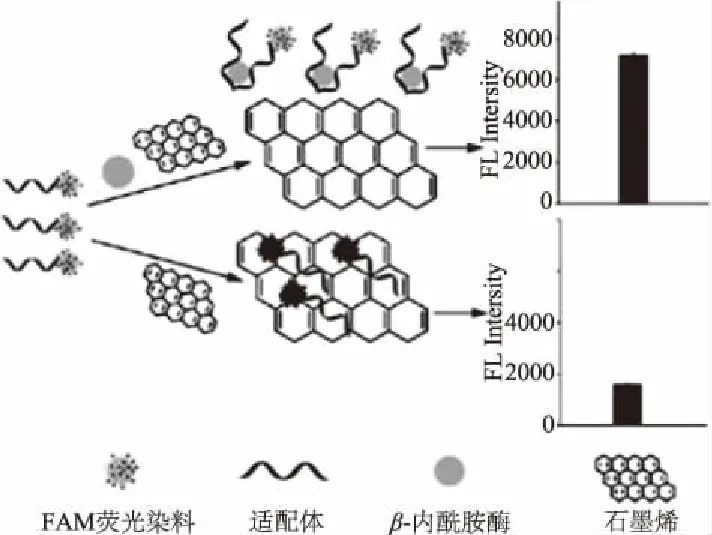
图3 基于荧光法的石墨烯传感器检测β-内酰胺酶
与荧光染料分子相比,量子点(Quantumdots,QDs)或半导体纳米粒子因具有稳定性好、摩尔消光系数高、量子产率高和荧光发射谱峰窄等优良的光学特性[12]。Zhang等[13]构建了一种可检测伏马菌素B1的量子点-适配体-GO传感器。当体系中不存在伏马菌素B1时,量子点-适配体被吸附在石墨烯的表面上而荧光猝灭,加入伏马菌素B1后,量子点-适配体优先与伏马菌素B1结合并从石墨烯上脱落,溶液的荧光强度相对增加,由此可定量检测伏马菌素B1的浓度。Wu等[14]借助于稀土上转换发光纳米材料独特的发光性质,设计了一种检测赭曲霉毒素A的适配体纳米荧光传感器。在磁性纳米粒子和上转换纳米粒子的表面分别修饰赭曲霉毒素A(OTA)适配体和适配体互补链,不存在OTA时,适配体与互补DNA序列形成双链体结构,从而使磁纳米表面具有较强的荧光强度;加入OTA后,适体优先与OTA结合并从磁纳米粒子表面解离,使其表面的荧光强度降低,从而可获知OTA的浓度。
虽然基于荧光的纳米适配体传感器以其选择性好、灵敏度强、稳定性高等广受关注。但是这种方法在实际样品中检测可能有背景荧光干扰,加之目前能够应用于食品检测的适配体种类有限,使其实际应用仍相对较少。
1.1.3 拉曼(SERS)传感器 基于拉曼的纳米适配体传感器具有简单、快速、灵敏度高,选择性强的特点,在检测小分子、蛋白质等方面倍受关注[15]。该类传感器一般是在纳米粒子上修饰拉曼标记,加入目标物时,目标物与适配体结合,导致纳米粒子聚集状态及拉曼强度的改变。以Feng等[16]设计的可检测双酚A(BPA)的适配体纳米金拉曼传感器为例(图4)。该传感器以纳米金粒子(AuNPs)和纳米金棒(AuNRs)为核,在纳米金上修饰拉曼标记;当体系中不存在双酚A时,BPA的适配体与其互补链形成双链结构并连接纳米金和纳米棒,使溶液的拉曼强度增大;加入双酚A时,双酚A与适配体结合而使纳米簇分散,溶液的拉曼强度减小,从而可间接获知双酚A的浓度。
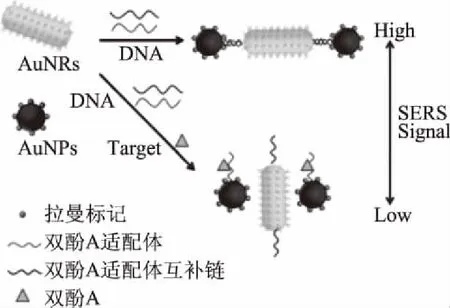
图4 基于拉曼法的纳米金-纳米棒传感器检测双酚A
拉曼光谱技术依靠的是拉曼散射效应,而拉曼散射光本身的强度相对较弱,另外,拉曼检测中普遍存在荧光干扰,使其实用性仍相对有限。
1.1.4 表面等离子共振传感器 表面等离子体共振(Surface Plasmon Resonance,SPR)传感器是一种先进的无标签和实时光学分析技术,已广泛应用于许多重要领域,包括环境监测,食品安全和医疗诊断[17]。Luo等[18]将SPR和纳米金结合设计了检测BPA(Bisphenol A)的生物传感器。使带负电荷的BPA适配体由配位作用随机缠绕在金纳米粒子表面,静电斥力增强而使纳米金溶胶分散良好。当加入BPA后,核酸适配体与目标物结合并从纳米金表面解离,导致纳米金因表面势能和静电斥力降低而团聚,周围介质的介电常数及折射率发生变化,从而引起SPR响应的变化,根据SPR红移值与BPA浓度的关系可间接测出BPA的浓度。
由于目前表面等离子体共振(SPR)检测仪器仍相对笨重,不利于现场检测的进行,加之表面等离子体共振传感器是基于表面折射率改变的一项分析技术,因此,也存在对极小的折射率的改变无法检测及非特异性吸附干扰等问题[19],其实际的应用还有待研究。
1.1.5 化学发光传感器 化学发光是指某些化学反应中发出可见光的现象,Liu等[20]将化学发光法和适配体纳米粒子相结合构建了试纸形式的化学发光传感器,可用于Hg2+离子的检测。使纳米多孔银(nanoporoussilver,NPS)与化学发光试剂P-酸(P-acid)缀合形成NPS@P-酸后,在其表面修饰Hg2+的适配体探针S2,形成NPS@P-酸-S2复合粒子,Hg2+的另一单链DNA适配体S1则固定于纤维素纸表面,因此,当向试纸上添加NPS@ P-酸-S2复合粒子及Hg2+时,Hg2+适配体探针S1和S2可与Hg2+特异性结合,然后添加高锰酸盐诱导发生化学发光,而发光强度取决于Hg2+的浓度,从而可以间接定量测定Hg2+的浓度。与单纯化学发光法相比,该方法的化学发光强度提高了8倍,显著改善了分析的灵敏度。但是,由于现有的化学发光标记物在达到顶峰衰减后,其发光值尚不稳定,因此该方法的批内批间变异系数仍高于酶联免疫方法[21]。
1.2 磁弛豫传感器
基于磁弛豫原理的传感技术日益受到研究者的广泛关注[22]。磁性纳米粒子的分散和聚集状态会引起其周围溶液中氢质子弛豫时间(T2)的变化[23],基于T2值的变化可确定目标分析物的浓度。磁弛豫传感器具有较高的选择性、灵敏度及可在不透明介质中检测的优势。Bamrungsap等[24]设计了一种检测溶菌酶(lysozyme)的磁化学传感器,该传感器以表面分别修饰溶菌酶适配体或其互补链的两种氧化铁纳米粒子为核心,当不存在溶菌酶时,两种纳米粒子相互团聚形成纳米簇,此时溶液具有相对较小的T2值;当加入溶菌酶时,溶菌酶与适配体结合而使纳米簇分散,溶液的T2值增大,因此通过测量ΔT2值可间接反映溶菌酶的浓度。
这种方法具有选择性好,灵敏度高等特点,但不能用于气体的检测,且目前并未开发出用于多分析物检测的方法。此外,制备磁性纳米粒子过程中可能存在非生物相容性前体和有毒溶剂,导致磁纳米的稳定性受损而影响实验结果的精确度[25]。
1.3 电化学传感器
电化学传感器基于测量溶液中电流、电位和阻抗的变化而间接得知待测目标物浓度,以其小巧、方便、灵敏度高等优点在食品安全检测中得到了广泛的应用。以Fan等[26]构建的检测啶虫脒(acetamiprid)的电化学传感器为例(图5),先将金纳米粒子(AuNP)沉积在裸金电极表面上,再在其上修饰啶虫脒的核酸适配体,并用6-巯基-1-己醇封闭裸金电极极表面上的非特异性结合位点。当加入啶虫脒时,电极表面上形成啶虫脒-适配体复合物,导致电子转移电阻(Ret)增加,而Ret的变化依赖于啶虫脒浓度,从而可实现对啶虫脒浓度的定量分析。
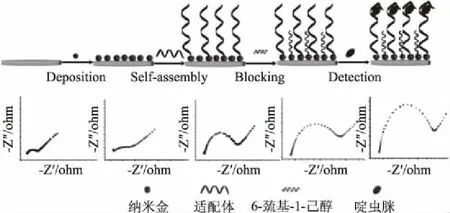
图5 基于电化学法的纳米金传感器检测啶虫脒
这种检测方法测定速度快、稳定性较好、不受检测液颜色的影响,但目前的研究还存在线性范围窄、离子干扰等问题,尤其是化学修饰电极的研究应用还处在探索实验阶段[27]。
1.4 石英微天平传感器
除以上各类传感器外,Chen等[28]则将石英微天平传感器与纳米金适配体传感技术相结合,设计了一种可检测α-凝血酶的传感器(图6)。该传感器以纳米金为核,表面修饰溶菌酶适配体(TBA29);将另一种溶菌酶适配体(TBA15)固定在晶体芯片上,形成用于捕获凝血酶的适配体单层,使石英微天平(quartz crystal microbalance,QCM)的频率信号减小,而耗散信号增加;加入凝血酶溶液后,凝血酶与适配体TBA15结合,频率信号进一步降低;最后,引入表面修饰TBA29的纳米金(TBA29-GNP),则形成三明治夹心结构,频率信号进一步减小,可高度敏感地检测凝血酶的浓度变化。该方法具有灵敏度高、专一性强、操作简单的特点,具有较好的应用前景。但是该类传感器的检测部件—石英晶片可重复利用率低,电子部件大多需要电脑控制,不利于现场检测。

图6 基于石英微天平法的纳米金传感器检测凝血酶
2 基于适配体的纳米传感器的应用进展
2.1 农药、兽药及其残留物
农兽药残留是影响食品安全的重要影响因子。Wang等[7]构建了可检测氧化乐果的核酸适配体纳米金传感器,和普通的乙酰胆碱酶抑制比色法(LOD为1.3 μmol/L)比较,该方法对氧化乐果的检测限可达0.1μmol/L,检测灵敏度提高了一个数量级,且方法具有较好的特异性,回收率在77.96%~95.7%之间,检测时间仅为10 s。Fan等[26]构建的适配体纳米金电化学传感器对啶虫脒(acetamiprid)的检测限可达1 nmol/L,线性范围为5~600 nmol/L,且具有较好的特异性,此方法在污水及番茄样品中的回收率在85.8%~105.1%之间,检测效果较好,有较强的实用性。
新霉素B是一种广泛使用的氨基糖苷类兽药,动物源性食品中新霉素B的存在对人类具有潜在的耳毒性和肾毒性。Ling等[29]以纳米金和新霉素B的RNA适配体设计了一种可检测新霉素B的荧光生物传感器,该传感器在新霉素B浓度0.1~10 μmol/L之间有线性响应,检测限可达0.1 μmol/L,响应快速,遗憾的是该研究未进行回收实验,且适配体特异性有待后续的改进。此外,由于牛奶中β-内酰胺酶的存在会减少或甚至抵消抗生素药物的治疗效果,因此中国食药监将牛奶中β-内酰胺酶的最大允许浓度为4 U/mL[11]。Qin等[11]设计的一种可检测β-内酰胺酶含量的适配体石墨烯纳米荧光传感器,该方法的检测限(LOD)可达0.5 U/mL,回收率为96.04%~119.67%,适配体特异性较好,可用于食品样品中β-内酰胺酶的快速检测。
2.2 致病微生物
对引起食源性疾病的致病微生物的快速、准确检测是确保食品安全的首要任务之一。Liu等[30]设计了一种可检测肠炎沙门氏菌的的适配体石墨烯纳米荧光传感器,该方法对乳样品中沙门氏菌的检测限可达300 CFU/mL,且具有较高的选择性。Duan等[31]以上转换纳米粒子和磁性纳米粒子为核,在其表面分别修饰2种适配体,用适配体共轭磁性纳米粒子对目标物进行捕获和浓缩后,再用上转换纳米粒子的荧光特性对两种病原菌的含量进行检测。该方法对鼠伤寒沙门氏菌和金黄色葡萄球菌的线性检测范围均为10~105CFU/mL,检测限分别为5和8 CFU/mL。方法具有良好的选择性,且与标准的平板计数法无显著差异,说明该方法检测结果可靠。
Chang等[32]则构建了一种基于适配体纳米金共振光散射的生物传感器,并成功检测到了单细胞的金黄色葡萄球菌,但遗憾的是该研究未进行检测的特异性分析和回收实验,故其实际检测效果有待验证。Ozalp等[33]也尝试将石英微天平传感器与纳米适配体传感技术相结合进行沙门氏菌的检测,发现在菌体浓度为1×102~4×104CFU/mL的范围内,传感器可获得线性响应,检测限为100 CFU/mL。
2.3 真菌毒素
建立准确高、特异性强的真菌毒素快速检测方法是控制真菌毒素危害的关键之一。Luan等[34]设计了一种由黄曲霉毒素B2(Aflatoxin B2,AFB2)敏感适配体和纳米金组成的比色传感器,该方法在AFB2浓度为0.025~10 ng/mL时有线性响应,检测限可达0.0795 nmol/L,回收率为89.4%~92.90%。该方法不但快速、灵敏,且可以使用视觉和微板读数,更为方便易用。Wang等[8]则针对赭曲霉毒素A的检测,设计了一种适配体纳米金比色传感器,该方法的视觉LOD可达2.481 nmol/L,定量LOD为0.447 nmol/L,该方法的线性范围为0~6.19 nmol/L,回收率为96%~110%,精确度较高,可以用于OTA的现场筛查。Wu等[14]设计了一种以上转换纳米粒子和磁性纳米粒子为核,检测赭曲霉毒素A的适配体纳米荧光传感器,该方法的LOD为0.0248 nmol/L,回收率为90.7%~117.98%,说明该方法具有较好的准确性和灵敏度,其结果与高效液相色谱法有较好的相符性。相比之下,该方法的检测灵敏度也较Wang等[8]设计的方法大大提高。此外,Zhang等[13]也尝试了应用量子点代替传统的荧光标记物质,和适配体纳米传感器相结合进行伏马菌素B1的检测,该方法在水样中的线性范围为3.2 nmol/L~320 μmol/L,在花生油中则为1.6 nmol/L~160 μmol/L,LOD值为1 nmol/L,这是一种相对简单,高灵敏性和强选择性的新型检测方法。
2.4 重金属
重金属检测方法的研究倍受关注。Wang等[9]设计的以Fe3O4@Au-适配体纳米粒子为核心的比色传感器可以定量分析Hg2+浓度。该方法的LOD值为0.7 nmol/L,相对偏差仅为2.13%~5%。而Liu等[20]开发了一种试纸形式的适配体纳米粒子化学发光传感器,该方法可在20 nmol/L~0.5 μmol/L的浓度范围内定量检测Hg2+,LOD低至1 pmol/L,检测精度相对较高,回收率在96.90%~102.40%,且具有较好的特异性,有较好的应用前景。王兴龙等[35]设计了进行Hg2+检测的基于适配体和纳米金的石英晶体微天平传感器,但该方法得到的LOD仅为2 nmol/L,在5~50 nmol/L范围内有良好线性关系,总体而言,检测灵敏度不及前两种方法。Wu等[36]设计了基于As3+适配体的纳米瑞利散射传感器,该生物传感器的检测限为2.67 nmol/L,可以满足美国EPA和WHO对饮用水中砷的检测要求(限量为133 nmol/L),该方法的动态线性范围为1.33×10-3~2.67 μmol/L,LOD仅为2.67×10-3μmol/L回收率为96.7%~104%,精确度较高,这为环境中As3+的检测提供了可能的新方法。
2.5 生物酶
在酶的检测方面,Bamrungsap等[24]设计了一种检测溶菌酶含量的基于适配体的磁纳米传感器,该方法的LOD为1 nmol/L,回收率在89.76%~93.66%之间,具有较高的灵敏度和选择性,适用于生物样品或混合液,不需要蛋白质的提纯和分解,操作简便,为识别白血病人提供了可能。Ma等[37]设计的基于适配体纳米粒子瑞利散射的生物传感器在检测溶菌酶时,更为灵敏,其LOD可达0.05 nmol/L,相对误差在7.9%~8.1%之间。Chen等[28]等设计的纳米金适配体石英微天平传感器在检测α-凝血酶时,LOD为0.1 nmol/L,与直接测定相比,灵敏度提高约2个数量级,回收率为106%~116%,该方法在复杂基质中也表现出良好的选择性和重复性,实用性较强。
2.6 其他目标物
双酚A有可能导致内分泌失调,威胁着胎儿和儿童的健康。Feng等[16]设计了可检测BPA的适配体纳米金拉曼传感器,其LOD为0.017 nmol/L,检测灵敏,线性范围为0.001~1 ng/mL,回收率在91.00%~95.30%之间,有较好的应用前景。Luo等[18]构建的适配体纳米金表面等离子共振传感器也可以实现对BPA的检测,且方法的LOD为0.016 nmol/L,比常规ELISA法增强了约30倍,回收率在88%~120.3%之间,该方法还可扩展至其他小分子,如氨苄青霉素的检测中。
Dong等[38]设计了检测乳中三聚氰胺含量的适配体纳米金拉曼传感器,该方法的LOD可达0.0079 nmol/L,特异性较好,回收率为97.33%~109.53%,结果准确,而常规气相色谱质谱联用仪(GC-MS)的LOD仅为0.002 μmol/L,酶联免疫吸附法(ELISA)的LOD为8.88 nmol/L。整体而言,适配体纳米金拉曼传感器法具有较好的灵敏度。
表1列举了近年来基于适配体的纳米传感器在食品安全检测中的应用,并对方法的特征进行了提炼,以供各位研究者参考。
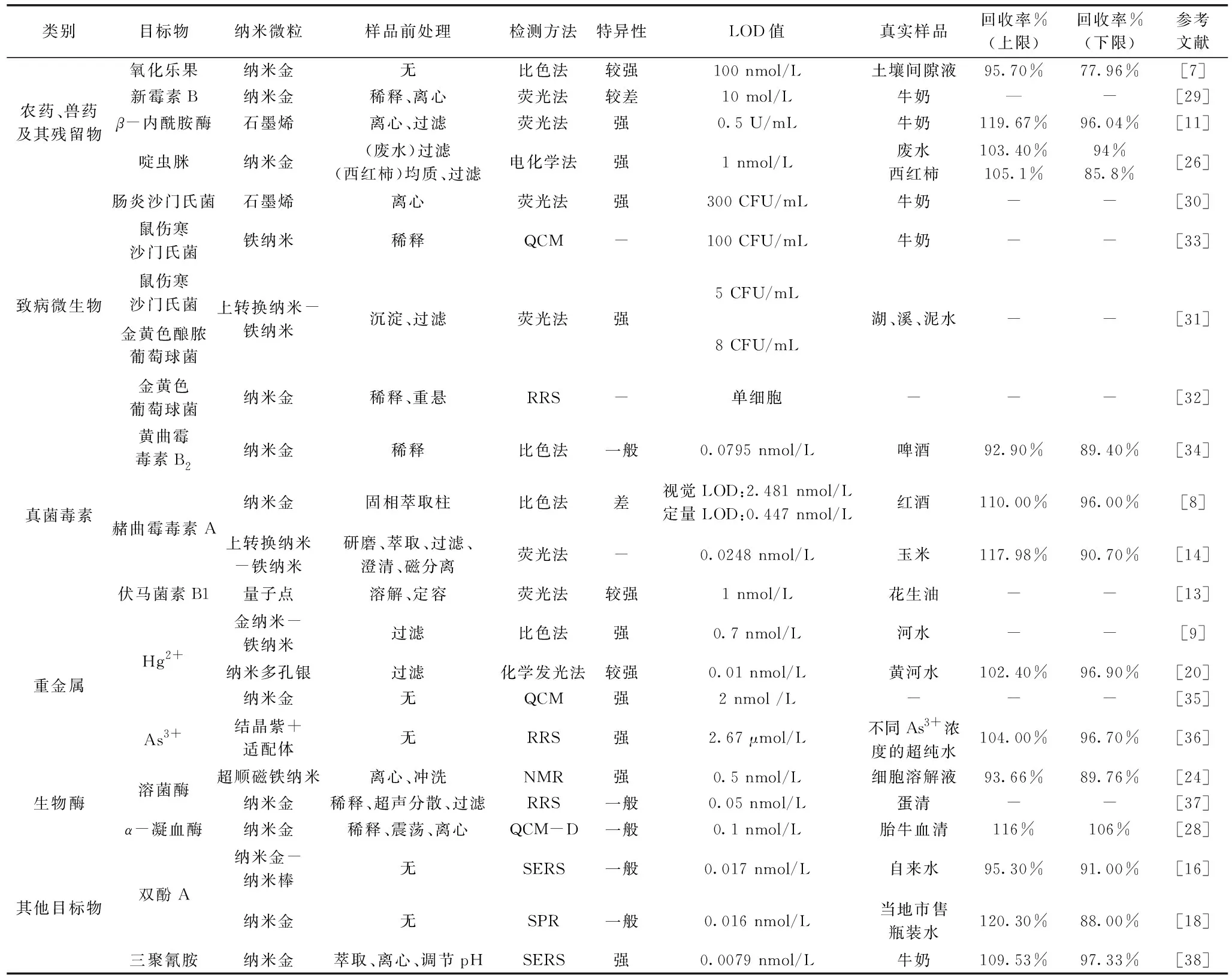
表1 基于核酸适配体的纳米生物传感器在食品安全检测中的应用及特征
3 结论与展望
近年来,基于适配体的功能化纳米探针以其高灵敏度和选择性在食品安全检测领域发挥着越来越重要的作用,众多研究人员从不同角度进行了大量的探索和应用,但该研究领域仍然有很大的发展空间。具体而言,目前可用于食品安全危害因子检测的核酸适配体种类还相对较少,后期可利用SELEX技术筛选出更有针对性的食品安全危害因子的适配体,扩大该检测方法的应用范围;另一方面,对适配体而言,轻微的修饰也常常会导致其对目标分析物的亲和力和特异性的显著损失,不能有效识别目标物。
因此,对适配体的功能化纳米探针构建过程进行系统研究,调节体系的pH、离子强度、修饰方式等因素,以有效保护适配体的亲和力及特异性。当然,为了提高方法在现场分析中的可行性,开发简便、易携带的生物传感器是未来研究的重点之一,也需要开发快速、有效、简单的样品前处理方法,有效避免背景干扰,提高方法的灵敏度和检测线。此外,从文献分析中也发现,若能通过在纳米粒子上修饰多种适配体以实现对多种危害因子的同时检测也是未来的快速检测的发展方向之一。
[1]彭飞进,徐幸,舒平,等. GC和GC-MS法测定饮料中香兰素和乙基香兰素含量[J]. 食品工业科技,2015,36(15):303-306.
[2]沈玉栋,张世伟,蔡肇婷,等. 呋喃西林代谢物荧光偏振免疫检测方法研究[J]. 分析测试学报,2009,28(1):27-31.
[3]樊晓博,徐社会,蒋宝,等. 酶标抗原直接竞争ELISA方法检测呋喃唑酮代谢物残留[J]. 食品工业科技,2015,36(21):318-322.
[4]郭培源,刘硕,杨昆程,等. 色谱技术、光谱分析法和生物检测技术在食品安全检测方面的应用进展[J]. 食品安全质量检测学报,2015,6(8):3217-3223.
[5]Ma W,Chen W,Qiao R,et al. Rapid and sensitive detection of microcystin by immunosensor based on nuclear magnetic resonance[J]. Biosensors and bioelectronics,2009,25(1):240-243.
[6]王国庆,陈兆鹏,陈令新. 基于核酸适配体和纳米粒子的光学探针[J]. 化学进展,2010,22(2):489-499.
[7]Wang P,Wan Y,Ali A,et al. Aptamer-wrapped gold nanoparticles for the colorimetric detection of omethoate[J]. Science China Chemistry,2015,59(2):237-242.
[8]Wang L,Ma W,Chen W,et al. An aptamer-based chromatographic strip assay for sensitive toxin semi-quantitative detection[J]. Biosensors and Bioelectronics,2011,26(6):3059-3062.
[9]Wang L,Liu F,Sui N,et al. A colorimetric assay for Hg(II)based on the use of a magnetic aptamer and a hybridization chain reaction[J]. Microchimica Acta,2016,183(11):2855-2860.
[10]Sharma R,Ragavan K V,Thakur M S,et al. Recent advances in nanoparticle based aptasensors for food contaminants[J]. Biosens and Bioelectronics,2015,74:612-627.
[11]Qin J,Cui X,Wu P,et al. Fluorescent sensor assay forβ-lactamase in milk based on a combination of aptamer and graphene oxide[J]. Food Control,2017,73:726-733.
[12]梁淼,刘锐,苏荣欣,等. 面向食品安全分析的核酸适配体传感技术[J]. 化学进展,2012,24(7):1378-1386.
[13]Lu Z,Chen X,Wang Y,et al. Aptamer based fluorescence recovery assay for aflatoxin B1 using a quencher system composed of quantum dots and graphene oxide[J]. Microchimica Acta,2014,182(3-4):571-578.
[14]Wu S,Duan N,Wang Z,et al. Aptamer-functionalized magnetic nanoparticle-based bioassay for the detection of ochratoxin A using upconversion nanoparticles as labels[J]. The Analyst,2011,136(11):2306-2314.
[15]刘颖. 基于纳米材料表面增强拉曼效应的致病菌检测方法研究[D]. 无锡:江南大学,2015.
[16]Feng J,Xu L,Cui G,et al. Building SERS-active heteroassemblies for ultrasensitive Bisphenol A detection[J]. Biosensors and Bioelectronics,2016,81:138-142.
[17]M B S,S W O. Optical biosensors[J]. Chemical Reviews,2008,108(2):423-461.
[18]Luo Z,Zhang J,Wang Y,et al. An aptamer based method for small molecules detection through monitoring salt-induced AuNPs aggregation and surface plasmon resonance(SPR)detection[J]. Sensors and Actuators B:Chemical,2016,236:474-479.
[19]宋洋,王静,王硕. 表面等离子体共振传感器对食源性化学危害物检测方法研究[J]. 中国食品学报,2015,15(7):186-191.
[20]Liu F,Wang S,Zhang M,et al. Aptamer based test stripe for ultrasensitive detection of mercury(II)using a phenylene-ethynylene reagent on nanoporous silver as a chemiluminescence reagent[J]. Microchimica Acta,2014,181(5-6):663-670.
[21]金茂俊,王静,杨丽华,等. 化学发光免疫分析方法在食品安全检测中的研究进展[J]. 食品安全质量检测学报,2014,5(3):840-845.
[22]杨艳,周治国,杨仕平. 基于磁弛豫原理的磁化学传感器研究进展[J]. 上海师范大学学报,2015,44(5):556-562.
[23]Lowery T J,Palazzolo R,Wong S M,et al. Single-coil,multisample,proton relaxation method for magnetic relaxation switch assays[J]. Analgtical Chemistry,2008,80(4):1118-1123.
[24]Bamrungsap S,Shukoor M I,Chen T,et al. Detection of lysozyme magnetic relaxation switches based on aptamer-functionalized superparamagnetic nanoparticles[J]. Analytical chemistry,2011,83(20):7795-7799.
[25]Alcantara D,Lopez S,Garcia-Martin M L,et al. Iron oxide nanoparticles as magnetic relaxation switching(MRSw)sensors:Current applications in nanomedicine[J]. Nanomedicine,2016,12(5):1253-1262.
[26]Fan L,Zhao G,Shi H,et al. A highly selective electrochemical impedance spectroscopy-based aptasensor for sensitive detection of acetamiprid[J]. Biosensors and Bioelectronics,2013,43:12-18.
[27]郭昌山,展海军. 电化学传感器测定食品中亚硝酸盐的研究进展[J]. 肉类研究,2006(10):25-28
[28]Chen Q,Tang W,Wang D,et al. Amplified QCM-D biosensor for protein based on aptamer-functionalized gold nanoparticles[J]. Biosensors and Bioelectronics,2010,26(2):575-579.
[29]Ling K,Jiang H,Zhang L,et al. A self-assembling RNA aptamer-based nanoparticle sensor for fluorometric detection of Neomycin B in milk[J]. Analytical and bioanalytical chemistry,2016,408(13):3593-3600.
[30]Liu K,Yan X,Mao B,et al. Aptamer-based detection of Salmonella enteritidis using double signal amplification by Klenow fragment and dual fluorescence[J]. Microchimica Acta,2015,183(2):643-649.
[31]Duan N,Wu S,Zhu C,et al. Dual-color upconversion fluorescence and aptamer-functionalized magnetic nanoparticles-based bioassay for the simultaneous detection of Salmonella Typhimurium and Staphylococcus aureus[J]. Analytica chimica acta,2012,723:1-6.
[32]Chang Y C,Yang C Y,Sun R L,et al. Rapid single cell detection of Staphylococcus aureus by aptamer-conjugated gold nanoparticles[J]. Scientific Reports,2013,3:1863-1870.
[33]Ozalp V C,Bayramoglu G,Erdem Z,et al. Pathogen detection in complex samples by quartz crystal microbalance sensor coupled to aptamer functionalized core-shell type magnetic separation[J].Analytica Chimica Acta,2015,853:533-540.
[34]Luan Y,Chen J,Xie G,et al. Visual and microplate detection of aflatoxin B2 based on NaCl-induced aggregation of aptamer-modified gold nanoparticles[J]. Microchimica Acta,2014,182(5-6):995-1001.
[35]王兴龙,袁敏,徐斐,等. 基于适配体和纳米金的石英晶体微天平传感器检测汞[J]. 分析实验室,2016,35(3):258-262.
[36]Wu Y,Zhan S,Xing H,et al. Nanoparticles assembled by aptamers and crystal violet for arsenic(III)detection in aqueous solution based on a resonance Rayleigh scattering spectral assay[J]. Nanoscale,2012,4(21):6841-6849.
[37]Ma L,Zhang X,Liang A,et al. A new and highly sensitive resonance Rayleigh scattering assay for lysozyme using aptamer-nanogold as a probe[J]. Luminescence the Journal of Biological and Chemical Luminescence,2014,29(8):1003-1007.
[38]Dong N,Hu Y,Yang K,et al. Development of aptamer-modified SERS nanosensor and oligonucleotide chip to quantitatively detect melamine in milk with high sensitivity[J]. Sensors and Actuators B Chemical,2016,228:85-93.
