圆鲣暗色肉蛋白酶解物的抗疲劳作用
2018-05-29陈义明曹文红章超桦卢虹玉曾少葵高加龙郑慧娜
陈义明,曹文红,2,3,4,5,章超桦,2,3,4,5,*,卢虹玉,2,3,4,5,曾少葵,2,3,4,5,高加龙,2,3,4,5,郑慧娜,2,3,4,5
(1.广东海洋大学食品科技学院,广东湛江 524088;2.广东省水产品加工与安全重点实验室,广东湛江 524088;3.广东普通高等学校水产品深加工重点实验室,广东湛江 524088;4.国家贝类加工技术研发分中心(湛江),广东湛江 524088;5. 广东普通高等学校水产品高值化加工与利用创新团队,广东湛江 524088)
圆鮀鲣(Auxistapeinosoma)属硬骨鱼亚纲鲈形目鲭亚目金枪鱼科,为暖水性中上层鱼类[1]。暗色肉是金枪鱼加工过程中的副产物,因其颜色深、易氧化、有异味和功能性较差等缺点,主要用于生产鱼粉和肥料等低值的产品[2]。苏阳等[3]对圆鮀鲣的普通肉和暗色肉的营养价值进行了研究,发现圆鮀鲣普通肉和暗色肉粗蛋白(干基)含量分别为87.72%和81.07%,必需氨基酸评分分别为96和89,DHA+EPA的含量占总脂肪的 17%~28%。此外,两者均含有丰富的 Ca、Fe、Zn等矿物元素,表明暗色肉营养价值丰富。章超桦等[4]初步研究圆鮀鲣肌肉组织酶解物的抗疲劳作用,结果表明,圆鮀鲣普通肉和暗色肉酶解物均具有抗疲劳作用。前期研究暗色肉粗酶解物(DMH)的抗疲劳作用,但是DMH中的成分非常复杂,主要成分为多肽和氨基酸为主的粗蛋白,还有少量的糖、粗脂肪和灰分,其中主要的抗疲劳活性物质尚不明确。
为了进一步探讨DMH的抗疲劳作用是否主要与其中所含的蛋白相关,还是蛋白与其他成分的协同作用,本文采用碱溶酸沉法提取圆鮀鲣暗色肉蛋白质(dark muscle protein,DMP),使用木瓜蛋白酶和中性蛋白酶水解DMP,研究暗色肉蛋白酶解物(dark muscle protein hydrolysate,DMPH)的基本成分、氨基酸组成和抗疲劳作用,并与DMH进行比较,初步推测DMH中主要的抗疲劳活性物质。
1 材料与方法
1.1 材料与仪器
圆鮀鲣 由雷州市运源水产有限公司提供,去除头、骨、皮,取肌肉组织中的暗色肉,绞肉机搅碎分装于聚乙烯袋中,-40 ℃保存直到使用;中性蛋白酶(20万U/g)、木瓜蛋白酶(20万U/g) 广西庞博生物工程有限公司;乳酸试剂盒、尿素氮试剂盒、肝糖原试剂盒、谷胱甘肽过氧化物酶测试盒、过氧化氢酶测试盒和超氧化物歧化酶测定试剂盒 南京建成生物工程有限公司;西洋参含片 佛山市顺德康富来保健品有限公司;雄性昆明小鼠 120只(SPF级),体重18~22 g,由南方医科大学实验动物中心提供,许可证编号:SCXK(粤)2016-0041。
T25分散均质机 艾卡(中国)仪器设备有限公司;RW20搅拌器 艾卡(中国)仪器设备有限公司;Thermo Lynx6000高速落地离心机 赛默飞世尔科技(中国)有限公司;R-1005旋转蒸发仪 郑州长城科工贸有限公司;FDU-1100真空冷冻干燥机 东京理化器械株式会社;Varioskan Flash多功能酶标仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 圆鮀鲣 DMP制备 参照郑惠娜等[5]方法,稍做修改,称取1000 g暗色肉,按1∶3比例加入蒸馏水,高速分散机10000 r/min匀浆后,采用 0.1 mol/L NaOH溶液调节溶液pH为12,然后4 ℃冰浴中用搅拌器搅拌3 h后,以9000 r/min,4 ℃离心15 min取上清液,用0.1 mol/L HCl溶液调节上清液pH为5.1,以9000 r/min,4 ℃离心15 min取沉淀,即得到圆鮀鲣DMP备用。
1.2.2 DMH和DMPH制备 参照苏阳等[6]的方法,分别取暗色肉和制备的DMP进行酶解,按料水比1∶3加入蒸馏水,pH6.8,原料中木瓜蛋白酶1100 IU/g,中性蛋白酶1400 IU/g,50 ℃条件下酶解2.5 h,酶解产物于100 ℃灭酶10 min后,以5000 r/min离心10 min取上清液,上清液于50 ℃真空条件下浓缩至体积为200 mL左右,真空度50 Pa,温度-35 ℃ 条件下冷冻干燥得DMH和DMPH,放入超低温冰箱备用。
1.2.3 DMH和DMPH基本成分测定 粗蛋白的测定:自动凯氏定氮仪法(GB 5009.5-2016)[7];灰分的测定:高温灼烧法(GB 5009.4-2016)[8];粗脂肪的测定:索氏提取法(GB 5009.6-2016)[9];总糖含量测定:苯酚硫酸法(GB/T 9695.31-2008)[10]。
1.2.4 氨基酸组成测定 DMH和DMPH中氨基酸测定参照Cao等[11]方法,样品经6 mol/L HCl于(110±1) ℃水解22 h后,用高速氨基酸分析仪进行17种组成蛋白质氨基酸含量的分析。
1.2.5 实验动物分组 分笼饲养,每5只一笼,室温(22±2) ℃,相对湿度50%±10%,噪音小于60 dB,日光灯的明暗间隔为12 h,自由饮食和饮水。经过1周的适应期后,120只小鼠随机平均分成6个组。按人体(以60 kg体重计)推荐量每日3.75 g的10倍,设置西洋参灌胃剂量为0.6 g/(kg·d)作为阳性组,低剂量组灌胃剂量为0.6 mg/g·d蛋白,高剂量组灌胃剂量为3.6 mg/g·d蛋白。西洋参含片粉末、DMH和DMPH在灌胃前配制成水溶液,每天上午9点进行灌胃,连续4周。实验动物分组及灌胃情况见表1。
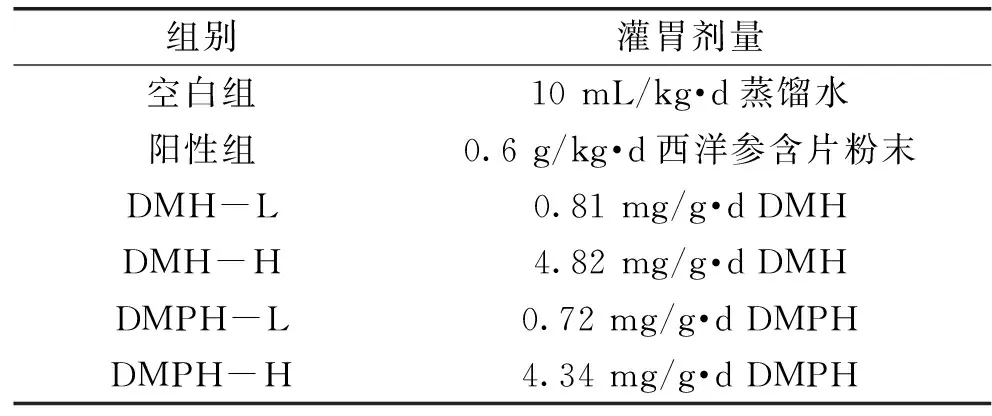
表1 实验动物分组及灌胃剂量
1.2.6 圆鮀鲣DMH和DMPH的体内抗疲劳活性
1.2.6.1 小鼠力竭游泳测试 每组随机取10只小鼠进行力竭游泳测试,最后一次灌胃后,小鼠允许休息30 min。在小鼠鼠尾根部负荷5%体重的铅坠后,将其置于水深约30 cm,水温(25±1) ℃的游泳箱中游泳。在实验过程中需使小鼠的四肢保持运动,若小鼠漂浮不动,可在其附近搅动水流迫使其运动。用秒表记录小鼠从游泳开始至头部完全沉入水中7 s不露出水面的时间为小鼠力竭游泳时间[12]。
1.2.6.2 疲劳相关的生化参数测定 最后一次灌胃后,小鼠允许休息30 min。将小鼠置于水深约30 cm,温度(25±1) ℃的游泳箱中游泳。游泳90 min后取出小鼠,眼球取血,血用于测定乳酸、尿素氮的含量与超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)的活力。小鼠当即处死取肝脏,经生理盐水洗净血水后用滤纸吸干放入密封袋中-40 ℃保存,肝脏用于测定肝糖原含量。乳酸、尿素氮和肝糖原含量以及SOD、CAT和GSH-Px活力测定均使用试剂盒,所有生化参数的检测均使用酶标仪。
1.3 数据处理
2 结果与分析
2.1 DMH和DMPH的基本成分
DMH和DMPH的基本成分测定结果如表2所示,DMP酶解后DMPH的粗蛋白含量显著高于DMH(p<0.05),DMPH的总糖、灰分和粗脂肪的含量显著低于DMH(p<0.05),说明碱溶酸沉法可以脱除暗色肉中部分多糖和粗脂肪,DMP酶解后DMPH中的粗蛋白含量升高。

表2 DMH和DMPH基本成分(%,干基)
2.2 DMH和DMPH的氨基酸组成
DMH和DMPH的氨基酸组成测定结果如表3所示,DMDP中氨基酸总浓度高于DMH,分别为69.80、78.05 g氨基酸残基/100 g暗色肉酶解粉,DMH和DMPH中分别含有17.91%和17.82%的亮氨酸、异亮氨酸和缬氨酸等支链氨基酸,支链氨基酸可以提高运动能力和显著延缓运动过程中肌肉中蛋白质的分解代谢[13]。DMH中支链氨基酸含量与DMPH相近,表明DMH和DMPH均能提高运动能力。此外,支链氨基酸还能减少运动过程中血液乳酸的积累,减轻血液乳酸导致的疲劳[10]。

表3 DMH和DMPH氨基酸组成
2.3 DMH和DMPH对小鼠力竭游泳时间的影响
小鼠力竭游泳测试结果如图1所示,与空白组相比,DMH和DMPH不同剂量组均能显著地延长小鼠力竭游泳时间(p<0.05)。DMH-H组和DMPH-H组小鼠力竭游泳时间显著高于阳性组(p<0.05)。DMH -H组小鼠力竭游泳时间显著高于DMH-L组(p<0.05),DMPH-L组和DMPH-H组无显著性差异(p>0.05)。结果表明,DMH和DMPH均具有抗疲劳作用,但是两者无显著性差异(p>0.05)。增加运动耐受性是直接测量抗疲劳作用的方法。负重游泳实验运动模型用来评价抗疲劳作用,可以增加小鼠的运动强度从而缩短研究时间,力竭游泳时间的长短可以表示疲劳的程度。

图1 DMH和DMPH对小鼠力竭游泳时间的影响
2.4 DMH和DMPH对小鼠乳酸、尿素氮、肝糖原含量的影响
小鼠血浆乳酸测定结果如表4所示,DMH和DMPH不同剂量组小鼠游泳90 min后,血液中乳酸含量显著低于空白组(p<0.05),DMH-L和DMH -H分别降低29.2%和32.5%,DMPH-L和DMPH-H组分别降低37.6%和42.0%。DMH和DMPH不同剂量组小鼠乳酸含量显著低于阳性组(p<0.05)。DMH-L和DMH -H组间无显著性差异(p>0.05),DMH-L组和DMPH-H组间无显著性差异(p>0.05)。结果表明,DMH和DMPH能帮助清除或者延缓小鼠体内乳酸的积累,从而起到抗疲劳的作用。糖酵解是短时间剧烈运动的主要能量来源[14],乳酸是无氧条件下碳水化合物糖酵解的产物,因此,血液乳酸是判断疲劳程度的重要指标之一。然而,研究发现,乳酸本身不是疲劳发展的直接原因,从乳酸上解离的H+能改变体内的pH,损伤某些器官和产生疲劳[15]。

表4 小鼠乳酸、尿素氮和肝糖原含量
小鼠血浆尿素氮测定结果如表4所示,DMH和DMPH不同剂量组小鼠尿素氮含量显著低于空白组(p<0.05),DMH-L和DMH -H分别降低29.3%和33.2%,DMPH-L和DMPH-H组分别降低17.6%和29.2%。DMH不同剂量组和DMPH-H组小鼠尿素氮含量显著低于阳性组(p<0.05)。DMH-L组和DMH -H组间无显著性差异(p>0.05),DMPH-H组尿素氮含量显著低于DMPH-L组(p<0.05)。DMH-L组尿素氮含量显著低于DMPH-L组(p<0.05),DMH-H组与DMPH-H组间无显著性差异(p>0.05)。结果表明,DMH和DMPH均能为小鼠机体提供能量,减缓蛋白质代谢水平,提高小鼠的运动耐受力,有一定抗疲劳功效。当身体不能由糖和脂肪的分解代谢获得足够的能量时,蛋白质和氨基酸分解代谢加强,尿素氮是蛋白质和氨基酸代谢的产物,长时间进行分解代谢后,体内尿素氮显著增加。所以,血液中的尿素氮含量的高低是衡量机体否疲劳一个重要指标。体内尿素氮的含量与运动耐受性呈正相关,身体的运动耐受性越差,尿素氮含量增加的越多[16]。
小鼠肝糖原测定结果如表4所示,DMH和DMPH剂量组小鼠肝糖原含量显著高于空白组(p<0.05),DMH-L和DMH -H分别为空白组的1.61和1.79倍,DMPH-L和DMPH-H组分别为空白组的1.62和1.65倍。DMH-L组和DMH-H组间无显著性差异(p>0.05),DMPH-L组和DMPH-H组间无显著性差异(p>0.05)。结果表明,DMH和DMPH能改善小鼠的能量代谢体系,从而提高机体对运动的耐受能力,具有一定的抗疲劳功效。糖原是运动期间重要的能量来源,糖原的作用是补充血糖的消耗和维持血糖在正常的生理范围。当糖原被大量消耗时,疲劳便会发生。因此,肝糖原含量是测定疲劳是否发生的一项重要指标。
2.5 DMH和DMPH对小鼠抗氧化酶的影响
2.5.1 DMH和DMPH对小鼠SOD活力的影响 小鼠血浆SOD测定结果如图2(a)所示,DMPH组小鼠SOD活力显著高于空白组(p<0.05),DMH 组小鼠SOD活力与空白组无显著性差异(p>0.05),阳性组小鼠SOD活力显著高于空白组(p<0.05),DMH和DMPH组小鼠SOD活力与空白组无显著性差异(p>0.05)。DMH-L组和DMH -H组间无显著性差异(p>0.05),DMPH-L组和DMPH-H组间无显著性差异(p>0.05)。
2.5.2 DMH和DMPH对小鼠CAT活力的影响 小鼠血浆CAT测定结果如图2(b)所示,DMH组和DMPH组小鼠CAT活力显著高于空白组(p<0.05),DMH组和DMPH组小鼠CAT活力显著高于阳性组(p<0.05)。DMH组和DMPH组间无显著性差异(p>0.05)。
2.5.3 DMH和DMPH对小鼠GSH-Px活力的影响 小鼠血浆GSH-Px测定结果如图2(c)所示,DMH组和DMPH组小鼠GSH-Px活力显著高于空白组(p<0.05),DMH组小鼠GSH-Px活力显著高于阳性组(p<0.05),DMPH组小鼠GSH-Px活力与阳性组无显著性差异(p>0.05)。DMH-L组和DMH -H组间无显著性差异(p>0.05),DMPH-L组和DMPH-H组间无显著性差异(p>0.05)。越来越多的研究表明,活性氧是蛋白质氧化的原因,而且强烈导致肌肉疲劳[14]。

图2 DMH和DMPH对小鼠抗氧化酶活力的影响
抗氧化酶系统(包括SOD、GSH-Px和CAT等)在清除自由基和其代谢产物方面是重要的,而且还能维持正常的细胞生理学,促进免疫功能和预防各种疾病[18]。结果表明,DMH和DMPH具有抗氧化活性,能提高小鼠体内抗氧化酶的活力,促进运动过程中自由基的清除。在生物系统中,自由基以活性氧的形式产生,如超氧阴离子、羟自由基、过氧化氢、单线态氧、氧化氮和过氧亚硝酸盐。过量产生的自由基将导致氧化应激,能导致组织损伤和疲劳[19]。具有抗氧化活性的天然产物能预防自由基攻击,许多蛋白质酶解物及其分离的多肽已经显示出抗氧化活性与抗疲劳作用,包括草鱼[20]、鲐鱼[21]和泥鳅[22]。
3 结论
DMPH的粗蛋白含量显著高于DMH(p<0.05),DMPH的总糖、灰分和粗脂肪的含量显著低于DMH(p<0.05)。DMH和DMPH中氨基酸组成全面,DMPH的氨基酸总浓度高于DMH。DMH中支链氨基酸含量与DMPH相近。DMH和DMPH能延长小鼠力竭游泳时间,减少肝糖原的消耗,通过降低乳酸和尿素氮含量帮助消除代谢产物的累积,而且还可提高小鼠体内抗氧化酶的活力,DMH和DMPH均具有抗疲劳作用,但是无显著性差异。
与DMH相比,DMPH中粗蛋白和氨基酸含量更高,可以推测暗色肉中蛋白质水解产生的多肽和氨基酸是DMH中主要的抗疲劳活性物质。本研究结果可以为抗疲劳功能产品的研究和开发奠定基础。然而,对其抗氧化活性及抗疲劳作用机制还需深入研究。
[1]李钰金,隋娟娟,李银塔,等. 金枪鱼鱼松的工艺研究[J]. 食品研究与开发,2012(3):67-70.
[2]Nalinanon S,Benjakul S,Kishimura H,et al. Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna[J]. Food Chemistry,2011,124(4):1354-1362.
[3]章超桦,苏阳,曹文红,等. 南海圆鮀鲣肌肉组织酶解产物抗疲劳活性的初步研究[J]. 食品科学技术学报,2017,20(3):43-49.
[4]苏阳,章超桦,曹文红,等. 南海产3种金枪鱼普通肉、暗色肉营养成分分析与评价[J]. 广东海洋大学学报,2015,35(3):87-93.
[5]郑惠娜,张晶晶,周春霞,等. pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J]. 中国食品学报,2014(7):230-235.
[6]苏阳. 南海产3种金枪鱼营养成分分析及肌肉蛋白酶解物抗疲劳活性的研究[D]. 湛江:广东海洋大学,2015.
[7]全国食品工业标准化技术委员会. GB 5009.5-2016,食品安全国家标准,食品蛋白质的测定[S].
[8]全国食品工业标准化技术委员会. GB 5009-4-2016,食品安全国家标准,食品中灰分的测定[S].
[9]全国食品工业标准化技术委员会. GB 5009.6-2016,食品安全国家标准,食品中脂肪的测定[S].
[10]全国食品工业标准化技术委员会. GB/T 9695.31-2008,肉制品总糖含量测定[S].
[11]Cao W,Zhang C,Hong P,et al. Autolysis of shrimp head by gradual temperature and nutritional quality of the resulting hydrolysate[J]. LWT-Food Science and Technology,2009,42(1):244-249.
[12]Jung K-A,Han D,Kwon E-K,et al. Antifatigue effect of rubus coreanus miquel extract in mice[J]. Journal of Medicinal Food,2007,10(4):689-693.
[13]Blomstrand E,Newsholme EA. Effect of branched-chain amino acid supplementation on the exercise-induced change in aromatic amino acid concentration in human muscle[J]. Acta Physiolscand,1992,146(3):293-298.
[14]Negro M,Giardina S,Marzani B,et al. Branched-chain amino acid supplementation does not enhance athletic performance but affects muscle recovery and the immune system[J]. Journal of Sports Medicine and Physical Fitness,2008,48(3):347-351.
[15]Wang JJ,Shieh MJ,Kuo S-L,et al. Effect of red mold rice on antifatigue and exercise-related changes in lipid peroxidation in endurance exercise[J]. Applied Microbiology and Biotechnology,2006,70(2):247-53.
[16]Wang L,Zhang HL,Lu R,et al. The decapeptide CMS001 enhances swimming endurance in mice[J]. Peptides,2008,29(7):1176-1182.
[17]Zhang Y,Yao X,Bao B,et al. Anti-fatigue activity of a triterpenoid-rich extract from Chinese bamboo shavings(Caulis bamfusae in taeniam)[J]. Phytotherapy Research,2006,20(10):872-876.
[18]Powers SK,DeRuisseau KC,Quindry J,et al. Dietary antioxidants and exercise[J]. Journal of sports sciences,2004,22(1):81-94.
[19]Sözmen EY,Sözmen B,Girgin FK,et al. Antioxidant enzymes and paraoxonase show a co-activity in preserving low-density lipoprotein from oxidation[J]. Clinical and experimental medicine,2001,1(4):195-199.
[20]任娇艳. 草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D]. 广州:华南理工大学,2008.
[21]Wang XQ,Xing RE,Chen ZY,et al. Effect and mechanism of mackerel(Pneumatophorus japonicus)peptides for anti-fatigue[J]. Food & Function,2014,5(9):2113-2119.
[22]You L,Zhao M,Regenstein JM,et al.Invitroantioxidant activity andinvivoanti-fatigue effect of loach(Misgurnusanguillicaudatus)peptides prepared by papain digestion[J]. Food Chemistry,2011,124(1):188-194.
