基于响应面法构建虾青素纳米乳液
2018-05-29吴婉仪解新安
吴婉仪,李 璐,解新安,李 雁
(华南农业大学食品学院,广东广州 510642)
虾青素(Astaxanthin)属于非维生素A类源胡萝卜素,具有很强的抗氧化活性和多种保健功能,如抗衰老、防癌变、增强机体免疫、维护中枢神经系统等[1-2],在保健品、化妆品等工业中有较为广泛的应用[3]。但由于其水溶性和稳定性较差,遇到光、热、氧气等极易被氧化分解,生物利用度低,所以对虾青素的保护和有效应用己成为众多研究者关注的问题[4-5]。
载体包埋技术可以用来改善天然虾青素的水分散性和稳定性,如纳米沉淀技术[6]、微胶囊包埋技术[7]、纳米乳液技术[8]等。区别于纳米沉淀技术的有机溶剂残留,生物相容性、生物可降解性、毒性等问题,以及工业生产常用的高温喷雾干燥微胶囊包埋技术不适用于对热不稳定的营养活性物质,纳米乳液作为一种胶体输送系统具有更高的稳定性[9-10],且通过高能外力包封纳米乳液后,脂溶性营养成分的生物利用率得到了显著提升[11],然而将纳米乳液用于虾青素包埋和保护的研究相对较少[12]。在制备纳米乳液的过程中,许多食品级的生物兼容性强的生物大分子乳化剂逐渐成为化学合成乳化剂很好的替代品[13-14],大豆卵磷脂是从大豆中提炼出来的具有多种保健功能的天然食品乳化剂,已被广泛应用于食品工业[15],但以其作为乳化剂构建纳米乳液的研究少见报道。
本研究以大豆卵磷脂为乳化剂,棕榈油为油相,采用高压均质法制备负载虾青素的纳米乳液,系统研究大豆卵磷脂乳化剂的添加浓度、乳化温度和乳化时间、以及油水比等单因素对所得乳液粒径和负载量的影响,并通过响应面法优化纳米乳液制备条件,以制备出负载率高、稳定性好的虾青素纳米乳液。
1 材料和方法
1.1 材料与仪器
大豆卵磷脂、棕榈油、虾青素标品(纯度≥98%) 均购自广东齐云生物技术有限公司;2,6-叔丁基对甲酚(BHT) 购自广州市雨韶贸易有限公司;二氯甲烷、二甲基亚砜、正己烷、无水乙醇 均购自广东光华科技股份有限公司。
Millipore超纯水系统 法国Millipore公司;scientz-150型高压均质机 宁波新芝生物科技股份有限公司;FJ200型高速分散均质搅拌器 上海弗鲁克流体机械制造有限公司;UV-2500型紫外可见分光度计 德国斯派克分析仪器公司;Zetasizer Nano ZS90型纳米粒度及Zeta电位分析仪 英国Malvern公司。
1.2 实验方法
1.2.1 虾青素纳米乳液的制备 在一定乳化温度下将一定量的大豆卵磷脂在一定乳化时间内溶解于去离子水中,之后在室温下搅拌过夜,使其充分水化,制得水相。取一定量的虾青素与棕榈油搅拌混匀,然后将虾青素油相与水相按不同的比例混合搅拌均匀后在高速分散机上以18000 r/min分散4 min制得粗乳液,再将制得的粗乳液在不同高压均质压力下均质不同次数,得到相应的虾青素纳米乳液。将制备好的乳液于4 ℃冰箱冷藏保藏。为了在贮藏中抑制乳液中微生物的生长,在乳液的油相与水相混合时加入0.02%(w/w)BHT抗氧化剂。
1.2.2 单因素实验 采用1.2.1法制备虾青素纳米乳液,进行单因素实验,考察以下因素对虾青素纳米乳液的性能影响。
1.2.2.1 乳化温度 固定制备条件为乳化时间45 min、高压均质压力及循环次数为110 MPa 3次、乳化剂浓度1%、油水比1∶9、虾青素添加量0.1%,考察不同乳化温度(35、45、55、65、75 ℃)对乳液粒径及虾青素负载率的影响。
1.2.2.2 乳化时间 固定制备条件为乳化温度55 ℃、高压均质压力及循环次数为110 MPa 3次、乳化剂浓度1%、油水比1∶9、虾青素添加量0.1%,考察不同乳化时间(15、30、45、60、75 min)对乳液粒径及虾青素负载率的影响。
1.2.2.3 高压均质压力及循环次数 固定制备条件为乳化温度55 ℃、乳化时间45 min、乳化剂浓度1%、油水比1∶9、虾青素添加量0.1%,考察不同高压均质压力(65、80、95、110 MPa)及循环次数(1、3、5、7次)对乳液粒径的影响。
1.2.2.4 乳化剂浓度 固定制备条件为乳化温度55 ℃、乳化时间45 min、高压均质压力及循环次数为110 MPa 3次、油水比1∶9、虾青素添加量0.1%,考察不同乳化剂浓度(0.5%、1.0%、1.5%、2.0%、2.5%)对乳液粒径及虾青素负载率的影响。
1.2.2.5 油水比 固定制备条件为乳化温度55 ℃、乳化时间45 min、高压均质压力及循环次数为110 MPa 3次、乳化剂浓度1%、虾青素添加量0.1%,考察不同油水比(1∶13、1∶11、1∶9、1∶7、1∶5,w/w)对乳液粒径及虾青素负载率的影响。
1.2.2.6 虾青素添加量 固定制备条件为乳化温度55 ℃、乳化时间45 min、高压均质压力及循环次数为110 MPa 3次、乳化剂浓度1%、油水比1∶9,考察不同虾青素添加量(0.1%、0.3%、0.5%、0.7%、0.9%)对乳液粒径及虾青素负载率的影响。
1.2.3 Box-Benhnken中心组合实验设计 纳米乳液体系配方的设计原则为使用最少的乳化剂乳化最大量的油脂量,并期望得到较高的虾青素负载量。在单因素实验的基础上,采用Box-Behnken设计优化高压均质法制备虾青素纳米乳液的工艺条件,基于纳米乳液体系配方设计原则及能耗考虑,选取乳化剂浓度(A)、油水比(B)、虾青素添加量(C)3个因子作为实验因素,以粒径(Y1)和负载率(Y2)作为响应值。将单因素选出来的最佳值定位0水平,因素水平表如表1所示。

表1 响应面实验因素水平编码表
1.2.4 纳米乳液粒径的测定 采用纳米粒度仪测量纳米乳液平均直径大小和多分散系数(PDI),测定温度固定在25 ℃,所有的乳液均使用去离子水稀释100倍后再进行检测,实验重复3次,取均值。
1.2.5 纳米乳液中虾青素含量的测定
1.2.5.1 虾青素标准曲线的绘制 用二氯甲烷溶液溶解虾青素,通过紫外-可见光分光光度计在400~600 nm波长范围内扫描,吸收图谱显示在477 nm处有明显的吸收峰。使用少量二氯甲烷溶解虾青素标品,以正己烷为溶剂配制质量浓度为0.2、1.0、5.0、10.0、20.0、40.0 μg/mL不同浓度的虾青素标准溶液,绘制虾青素标准曲线为A=0.0484C-0.0875,相关系数r=0.9994。
1.2.5.2 纳米乳液中虾青素负载率和保留率的测定 负载率和保留率是评定负载功能性营养成分纳米乳液质量的重要指标,负载率反映的是虾青素被乳液负载的程度,而保留率为虾青素纳米乳液在贮藏过程中虾青素的保留程度。根据杜有功[16]的方法稍有改动,准确量取0.5 mL纳米乳液与0.5 mL二甲基亚砜混合均匀,然后依次加入2 mL正己烷-二氯甲烷(3∶1,v/v)混合溶剂进行提取,重复提取3次后合并萃取液,在4000 r/min下离心10 min,取上层清液测其吸光值,根据标准曲线计算虾青素质量浓度。通过公式(1)计算虾青素的负载率:

式(1)
式中:C1为纳米乳液中虾青素的浓度;C0为纳米体系中加入虾青素总浓度。
通过公式(2)计算虾青素的保留率:
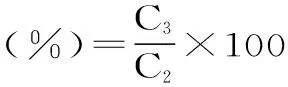
式(2)
式中:C3为一定贮藏时间后纳米乳液中虾青素的浓度;C2为贮藏前乳液负载的虾青素浓度。
1.3 数据处理
所有实验至少重复三次并采用平均值,采用Origin 8.5软件作图,Design-Expert 8.0.6软件进行回归分析。
2 结果与分析
2.1 单因素实验
2.1.1 乳化温度对虾青素纳米乳液的性能影响 选择合适的乳化温度对形成粒径较小且均一的纳米乳液具有重要影响,由图1(a)可知,当乳化温度在35~75 ℃之间时,纳米乳液粒子的粒径先减小,在温度为55 ℃时纳米乳液粒子粒径达到最小,当温度继续升高时,纳米乳液液滴的粒径呈现增加的趋势。这可能是由于乳化温度较低时,分子的空间位阻作用使乳化剂分子动能受限,界面吸附的乳化剂分子较少,不利于乳化。温度的提升可以帮助降低界面张力及粘度,使乳化反应易于进行,但当乳化温度过高时,乳化剂分子具有较高的热动能,乳化反应的速度和不稳定性则会加速[17]。而乳液粒径的PDI值均较小,说明了制备的乳液粒径分布均一。由图1(b)可知,受到乳化剂的影响,在35~55 ℃范围内,随着乳化温度的上升,虾青素负载率增加,而温度持续上升时,负载率开始下降。因此选定乳化温度为55 ℃,在此温度下乳化剂的乳化效果最佳。
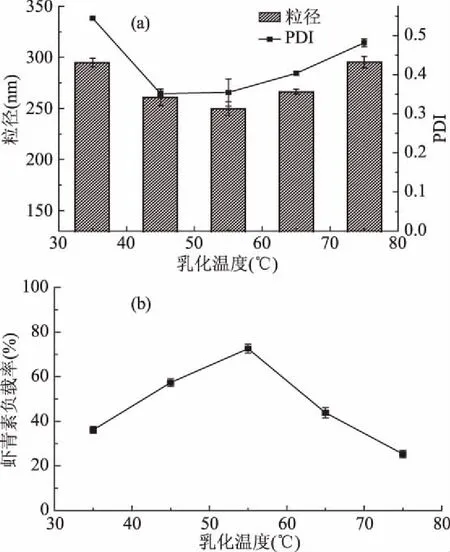
图1 不同乳化温度下纳米乳液的平均粒径和分散系数(a)、虾青素负载率(b)
2.1.2 乳化时间对虾青素纳米乳液的性能影响 乳化时间影响乳化剂的乳化效果,如图2(a),在乳化时间为15~45 min,增加乳化时间有助于得到更小粒径的乳液液滴,在乳化时间为45 min时粒径达到最小,随着乳化时间的继续增加粒径转为增大。对于乳液粒径的PDI值,在适宜的乳化时间范围下较小,说明了其粒径的分布越窄。由图2(b)可知,虾青素负载率在对应的乳化时间范围内,随着乳化时间的增加,负载率先增加后减小,在45 min时达到最大。因此选定乳化时间为45 min。
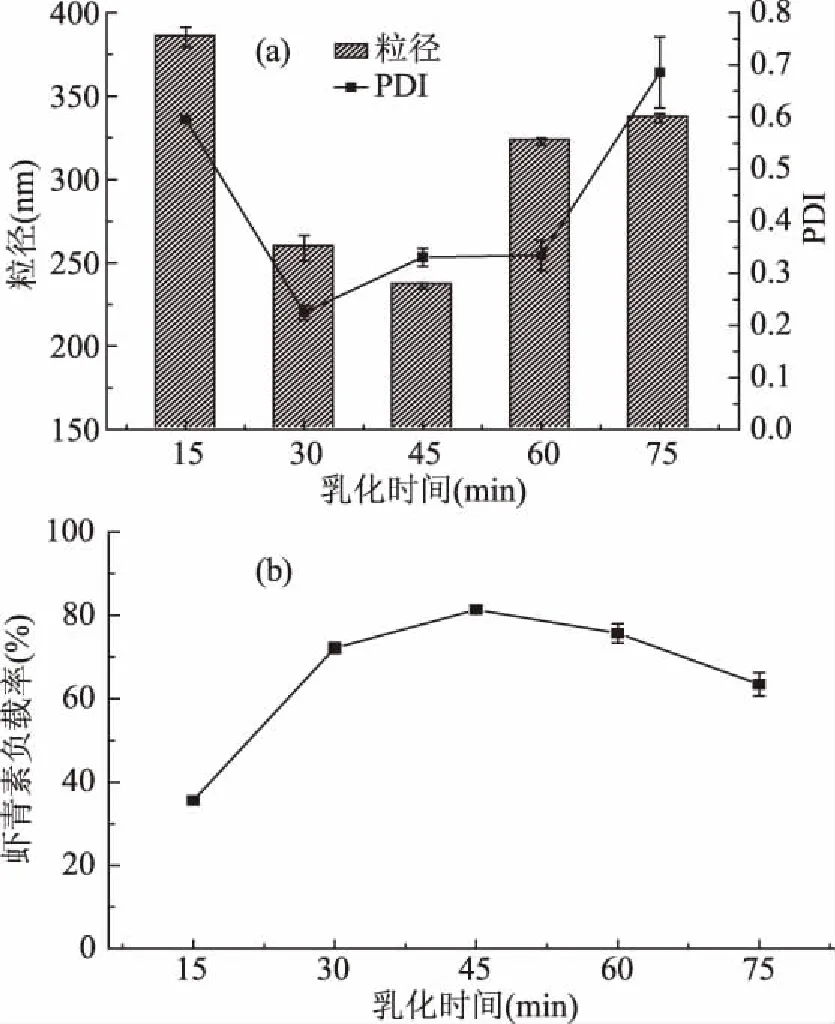
图2 不同乳化时间下纳米乳液的平均粒径和分散系数(a)、虾青素负载率(b)
2.1.3 高压均质压力及循环次数对虾青素纳米乳液的性能影响 高压均质法制备纳米乳液时,粗乳液粒子在巨大的剪切、碰撞和空穴效应的作用下,粒径逐渐减小,其中高压均质压力大小和循环次数是制约纳米乳液粒子大小的决定性因素,而对功能性营养物质的负载率影响较小[18]。由图3可知,随着高压均质压力的增加,纳米乳液的粒径呈明显降低的趋势,当高压均质压力一定时,粒径随循环次数的增加呈减小的趋势,这是因为高压均质机均质一次具有一定的破碎颗粒概率,压力在均质阀中产生的能量并不均匀,处于高能区的粒子就被破碎,而低能区的粒子不能被破碎,因此需要多次均质使得粒径破碎更均匀[19]。但当液滴粒径细到一定的程度时,继续被破碎所需的能量与高压均质机高压产生的能量相等时,均质次数的增加对粒径降低的效果并不显著[20]。因此选定均质压力110 MPa,均质次数3次进行后续的实验。

图3 不同高压均质压力和循环次数下纳米乳液的平均粒径
2.1.4 乳化剂浓度对虾青素纳米乳液的性能影响 乳化剂浓度对纳米乳液粒径和体系分散系数具有重要影响,如图4(a),纳米乳液粒径随卵磷脂浓度的增加呈现先降低后升高的趋势,当卵磷脂浓度为1.0%(w/w)时,纳米乳液粒径达到最低。这主要是因为当乳化剂用量较少时,不能有效乳化体系中所含油脂,这不仅导致体系粒子粒径变大,还导致油水界面膜强度变小,从而导致体系稳定性降低。而当乳化剂用量过多时,乳化剂不仅能形成紧密的界面膜,过多的乳化剂还可能吸附在界面上,导致液滴粒径变大[21]。对于乳液粒径的PDI值,随着乳化剂浓度的增加,粒径的分布越不均一。由图4(b)可知,乳液的虾青素负载率在乳化剂浓度为0.5%~1.0%(w/w)时显著(p<0.05)上升,在1.5%~2.5%(w/w)时略有下降趋势。因此选定最佳乳化剂浓度为1.0%(w/w)。

图4 不同乳化剂浓度下纳米乳液的平均粒径和分散系数(a)、虾青素负载率(b)
2.1.5 油水比对虾青素纳米乳液的性能影响 由图5(a)可知,油水比对纳米乳液的粒径和PDI值具有显著的影响,液滴的粒径随着油水比的增加而显著增大。这是由于当油含量增大时,定量的乳化剂为了能乳化更多的油脂,则需要增大所乳化的油滴体积,降低油滴与水相的接触面积,从而导致体系粒径的增大,因此油水比的增加不利于形成粒径小且均一稳定的纳米乳液体系,而由图5(b)可知,乳液的虾青素负载率随着油水比的增加而增加,油相的增大有利于负载更多的虾青素,为获得较高虾青素负载率同时粒径较低的乳液,选定最佳油水比例为1∶9。
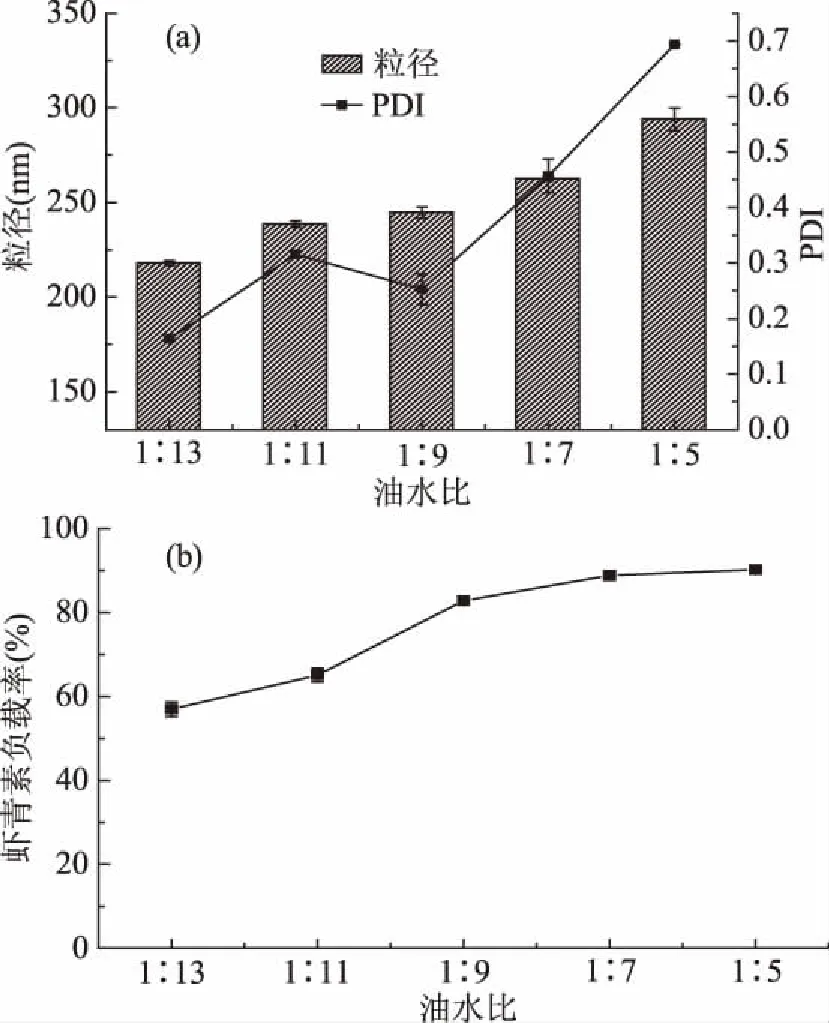
图5 不同油水比下纳米乳液的平均粒径和分散系数(a)、虾青素负载率(b)
2.1.6 虾青素添加量对虾青素纳米乳液的性能影响 由图6可以看出,随着虾青素添加量的增加,纳米乳液的粒径和PDI值增大,虾青素负载率整体变化幅度较小,均在80%以上,在添加量为0.7%(w/w)时达最大值,为92.91%。为保证在较高负载率下得到较小的粒径范围,在响应面实验中选定虾青素添加量范围为0.1%~0.5%(w/w)。

图6 不同虾青素添加量下纳米乳液的平均粒径和分散系数(a)、虾青素负载率(b)
2.2 BBD实验结果及数据分析
2.2.1 BBD实验设计方案结果及回归模型方差分析 根据单因素实验结果,由Design-Expert 8.0.6分析软件设计出的实验方案及实验结果如表2所示,对所得数据进行回归分析,回归分析结果见表3、表4。
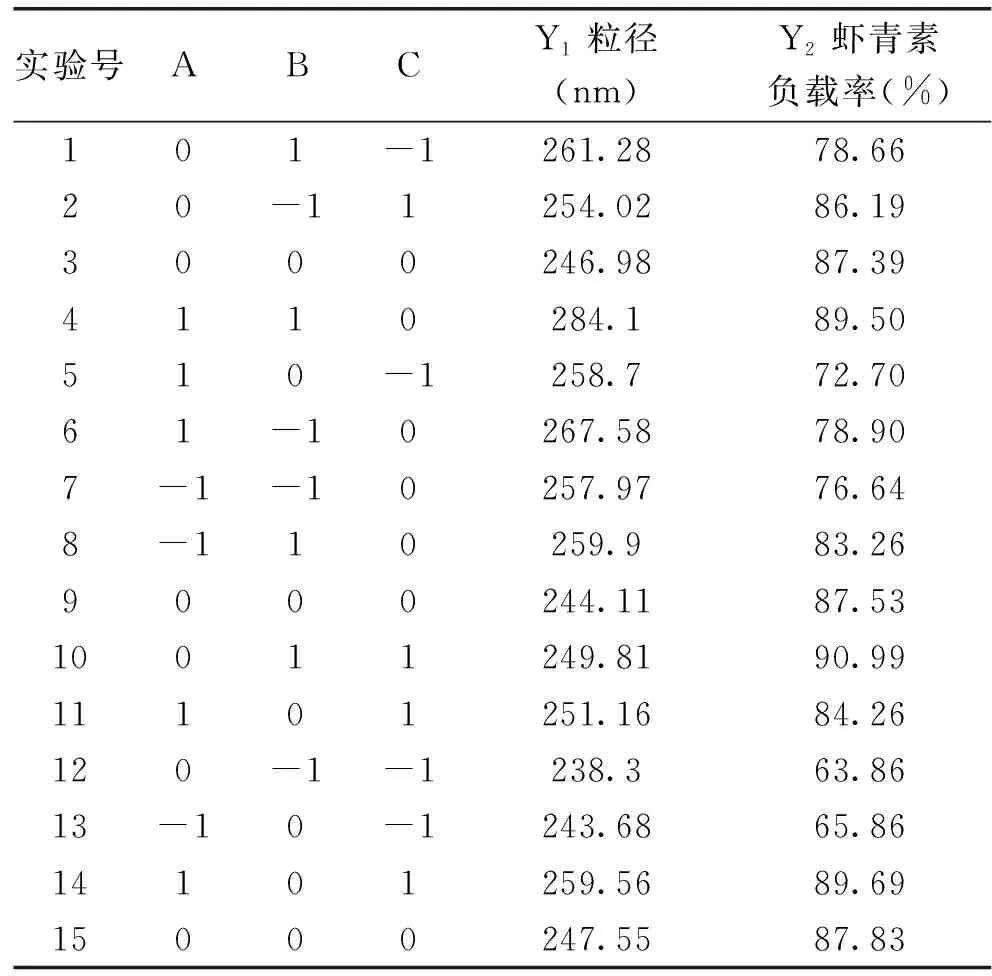
表2 响应面设计方案与实验结果
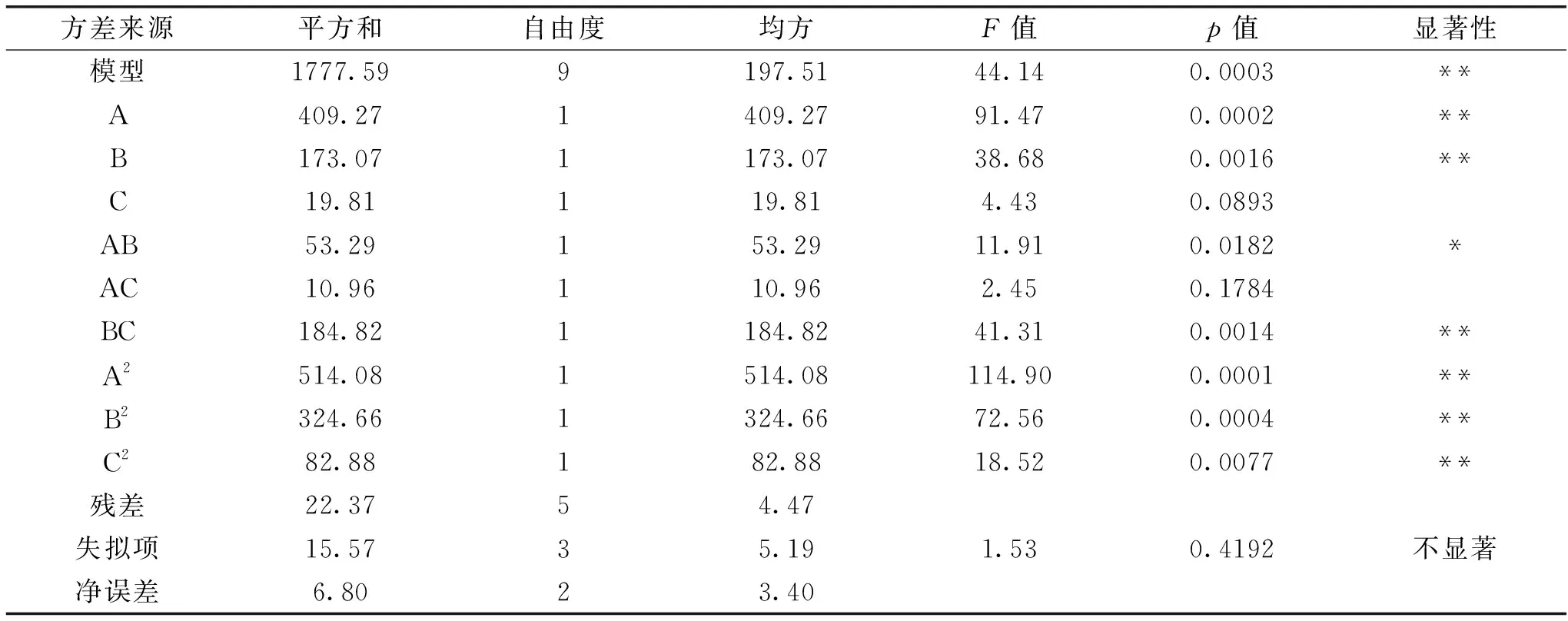
表3 粒径方差分析
以虾青素纳米乳液的粒径和虾青素负载率为响应值,利用Design-Expert 8.0.6分析软件分别进行多元回归拟合,其响应值与各因素之间的二次回归方程如下:
Y1=246.21+7.15A+4.65B+1.57C+3.65AB-1.65AC-6.80BC+11.80A2+9.38B2-4.74C2
Y2=87.58+2.59A+4.60B+8.74C+0.99AB-0.34AC-2.50BC-3.64A2-1.86B2-5.80C2
由表3、表4的方差分析可得,回归方程均差异极显著(p<0.01),而失拟项均不显著,根据方程的相关系数和校正系数,说明模型具有统计学意义,方程与实际情况拟合较好,能够比较准确地反应出各因素以及各因素之间的相互影响关系,可用来对虾青素纳米乳液工艺过程进行初步分析和预测。在显著性检验中,由表3可知,对于粒径,一次项A、B的影响极显著(p<0.01),表明乳化剂浓度和油水比对液滴粒径有极显著影响。各因素对纳米乳液粒径影响大小依次为乳化剂浓度>油水比>虾青素添加量。二次项只有AC无显著差异,说明油水比与乳化剂浓度、油水比与虾青素添加量的交互作用对纳米乳液粒径有显著影响。由表4可知,对于虾青素负载率,乳化剂浓度、油水比和虾青素添加量都对虾青素的负载率有极显著影响,且根据F值,其影响程度依次为虾青素添加量>油水比>乳化剂浓度,同时油水比与乳化剂浓度、油水比与虾青素添加量的交互作用对虾青素的负载率有显著影响。

表4 虾青素负载率方差分析
2.2.2 各因素间对纳米乳液粒径及虾青素负载率交互作用的响应面分析 根据二次回归方程,对乳化剂浓度、油水比、虾青素添加量3个影响因子的交互作用进行分析,分别得到各因素交互作用关系的响应面图和等高线图如图7、图8。

图8 各因素对纳米乳液虾青素负载率影响的响应面图
根据粒径方差分析表3,乳化剂浓度和油水比、油水比和虾青素添加量之间的交互作用显著。图7(a)所示为固定虾青素添加量为零水平,乳化剂浓度与油水比对乳液粒径的影响和两者之间的交互作用。乳液粒径随乳化剂浓度和油水比的增加呈先下降后平缓上升的趋势,且乳化剂浓度的下降幅度大于油水比,说明乳化剂浓度对乳液粒径的影响较大。图7(c)所示为固定乳化剂浓度为零水平,油水比和虾青素添加量对乳液粒径的影响和两者之间的交互作用,可以看出油水比使粒径下降的幅度较虾青素添加量陡峭,说明油水比对乳液粒径的影响较虾青素添加量大。

图7 各因素对纳米乳液粒径影响的响应面图
根据虾青素负载率方差分析表4,与对乳液粒径影响的分析相同,乳化剂浓度和油水比、油水比和虾青素添加量之间的交互作用显著。图8(c)所示为固定乳化剂浓度为零水平,油水比和虾青素添加量对乳液虾青素负载率的影响和两者之间的交互作用。固定油水比不变时,虾青素负载率随虾青素添加量增加先上升后达某一定值时趋于平缓,而固定虾青素添加量不变时,虾青素负载率随油水比的增大而上升到趋于平缓。虾青素添加量使虾青素负载率增加的幅度较油水比稍陡峭,说明虾青素添加量对乳液虾青素负载率的影响较油水比稍大。图8(a)所示为固定虾青素添加量为零水平,乳化剂浓度与油水比对乳液虾青素负载率的影响和两者之间的交互作用。乳化剂浓度和油水比使乳液虾青素负载率增加的幅度差异显著,根据方差分析表,油水比对乳液虾青素负载率的影响较乳化剂浓度大。
2.2.3 验证实验 为确定各因素的最佳取值,通过数学模型对虾青素纳米乳液的响应面分析,得到使乳液粒径最小、虾青素负载率最高的工艺参数:乳化剂浓度为0.965%(w/w),油水比为1∶8.450,虾青素添加量为0.5%(w/w),此时模型预测纳米乳液的粒径为242.65 nm,虾青素负载率为90.72%。考虑到实际操作,将最佳工艺参数修正为乳化剂浓度为1%(w/w),油水比为1∶8.5,虾青素添加量为0.5%(w/w),此条件下进行3次平行验证实验,得到平均粒径为238.84 nm,虾青素的负载率为90.41%,实际值与理论值相近,说明该响应面方法应用可靠。并且在4 ℃避光的贮存条件下,与溶于棕榈油的虾青素对照,一周后纳米乳液虾青素的保留率为85.34%,高于对照组的54.92%,说明虾青素纳米乳液能有效的缓解虾青素的降解,提高其应用价值。
3 结论
根据单因素实验,确定了制备虾青素纳米乳液的最佳乳化温度为55 ℃,最佳乳化时间为45 min,高压均质的最佳压力及循环次数为110 MPa 3次,在此条件下采用响应面法对虾青素纳米乳液制备工艺条件中乳化剂浓度、油水比和虾青素添加量三个因素进行了优化,建立了乳液粒径和虾青素负载率的回归模型,根据模型优化的虾青素纳米乳液制备条件为乳化剂浓度为1%(w/w),油水比为1∶8.5,虾青素添加质量分数为0.5%(w/w),按此条件下制备得到虾青素纳米乳液的粒径为238.84 nm,虾青素负载率可达到90.41%,与模型预测结果相近,进一步验证了模型的可靠性。最优制备条件下的虾青素纳米乳液与溶于棕榈油的虾青素对照组相对比,一周后纳米乳液的虾青素保留率高,稳定性好。
[1]Zhang L,Wang H. Multiple mechanisms of anti-cancer effects exerted by astaxanthin[J]. Marine Drugs,2015,13(7):4310-4330.
[2]干昭波. 虾青素的性质、生产及发展前景[J]. 食品工业科技,2014,35(3):38-40.
[3]张慧,徐公世. 虾青素的研究和开发进展[J]. 中国食品添加剂,2005(C00):201-203.
[4]J Pu,JD Bankston,S Sathivel. Developing microencapsulated flaxseed oil containing shrimp(Litopenaeussetiferus)astaxanthin using a pilot scale spray dryer[J]. Biosystems Engineering,2011,108(2):121-132.
[5]朱明军,宗敏华,吴振强,等. 虾青素研究进展[J]. 食品工业科技,2000,31(2):81-83.
[6]Tachaprutinun A,Udomsup T,Luadthong C,et al.Preventing the thermal degradation of astaxanthin through nanoencapsulation[J]. International Journal of Pharmaceutics,2009,374:119-124.
[7]黄文哲,杨哪,谢正军,等. 喷雾干燥制备虾青素微胶囊的工艺研究[J]. 食品工业科技,2010,31(07):239-242.
[8]陈风平.低能化纳米乳的制备及作为虾青素运送体系的研究[D].青岛:中国海洋大学,2014.
[9]Yu H L,Huang Q R. Improving the oral bioavailability of curcumin using novel organogel-based nanoemulsions[J].Journal of Agricultural and Food Chemistry,2012,60(21):5373-5379.
[10]Tadros T,Izquierdo P,Esquena J,et al. Formation and stability of nano-emulsions[J]. Advances in Colloid and Interface Science,2004,108(10):303-318.
[11]Anarjan N,Mirhosseini H,Baharin BS,et al. Effect of processing conditions on physicochemical properties of astaxanthin nanodispersions[J]. Food Chemistry,2010,123(2):477-483.
[12]Troncoso E,Miguel Aguilera J,McClements D J. Fabrication,characterization and lipase digestibility of food-grade nanoemulsions[J]. Food Hydrocolloids,2012,27(2):355-363.
[13]Gong J,Huo M R,Zhou J P,et al. Synthesis,characterization,drug-loading capacity and safety of novel octyl modified serum albumin micelles[J]. International Journal of Pharmaceutics,2009,376(1-2):161-168.
[14]Mao L K,Xu D X,Yang J,et al. Effects of small and large molecule emulsifiers on the characteristics of beta-carotene nanoemulsions prepared by high pressure homogenization[J]. Food Technology and Biotechnology,2009,47(3):336-342.
[15]杨继勤. 奇妙的天然乳化剂-卵磷脂[J]. 中国食品工业,2000(12):32-33.
[16]杜有功. 虾青素及其几种含量测定方法简介[C]//2015年浙江省医学会临床药学分会、浙江省中西医结合学会中药分会学术会议论文集.浙江:浙江省科学技术学会,2015:5.
[17]Milton J. Rosen,Joy T.Kunjappu. 表面活性剂和界面现象[M]. 北京:化学工业出版社,2015.
[18]Liang R.,Xu S,Shoemaker CF,et al. Physical and antimicrobial properties of peppermint oil nanoemulsions[J]. Journal of Agricultural and Food Chemistry,2012,60:7548-7555.
[19]Yuan Y,Gao Y,Zhao J,et al. Characterization and stability evaluation ofβ-carotene nanoemulsions prepared by high pressure homogenization under various emulsifying conditions[J].Food Research International,2008,41:61-68.
[20]Kos Ei,S Petersen,L Helmdach,et al.Parameter selection of emulsification processes:Conditions for nano-and macroemulsions[J]. Chemical Engineering and Technology,2002,35:1604-1608.
[21]Y Yang,Me Leser,Aa Sher,et al. Formation and stability of emulsions using a natural small molecule surfactant:Quillaja saponin[J]. Food Hydrocolloids,2013,30(2):589-596.
