小檗碱对脓毒症患者肠黏膜屏障功能的保护作用
2018-05-29谢文杰刘玉兰周青山
王 璐,谢文杰,刘 娇,柳 舟,刘玉兰,周青山
(武汉大学人民医院,湖北 武汉 430060)
脓毒症是指由感染引起的全身炎症反应综合征,并发症多,病死率高达30%~70%,ICU住院时间长,花费高[1]。脓毒症发生时,炎性反应致炎症因子增加,肠道内环境平衡紊乱,肠上皮细胞凋亡增多,肠道黏膜屏障受到破坏,肠黏膜通透性发生改变,致使肠道菌群失调,进而引发全身炎症反应,危及患者生命[2]。目前,临床尚未成功开发出有针对性的治疗脓毒症肠道损伤的药物。小檗碱是中药黄连的主要成分,系从毛莨科黄连属植物黄连根和皮中提取的异喹啉类生物碱,已被广泛应用于治疗各种肠道疾病[3],但是在脓毒症肠黏膜屏障功能障碍患者中的应用报道较少。因此本研究采用随机对照双盲试验方法,观察了小檗碱对脓毒症患者血清中二胺氧化酶(DAO)、D-乳酸水平的影响,探讨了小檗碱对脓毒症患者肠黏膜屏障功能的保护作用。
1 临床资料
1.1一般资料 选取2016年3月1日—2017年4月30日入住武汉大学人民医院的76例脓毒症患者,均参照2016年美国危重病学会(SCCM)、欧洲危重病学会(ESICM)专家推荐的Sepsis 3.0的诊断标准[4]确诊。排除近1个月内胃肠道手术史者;胃肠道肿瘤者;近1个月内有急性胃肠道疾病者;慢性肾功能不者;未控制的糖尿病患者;长期用免疫抑制剂或免疫功能低下者;入院48h内死亡或出院者;不可复苏的临终状态者;治疗过程中自动放弃治疗或意外终止者。本研究实施前通过医院医学伦理委员会审批,入组前征得患者或家属的同意,并签署知情同意书。按计算机产生的随机数字将76例脓毒症患者随机分为2组:小檗碱组42例,男22例,女20例;年龄(57.82±10.36)岁;APACHEⅡ评分(17.23±4.42)分,SOFA评分(12.34±3.12)分;感染部位:肺部23例,胆管4例,泌尿道6例,菌血症5例,皮肤软组织4例。对照组34例,男18例,女16例;年龄(56.24±13.67)岁;APACHEⅡ评分(18.32±3.79)分,SOFA评分(12.89±3.54)分;感染部位:肺部19例,胆管4例,泌尿道5例,菌血症3例,皮肤软组织3例。2组男女比例、年龄、APACHEⅡ评分、SOFA评分和感染部位比较差异均无统计学意义(P均>0.05),具有可比性。
1.2治疗方法 2组患者均遵循早期肠内营养支持治疗原则,给予常规治疗。在此基础上,小檗碱组予以小檗碱(广东华南药业集团有限公司,国药准字H44020751,批号:160207)口服,300 mg/次,3次/d;对照组给予安慰剂口服。2组均连服7 d,研究过程中无中途出院、死亡、出现严重并发症或需要手术治疗者,未观察到胃肠道不良反应的发生。
1.3观察指标 ①采用分光光度计法,严格按照美国RD公司的相应检测试剂盒说明书检测2组治疗前及治疗第1,3,5天血清DAO、D-乳酸水平。②统计2组治疗第1,3,5天肠功能评分和肠内营养耐受率,对比2组患者的预后(第7天APACHEⅡ评分、SOFA评分、住ICU时间、28 d病死率)。肠功能评分以无腹胀,肠鸣音正常为0分;腹胀伴肠鸣音减弱为1分;腹胀明显伴肠鸣音接近消失为2分;麻痹性肠梗阻或应激性溃疡出血为3分。肠内营养不耐受以患者出现腹泻、误吸、胃潴留、呕吐和腹胀等表现为判定标准。
2 结 果
2.12组治疗前后DAO和D-乳酸水平比较 治疗前2组DAO和D-乳酸水平比较差异均无统计学意义(P均>0.05)。随着治疗时间推移,2组DAO和D-乳酸水平均逐渐下降(P均<0.05)。治疗第5天,小檗碱组DAO和D-乳酸水平均明显低于对照组(P均<0.05)。见表1。
表1 2组治疗前后DAO和D-乳酸水平比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.22组治疗后肠功能评分及肠内营养耐受率比较 治疗第1天,2组肠功能评分和肠内营养耐受率比较差异均无统计学意义(P均>0.05);治疗第3天、第5天,小檗碱组的肠功能评分均明显低于对照组(P均<0.05);治疗第5天,小檗碱组肠内营养耐受率明显高于对照组(P<0.05)。见表2。
2.32组预后比较 治疗第7天,小檗碱组SOFA评分、APACHEⅡ评分均明显低于对照组(P<0.05);小檗碱组住ICU时间明显短于对照组(P<0.05);2组28 d病死率比较差异无统计学意义(P>0.05)。见表3。
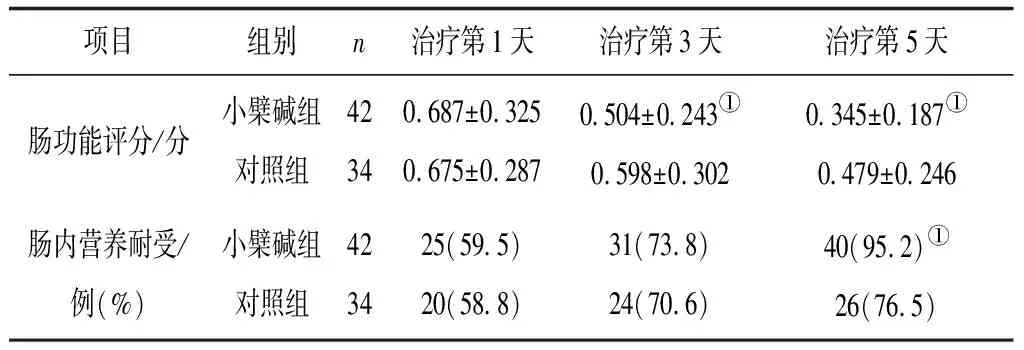
表2 2组治疗后肠功能评分及肠内营养耐受率比较
注:①与对照组比较,P<0.05。

表3 2组治疗第7天SOFA评分、APACHEⅡ评分及住ICU时间、28 d死亡情况比较
注:①与对照组比较,P<0.05。
3 讨 论
脓毒症发生时,肠道是最易受损的器官之一,其通过肠道缺氧缺血、再灌注损伤、炎症因子释放、肠上皮细胞凋亡等机制,引起肠道屏障功能障碍、肠内细菌及毒素移位,使肠道成为脓毒症并发多器官功能不全最早受累的器官,而且使脓毒症病程进入恶性循环[5]。肠道炎症反应时,大量促炎性细胞因子在肠道中产生和释放,这些促炎性细胞因子通过肌球蛋白轻链激酶使肌球蛋白轻链磷酸化,从而下调紧密连接蛋白的生成或使其结构紊乱,最终使得肠屏障功能受损,紧密连接长度缩短、间隙增宽,通透性增加[6]。目前针对脓毒症肠黏膜屏障损伤的治疗主要包括控制感染和炎症,早期营养支持、补充谷氨酰胺、补充益生菌等,缺乏有效保护肠黏膜屏障的药物。因而寻找保护肠黏膜屏障功能的有效药物对缩短脓毒症的病程、改善预后具有重要意义。
小檗碱为中药黄连中提取的一种生物碱,口服后绝大部分以原型从粪便排出,具有抗菌、抗炎、抗肿瘤及调节血糖、血脂、免疫功能等作用[7-9]。近年来研究发现,小檗碱能减轻内毒素诱导的小鼠肠损伤、脓毒症性肠损伤,并抑制肠上皮细胞凋亡[10]。小檗碱与育亨宾联合能显著降低脓毒症小鼠的病死率;小檗碱单用可使脓毒症小鼠脾细胞Bim表达下调、线粒体Bax蛋白表达下降,且Caspase-9的活性降低,其可以通过抑制细胞内源性凋亡途径参与脓毒症诱导的脾细胞凋亡过程[11]。谈善军等[12]报道,腹腔暴露后脓毒症大鼠给予小檗碱干预后,血清D-乳酸水平、肠道FD4清除率和肠黏膜损伤Chiu评分均有所降低,且中、高剂量组最为显著。Gun等[13]研究发现,小檗碱可以降低内毒素小鼠模型的肠黏膜屏障通透性。
肠黏膜屏障功能监测包括肠黏膜通透性测定、细菌易位、血浆内毒素含量、肠黏膜组织学观察等。临床上准确检测肠黏膜屏障功能较困难,多通过DAO和循环D-乳酸评估肠道上皮的渗透性能,从而间接评估肠黏膜的屏障功能[14]。肠黏膜屏障受损时,DAO释放入血,导致血浆和肠腔DAO活性增高而肠黏膜内DAO活性降低,DAO在外周血中活性稳定,因此通过检测外周血DAO活性可以反映肠黏膜屏障功能。D-乳酸是肠道细菌代谢裂解的产物,肠道发生缺血性损伤时,肠道内细菌大量繁殖,产生大量D-乳酸同时肠黏膜细胞损伤,肠道通透性增加,D-乳酸进入血循环,因此测定D-乳酸可反映肠黏膜损伤程度和肠通透性变化。上述2种指标成为目前客观评价肠屏障功能较好的指标。
大量临床研究表明小檗碱口服后的主要不良反应为恶心、呕吐、腹泻等胃肠道反应和轻度的肾脏炎症等,但不良反应程度较轻,患者可以耐受,安全性较高[15]。因此本研究将小檗碱应用于脓毒症患者中,结果显示治疗第5天小檗碱组DAO活性及D-乳酸浓度均明显低于对照组;治疗第3天、第5天,小檗碱组的肠功能评分均明显低于对照组,肠内营养耐受率均明显高于对照组;治疗第7天,小檗碱组SOFA评分、APACHEⅡ评分均明显低于对照组;小檗碱组住ICU时间明显短于对照组;2组28 d病死率比较差异无统计学意义。提示小檗碱可以保护脓毒症患者肠黏膜屏障功能,提高肠内营养耐受率,为探索改善脓毒症相关性肠功能损害的预后提供了新思路。但由于研究条件的局限,本实验结果只能作为初步的经验参考,今后还需要加大样本量,进一步确认小檗碱的治疗效果,探讨小檗碱保护肠黏膜屏障的作用机制。
[]
[1] Rhodes A,Evans LE,Alhazzani W,et al. Surviving sepsis campaign:international guidelines for management of sepsis and septic shock:2016[J]. Crit Care Med,2017,45(3):486-552
[2] Mittal R,Coopersmith CM. Redefining the gut as the motor of critical illness[J]. Trends Mol Med,2014,20(4):214-223
[3] 钟祥,李应东. 小檗碱药理作用研究进展[J]. 亚太传统医药,2012,8(3):185-186
[4] Singer M,Deutschman CS,Seymour CW,et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA,2016,315(8):801-810
[5] Klingensmith NJ,Coopersmith CM. The gut as the motor of multiple organ? Dysfunction in critical illness[J]. Crit Care Clin,2016,32(2):203-212
[6] Saitoh Y,Suzuki H,Tani K,et al. Tight junctions. Structural insight into tight junction disassembly by clostridium perfringens enterotoxin[J]. Science,2015,347(6223):775-778
[7] 张梦媛,颜宇琦,秦洪琼,等. 小檗碱对甲型流感病毒FM1株感染小鼠肺中RLH信号通路的影响[J]. 中山大学学报:医学版,2016,37(6):834-839
[8] 王新,唐丽,杨造鹏,等. 小檗碱对DSS结肠炎小鼠发挥保护作用的实验观察[J]. 中成药,2016,38(5):1132-1135
[9] 朴美玉,曹海龙,杨博丽,等. 小檗碱对Apc(Min/+)小鼠肠道息肉组织肿瘤相关巨噬细胞的影响[J]. 中华消化杂志,2014,34(10):686-688
[10] 李红梅,邢云,唐翔诩,等. 小檗碱抑制脓毒症诱导的肠上皮细胞凋亡[J]. 中国病理生理杂志,2016,32(9):1660-1665
[11] 贾宝银,杨多猛,王媛,等. 小檗碱与育亨宾对脓毒症小鼠脾细胞凋亡的影响及其机制研究[J]. 中国病理生理杂志,2014,30(12):2206-2212
[12] 谈善军,虞文魁,林志亮,等. 小檗碱对腹腔暴露后大鼠肠黏膜屏障的影响[J]. 肠外与肠内营养,2015,22(5):291-294
[13] Gu L,Li N,Gong J,et al. Berberine ameliorates intestinal epithelial tight junction damage and down-regulated MLCK pathways in a mouse model of endotoxemia[J]. J Infect Dis,2011,203(11):1602-1612
[14] 盛鹰,谢晓洪,金文静,等. 早期药物干预对脓毒症患者肠功能障碍的防治及预后影响[J]. 中国急救医学,2015,35(4):304-308
[15] 赵锡艳,仝小林,赵林华,等. 黄连单方及其主要成分不良反应现代研究进展[J]. 中国中药杂志,2013,38(2):292-295
