VEGF受体3在人脑胶质母细胞瘤中的表达及作用
2018-05-29付朋岑泳村黄琴赵洪洋项炜
付朋 岑泳村 黄琴 赵洪洋 项炜*
(华中科技大学同济医学院附属协和医院: 1神经外科; 2康复科,湖北 武汉 430022)
胶质母细胞瘤(glioblastoma, GBM)为成年人最常见的原发性颅内肿瘤中恶性程度最高、预后最差的肿瘤[1]。脑胶质瘤的重要特征在于其血管增生程度[2]。肿瘤的血管依赖于分化抗原簇31(cluster of differentiation 31, CD31)阳性的内皮细胞的增殖分裂,扩展延长,内皮细胞产生的血管共同为胶质瘤细胞向邻近脑组织的外迁与侵袭提供桥梁[3]。大量研究表明血管内皮细胞生长因子(vascular endothelial cell growth factor, VEGF)广泛参与脑胶质瘤血管拟态的发生发展,但最早研发抗肿瘤血管中针对VEGF-A作用的贝伐单抗阿伐斯丁(Avastin)在临床试验结果中显示治疗效果欠佳[4]。同时,研究结果表明多种肿瘤中血管内皮细胞生长因子C及其受体3(vascular endothelial cell growth factor C/vascular endothelial cell growth factor receptor 3, VEGF-C/VEGFR-3)轴能够促进肿瘤血管的增殖与迁移[5-6]。而关于人脑胶质瘤中很少对VEGF-C/VEGFR-3的研究。本文旨在了解VEGFR-3在人脑胶质母细胞瘤中的表达,初步了解其参与人脑胶质母细胞瘤血管拟态作用,探讨其作为新的抗肿瘤血管治疗靶点的可能。
材料与方法
一、实验材料
实验于2014年6月至2015年8月在华中科技大学同济医学院附属协和医院中心实验室完成。所用人脑胶质瘤新鲜肿瘤组织来源于武汉协和医院神经外科手术切除标本,以上均征得患者家属知情同意。术后新鲜肿瘤标本行病理检查并根据世界卫生组织(World Health Organization, WHO)神经上皮组织肿瘤分级证实为WHO IV级胶质母细胞瘤。
二、内皮细胞的分离和培养
1.细胞的提取:取新鲜手术肿瘤标本除去血块,血管及电灼和坏死组织。磷酸缓冲盐溶液(phosphate buffer solution, PBS)漂洗2次去除血液残留;将肿瘤组织剪成1 mm×1 mm瘤块,加入0.25%胰蛋白酶中,置于37 ℃电磁恒温搅拌器上消化1 h,细胞悬液经70 μm的滤网过滤;在离心机转速1 500 r/min上离心5 min,弃上清并小心使用PBS洗涤沉淀两次除去残留胰酶,用5 mL含0.1%牛血清白蛋白(bovine serum albumin, BSA)的PBS重悬成单细胞悬液。
2.免疫磁珠分选:将CD31抗体(ABCM公司)4 μL与M-450免疫磁珠(Dynal公司)40 μL预先与0.1%BSA的PBS 4 mL混合震荡过夜,并洗脱未结合抗体后备用。将细胞细胞悬液与抗体CD31标记了的免疫磁珠液相混合;摇床4 ℃轻摇10 min,分离器中分离所得阳性细胞,用含0.1% BSA的PBS反复重悬和磁分离,如此反复进行3次后,将细胞重悬内皮细胞培养基(LONZA公司, EBM-2 Basal Medium 500 mL),计数板计数调整细胞密度5×103个/mL并培养在10 cm培养瓶中。
3.细胞体外传代培养: CD31阳性内皮细胞为贴壁细胞。 细胞培养在37 ℃,5% CO2培养箱中,根据细胞的接种数目、生长速度每3~4 d换液,贴壁在70%~80%时消化传代,用0.25%不含乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)胰酶消化2 min,显微镜下观察见大部分细胞脱落后,培养基轻吹打终止消化离心,弃上清,重悬传代。
三、脑胶质瘤组织染色
取新鲜的人脑胶质瘤肿瘤组织,用10%福尔马林固定后常规脱水处理并石蜡包埋。切片机上制取石蜡切片,每张切片厚度控制在10 μm。切片经脱蜡,水化;使用3%过氧化氢室温孵育消除内源性过氧化物酶的活性。用热修复法进行抗原修复暴露抗原决定簇;5%正常山羊血清(PBS稀释)封闭,室温孵育,加入适当比例一抗4 ℃条件下孵育过夜。加入适当稀释比例的生物素标记二抗孵育后;洗涤加入辣根过氧化物酶标记链霉卵白素37 ℃孵育;二氨基联苯胺(diaminobebzidine, DAB)显色,蒸馏水充分冲洗,复染,脱水透明后封片。显微镜下观察拍片。
四、酶联免疫吸附法
取经培养3 d后所得胶质瘤细胞系U87、U251的细胞培养液,用酶联免疫试剂盒测定。一抗包埋96孔板后4 ℃孵育过夜,加入待测培养液100 μL每孔至96孔板中后室温温孵育1 h。冲洗之后,加入检测抗体(生物素标记)每孔100 μL,室温下放置1 h后冲洗;加入100 μL酶结合工作液并避光孵育1 h冲洗后;加入100 μL显色底物液孵育20 min后终止。最后在450 nm波长下测量OD值。设空白对照和标准对照。
五、实时聚合酶链式反应
使用Trizol法提取人脑胶质瘤细胞和组织中RNA,最后加上0.01%焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)水20 μL备用。人VEGFR-3上游引物:5'-AGAG GAACCAGGAGGACAAG-3';下游引物:5'-CAGGTGCT GAAGGACATT-3'(330 bp);内参人β-actin上游引物:5'-ATCATGTTTGAGACCTTCAA-3';下游引物:5'-CATCTCTTGCTCGAAGTCCA-3'。PCR产物电泳、图像分析:取所得产物15 μL上样量在3%琼脂糖凝胶上电泳,60 V电压,15 min,2 h后图像分析鉴定。
六、血管成形功能测定
μ型孔板铺板:预先加入IV型胶原(Collagen IV)10 μL/孔,置37 ℃温箱中孵育1 h备用。制备悬浮细胞:取处于对数生长期状态良好的胶质瘤内皮细胞,弃培养基,PBS冲洗;用0.25%不含EDTA胰酶消化1~2 min至细胞悬浮加培养基终止消化,离心1 000 r/min,5 min;弃上清,培养基按照每孔5×105个细胞/50 μL的浓度分对照组和实验组两管悬浮;其中对照组未任何处理,实验组中按所悬浮液体积加入一定比例MAZ51吹打混匀(确保工作液中MAZ51浓度为7 μM),每孔50 μL体积植入预先备好的μ型孔板。培养及功能检测:将接种好的细胞板在37 ℃,5% CO2培养箱中培养,24 h后显微镜下观察拍片并使用软件分析不同实验控制因素下血管成形的功能。
七、划痕实验
用6孔板培养细胞做划痕实验,预先用记号笔在6孔板背后均匀划出约间隔0.5 cm的横穿过孔直线,每孔至少划5条线。取处于对数期生长良好的细胞,弃培养液,PBS冲洗,加入用0.25%不含EDTA胰酶消化至细胞悬浮,培养基终止消化,1 000 r/min,5 min;弃上清,培养基重悬为单个细胞并计数板计数;调节密度为约5×105个细胞/mL的浓度并分对照组和实验组两管;对照组未任何处理,实验组中加入MAZ51与细胞悬液吹打混匀(确保工作液中MAZ51浓度为7 μM)然后各向每孔加入1.5 mL细胞悬液。置于37 ℃,5% CO2温箱培养24 h后,用200 μL枪头在板底孔内作垂直于记号线划痕,使划痕线部位细胞脱落形成伤口;PBS冲洗3次,洗去脱落细胞,换液(其中实验组中为配置好的7 μM的MAZ51的工作液),记此时为0 h;并于24 h后进行拍照观察记录每一划痕和标记线交汇处的伤口宽度。
八、细胞增殖实验
细胞准备:取生长良好的细胞,弃培养液,PBS冲洗;胰酶消化,培养基终止;1 000 r/min,5 min;弃上清,培养基重悬为单个细胞并取样计数板进行计数。从而计算细胞悬液浓度并求出存活与死亡细胞数的比例,记录种板前实验组与对照组的活细胞数量。然后各向每个6孔板加入1.5 mL/孔细胞悬液,其中对照组的培养基未任何处理,实验组中加入MAZ51与细胞悬液吹打混匀(确保工作液中MAZ51浓度为7 μM)。置于37 ℃,5% CO2温箱培养24 h。24 h后将两组细胞重新消化细胞,并用同样方法再次计数。为控制实验最后计数误差,相同条件下进行实验重复3次。采用SPSS 17.0软件对数据进行统计学检验分析。
结 果
一、VEGF-C在人脑胶质母细胞瘤组织和细胞系中的表达
为明确VEGF-C在恶性胶质瘤细胞的表达,我们从人脑胶质母细胞瘤组织和胶质瘤细胞系U87中提取RNA,利用RT-PCR进行测定。如图1B示人脑胶质瘤细胞系U-87中,及人脑胶质母细胞瘤组织中均表达VEGF-A、VEGF-C、 VEGF-D;使用ELISA方法进一步测定胶质瘤细胞系U87、U251培养液中VEGF-C的分泌情况,如图1C示在胶质瘤细胞系U251、U87中VEGF-C都有表达的存在,但有量的差异。
二、VEGFR-3在人脑胶质母细胞瘤组织中的表达
为了解VEGF-C对应的受体VEGFR-3在脑胶质瘤中的表达,本文使用免疫组化技术显示人脑胶质母细胞瘤组织标本中VEGFR-3的表达。图2A中HE染色标本中可见人脑胶质母细胞瘤中细胞增生明显。相对图2B阴性对照,图2C中可见胶质母细胞瘤中CD31阳性表达血管内皮细胞提示肿瘤血管增生。图2D示VEGFR-3在人脑胶质母细胞瘤中广泛阳性表达,不仅表达肿瘤间质中细胞,而且表达于肿瘤血管内皮细胞中(如图2中箭头所示)。
三、VEGFR-3在胶质母细胞瘤血管内皮细胞中的表达
为明确VEGFR-3在胶质母细胞瘤血管内皮细胞中的表达,本实验将肿瘤血管内皮细胞使用磁珠分离法成功分离出CD31阳性表达的细胞并成功进行体外培养。进一步使用RT-PCR和免疫组化技术显示VEGFR-3在血管内皮细胞上的表达,如图3、4所示,在基因水平和分子水平均可见人脑胶质母细胞瘤肿瘤血管内皮细胞中VEGFR-3阳性表达。

图1 VEGF-C在人脑胶质母细胞瘤组织和细胞系中的表达
Fig 1 The expression of VEGFR-C in human glioblastoma tissues and cell lines
A: The treatment of glioma with Avastin was achieved by blocking the receptor sites of VEGF-A and the expression of VEGF-C/VEGFR-3 in human gliomas lead to the bad performance of Avastin; B: The expression of VEGF-A, VEGF-C and VEGF-D in human glioma cell line U87 and human glioblastomas was detected by RT-PCR; C: Different secretion of VEGF-C in cell lines U251 and U87 was detected by ELISA.
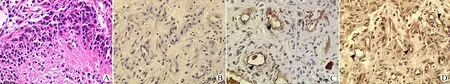
图2 VEGFR-3在人脑胶质母细胞瘤组织中的表达 (A: HE染色;B~D:DAB染色,×200)
Fig 2 The expression of VEGFR-3 in human glioblastoma tissues (A: HE; B~D: DAB,×200)
A: Glioblastoma tissues showed significant proliferation of cancer cells (HE); B: Negative control; C: CD31 positive expression of vascular endothelial cells; D: VEGFR-3 was widely expressed in human glioblastoma tissues and endothelial cells (IHC-P). Bar=50 μL.
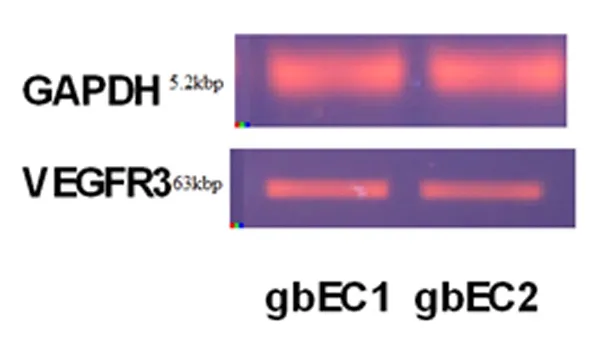
图3 VEGFR-3在胶质母细胞瘤血管内皮细胞中的表达
Fig 3 The expression of VEGFR-3 in human glioblastoma vascular endothelial cells by RT-PCR
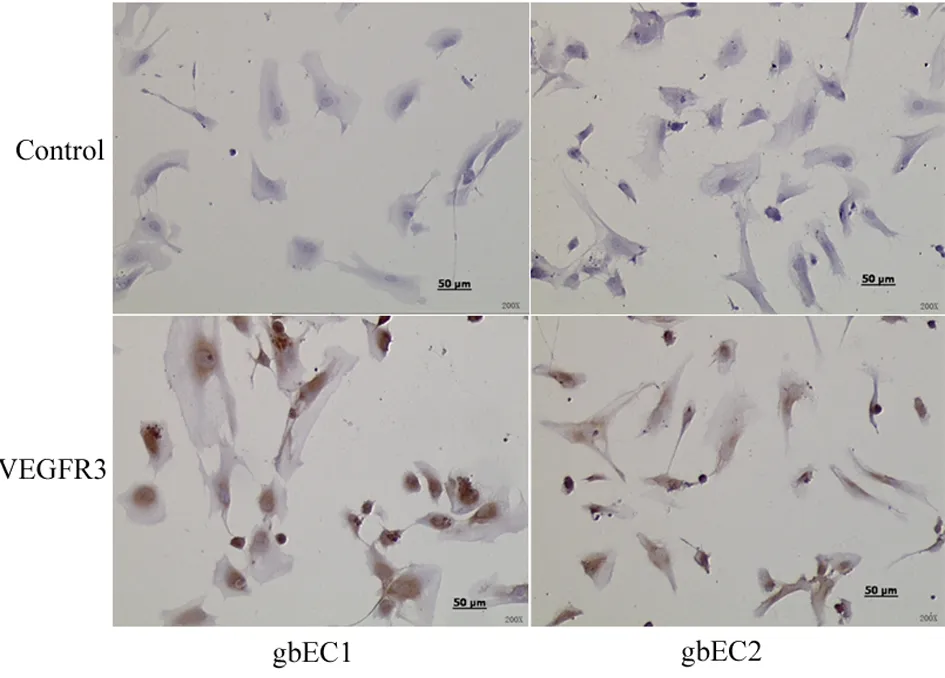
图4 VEGFR-3在胶质母细胞瘤血管内皮细胞中的表达 (HE, ×200)
Fig 4 The expression of VEGFR-3 in human glioblastoma vascular endothelial cells by immunohistochemistry (HE, ×200) Bar=50 μL.
四、VEGFR-3对肿瘤血管内皮细胞增殖、迁徙和血管成形能力的作用
为明确VEGFR-3在人脑胶质母细胞瘤肿瘤血管拟态中的作用,本实验在体外使用VEGFR-3特异性抑制剂MAZ51分别测试其对人脑胶质母细胞瘤血管内皮细胞的血管成形能力(图5A)、迁徙能力(图5B)和增殖(5C)。如图所示,7 μM的MAZ51可以明显抑制肿瘤血管内皮细胞的血管成形、迁徙和增殖能力。
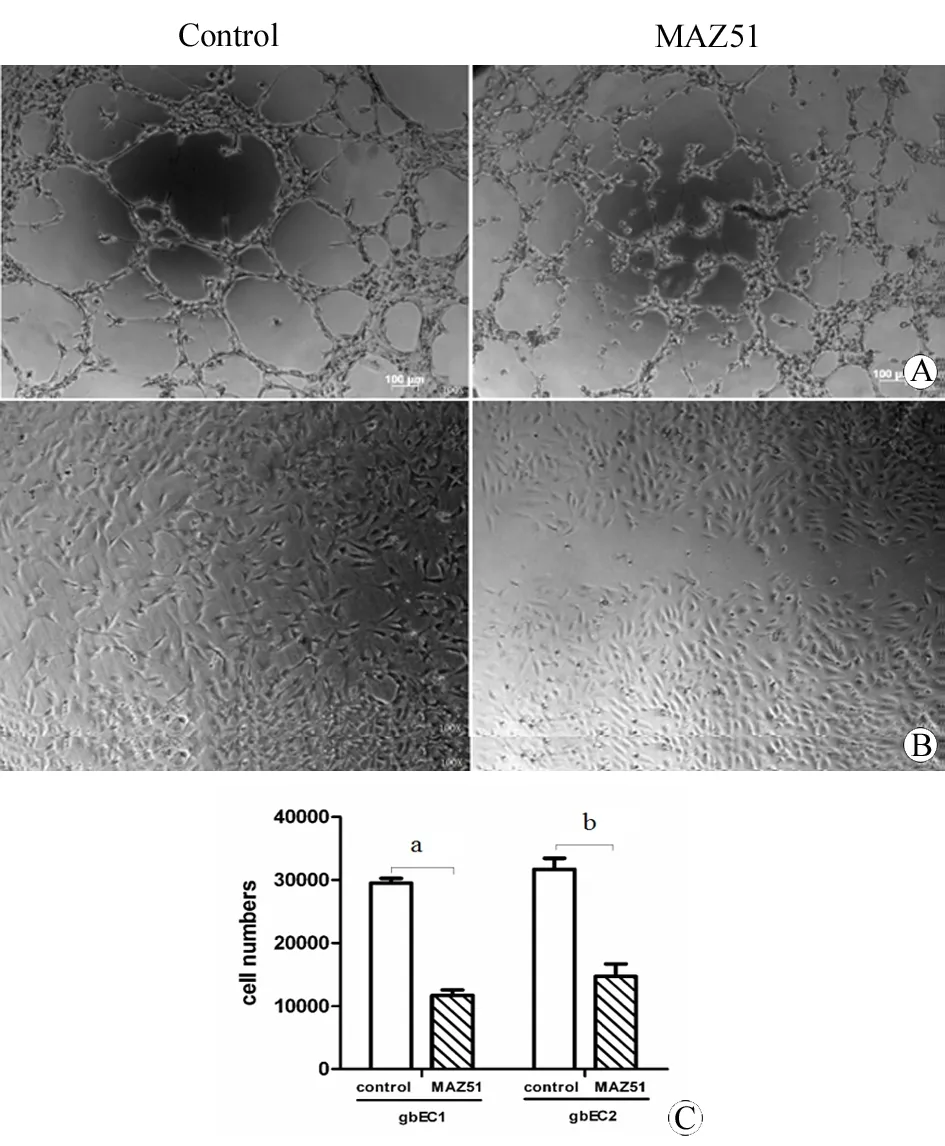
图5 VEGFR-3对肿瘤血管内皮细胞增殖、迁徙和血管成形能力的作用
Fig 5 Effect of VEGFR-3 on proliferation migration and formation of tumor vascular endothelial cells
A: VEGFR-3 with specific inhibitor MAZ51 could influence the proliferation of tumor vascular endothelial cells; B: VEGFR-3 with specific inhibitor MAZ51 could influence the migration of tumor vascular endothelial cells; C: VEGFR-3 with specific inhibitor MAZ51 could influence the tube formation ability of tumor vascular endothelial cells.
aP<0.05;bP<0.05,vscontrol group.
讨 论
血管内皮细胞生长因子为分泌性的糖蛋白,可以分为VEGF-A、PGF、VEGF-B、VEGF-C、BEGF-A五个亚型,其中VEGF-A已经被发现广泛表达于人脑胶质瘤并参与其发生发展的多个环节[4]。但是针对VEGF-A的单抗阿伐斯丁在人脑胶质瘤临床试验结果中显示疗效欠佳[5],而其他亚型在人脑胶质瘤中表达和作用仍有待进一步研究。研究表明VEGF-C/VEGFR-3同样广泛表达于人类肿瘤细胞和淋巴内皮细胞中,VEGF-C/VEGFR-3高表达和肿瘤的增殖与迁移密切相关,如图1A所示[6-8]。
本实验初步研究证实VEGF-C人脑胶质母细胞瘤组织中广泛表达,同时胶质瘤细胞系U87、U251均有表达,在U251细胞中VEGF-C的表达含量较U87表达量稍低,文献显示VEGF-C的高表达和人脑胶质瘤的预后不良相关[9]。我们的研究结果显示VEGFR-3广泛表达于胶质瘤间质中,同时其还表达于肿瘤血管内皮细胞上。符合了VEGFR-3的表达和脑胶质瘤的级别呈正相关的报道[10],我们在基因水平和分子水平证实了人脑胶质母细胞瘤分离所得的内皮细胞上VEGFR-3的阳性表达,为进一步研究VEGFR-3对该肿瘤发生发展提供了基础。
为进一步明确在脑胶质瘤血管拟态中VEGF-C/VEGFR-3的作用,我们使用VEGFR-3特异性阻滞剂MAZ51,结果显示MAZ51能有效降低肿瘤内皮细胞的侵袭,增殖和血管成形能力。关于具体的作用机制目前报道不一。在研究口腔鳞状癌细胞中显示MAZ51可抑制影响淋巴血管的形成和影响肿瘤血管内皮细胞;MAZ51的抑制作用呈现剂量和暴露时间依赖性,非细胞毒性剂量能通过作用VEGF-C/VEGFR-3结合体抑制细胞的增殖和迁徙能力[11]。
总之,本课题证实了VEGF-C在胶质母细胞瘤中表达,同时其对应的VEGFR-3在肿瘤内皮细胞中的表达,并在体外实验中使用VEGFR-3特异性抑制剂MAZ51证实了其可以抑制肿瘤血管内皮细胞的增殖,迁徙和血管成形能力,以上结果证实了VEGF-C/VEGFR-3参与人脑胶质瘤血管拟态的发生发展,同时提示了VEGF-C/VEGFR-3有可能成为人脑胶质瘤抗血管治疗新的靶点。
参考文献
1LOUIS D N, OHGAKI H, WIESTLER O D, et al. The 2007 WHO classification of tumours of the central nervous system [J]. Acta Neuropathol, 2007, 114(2): 97-109.
2付朋, 黄琴, 姜晓兵, 等. 人脑胶质瘤相关间充质干细胞的分离、鉴定及生物特性研究 [J]. 中华实验外科杂志, 2014, 31(9): 1889-1891.
3梅鑫, 张清平, 陈建良,等. 四通道荧光成像观察胶质母细胞瘤的血管起源 [J].中华神经外科疾病研究杂志, 2016, 15(3): 225-229.
4BAUMGARTEN P, BLANK A E, FRANZ K, et al. Differential expression of vascular endothelial growth factor A, its receptors VEGFR-1, -2, and -3 and co-receptors neuropilin-1 and -2 does not predict bevacizumab response in human astrocytomas [J]. Neuro Oncol, 2016, 18(2): 173-183.
5VEIKKOLA T, ALITALO K. VEGFs, receptors and angiogenesis [J]. Semin Cancer Biol, 1999, 9(3): 211-220.
6寿雪飞, 李士其, 张玉林, 等. 血管内皮生长因子及其受体表达和侵袭性垂体腺瘤血管生成关系的研究 [J]. 中华神经外科疾病研究杂志, 2005, 4(5): 395-398.
7MARCHIO S, PRIMO L, PAGANO M, et al. Vascular endothelial growth factor-C stimulates the migration and proliferation of Kaposi's sarcoma cells [J]. J Biol Chem, 1999, 274(39): 27617-27622.
8KODAMA M, KITADAI Y, TANAKA M, et al. Vascular endothelial growth factor C stimulates progression of hunman gastric cancer via both autocrine and paracrine mechanisms [J]. Clin Cancer Res, 2008, 14(22): 7205-7214.
9JENNY B, HARRISON J A, BAETENS D, et al. Expression and localization of VEGF-C and VEGF-3 in glioblastomas and haemangioblastomas [J]. J Pathol, 2006, 209(1): 34-43.
10GRAU S J, TRILLSCH F, HERMS J, et al. Expression of VEGFR3 in glioma endothelium correlates with tumor grade [J]. J Neurooncol, 2007, 82(2): 141-150.
11MATSUURA M, ONIMARU M, YONEMITSU Y, et al. Autocrine loop between vascular endothelial growth factor (VEGF)-C and VEGF receptor-3 positively regulates tumor-associated lymphangiogenesis in oral squamous cancer cells [J]. Am J Pathol, 2009, 175(4): 1709-1720.
