不同基质对‘寒香蜜’葡萄插条生长及VvLFY和VvAP1基因表达的影响
2018-05-26李晓鹏安颜颖上官凌飞房经贵
李晓鹏,安颜颖,上官凌飞,房经贵*
(1. 南京农业大学园艺学院/江苏省果树品种改良与种苗繁育工程中心,江苏南京 210095;2. 南京农业大学农学院,江苏南京 210095;)
开花是植物生命过程中的重要环节,它标志着植物从营养生长到生殖生长的转变,植物花发育机理也是植物发育生物学研究的热点之一。植物花发育过程大致可分三个阶段:开花决定(成花诱导)、花的发端和花器官的发育。开花决定阶段中,茎端分生组织形态上没有变化,但是在生理生化和基因表达层面发生了改变[1],影响这一阶段的因素主要是光照、温度、水分和营养条件等;花的发端指茎端分生组织向花分生组织转变,此过程由花分生组织决定基因控制[2];花器官的发育过程中,花器官特征基因决定花器官的特征,即决定花器官原基发育为各花器官。当植物内外环境达到合适的条件时,开花基因就会启动花分生组织特征基因,使植物从营养生长转变到生殖生长。
目前,人们通过对拟南芥和金鱼草等模式植物,进行了大量的关于成花过程相关基因的研究,对花发育分子机制网络已有一定的认识[3-4]。LEAFY(LFY)基因在花发育中起关键作用[3,5],是决定从营养生长向生殖生长阶段转变的重要元件[6-7],还参与维持花分生组织的正常功能、成花启动、防止花分生组织的逆转等功能[8-10]。但是该基因在植物组织内的表达并不呈现专一性[11]。APETALA1(AP1)基因即是花分生组织特征基因,属于MADS-box基因家族[12],AP1基因是LFY基因的直接靶基因[13],LFY基因靠激素调控路径正向调控AP1基因的表达[14-15],AP1基因在LFY基因的下游表达,又正向作用于LFY基因的表达。
葡萄是世界范围内的重要果树,葡萄花发育有很多独有的特点[16],研究其花器官的发育和果实的形成具有重要的理论和实践意义。葡萄成花周期在一年以上,春季花序从芽侧生分生组织(原基)发端,夏季进入休眠状态,翌年结束休眠产生花与果实[17-18]。扦插育苗一直是葡萄苗木繁殖的主要方法,具有育苗时间短、繁殖量大、操作简单、能保持品种优良性状等优点[19]。扦插过程中,葡萄插条的生长状况受到育苗基质的透水、透气能力和肥力影响,从而影响着葡萄苗木的育苗周期和经济效益。在前期的试验中发现,部分葡萄插条会长出花序,并且不同扦插基质之间的插条对比尤为明显。针对这一现象,本研究选用不同物理性质的基质,通过对不同基质条件下葡萄插条花发育关键基因(LFY和AP1)表达的研究和分析,找出扦插基质、成花关键基因和插条花序生长之间的关系,进而为葡萄花发育调控提供理论参考。
1 材料与方法
试验于2015年在南京农业大学园艺学院葡萄实验大棚中进行。
1.1 试验材料
供试品种为欧美杂种‘寒香蜜’(Reliance)。在2015年12月,选取生长健壮且粗度较为一致的枝条,修剪为1 m的插条,层积放置到2016年3月14日,修剪成含两个芽的插条用于试验。插条下剪口靠节斜剪,上剪口距离芽眼3 cm平剪,用清水浸泡插条24 h左右,NAA800倍液处理15 s后插于营养钵中。扦插基质主要采用珍珠岩、蛭石和营养土以及3种基质的混合物,扦插基质具体配比如表1所示。每种基质处理设4次重复,每重复20株,每处理共80株。
1.2 试验试剂
RNaseFree DNase酶Ⅰ、Ex-Taq酶、dNTPs、DNA Marker、SYBRGreenⅠ购自日本TakaRa公司;SuperScript Ⅱ反转录酶、RNaseOUTTM Ribonuclease Inhibitor购自Invitrogen公司。
1.3 荧光定量PCR引物设计
鉴于葡萄花发育相关基因的重要性,根据植物成花途径中有关基因的上下游关系、相互作用方式以及功能特点,上调基因VvLFY和花器官特异性基因VvAP1作为研究对象[20],选取UBI作为内参基因。引物序列(表2),由上海捷瑞生物技术有限公司合成。
1.4 RNA提取和cDNA合成
分别于2016年3月23日、3月29日、4月3日、4月9日4个时期采集插条嫩枝,液氮研磨成粉备用。葡萄RNA的提取采用CTAB法[21-22],参照RNase Free DNase酶Ⅰ说明书进行DNA消化。以总RNA为模板,参照SuperScriptⅡ反转录试剂盒说明书进行操作。cDNA放于-20 ℃下保存备用。
1.5 荧光定量PCR

表1 各处理基质配比用量(体积比)Table 1 Matrix combinations and amounts of different treatments (V/V)
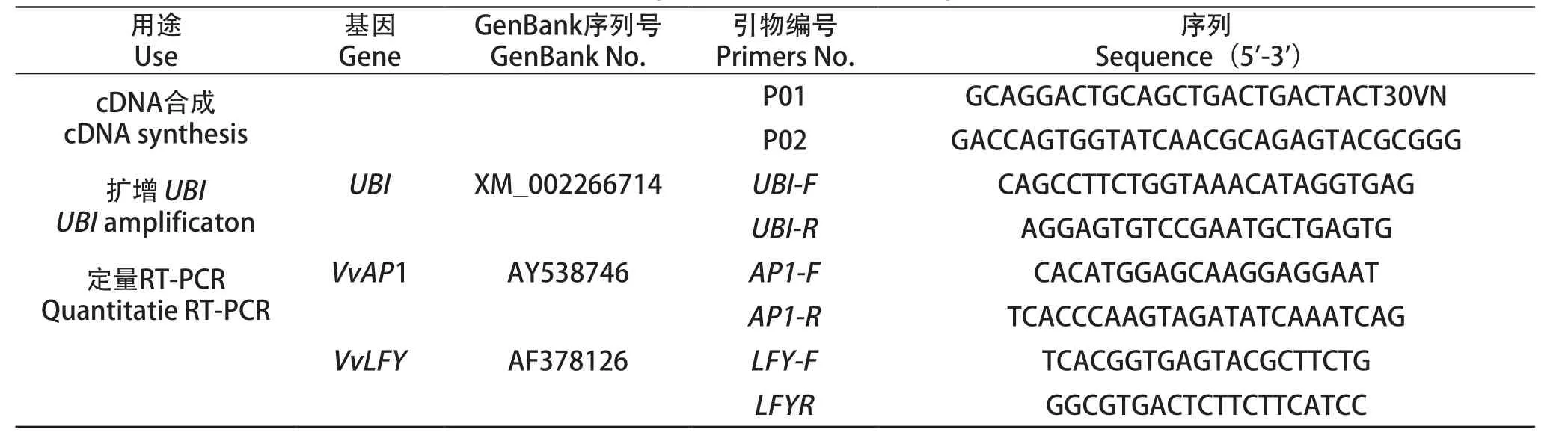
表2 引物用途及序列Table 2 Sequence information of primers
参照已有研究报道[23-25],分别取2 μg葡萄芽不同发育时期的cDNA为模板和相应的引物。利用Rotor-Gene荧光定量PCR仪进行实时荧光定量PCR,反应体系按SYBR GreenⅠ(TOYOBO, Osaka,Japan)说明书进行。优化后的反应条件为95 ℃预变性60 s;95 ℃预变性20 s;58 ℃预变性20 s;72 ℃预变性20 s;45个循环。利用溶解曲线分析引物的特异性扩增。每组3次重复。试验得到的数据用LinReg PCR和Rotor-Gene软件计算,利用相对定量分析法进行分析[26]。
2 结果与分析
2.1 不同基质插条生长状况
2.1.1 苗木扦插成活率
由于空间原因,每个处理的插条首先集中扦插于大营养钵中,2016年4月15日插条基本成活,再分装于小营养钵中。分装过程中对不同扦插基质的插条根系及地上部的生长情况进行测量,结果见图1和表3。由表3可知,6种基质中的插条成活率都在90%以上,基质A最低,成活率为91%,其它基质的成活率几乎为100%。
2.1.2 苗木新根数量及长度
由表3可知,4月15日,基质A和基质B插条根部大部分处于白色的愈伤组织阶段,基质B生有零星的新根。其它4种基质中,扦插条均长出大量的新根,新根数目由低到高的处理分别为基质D、基质C、基质E和基质F,平均数目分别为27.6条、31.4条、53.2条和70.3条。新生根系的长度与根数目呈正相关,根数目越多,新根越长。根平均长度最短的是基质B,为1.344 cm,最长的为基质F,为8.203 cm。
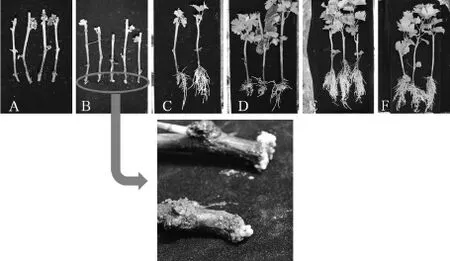
图1 4月15日各个处理扦插苗生长情况Figure 1 Growth status of grape cuttings on April 15
2.1.3 苗木新生枝条生长情况
4月15日,各处理新生枝条的长度由低到高的顺序为基质B、基质A、基质C、基质D、基质E和基质F,高度分别是1.7 cm、2.2 cm、3.6 cm、6.9 cm和7.7 cm,基质A和基质B、基质C和基质D的新生枝条和根系的生长量不成正比,基质A并没有长出新根,这种情况同样出现在基质C和基质D两种处理中,基质D的新根数量少于基质C,但其地上部的生长状况好于基质C。
到5月30日时,地上部的枝条生长情况与4月15日类似,基质A和基质B中的枝条长势矮小,其它4种基质长势健壮,新枝的高度和节间长度明显大于前两种基质的插条。
2.2 不同基质插条成花情况
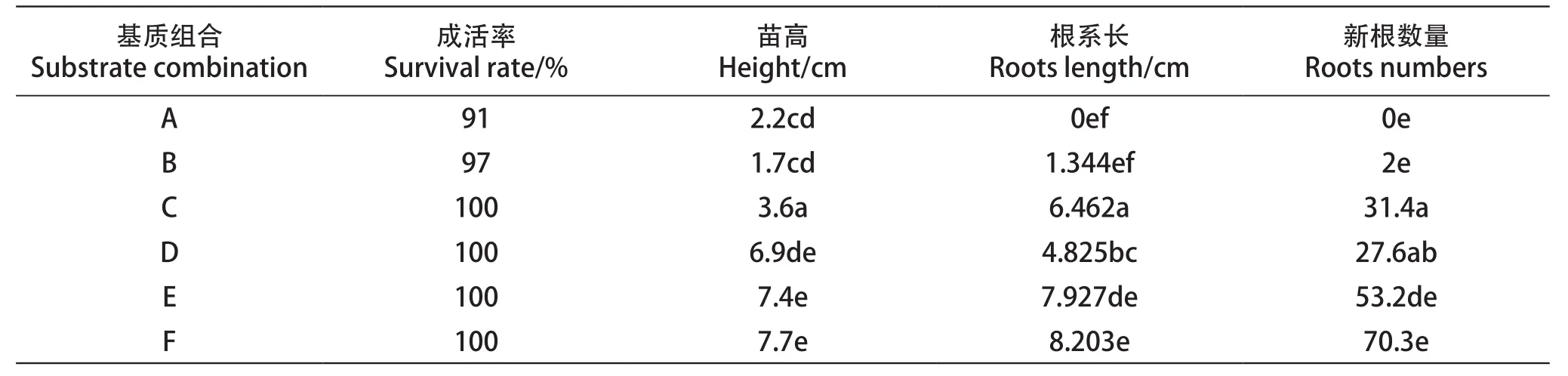
表3 4月15日不同基质组合的葡萄插条根系生长情况Table 3 Effect of different substrate combinations on roots development of grape cuttings on April 15
随着插条的生长,3月29日基质E和基质F开始出现花苞,但是花苞产生后持续了一个月左右,最终枯萎脱落。期间,花苞的大小并没有太大的变化。基质C、基质D的插条地上部发育远远好于基质A和基质B的插条,但是这4个处理并没有花苞出现。
2.3 不同基质成花基因的表达情况分析
根据葡萄插条的生长动态以及花苞抽生情况,选取了4个时期的插条为材料,进行成花基因的表达分析,基因分别为VvLFY和VvAP1。
VvLFY基因在不同基质的插条中的表达趋势如图2所示,不同处理的表达趋势不同。VvLFY在4个时期的表达整体呈下降趋势。基质E和F处理中,VvLFY在3月23日和3月29日的表达量明显高于其它4种处理,4月3日,基质E和F处理的基因表达量快速下降,表达量降低到与其它4种处理一致的水平。但是基质C和基质D的插条VvLFY表达量变化虽然不是特别明显,但是总体上的趋势呈先上升,在3月29日到达高峰,随后降低到一致水平。

图2 不同时期VvLFY基因的表达水平变化趋势Figure 2 The variation of expression levels of VvLFY at different periods
VvAP1基因在不同基质插条中的表达趋势如图3所示,VvAP1基因的表达呈先上升后下降的趋势,但是有花苞形成的基质E和F的插条的VvAP1表达量在3月23日、3月29日和4月3日的表达量高于其他基质中的插条,6种处理在4月3日的表达量处于高峰,4月9日各基质的插条VvAP1基因表达量下降,基质E和F的插条VvAP1表达量在6种基质处理中处于中游水平,而前期基因相对表达量最低的基质A和B处理的基因表达量在4月9日表达最高。
3 讨论
3.1 不同基质对葡萄扦插效果的影响
在扦插的过程中,选择适宜的基质是决定扦插苗生产是否健康的重要因素。前人的研究表明,基质的种类、不同配比对插穗生根影响差异显著[27],不同基质的配比对基质的理化性质改变明显[28]。适宜的基质与基质的含水量、孔隙度和pH密切相关,基质的含水量高,则降低基质的透气性,插穗下端易腐烂;基质的含水量过低,虽然增加了基质的透气性,但插穗可能因缺水导致枯萎现象。孔隙度的高低决定了基质中气相和液相的比例,从而影响插穗的成活率[29]。
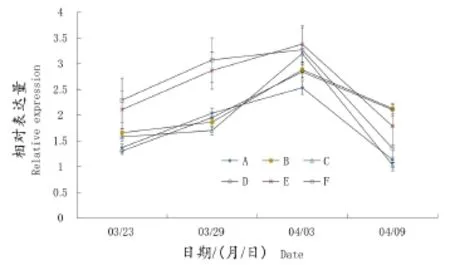
图3 不同时期VvAP1基因的表达水平变化趋势Figure 3 The variation of expression levels of VvAP1 at different periods
本试验的结果表明,在不同的基质中,插条的根系发育、地上部的生长均有明显的差异。从生根情况看,所有含珍珠岩的基质插条的生长状况良好,其中,基质E和基质F优于其他处理。插条的生根状况会受到基质性质的影响。混合基质中珍珠岩的持水性较差,但透气性较好,在经常浇水的前提下,有利于根系的形成,提高成活率和生根率;蛭石的吸水保水能力强,透气性比珍珠岩略差,含有蛭石的处理插条生长情况比珍珠岩略差;泥炭土的透气性最差,结果表明泥炭土对葡萄插条的生长不利。
3.2 不同基质对葡萄扦插成花的影响
在本研究的6个处理中,最终仅有两种处理的插条产生了花苞,两种插条的共同点是初期抽生出花苞,最终根系及新生枝条生长状况最好。高等植物的营养生长和生殖生长互相影响,扦插苗脱离母体,花苞的生长得益于枝条内储存的营养物质,基质E和F的插条所处的环境适宜,促进了花的分化,因此着生了花序,但在生长过程中由于营养生长的旺盛,给花序的营养供给不足,花序掉落,这也证明了扦插苗的营养生长占有主要的地位。
3.3 成花基因的表达对葡萄扦插成花的影响
LFY基因是花分生组织的特异性基因。开花诱导后,植物的LFY基因被激活,LFY在顶端花序分生组织的周边积累,然后在花原基进行强表达,接着在花发育过程中继续表达[5]。LFY基因对分生组织的营养性生长起抑制作用,使更多的分生组织细胞转向花原基的形成[13,30]。本试验中,各个处理的VvLFY基因均有一定量的表达,这表明葡萄插条全部具有成花的潜力。基质E和基质F的VvLFY基因表达量较高,促进了花序的形成,而其它处理的VvLFY基因表达量较低,对抽生花序的影响较低,最终由于插条的生长状况不良导致不能形成花苞。
在高等植物的成花过程中,AP1基因是花器官发育的相关基因,是一个关键的调控点,AP1基因的表达受LFY基因的调控。本研究发现VvAP1基因的表达量变化滞后于VvLFY的表达量,说明了VvLFY正向调节VvAP1的表达,但4月3日VvAP1仍然有一个表达高峰,此时的VvLFY的表达量已经降低,这表明VvAP1基因的表达受多种因素的调节,不仅仅限于VvLFY基因。VvAP1基因在插条的生长过程中呈先升高后降低的趋势,表明所有插条的花发育进程在萌芽期没有中断,只是由于环境因素并没有产生花序,下一步的研究将对此时期的芽结构进行观察分析。
4 结论
成花是高等植物最关键的生命过程,决定繁育的成败,由内在控制元件和外部环境共同控制[31-32]。本研究通过不同配比的基质扦插葡萄枝条,发现透气性更好的基质珍珠岩、蛭石中有利于插条的生长,也就是珍珠岩和蛭石混合基质或者珍珠岩基质中的插条表现更好,甚至能生长出花序,其他4种基质的插条新枝发育不良,不能生长出花序。成花关键基因LFY和AP1在插条嫩枝的表达说明外部环境能影响插条成花的潜力;虽然后两种基质处理的插条新枝生长良好,能促进花序形成,但由于营养物质过多消耗在根和新枝等营养器官,导致花序发育不良、脱落,说明生殖生长建立在营养生长的基础之上[33]。
[1] 雍伟东, 谭克辉, 许智宏, 等. 高等植物开花时间决定的基因调控研究[J]. 科学通报, 2000(5): 455-466.
[2] SESSIONS A, YANOFSKY M F, WEIGEL D. Patteming the floral meristem[J]. Seminars in Cell & Developmental Biology,1998, 9(2): 221-226.
[3] COEN E S, ROMERO J M,DOYLE S, et al. Floricula: a homeotic gene required for flower development in antirrhinum majus[J]. Cell, 1990, 63(6): 1311-1322.
[4] THOMAS J. Molecular and genetic mechanisms of floral control[J]. The Plant Cell, 2004(16): 1-17.
[5] WEIGEL D, ALVAREZ J, SMYTH D R, et al. LEAFY controls floral meristem identity in Arabidopsis[J]. Cell, 1992, 69(5): 843-859.
[6] BLAZQUEZ M A, SOOWAL L N, LEE I, et al. LEAFY expression and flower initiation in Arabidopsis[J]. Development,1997, 124(19): 3835-3844.
[7] BLAZQUE M A, WEIGEL D. Integration of floral inductive signals in Arabidopsis[J]. Nature, 2000, 404(6780): 889-892.
[8] SHANNON S, MEEKS-WAGNER D R. Genetic interactions that regulate inflorescence development in Arabidopsis[J]. The Plant Cell, 1993, 5(6): 639-655.
[9] MANDEL M A, YANOFSKY M F. A gene triggering flower formation in Arabidopsis[J]. Nature, 1995, 377(6549): 522-524.
[10] MIZUKAMI Y, MA H. Determination of Arabidopsis floral meristem identity by AGAMOUS[J]. Plant Cell, 1997(9): 393-408.
[11] WANG L L, LIANG H M, PANG J L, et al. Regulation network and biological roles of LEAFY in Arabidopsis thaliana in floral development[J]. Hereditas(Beijing), 2004, 26(1): 137-142.
[12] BECKER A, THEIßEN G. The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J]. Molecular Phylogenetics & Evolution,2003, 29(3): 464-489.
[13] RUIZGARCA L, MADUEO F, WILKINSON M, et al.Different roles of flowering time genes in the activation of floral initiation genes in Arabidopsis[J]. Plant Cell, 1997, 9(11): 1921-1934.
[14] WAGNER D, SABLOWSKI R W M, MEYERPWITZ E M.Transciptional activation of APETALA1 by LEAFY[J]. Science,1999, 285(5427): 582-584.
[15] PARCY F, NILSSON O, BUSCH M A, et al. A genetic framework for floral patterning[J]. Nature, 1998, 395(6702):561-566.
[16] MULLINS M G, BOUQUET A, WILLIAJRNS L E. Biology of the grapevine[M]. Cambridge: Cambridge University Press,1991.
[17] CARMONA M J, CHAB J , MARTNEZ-ZAPATER J M, et al.A molecular genetic perspective of reproductive development in grapevine[J]. Journal of Experimental Botany, 2008, 59: 2579.
[18] 刘丹, 孙欣, 慕茜, 等. 葡萄花芽发育相关基因在不同节位芽中的表达分析[J]. 中国农业科学, 2015, 48(10): 2007-2016.
[19] 李西萍. 葡萄硬枝扦插育苗技术[J]. 现代园艺, 2012(15): 26.
[20] 杨光, 岳林旭, 王晨, 等. 葡萄9个重要花发育相关基因在'藤稔'夏芽成花过程中的表达分析[J]. 果树学报, 2010, 27(6): 898-903.
[21] 张彦苹, 王晨, 于华平, 等. 适于葡萄不同组织RNA提取方法的筛选[J]. 西北农业学报, 2010, 19(11): 135-140.
[22] CHANG S, PURYEAR J, CAIRNEY J. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter, 1993, 11: 113-116.
[23] 王晨, 刘洪, 房经贵, 等. 基于 EST数据库的葡萄 APETALA2基因cDNA克隆及其表达分析[J]. 果树学报, 2010, 27(2): 207-212.
[24] 慕茜, 刘更森, 孙欣, 等. 冬季休眠后期藤稔葡萄花芽发育相关基因表达的分析[J]. 园艺学报, 2013, 40(5): 828-838.
[25] 任国慧, 陶然, 王晨, 等. 葡萄浆果着色与UFGT和MYBA基因表达量的关系研究[J]. 南京农业大学学报, 2013(4): 30-36.
[26] RAMAKERS C, RUIJERA J M, LEKANE DEPREZ R H,et al. Assumption-free analysis of quantitative real-time polymerasechain reaction (PCR) data[J]. Neuroscience Letters,2003, 339(10: 62-66.
[27] 张黎, 翟彦. 不同基质对月季半成熟枝扦插繁殖的影响[J]. 西北农业学报, 2005, 14(6): 112-115.
[28] 戴启金, 施新程, 金申燕, 等. 不同基质对美国侧柏扦插生根的影响[J]. 林业科学, 2004, 29(1): 53-54.
[29] 王月生, 周志春, 金国庆, 等. 基质配比对南方红豆杉容器苗及其移栽生长的影响[J]. 浙江林学院学报, 2007, 24(5): 643-646.
[30] COEN E S, CARPENTER R. The metamorphosis [J]. The Plant Cell, 1993(5): 1175-1181.
[31] ECKARDT N A. A time to grow time to flower[J].The Plant Cell, 2005(17): 2615-2617.
[32] ZHANG S, YANG C, PENG J, et al. GASA5, a regulator of flowering time and stem growth in Arabidopsis thaliana[J].Plant Molecular Biology, 2009, 69(6): 745-759.
[33] 李彦连, 张爱民. 植物营养生长与生殖生长辨证关系解析[J].中国园艺文摘, 2012(2): 36-37.
