葡萄砧木品种‘3309M’中microRNA的鉴定
2018-05-26朱旭东安颜颖王晨贾海锋房经贵
朱旭东,安颜颖,王晨,贾海锋,房经贵*
(1. 南京农业大学园艺学院/江苏省果树品种改良与种苗繁育工程中心,江苏南京 210095;2. 南京农业大学农学院,江苏南京 210095)
内源小分子RNA(small RNA,sRNA)是一类长度为19~25 nt的非编码的重要调节分子[1],其通过介导靶基因的裂解或抑制靶翻译在转录或转录后水平调控基因的表达[2]。microRNA(miRNA)是非编码的sRNA主要类型之一,广泛地分布在生物有机体内,该类sRNA分子在植物的生长发育及对环境胁迫的应答反应中起着重要作用。通常,它们的表达展示出不同种之间的发育时期或组织的特异性。越来越多的研究表明,miRNAs可能参与器官的发育、细胞的增殖与分化、细胞凋亡等重要过程[3]。有关miRNA的鉴定与其功能分析成为生物研究领域的重点。随着具有通量大、时间短、精确度高和信息量丰富等优势的下一代测序技术的高速发展并成为miRNA识别与鉴定的高效技术[4-5],葡萄属植物目前已在欧亚与欧美两个种群上开展了高通量测序,大批量的挖掘了葡萄种的miRNA[6-7]。但是,迄今为止,在葡萄砧木上尚无miRNA的相关研究报道。
砧木在葡萄种植中的应用起源于19世纪60年代,而随着葡萄优质砧木的推广与应用,葡萄嫁接栽培已成为世界各主要葡萄栽培生产国发展葡萄和葡萄酒产业的重要举措[8-9],并促进了葡萄产业更好地发展。因此,有关葡萄砧木生长发育机理的研究得到了重视。
葡萄砧木miRNA的研究对砧木抗性机理的认识具有重要意义。为此,本研究首次构建了葡萄砧木‘3309M’的miRNA文库,并通过高通量测序技术对该miRNA文库进行深度测序,分析了葡萄砧木miRNA文库的特点,以便于发现葡萄砧木中参与抗寒、抗病及果实品质发育的葡萄砧木特异的miRNA,为以后进一步分析其功能以及葡萄砧穗互作机制的研究奠定基础。
1 材料与方法
1.1 试验材料
葡萄砧木‘3309M’(Vitis labrusca)的叶片和根于2016年采自中国农业科学院郑州果树研究所,所有的样品采集后立即投入液氮带回实验室-80 ℃保存,用于总RNA的提取。
1.2 总RNA、sRNA的提取
RNA提取前所有的枪头、Eppendorf管均用0.1%DEPC水于37 ℃浸泡过夜,高压灭菌,烘干待用。其他玻璃器皿、研钵等按照分子克隆介绍的方法处理。分别按照如下的方法提取葡萄的叶、茎、卷须、花序、花和果实等器官的总RNA即按照SDS-酚法提取总RNA,并用4 mol/L的LiCl富集LMW RNA。
sRNA 3'末端加ploy(A)的反应总体系为25 µL:1.5µg sRNA模板;5 µL 5×buffer;2.5 µL 25 mmol MgCl2;0.25 µL ATP(100 nM/µL);1 µL PAP(2 U/µL);DEPC水补足。置于37 ℃,保温1 h,得到加ploy(A)尾巴的sRNA。加尾后的小分子RNA用酚/氯仿抽提,乙醇沉淀,后用适量的DEPC水溶解。
1.3 sRNA cDNA文库的构建和测序
1.3.1 5'端与3'端接头的连接
将“1.2 总RNA、sRNA的提取”获得的sRNA与1.3 μL 5'端接头(5'UCAGAGUUCUACAGUCCGACGA UC)、1 μL 10×T4 RNA连接酶缓冲液、1 μL T4 RNA连接酶、1 μL RNA酶抑制剂混合,于20 ℃反应6 h。随后以15% TBE-Urea PAGE胶进行分离纯化,将长度为40~60个核苷酸的条带切下,粉碎、洗脱、过滤和沉淀。得到的沉淀用无RNA酶的6.4 μL纯水溶解后,与0.6 μL 3'端接头(5'UCGUAUGCCGUCUUCUGCUUGU idT)、1 μL 10×T4 RNA连接酶缓冲液、1 μL T4 RNA连接酶、1 μL RNA酶抑制剂混合,于37 ℃反应6 h。连接产物用10% TBE-Urea PAGE胶分离纯化:将长度为70个核苷酸的条带切下并按前述步骤回收胶内的核酸。得到的核酸沉淀用5 μL无RNA酶的DEPC水溶解。
1.3.2 逆转录
将获得的连有3'端和5'端接头的sRNA产物用SuperScriptⅡ逆转录酶试剂盒进行逆转录。将4.5 μL产物与1.5 μL反转录引物(5'CAAGCAGAAGACGGC ATACGA)混合,于65 ℃加热10 min去除RNA二级结构,置于冰上。随后加入2 μL 10×第一链缓冲液、1 μL 10mmol/L dNTP、2 μL 100 mmol/L二硫苏糖醇(DTT)、1 μL RNA酶抑制剂,用DEPC水补至9 μL置于65 ℃温浴5 min,再加入1 μL SuperScriptⅡ反转录酶,在50 ℃下反应1 h。
1.3.3 cDNA文库的纯化和测序
获得的cDNA用15%的TBE-PAGE胶进行分离纯化,得到的cDNA用Agilent 2100测定其浓度,最终浓度稀释到10 nmol/L,用Illumina新一代测序仪1 G Genome Analyzer系统测序平台进行测序。
1.4 miRNA的鉴定
通过Base Callin将原始图像数据转换为序列数据,即为原始数据,并保存在“Fastq”文件中。为获得高质量的序列,从原始序列(raw reads)数据中去除接头序列和质量值Q≤5的碱基数占整个reads的50%以上的低质量序列,将获得的干净序列(clean reads)用于数据分析。通过比对miRBase 21.0库中葡萄物种的miRNA序列,得到保守的miRNA。针对miRNA的生物特征,利用Mireap软件进行非保守的miRNA鉴定。
miRNA表达量采用TPM(transcripts per million)校准,计算公式为:miRNA在文库中的归一化表达量=(Read count×106)/Total read count。若2个文库中任何1个miRNA基因的表达量在归一化后为0,则被修改为0.01;若2个文库中任何1个miRNA基因的表达量在归一化后小于1,则表示其表达量较低,不宜进行差异表达分析。根据公式“差异倍数(foldchange)=log2(根文库中miRNA的归一化表达量/叶片文库中miRNA的归一化表达量)”计算根与叶片文库miRNA表达的差异倍数。
1.5 miRNA靶基因的预测
将测得序列与NCBI数据库和Rfam10.0数据库中水稻和拟南芥的非编码RNA进行比对,并将sRNA的特异序列(unique reads)与miRBase 21.0数据库中所有植物的序列进行BLASTn比对,只有完全匹配的序列才是保守的miRNA。根据上述分析结果确定根和叶片文库中已知的miRNA数量,对已知的差异表达的miRNA进行分析,以foldchange≥1且FDR≤0.05作为miRNA显著差异表达的筛选条件。
对差异表达的miRNA利用psRNATarget进行靶基因预测,并使用BLAST软件将靶基因序列与NR(https://www.ncbi.nlm.nih.gov/)、Swiss-Prot(http://www.uniprot.org/)、GO(http://www.geneontology.org/)、COG(https://www.ncbi.nlm.nih.gov/COG/)、KEGG(http://www.kegg.jp/)、KOG(Clusters of orthologous groups for eukaryotic complete genomes)、Pfam(http://pfam.xfam.org/)数据库比对,获得靶基因的注释信息。
2 结果与分析
2.1 葡萄砧木sRNA的测序分析
高通量测序结果表明:葡萄砧木根和叶片文库中sRNA的原始序列分别有12 633 906和12 686 708条;去除接头序列、poly-A序列、≤18 nt序列和低质量序列后,干净序列分别有12 174 719和12 397 993条。在根和叶片文库中,sRNA的特异序列分别有2 772 037和1 676 324条(表1),其中,能与基因组比对成功的sRNA特异序列分别有949 559和633 100条,分别占各自sRNA特异序列总数的34.2%和37.8%。
由表1可见,葡萄砧木‘3309M’根和叶片文库中sRNA类型较多,包括miRNA、rRNA、snRNA、snoRNA、tRNA和重复序列。其中,根和叶片文库中未注释的sRNA序列分别有1 597 233和1 070 626条,分别占各自sRNA特异序列总数的57.62%和63.87%,在已注释的sRNA中,rRNA最多,分别占根和叶片文库中sRNA特异序列总数的31.61%和22.67%;其次为tRNA,分别占各自sRNA特异序列总数的3.53%和2.53%;miRNA较少,分别仅占各自sRNA特异序列总数的0.47%和0.81%。
2.2 葡萄砧木中保守miRNA的鉴定
为了鉴定葡萄中保守的miRNA,深度测序的小分子RNA序列与目前miRBase 21.0已知的植物保守miRNA的进行比对。结果表明,通过高通量测序鉴定了葡萄砧木根和叶片中文库分别包含104个和90个miRNA家族,共181条miRNA,并且这些鉴定的保守miRNA不同家族成员的数量存在重要的差异,其中大多数的家族仅包含几个成员,而有4个家族(miR169、miR395、miR171和miR156)却分别包含25、13、10和9个等多个成员,还有一些家族只有一个成员如miR162、miR168(图1)。不同miRNA家族的读数(read count)也存在剧烈变化,其变化范围从1到413 112次(图2)。在葡萄砧木保守miRNA中,miR159、miR166、miR396和miR482具有最多的读数,而另外10条miRNA家族的读数很低。这些miRNA表达丰度的剧烈变化,能够进一步反映出这些miRNA可能在葡萄砧木生长发育过程中的调控功能存在重要差异。

表1 葡萄砧木sRNA的组成Table 1 Composition of small RNA in grapevine rootstock
分析葡萄砧木保守miRNA长度的结果(图3)可知,长度为21 nt的miRNA所占比例最高,为69.45%;长度为20 nt和22 nt的miRNA所占比例相当,为11.63%和12.65%。总体上看,在葡萄砧木miRNA中,长度为20~22 nt的miRNA所占比例较高,为93.23%。

图1 葡萄砧木保守miRNA不同家族的成员数量Figure 1 Numbers of members of each conserved miRNA families in grapevine rootstock

图2 葡萄保守miRNA不同家族成员的读数Figure 2 Numbers of identified miRNAs in each conserved miRNAs family in grapevine rootstock
对葡萄砧木保守miRNA碱基偏好性进行分析(图4),结果表明,保守miRNA的第一个碱基偏好U,比例达到71%,说明该测序数据质量良好。
2.3 葡萄砧木中miRNA靶基因功能的预测
充分认识miRNA的靶基因将有助于我们深入理解miRNA调控基因的范围以及更广泛地描述这些miRNA功能的重要性。本研究根据miRNA与其靶基因之间近乎完全或完全的互补性以及一些靶基因预测的标准,预测了25个miRNA家族总共412个靶基因。将预测到的412个葡萄砧木根和叶片中miRNA的靶基因分别在Swiss-Prot、GO、KEGG、COG、KOG、Pfam和NR数据中进行功能注释,发现分别有354、147、95、190、248、373和412个靶基因得到注释。

图3 保守miRNA的长度分布图Figure 3 Size distributions of conserved miRNA sequences from grapevine rootstock

图4 miRNA各位点碱基分布图Figure 4 The bias distribution of nucleotide base in each position of miRNA sequences

图5 葡萄砧木中鉴定的保守miRNA靶基因的GO功能分类结果Figure 5 GO classification of conserved miRNA target genes identified in grapevine rootstock
利用GO功能分类对葡萄砧木根和叶片鉴定的保守miRNA靶基因进行功能预测(图5),结果表明:大部分差异表达miRNA靶基因的功能主要集中在生物学过程、细胞组分和分子功能3方面。细胞组分中,细胞、细胞部分和细胞器中的差异表达miRNA靶基因较多;在分子功能中,多数差异表达miRNA靶基因与结合功能及催化活性有关,与核苷酸结合有关的miRNA靶基因最多;在生物过程中,差异表达miRNA靶基因的功能主要集中在代谢过程(Metabolic process)、细胞过程(Cellular process)、单一生物过程(Single-organism process)、生物调节( Biological regulation)、响应刺激(Response to stimulus)等。
对葡萄砧木根和叶片中鉴定的保守miRNA靶基因进行KEGG通路富集分析(图6)。结果显示:富集差异表达miRNA靶基因数量最多的通路依次为核糖体(Ribosome)、植物激素信号转导(Plant hormone signal transduction)、氧化磷酸化(Oxidative phosphorylation)、RNA运输(RNA transport)、内质网蛋白质(Protein processing in endoplasmic reticulum)、糖酵解/糖异生(Glycolysis/Gluconeogenesis)等,富集的差异表达miRNA靶基因数分别为206、199、181、161、153和145个。
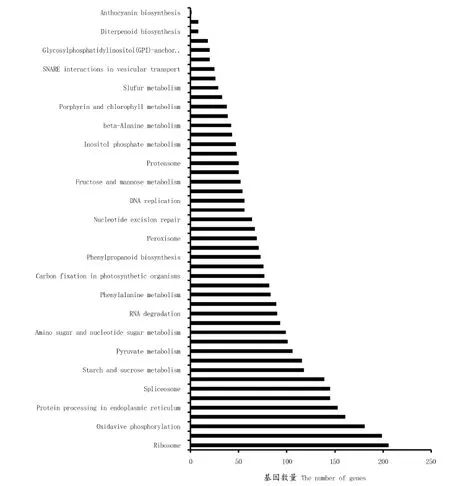
图6 葡萄砧木中鉴定的保守miRNA靶基因的KEGG通路富集分析的结果Figure 6 KEGG enrichment analysis of conserved miRNA target genes identified in grapevine rootstocks
依据同源基因的功能注释,我们把这些靶基因分为三大类:最大的一类是转录因子,其参与植物的生长、发育以及由营养生长到生殖生长的转型;第二大类是编码不同的酶蛋白基因,其主要涉及在不同的代谢过程如ATP、sulfurylase/APS kinase、ATP synthase等;第三类与免疫反应(NLA)、胁迫反应(CWP3)、抗病反应(NBSLRR)以及信号转导(ARF、AFB)等过程相关。大多数潜在的靶基因预测的功能与萝卜[10]、枳[11]、番茄[12]和拟南芥[13]等植物上鉴定的功能基本一致,表明不同植物中的靶基因的功能具有较高的保守性。
2.4 葡萄砧木根和叶片中显著差异表达miRNA的筛选
进一步的分析结果(表2)表明:以foldchange≥1且FDR≤0.05作为筛选条件,确定显著差异表达的miRNA家族有32个,共87条miRNA家族成员,其中54条miRNA在叶片文库上调表达(分别属于vvimiR167a、vvi-miR156f、vvimiR156i、vvi-miR156g、vvimiR172d等成员),33条miRNA下调表达。
2.5 葡萄砧木中新的miRNA的鉴定

表2 葡萄砧木根和叶片中显著差异表达miRNA的表达特性分析Table 2 Analysis on the expression of miRNA in grape rootstocks roots and leaves

续表2 Continued table 2
针对miRNA的生物特征,对于比对到参考基因组的序列,利用Mireap软件进行非保守的miRNA鉴定。测序序列比对到参考序列,通过碱基数目延伸,获得潜在前体序列,对前体序列进行miRNA结构预测,获得新的非保守的miRNA。本研究发现了104条新的miRNA,其前体均能够被折叠成稳定的二级结构。在这些新的miRNA中,有32条新的miRNA的5'末端以U开头,而另外53条miRNA的5'末端以A开头(在双链RNA中A互补于U),这些是miRNA序列结构的重要特征。所有这些分析结果有力地证明了葡萄砧木中新的miRNAs的真实性。
研究发现,新的非保守的miRNAs被测序到的读数(rea count)通常比保守的miRNA的数量要少,只有25条miRNA的序列的读数达到10次(表3)。这些结果与山葡萄和鲜食葡萄中的研究报道相一致[14-16],大多数新的特异的miRNA通常比保守miRNA的表达水平低,且具有时空的特异性。基因组定位分析表明,这些新的miRNA均定位在葡萄第10、11、12和13条染色体,分别有24、22、26和32条miRNA,可以看出其在染色体上的分布是不均匀的。
3 讨论和结论
3.1 葡萄砧木保守miRNA的鉴定
大多数成熟的miRNA在不同植物中具有较高的保守性[1,3]。这能为预测不同植物中的同源miRNA提供有力证据。研究发现山葡萄与野生葡萄等不同品种中保守的和新的miRNA的数量与种类具有显著差异[14-16],表明葡萄的不同品种、不同组织中miRNA文库存在自身特点,有必要在不同葡萄种质的不同组织中开展高通量测序,以便能够发现更多种类和数量的miRNA。

表3 葡萄砧木中鉴定的新的miRNATable 3 Novel miRNA identified in grapevine rootstock
本研究构建了葡萄砧木品种‘3309M’根和叶组织的小RNA文库,鉴定了181条保守的和104条非保守的miRNA。葡萄砧木根和叶片中共有32个miRNA家族共87条显著差异表达,其中vvi-miR167a、vvi-miR166b、vvimiR162和vvi-miR156等54条miRNA上调表达,其余33条miRNA下调表达。不同植物中的miRNA存在一定差异。本研究中,葡萄砧木根和叶片中miRNA长度均以21 nt为主。相关研究结果显示,萝卜中的miRNA长度以21 nt和24 nt为主[10];枳和番茄的miRNA长度以21 nt为最多[11-12],而拟南芥中的miRNA长度则以24 nt为最多[13],但与鲜食和野生葡萄中miRNA的长度分布一样[14-16],表明不同植物的miRNA长度存在差异,可能与植物种类及参与miRNA生物合成的酶不同有关。
3.2 葡萄砧木保守miRNA的靶基因
为了鉴定植物miRNA的功能,进一步确定其靶基因非常必要。目前,植物上靶基因预测最有效的工具是基于miRNA与靶基因高度同源性的生物信息学预测方法。本研究利用生物信息学方法预测了葡萄砧木中保守miRNA的靶基因,发现预测的大多数靶基因是植物特异的转录因子,如AP2、NAC、SBP、NF-YA、GRAS、Zincnger(C2H2)和ARF等,与鲜食葡萄和野生葡萄中miRNA靶基因类似,表明miRNA功能的保守性。本研究中,葡萄砧木根和叶片中miRNA靶基因的功能主要集中在植物激素信号转导、氧化磷酸化、RNA运输、内质网蛋白质运输、糖酵解/糖异生等方面,这可能与葡萄砧木的抗性较强有关。葡萄砧木miRNA的靶基因功能注释表明它们在葡萄的生长、发育及对环境胁迫反应的应答过程中起着重要作用,开展进一步的研究有助于更广泛地理解miRNA在葡萄砧木生长发育中的功能。
3.3 葡萄砧木中新的miRNA的预测
本研究根据miRNA的特征如前体典型的发夹结构等特点,共预测了104条非保守的新的miRNA。所有这104条新的miRNA的前体都能够折叠成典型的发夹结构并满足miRNA的预测标准。只有25条新的miRNA的读数达到10次以上。所有这些结果证明,这104条新的miRNA在葡萄砧木中确实存在。新的miRNA在葡萄砧木特定组织的特异表达能够为研究它们的生理功能提供重要信息。葡萄砧木特异的miRNA在其生长发育过程中的详细功能仍有待我们全面深入地阐述。
[1] PHILLIPS J, DALMAY T, BARTELS D. The role of small RNAs in abiotic stress[J]. FEBS Letters, 2007, 581(19): 3592-3597.
[2] LI Y, ZHENG Y, ADDO-QUAYE C, et al. Transcriptome-wide identification of microRNA targets in rice[J]. Plant Journal, 2010,62(5): 742-759.
[3] ZENG C Y, WANG W Q, ZHENG Y, et al. Conservation and divergence of microRNAs and their functions in Euphorbiaceous plants[J]. Nucleic Acids Research, 2010, 38(3): 981-995.
[4] YU H P, SONG C N, JIA Q D, et al. Computational identification of microRNAs in apple expressed sequence tags and Validation of their precise sequences by miR-RACE[J]. Physiologia Plantarum, 2011, 141(1): 56-70.
[5] SONG C N, WANG C, ZHANG C Q, et al. Deep sequencing discovery of new and conserved microRNAs in trifoliate orange(Citrus trifoliate)[J]. BMC Genomics, 2010(11): 431.
[6] PANTALEO V, SZITTYA G, MOXON S, et al. Identification of grapevine microRNAs and their targets using high-throughput sequencing and degradome analysis[J]. Plant Journal, 2010,62(6): 960-976.
[7] MICA E, PICCOLO V, DELLEDONNE M, et al. Correction:high throughput approaches reveal splicing of primary microRNA transcripts and tissue specific expression of mature microRNAs in Vitis vinifera[J]. BMC Genomics, 2010(11): 109.
[8] 袁园园, 姚玉新, 王文军, 等. 葡萄嫁接栽培研究现状与展望[J].中外葡萄与葡萄酒, 2012(6): 57-61.
[9] RASHEDY A. Response of two grape rootstocks to some salt tolerance treatments under saline water conditions[J]. Journal of Horticultural Science & Ornamental Plants, 2010, 2(2): 93-106.[10] SUN X C, XU L, WANG Y, et al. Identification of novel and salt responsive miRNAs to explore miRNA-mediated regulatory network of salt stress response in radish (Raphanus sativus L.)[J].BMC Genomics, 2015(16): 197.
[11] ZHANG X N, LI X, LIU J H. Identification of conserved and novel cold-responsive microRNAs in trifoliate orange (Poncirus trifoliate (L.) Raf.) using high-throughput sequencing[J]. Plant Molecular Biology Reporter, 2014, 32(2): 328-341.
[12] MOXON S, JING R C, SZITTYA G, et al. Deep sequencing of tomato short RNAs identifies microRNAs targeting genes involved in fruit ripening[J]. Genome Research, 2008, 18(10):1602-1609.
[13] KASSCHAU K D, FAHLGREN N, CHAPMAN E J, et al.Genome-wide profiling and analysis of Arabidopsis siRNAs[J].PLoS Biology, 2007, 5(3): e57.
[14] WANG C, WANG X, NICHOLAS K, et al. Deep sequencing of grapevine flower and berry short RNA library for discovery of novel microRNAs and validation of precise sequences of grapevine microRNAs deposited in miRBase[J]. Physiologia Plantarum, 2011. 143(1): 64-81.
[15] WANG C, HAN J, LIU C, et al. Identification of microRNAs from Amur grapes (Vitis amurensis Rupr.) by deep sequencing and analysis of microRNA variations with bioinformatics[J].BMC Genomics, 2012(13): 122.
[16] WANG C, HAN J, NICHOLAS K, et al. The characterization of target mRNAs for table grapevines miRNAs with an integrated strategy of modified RLM RACE, PPM RACE and qRT-PCRs of cleavage products[J]. Journal of Plant physiology, 2013,170(10): 943-957.
