魔芋粉对小鼠急性酒精性胃黏膜损伤和慢性酒精性肠损伤的影响
2018-05-25沈玖君邓利玲帅天罡
沈玖君,邓利玲,2,帅天罡,任 旺,邓 利,3,钟 耕,*
酒在中国有着悠久的历史,已经成为人们日常生活和社交活动中不可缺少的。随着社会经济的高速发展,酒的消耗不断增加,一次过度或长期大量地饮酒会损害身体健康[1]。有研究表明,长期过度饮酒会造成肝损伤[2]、胃损伤[3]、肠损伤[4]。目前,对酒精性疾病预防的方法主要是戒酒[5]、使用化学合成物[6]、草本植物及天然提取物[7]等。梁桂宁等[8]采用小鼠急性酒精性胃损伤造模,发现紫菜多糖具有保护酒精性胃损伤的作用;蔡夏夏等[9]研究发现膳食5′-核苷酸能够促进慢性酒精性肠损伤的肠道稳态。如今预防酒精性脏器损伤的天然产品具有良好的市场前景[10]。
魔芋粉是优良的膳食纤维,在我国魔芋已经被界定为普通食材,魔芋在绿色食品、疾病防治领域都具有良好的应用和开发[11]。魔芋葡甘聚糖(konjac glucomannan,KGM)是魔芋粉的主要组成成分[12],KGM具有减肥[13]、降低血糖[14]、调节肠道功能[15]、增强免疫功能[16]等多种药理功能作用。目前已有研究表明KGM在酒精性肝病中起到了较好的预防保护作用,如杨芳等[17]用KGM喂食酒精性脂肪肝大鼠,结果表明KGM通过发挥其抗氧化应激作用可有效地预防大鼠酒精性脂肪肝;但目前鲜有研究报道魔芋粉对酒精性胃和肠损伤的影响。因此本研究将通过建立急性酒精性胃黏膜损伤和慢性酒精性肠损伤的实验模型,来探索魔芋粉对酒精性小鼠胃和肠损伤的保护作用及可能的机制,以期为开发天然的预防酒精性脏器损伤的食品提供理论支撑。
1 材料与方法
1.1 动物、材料与试剂
实验动物为昆明种清洁级小鼠,雄性,体质量(20±2)g,由腾鑫生物技术有限公司提供,动物合格证号:SCXK-(渝)2012-0011,检疫后备用。小鼠饲料、垫料由腾鑫生物技术有限公司提供。
魔芋粉(KGM质量分数为93%) 重庆康家客食品有限公司;乙醇体积分数56%红星二锅头白酒 北京红星股份有限公司。
一氧化氮(nitric monoxide,NO)、超氧化物歧化酶(superoxide dismutase,SOD)、前列腺素E2(prostaglandin E2,PGE2)试剂盒 郑州唯尔生物科技有限公司;荧光定量聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒、MiniBEST Bacterial Genomic DNA Extraction Kit 日本TaKaRa公司;异丁酸、戊酸、正丁酸、乙酸标准品 上海阿拉丁试剂公司。其他试剂均为国产分析纯。
1.2 仪器与设备
低温离心机 德国Sigma公司;HIMG酶标仪基因有限公司;DHG-9070A电热恒温鼓风干燥箱上海齐欣科学仪器有限公司;EG1150H切片机 德国Leica公司;TKY-BMB包埋机 湖北泰康医疗设备有限公司;H550L高分辨率数码照相机 日本尼康公司;LightScanner32 Real-Time PCR仪 美国Idaho公司;Rtx-wax毛细管柱 美国RESTEK公司;GC-2010气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 动物分组、给药及取材
饲养环境:动物饲养房温度保持在22~24 ℃,相对湿度60%~70%,定时通风换气,自然明暗周期12 h(开灯8:00~20:00)。恒温恒湿,标准饲料,自由饮水。将100 只昆明种小鼠适应性喂养一周后,随机分为魔芋粉低(170 mg/kg mb)、中(240 mg/kg mb)、高(400 mg/kg mb)剂量组及空白组和模型组,每组各10 只。实验前对各组小鼠进行称量、标号并记录。
急性酒精性胃黏膜损伤小鼠造模的方法参照文献[18],任选5 组小鼠进行实验,魔芋粉各剂量组小鼠分别按0.4 mL/20 g mb灌胃魔芋粉溶液7 d,第7天各组给药后禁食不禁水12 h,于第8天,魔芋粉各组分别按0.2 mL/10 g mb给药,30 min后,模型组和魔芋粉各组均以14 mL/kg mb灌入乙醇体积分数56%的白酒。1 h后所有小鼠均颈椎脱臼处死,解剖取胃组织置于-80 ℃储存,用于相关指标的测定。
慢性酒精性肠损伤小鼠的造模方法参照参考文献[19],任选5组小鼠进行实验,魔芋粉各剂量组按0.2 mL/10 g mb灌胃,0.5 h后模型组和魔芋粉组先以0.08 mL/10 g mb连续灌胃3 d,再以0.10 mL/10 g mb连续灌胃4 d,再以0.12 mL/10 g mb连续灌胃5 d,再以0.14 mL/10 g mb灌胃至实验结束前一天,最后以0.15 mL/10 g mb冲击性灌胃,空白组和模型组灌胃相同体积的生理盐水。实验动物每日灌胃一次,连续灌胃5 周。小鼠颈椎脱臼处死后,解剖取出肠道,收集盲肠内容物置于-80 ℃保存用于指标测定,并取约1~2 cm肠段用于制备组织切片。
1.3.2 胃黏膜损伤溃疡指数的测定
把胃平铺在滤纸上,观察胃大体溃疡、糜烂出血点的大小、形状以及发生部位,并按Guth等[20]的标准计算溃疡指数I和溃疡抑制率A,按溃疡或糜烂面积大小给予计分。1)点状出血:出血性糜烂小点或胃黏膜缺损小于1 mm,称点状溃疡,每3 个点状溃疡计1 分;2)条状出血:用游标卡尺测量溃疡面最大长径和垂直于最大长径的最大宽径,计算两者的乘积,宽为1 mm者每毫米长为1分;宽为2 mm者每毫米长为2 分;宽为3 mm者每毫米长为3 分;3)点状和条状出血计算值之和即为溃疡指数[21]。按下式计算溃疡抑制率A。

式中:I1、I2分别为模型组、给药组的平均溃疡指数。
1.3.3 胃和肠道组织病理切片观察
胃和肠道组织病理切片观察参照文献[22]。将各组胃、肠组织放入体积分数4%的甲醛溶液固定,用流水冲洗洗去固定液,将组织移入体积分数70%的酒精溶液中保存。将组织依次置于不同浓度的酒精中梯度脱水至组织块完全脱水透明,并经包埋、切片、染色于数码显微镜下观察胃和肠道组织的细胞病理改变。
1.3.4 胃组织匀浆中SOD、PGE2活力及MDA、NO含量的测定
胃组织匀浆制备方法参照参考文献[23]。将胃组织(0.3~0.4 g)称质量后放入10 mL的小烧杯中。用移液管取质量分数0.86%的冰生理盐水,总量为所取组织质量的9 倍,用剪刀尽快剪碎组织,剪碎的组织倒入匀浆管中,使用匀浆机将组织充分研碎,整个过程均在冰上进行。将制备好的组织匀浆用离心机以3 000 r/min离心15 min,取上清液,置于4 ℃用于各项指标的测定。
采用酶联免疫吸附法测定SOD、PGE2的活力及NO含量;用TBA法测MDA含量。步骤严格按照试剂盒说明书。
1.3.5 盲肠内容物游离氨含量的测定
称取0.3 g盲肠内容物加入10 倍质量的双蒸水,置于漩涡振荡仪上涡旋混匀后置于离心机上4 000 r/min离心10 min,静置,取上清液测定游离氨含量。吸取上述上清液1.0 mL,依次加入配制的Ⅰ溶液(含有0.001 mol/L亚硝基铁氰化钠的0.5 mol/L苯酚)1.0 mL和Ⅱ溶液(含有0.03 mol/L次氯酸钠的0.625 mol/L氢氧化钠溶液)1.0 mL,混合上述溶液,于60 ℃下反应5 min,再在625 nm波长处测定其吸光度。
1.3.6 盲肠内容物SCFA含量的测定
盲肠内容物中短链脂肪酸(short-chain fatty acids,SCFA)的提取方法参考文献[24]。准确称取各实验组小鼠的盲肠内容物0.2 g,溶于2.0 mL无菌蒸馏水中,置于漩涡振荡仪上使其成均匀悬浮液静置10 min,再4 000 r/min离心15 min。吸取上清液1.0 mL置于5 mL离心管中,再加入100 μL体积分数50%的硫酸溶液和1.0 mL无水乙醚,振荡混匀并密封置于4 ℃冰箱内静置30 min,移取上层乙醚溶液进行气相色谱分析。
气相色谱条件:用Rtx-wax柱(30 m×0.25 mm,0.25 µm)进行实验,进样量为1 μL;进样口温度200 ℃;进样方式:分流;柱流量0.91 mL/min,柱箱温度100 ℃、平衡时间0.5 min;8 ℃/min升温至180 ℃、保留时间1 min;20 ℃/min升温至200 ℃、保留时间5 min;检测器温度220 ℃;氢气流量30.0 mL/min,尾吹流量20.0 mL/min,空气流量300 mL/min。
在气相色谱条件下进样测定,5 种SCFA的基本性质见表1;5 种SCFA的标准品色谱图见图1。
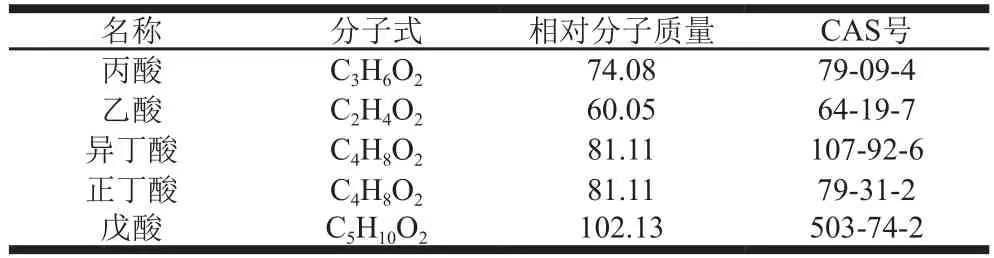
表1 5 种SCFA基本性质Table 1 Basic properties of 5 SCFAs
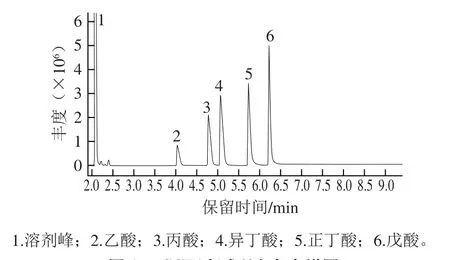
图1 SCFA标准品气相色谱图Fig. 1 GC profile of SCFA standards
1.3.7 盲肠内容物微生物菌群的测定
1.3.7.1 细菌基因组DNA的提取
称取盲肠内容物0.2 g,加入无菌磷酸盐缓冲溶液3 mL,3 000 r/min离心5 min,提取上清液,12 000 r/min离心3 min,收集沉淀,弃上清液。再按照粪便基因组DNA提取试剂盒提取细菌基因组总DNA,经微量紫外分光光度计测得A260nm/A280nm值在1.8~2.0之间,说明纯度较高,可作为荧光定量PCR的模板。
1.3.7.2 荧光定量PCR
盲肠内容物微生物含量测定在定量PCR仪上进行,采用SYBR GreenⅠ染料法,反应体系为20 μL,PCR扩增反应体系如表2所示。反应条件为:95 ℃ 1 min预变性后,双歧杆菌再进行95 ℃、5 s,56 ℃、15 s,72 ℃ 30 s,共40 个循环;乳酸菌、肠杆菌和肠球菌再进行95 ℃、5 s,65 ℃、15 s,72 ℃、30 s,共40 个循环。循环结束后就进入溶解,溶解程序为:95 ℃、5 s,65 ℃、15 s,95 ℃、0.1 ℃/s降温。相关引物见表2。细菌数量的计算参照骞宇[25]的方法,扩增结果用LightScanner 32 Real-Time PCR仪进行分析。反应体系为:10 μL SYBR Green Realtime PCR Master Mix、0.8 μL上游引物和下游引物、2 μL DNA模板、6.4 μL双蒸水。

表2 细菌的PCR扩增引物序列Table 2 Primer sequences used for PCR amplification of bacteria genomic DNA
1.4 数据统计分析
采用SPSS 18.0软件进行统计处理,单因素方差分析法进行显著性分析,测定结果均以 ±s表示。当P<0.05时有统计学意义,认为有显著差异。
2 结果与分析
2.1 魔芋粉对小鼠胃黏膜溃疡指数、胃组织抗氧化因子、黏膜保护因子含量的影响
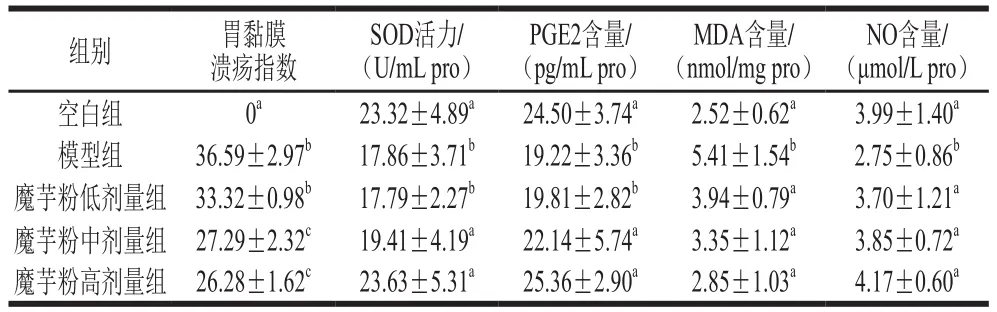
表3 魔芋粉对小鼠组胃黏膜溃疡指数、胃组织抗氧化因子、黏膜保护因子的影响(n=8)Table 3 Effect of konjac powder on gastric mucosal ulcer index,antioxidant factors and defensive function (n= 8)
如表3可知,模型组小鼠溃疡指数与空白组差异较大,模型组小鼠胃黏膜组织中MDA含量显著升高(P<0.05),SOD活力显著降低(P<0.05),模型组小鼠胃黏膜中NO、PGE2含量显著低于空白组小鼠(P<0.05),说明胃黏膜损伤小鼠造模成功。实验通过魔芋粉干预,与模型组相比,魔芋粉中、高剂量组的胃黏膜溃疡抑制率分别为25.42%、28.18%。SOD活力、NO和PGE2含量显著升高(P<0.05),MDA含量显著降低(P<0.05)。提示魔芋粉对急性酒精性胃黏膜损伤可能有一定的保护作用,且与魔芋粉的剂量有关。
2.2 魔芋粉对小鼠胃黏膜组织病理的影响

图2 魔芋粉对各实验组小鼠胃组织病理的影响(×100)Fig. 2 Effect of konjac powder on pathological change of stomach tissue in mice (× 100)
空白组小鼠胃黏膜各层结构清晰完整,未见明显的出血和炎性细胞浸润(图2a)。模型组小鼠胃黏膜损伤严重,肌层细胞破裂脱落,各种细胞受损严重,局部区域大量出血坏死,可见大量的炎性细胞浸润(图2b)。魔芋粉低剂量组小鼠胃黏膜损伤程度较模型组有所减轻,但黏膜上皮细胞脱落严重,有明显的充血和炎性细胞浸润现象(图2c)。魔芋粉中剂量组小鼠胃黏膜损伤程度大大降低,胃组织各层结构较为清晰,黏膜上皮和腺体无明显损伤,部分表面破损,局部有少量的充血和炎性细胞浸润(图2d)。魔芋粉高剂量组小鼠胃黏膜未见明显损伤,各层结构清晰完整,炎性细胞浸润不明显,几乎接近空白组小鼠(图2e)。提示魔芋粉能保护小鼠胃黏膜损伤。
2.3 魔芋粉对盲肠内容物SCFA、游离氨、肠道微生物的影响
2.3.1 魔芋粉对盲肠内容物SCFA的影响
如表4所示,与空白组小鼠比较,模型组小鼠盲肠内容物中乙酸、丙酸、正丁酸和戊酸的含量均显著降低(P<0.05)。与模型组小鼠比较,魔芋粉中、高剂量组小鼠盲肠内容物中乙酸、丙酸、正丁酸、异丁酸、戊酸的含量显著升高(P<0.05)。魔芋粉低剂量组小鼠盲肠内容物各酸含量较模型组变化无显著性意义(P>0.05)。结果提示魔芋粉能提高酒精性肝损伤小鼠盲肠内容物SCFA的含量,且魔芋粉中、高剂量组效果明显好于魔芋粉低剂量组。
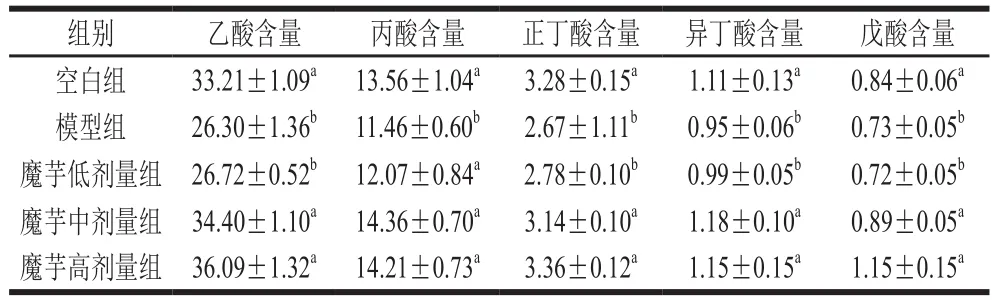
表4 魔芋粉对盲肠内容物SCFA的影响(n=8)Table 4 Effect of konjac powder on SCFAs in cecum contents (n = 8)μmol/g
2.3.2 魔芋粉对盲肠内容物游离氨和微生物水平的影响
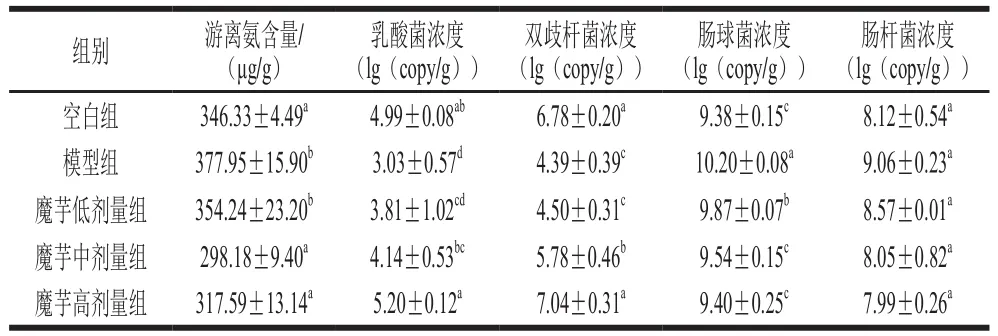
表5 魔芋粉对盲肠内容物游离氨和微生物水平的影响(n=8)Table 5 Effect of konjac powder on free ammonia and microorganisms lovels in cecum contents (n= 8)
如表5所示,与空白组小鼠相比,模型组小鼠盲肠内容物中游离氨含量、肠球菌浓度显著升高(P<0.05);乳酸菌和双歧杆菌的数量显著降低(P<0.05),提示长期或大量地饮酒,可使盲肠内容物游离氨含量升高,改变肠道微生态,益生菌浓度降低,有害菌浓度增加。与模型组小鼠相比,魔芋粉中、高剂量组盲肠内容物游离氨含量、肠球菌浓度显著降低(P<0.05),乳酸菌和双歧杆菌浓度显著升高(P<0.05),提示魔芋粉可以改善酒精性肠损伤。
2.4 魔芋粉对小鼠肠道组织病理的影响
如图3所示,空白组小鼠小肠结构清晰,肠绒毛完整且较长,刷状缘规则排列,黏膜层和肌层较厚(图3a)。与空白组小鼠比较,模型组小鼠小肠绒毛萎缩且不完整,甚至有脱落现象,黏膜层和肌层变薄,固有层出现炎性细胞浸润,上皮细胞出现溃疡等(图3b)。魔芋粉低剂量组小鼠肠绒毛明显增长但不完整,固有层仍有炎性细胞浸润(图3c)。魔芋粉中剂量组小肠有明显的改善,绒毛刷状缘排列整齐,且有所增长(图3d)。而魔芋粉高剂量组小鼠肠绒毛较模型组整齐完整,且明显增长,与空白组相似(图3e)。提示魔芋粉能够改善酒精性小鼠肠道受损的状态,且因其剂量不同,改善程度也有所不同。
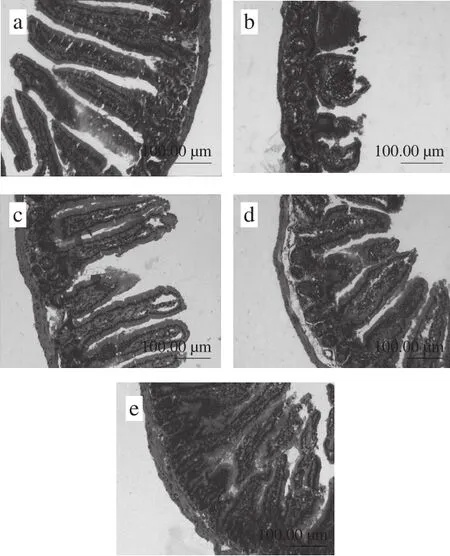
图3 魔芋粉对各实验组小鼠小肠组织病理的影响(×100)Fig. 3 Effect of konjac powder on pathological change of mouse intestinal tissue (× 100)
3 讨 论
随着社会经济的高速发展,酒的消耗不断增加,酒精所引发的疾病和问题也日益严重,急性酒精中毒己经成为节假日发病最高的疾病之一。过量饮酒所导致的醉酒,即急性酒精中毒。急性酒精中毒是指一次性摄入过量的酒精或酒类饮料,乙醇在体内的氧化代谢率小于吸收率,使较多的乙醇经过血液循环进入大脑,引起中枢神经系统产生先兴奋后抑制的状态,可能出现反应灵敏度下降、嗜睡等现象,严重者可导致血压下降、昏迷、呼吸困难,甚至死亡[26]。在我国解酒产品的种类很多,但长期使用可能会产生毒副作用。随着人们保健意识的增强,开发具有解酒功能的天然食品倍受青睐。魔芋粉是一种天然的食材,本实验研究其对急性酒精性胃黏膜损伤和慢性酒精性肠损伤的作用,为研究开发天然的预防酒精性疾病的产品提供理论依据。
胃是酒精代谢最先接触的重要器官,过度饮酒或长期饮酒可引起胃黏膜急性或慢性损伤[27]。在乙醇的刺激下,胃黏膜组织可产生大量氧自由基,并且氧自由基生成量与乙醇呈剂量相关性,氧自由基与膜内多价不饱和脂肪酸结合,形成MDA[28]。MDA是重要的脂质过氧化反应产物之一,可反映机体内脂质过氧化程度,测定其含量常能间接反映细胞损伤的程度。SOD则是对机体氧化与抗氧化系统保持平衡起着重要作用的抗氧化酶之一,具有清除氧自由基并保护细胞免受损伤的功能[29]。NO可以降低胃黏膜中过氧化物酶活性,促进胃黏液分泌起到胃黏膜保护作用[30]。PGE2通过增强胃黏膜的屏障作用,增加黏膜表面黏液分泌和黏膜血流量,清除氧自由基,抑制胃酸等来保护胃黏膜[31]。梁桂宁等[8,32]的研究结果表明,紫菜多糖可通过提高急性酒精灌胃小鼠组织SOD、PGE2,NO、GSH-Px水平从而保护胃黏膜免受损伤。黄进波等[33]研究结果表明竹叶黄酮通过抗氧化、抑制氧自由基产生并升高胃黏膜NO、PEG2含量对小鼠急性胃黏膜损伤起保护作用。Sindhu等[34]研究发现叶黄素可以降低大鼠溃疡指数,升高SOD活性可起到保护胃黏膜损伤的作用。本实验模型组小鼠胃黏膜溃疡指数、SOD、MDA含量均较空白组明显升高,在魔芋粉干预后,与模型组相比,魔芋粉中、高剂量组小鼠胃组织NO、PGE2、SOD水平显著升高,胃黏膜溃疡抑制率、MDA含量显著下降。由实验结果可知,魔芋粉通过升高SOD的活性,增强了清除氧自由基的能力,减少了氧自由基与膜内多价不饱和脂肪酸结合,进而降低了脂质过氧化产物MDA的产生,因而有效地减轻了对胃黏膜结构损伤。此外,经过魔芋粉的干预,小鼠胃黏膜组织NO、PGE2含量明显升高,有效地降低了胃黏膜中过氧化物酶的活性,增强了胃黏膜的屏障作用,进而起到了保护胃黏膜的作用。
肠道微生物的稳态与人类健康密切相关[35]。肠道中的双歧杆菌和乳酸杆菌在机体内的有益作用已为人们所共识,它们不但可以调整机体的微生态平衡,改善消化功能,还可以增强机体的免疫力,延缓衰老。酒精可引起肠黏膜结构完整性的破坏和功能性的障碍,使肠黏膜的通透性增加,导致细菌移位,引起肠道微生态系统失衡。酒精的摄入会导致肠道紊乱,肠黏膜损伤导致黏膜的屏障功能减弱[36]。益生菌的补充使得革兰氏阴性菌数量减少,改善酒精引起的肠道菌群变化[37]。游离氨是肠道内主要的腐败产物,可使肠表皮细胞生理代谢和结构发生变化,对肠道健康极其不利。有报道指出,SCFA具有保护肠道功能及形态的作用,还有调节肠道菌群生态平衡、改善肠道功能和抗病原微生物等作用[38]。常冰等[39]研究发现益生菌合剂可以起到保护肠道完整性的作用。本实验的结果表明,与空白组相比,模型组小鼠盲肠内容物SCFA含量、乳酸菌和双歧杆菌的浓度显著降低(P<0.05);游离氨含量、肠球菌数量显著升高(P<0.05)。经魔芋粉灌胃干预后,与模型组相比,魔芋粉中、高剂量组小鼠盲肠内容物SCFA、乳酸菌和双歧杆菌浓度显著升高(P<0.05);游离氨含量、肠球菌浓度显著降低(P<0.05)。由以上结果可知,魔芋粉使肠道中有益菌浓度增加,有害菌浓度降低,因而SCFA含量显著升高,游离氨含量显著降低,进而有效地调节肠道微生物的平衡,修复结肠屏障的完整性,并对肠道功能及形态起到了较好的保护作用。
4 结 论
本实验通过建立急性酒精性胃黏膜损伤模型和慢性酒精性肠损伤模型来探讨魔芋粉对酒精性疾病的预防保护作用。通过魔芋粉的干预后,对胃黏膜溃疡指数,胃组织相关指标,肠道内容物及肠道微生物含量进行测定;结果表明:魔芋粉对小鼠急性酒精性胃黏膜损伤和慢性酒精性肠损伤具有预防保护作用,其可能的机制是魔芋粉通过减少脂质过氧化产物,增强抗氧化作用,清除自由基实现对胃损伤的保护。通过调整肠道微生态的稳态,增强屏障的保护作用实现对慢性酒精性肠损伤的保护。也为研究开发天然的预防酒精性脏器损伤的食品提供了理论支撑,且魔芋粉中、高剂量组优于魔芋粉低剂量组,综合经济因素考虑,可选择中剂量。
参考文献:
[1] 田长生, 靳海丽, 贾剑锋. 长期过量饮酒者体检结果分析[J]. 中国卫生产业, 2014, 11(28): 5-7.
[2] 王麟士, 裴琇. 酒精性肝病[J]. 临床荟萃, 2001,16(24): 1141-1143.DOI:10.3969/j.issn.1004-583X.2001.24.034.
[3] SENOL A, ISLER M, KARAHAN A G, et al. Preventive effect of probiotics and α-tocopherol on ethanol-induced gastric mucosal injury in rats[J]. Journal of Medicinal Food, 2011, 14(1/2): 173-179.DOI:10.1089/jmf.2010.0040.
[4] LIPPAI D, BALA S, CATALANO D, et al. Micro-RNA-155 deficiency prevents alcohol-induced serum endotoxin increase and small bowel inflammation in mice[J]. Alcoholism-Clinical & Experimental Research, 2014, 38(8): 2217-2224. DOI:10.1111/acer.12483.
[5] KIM, M S, ONG M, QU X. Optimal management for alcoholic liver disease:conventional medications, natural therapy or combination?[J]. World Journal of Gastroenterology, 2016, 22(1): 8-23. DOI:10.3748/wjg.v22.i1.8.
[6] SHPILENYA L S, MUZYCHENKO A P, GASBARRINI G, et al.Metadoxine in acute alcohol intoxication: a double-blind, randomized,placebo-controlled study[J]. Alcoholism-Clinical and Experimental Research, 2002, 26(3): 340-346. DOI:10.1111/j.1530-0277.2002.tb02543.x.
[7] DORN C, KRAUS B, MOTYL M, et al. Xanthohumol, a chalcon derived from hops, inhibits hepatic inflammation and fibrosis[J].Molecular Nutrition & Food Research, 2010, 54(Suppl 2): 205-213.DOI:10.1002/mnfr.200900314.
[8] 梁桂宁, 黄媛恒, 贾晓栋, 等. 紫菜多糖对急性酒精灌胃小鼠胃组织SOD、GSH-Px的影响[J]. 中国实用医药, 2012, 7(4): 248-249.DOI:10.3969/j.issn.1673-7555.2012.04.207.
[9] 蔡夏夏, 鲍雷, 王楠, 等. 膳食5′-核苷酸对酒精性肝损伤大鼠肠道菌群的影响[J]. 食品科学, 2015, 36(15): 212-216. DOI:10.7506/spkx1002-6630-201515039.
[10] 梁璐璐. 蜂蜜对急性酒精中毒大鼠胃黏膜损伤的保护作用及其机制的初步研究[D]. 广州: 广东药学院, 2015: 4-8.
[11] 钟刚琼, 盛德贤, 滕建勋, 等. 魔芋食品的开发利用与研究进展[J]. 食品研究与开发, 2005, 26(1): 106-108. DOI:10.3969/j.issn.1005-6521.2005.01.040.
[12] KHANNA S, TESTER R F. Influence of purified konjac glucomannan on the gelatinisation and retrogradation properties of maize and potato starches[J]. Food Hydrocolloids, 2006, 20(5): 567-576. DOI:10.1016/j.foodhyd.2005.05.004.
[13] WALSH D E, YAGHOUBIAN V, BEHFOROOZ A. Effect of glucomannan on obese patients: a clinical study[J]. International Journal of Obesity, 1984, 8(4): 289-293.
[14] VÁZQUEZ-VELASCO M, GONZÁLEZ-TORRES L, MÉNDEZ M T, et al. Glucomannan and glucomannan plus spirulina-enriched squid-surimi added to high saturated diet affect glycemia, plasma and adipose leptin and adiponectin levels in growing fa/fa rats[J].Nutricion Hospitalaria, 2015, 32(6): 2718-2724. DOI:10.3305/nh.2015.32.6.9936.
[15] CHEN H L, CHENG H C, WU W T, et al. Supplementation of konjac glucomannan into a low-fiber Chinese diet promoted bowel movement and improved colonic ecology in constipated adults: a placebo-controlled,diet-controlled trial[J]. Journal of the American College of Nutrition, 2008,27(1): 102-108. DOI:10.1080/07315724.2008.10719681.
[16] OMIZU S, ONISHI N, SUZUKI H, et al. Oral administration of pulverized Konjac glucomannan prevents the increase of plasma immunoglobulin E and immunoglobulin G levels induced by the injection of syngeneic keratinocyte extracts in BALB/c mice[J].Clinical & Experimental Allergy, 2006, 36(1): 102-110. DOI:10.1111/j.1365-2222.2005.02405.x.
[17] 杨芳, 禹强, 韩玉翠, 等. 魔芋葡甘聚糖对饮酒大鼠血清硒及脂质过氧化的影响[J]. 西北农林科技大学学报(自然科学版), 2013, 41(5):14-18.
[18] 洪燕坪. 解酒饮对小鼠胃黏膜及急性四氯化碳肝损保护作用的药效学研究[D]. 南宁: 广西医科大学, 2017: 38-39.
[19] SUN F, XIE M L, ZHU L J, et al. Inhibitory effect of osthole on alcohol-induced fatty liver in mice[J]. Digestive and Liver Disease,2009, 41(2): 127-133. DOI:10.1016/j.dld.2008.01.011.
[20] GUTH P H, AURES D, PAULSEN G. Topical aspirin plus HCl gastic lesions in the rat. cytoprotective effect of prostaglandin, cimetidine and probantine[J]. Gastroenterology, 1979, 76(1): 88-93.
[21] 戚颖欣, 孟军, 曹柏营. 小分子大豆多肽对小鼠胃黏膜保护作用的研究[J]. 食品科学, 2011, 32(23): 289-292.
[22] LIVEROFA D R, MARTINS G G, TELLES J E Q, et al.Hydroethanolic extract of Baccharis trimera, ameliorates alcoholic fatty liver disease in mice[J]. Chemico-Biological Interactions, 2016,260: 22-32. DOI:10.1016/j.cbi.2016.10.003.
[23] 梁桂宁. 紫菜多糖保护小鼠胃黏膜免受酒精急性损伤的机制研究[D].南宁: 广西医科大学, 2009: 9.
[24] 贾益群, 叶福媛, 王双, 等. 生物样品中短链脂肪酸的快速提取与分析方法[J]. 实验室研究与探索, 2012, 31(7): 262-264.
[25] 骞宇. 抗消化淀粉对实验鼠肠道生理环境和胃肠功能性作用的影响[D]. 重庆: 西南大学, 2013: 106-111.
[26] 庞晓军, 符春晖, 林启云. 解酒饮的药理学研究[J]. 中国新药杂志, 2004,13(增刊1): 1341-1343. DOI:10.3321/j.issn:1003-3734.2004.12.087.
[27] 罗永祥, 彭燕. 乙醇对胃粘膜损伤的机制研究概况[J]. 西南军医,2011, 13(1): 122-123. DOI:10.3969/j.issn.1672-7193.2011.01.066.
[28] 何绍珍. 乙醇性胃黏膜损伤中氧自由基与线粒体DNA ATPase6,8基因表达关系的研究[D]. 福州: 福建医科大学, 2007: 8; 20.
[29] MCCORDORD J M, KEELE B B, FRIDOVICH I. An enzymebased theory of obligate anaerobiosis: the physiological function of superoxide dismutase[J]. Proceedings of the National Academy of Sciences, 1971, 68(5): 1024-1027.
[30] QUI B S, MEI Q B, LIU L, et al. Effects of nitric oxide on gastric ulceration induced by nicotine and cold-restraint stress[J]. World Journal of Gastroenterology, 2004, 10(4): 594-597. DOI:10.3748/wjg.v10.i4.594.
[31] 李冀, 毕珺辉, 孙宇峰. 四逆散抗实验性胃溃疡的药效学及作用机理研究[J]. 中华中医药学刊, 2007, 25(7): 1317-1319. DOI:10.3969/j.issn.1673-7717.2007.07.001.
[32] 梁桂宁, 黄媛恒, 梁志锋, 等. 紫菜多糖对急性酒精性胃黏膜损伤小鼠胃组织PGE2及NO的影响[J]. 甘肃中医学院学报, 2012, 29(2): 7-8.DOI:10.3969/j.issn.1003-8450.2012.02.003.
[33] 黄进波, 萧钦, 周佳佳, 等. 竹叶黄酮对乙醇诱导小鼠急性胃黏膜损伤的保护作用[J]. 现代药物与临床, 2015, 30(7): 779-783.DOI:10.7501/j.issn.1674-5515.2015.07.006.
[34] SINDHU E R, KUTTAN R. Carotenoid lutein protects rats from gastric ulcer induced by ethanol[J]. Journal of Basic & Clinical Physiology & Pharmacology, 2012, 23(1): 33-37. DOI:10.1515/jbcpp-2011-0032.
[35] MOUNTZOURIS K C, MCCARTNEYA L, GIBSON G R. Intestinal microflora of human infants and current trends for its nutritional modulation[J]. British Journal of Nutrition, 2002, 87(5): 405-420.DOI:10.1079/BJNBJN2002563.
[36] BULL-OTTERSON L. Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment[J]. PLoS ONE, 2013, 8(1):e53028. DOI:10.1371/journal.pone.0053028.
[37] 武岩峰. 鼠李糖乳杆菌通过调整肠道正常菌群缓解慢性酒精性肝损伤的研究[D]. 长春: 吉林农业大学, 2016: 3-4.
[38] TAPPENDEN K A, THOMSON A B, WILD G E, et al. Short-chain fatty acid-supplemented total parenteral nutrition enhances functional adaptation to intestinal resection in rats[J]. Gastroenterology, 1997,112(3): 792-802. DOI:10.1053/gast.1997.v112.pm9041241.
[39] 常冰, 桑力轩, 王颖, 等. 思连康控制大鼠酒精性肝病肠黏膜损伤的效果评价[J]. 中国医师杂志, 2015, 17(10): 1471-1473. DOI:10.3760/cma.j.issn.1008-1372.2015.10.009.
