酸性电解水对南美白对虾中多酚氧化酶活性的影响
2018-05-25孙江萍俞文英潘迎捷
孙江萍,赵 莉,俞文英,谢 晶,2,3,潘迎捷,2,3,赵 勇,2,3,*
黑变是影响南美白对虾货架期的一个重要因素,黑变大幅降低了对虾的食用价值和经济价值[1]。黑变主要是由虾体中多酚氧化酶(polyphenoloxidase,PPO)参与的酶促反应引起的[2]。PPO将虾体内的酚类物质氧化成醌类物质,醌类物质再进行聚合产生深色的高分子质量物质,最后在虾的表面形成黑色的斑点[3-4]。为了抑制黑色斑点的形成,延长虾的货架期,市场上存在很多抑制黑变产生的抑制剂,比如绿茶提取物[5]、抗坏血酸[6]、金针菇提取物[7]、葡萄籽提取物[8]。这些抑制剂主要作用原理就是通过抑制虾中PPO的活力达到抑制黑变的效果,从而延长对虾的货架期。
酸性电解水(acidic electrolyzed water,AEW)是近年来发展起来的一种新型杀菌保鲜技术。AEW是由一定浓度的电解质溶液在电解槽进行电离得到的,具有操作简单、价格低廉等优点[9]。AEW最大的优势在于其对人体及环境安全无污染[10-11]。AEW的pH值低,氧化还原电位(oxidation reduction potential,ORP)高(>1 000 mV),并具有较高的有效氯浓度(available chlorine concentration,ACC),根据AEW pH值的不同,可将AEW分为弱AEW(pH 5.0~6.5)和强AEW(pH 2.3~2.7)[12]。目前有关AEW的研究主要聚焦在杀菌效果和食品保鲜等方面。杀菌方面,AEW对副溶血性弧菌[13]、大肠杆菌[14]、单增李斯特菌[15]、肠杆菌[16]等都有很强的杀灭效果。保鲜方面,周然等[17]用微AEW对水蜜桃进行护色保鲜效果的研究,结果发现AEW能够有效保护水蜜桃在贮存过程中的色泽。Jia Guoliang等[18]的研究表明,AEW对山药的黑变具有明显抑制效果。本实验室之前的研究发现,将南美白对虾于4 ℃条件下贮藏之前用AEW处理5 min,可以有效推迟虾头黑变的时间,延长南美白对虾的货架期[19]。
国内外有关AEW的研究主要聚焦在其杀菌效果以及保鲜效果等基础感官实验,鲜有对AEW杀菌保鲜机理进行深入的探索。在保鲜方面,尽管AEW对不同食品的护色作用已有一定的研究,然而对于AEW能够护色的机理至今鲜见报道。本研究着重关注黑变生成过程的关键性酶——PPO的活力变化,对南美白对虾头部PPO进行分离纯化,并体外研究AEW对PPO活力的影响,以期初步解释AEW延缓虾头黑变的机理,为AEW在食品保鲜领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
南美白对虾购自上海集贸市场。挑选规格、大小一致((13±1)g)的南美白对虾用于实验。
L-多巴(L-3,4-dihydroxyphenylalanine,L-DOPA)、固体硫酸铵 国药化学试剂公司;Sephadex G-100葡聚糖凝胶、DEAE-52纤维素、考马斯亮蓝G-250、甲叉双丙烯酰胺、上样缓冲液 生工生物工程股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
FW-200型强酸性电解水制备仪 日本AMANO公司;pH/ORP测定仪 梅特勒-托利多仪器(上海)有限公司;RC-3F型高浓度有效氯测定仪 北京中西远大科技有限公司;CR21GⅢ型高速台式冷冻离心机日本日立公司;层析柱(330 mm×16 mm) 上海炎灵精密科学仪器有限公司。
1.3 方法
1.3.1 AEW的制备
将1.5 g/L NaCl溶液倒入强酸性电解水制备仪中电离15 min后,获得2 L AEW和2 L碱性电解水,将AEW装入棕色瓶。用pH/ORP测定仪测定AEW的pH值、ORP,ACC用有效氯测定仪测得。由于AEW中有效氯具有时效性,实验中AEW均采取现制现用的方式。
经检测,本实验所用AEW的ACC为(72±1)mg/L,pH值为2.35±0.01,ORP为(1 172.40±0.46)mV。
1.3.2 前处理
将新鲜的南美白对虾随机分为2 组,分装到无菌袋中,AEW处理组按料液比1∶9(m/V)加入AEW浸泡处理5 min后将AEW倒净,放入4 ℃恒温箱贮存5 d,每隔1 d取对虾进行颜色观察、拍照。以去离子水处理南美白对虾作为对照组。
1.3.3 PPO的提取、分级纯化
PPO粗酶液的提取根据文献[20]的工艺进行。取20 g的虾头,按1∶3(m/V)加入预冷的磷酸盐缓冲液(pH 7.2,含1 g/L十二烷基聚乙二醇醚、1mol/L NaCl,下同),用剪刀将虾头充分剪碎。浸提30 min后在8 000 r/min、4 ℃条件下高速冷冻离心30 min,去除沉淀,得到的上清液为粗酶液。
硫酸铵分级沉淀。取5 mL上述粗酶液,在不同饱和度(30%、40%、50%、60%、70%)硫酸铵条件下进行沉析,静置30 min后以12 000 r/min、4 ℃高速冷冻离心30 min,分别测定上清液(粗酶液)与沉淀中的PPO活力。
DEAE-52柱纯化。DEAE-52纤维素柱填料填装,然后在上述粗酶液中加入硫酸铵,使得饱和度达到40%,静置,离心,去上清液,用缓冲液将沉淀溶解后加到DEAE-52柱中进行分离,以50 mmol/L磷酸盐缓冲液(pH 7.2)作为洗脱液,流速0.75 mL/min,每9 min收集一管,共收集50 管,并为收集次序为基础进行编号,依次为1~50号,检测每管中PPO活力。收集活力最高的3 管酶液(D1),备用。
Sephadex G-100柱纯化。后将经DEAE-52柱纯化收集到的酶液D1进行Sephadex G-100柱分离,以50 mmol/L磷酸盐缓冲液(pH 7.2)作为洗脱液,流速0.75 mL/min,每9 min收集一管,共收集50 管,并以收集次序为基础进行编号,依次为1*~50*号,检测每管中PPO活力。收集活力最高的4 管酶液(G1),备用。
浓缩:将两种柱纯化后得到的酶液D1和G1分别加到超滤管中,4 000 r/min、4℃条件下冷冻离心15 min,收集上部浓缩液(D2、G2)备用。
1.3.4 PPO活力的测定
PPO活力的测定采取文献[21]的方法。反应温度为37 ℃,3 mL反应体系中含有2.4 mL磷酸盐缓冲液、200 μL L-DOPA(50 mmol/L)、400 μL酶液,混匀后,用移液器取200 μL到96 孔板,分别测定反应10 min与反应0 min后475 nm波长处吸光度,并计算吸光度差值。PPO的活力单位定义为每分钟消耗1 μmol底物所需的酶量。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
将D1、D2、G1、G2分别与上样缓冲液1∶1(V/V)混合,上样量20 μL,5%浓缩胶,10%分离胶,60 V电泳0.5 h后调整到120 V继续电泳2 h。考马斯亮蓝G-250进行染色2 h,用脱色液(V(冰醋酸)∶V(乙酸)∶V(去离子水)=1∶3∶6)进行脱色,照胶,得到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electropheresis,SDS-PAGE)图谱。
1.3.6 AEW对PPO活力的影响
取7 支5 mL离心管,加入400 μL酶液G2,分别加入体积分数0.00%、0.33%、1.67%、3.33%、5.00%、6.67%、13.30%、20.00%、26.67%、33.33%的AEW,混匀后反应3 min,分别加入2 400、2 390、2 350、2 300、2 250、2 200、2 000、1 800、1 600、1 400 μL磷酸盐缓冲液,最后加入200 μL L-DOPA,混匀。用移液枪吸取200 μL转移到96 孔板,测定475 nm波长处,37 ℃条件反应10 min与反应0 min的吸光度差值。
1.3.7 AEW抑制类型判断
在1.3.6节所述反应体系中,保持酶量不变,通过改变抑制剂AEW添加量(0.00%、0.67%、1.30%)及底物L-DOPA浓度(5、10、15、20、25 mmol/L),测定吸光度变化,并计算出PPO进行氧化还原反应的初始速率V0。米氏方程如式(1)所示。

混合抑制方程如式(2)所示。
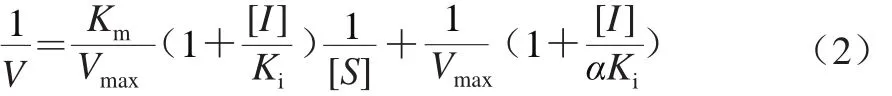
式中:V为酶反应速率/(U/(mL·min));Vmax为最大反应速率/(U/(mL·min));[S]为反应底物浓度/(mmol/L);[I]为抑制剂体积分数/%;Km为米氏常数;Ki为抑制常数;α为表观系数。
以1/[S]为横坐标,1/[V]为纵坐标制作Lineweaver-Burk双倒数作图,根据直线交点位置判断AEW的抑制类型,从动力学方程可知,斜率因为Km与Vmax都是非0常数,因此以[I]为横坐标,斜率为纵坐标作图,横轴截距的绝对值为Ki值。
1.4 数据处理
采用分析软件Origin 8.0对所有数据进行拟合分析。
2 结果与分析
2.1 AEW对虾头黑变的抑制效果

图1 南美白对虾在4 ℃贮存过程中的黑变情况Fig. 1 Photographs of Litopenaeus vannamei with or without AEW treatment during storage
由图1可知,南美白对虾在4 ℃贮藏过程中会迅速变黑,第1天对照组南美白对虾发生了轻微的黑变,AEW处理组南美白对虾色泽变化不明显,第3天和第5天对照组南美白对虾黑变情况十分严重,而第3天AEW处理组南美白对虾只发生了轻微的黑变,第5天南美白对虾的黑变程度与对照组南美白对虾在第3天的黑变程度相近。用灰度扫描软件(Image J)对图中虾的灰度进行扫描,结果分别为:对照组第1、3、5天灰度分别为73、92、81;AEW处理组第1、3、5天灰度分别为83、105、92。灰度值越小颜色越深,从数据看,第1天对照组和AEW处理组的灰度值分别小于后两天的测量值,分析偏小的原因可能是新鲜的虾头部原有的青色在图片处理的时候自动默认为黑色,导致扫描时灰度值偏小。整体上看,对照组每天的灰度值都小于AEW处理组的灰度值,说明对照组的黑变情况比AEW处理组的严重。因此,AEW可以减缓南美白对虾黑变速率,从而延长其货架期。此实验结果与Wang Meng[16]、Lin Ting[19]等研究结果一致。研究表明,PPO是引起虾黑变的关键性酶[22],南美白对虾产生免疫反应时体内的PPO会诱导虾体的酚类物质产生醌类物质[23],醌类物质经过聚合反应产生深色物质,最后在虾表面产生黑色斑点,而AEW 3 种独特的性质(低pH值、高ORP值、高浓度有效氯)都可能会使虾体中的PPO失活,从而延缓了南美白对虾的黑变速率。为了探究AEW是否能够抑制虾体中PPO活力,本研究将虾体中的PPO进行提取纯化,并进行体外酶动力学的探索。
2.2 南美白对虾头部PPO的提取纯化
2.2.1 硫酸铵分级沉淀
硫酸铵沉淀法是蛋白质纯化过程中广泛使用的一种有效的分离方法,不同饱和度硫酸铵条件下沉淀出来的蛋白不同[24]。为了确定目的蛋白的盐析范围,本实验以硫酸铵饱和度为30%~70%的范围、梯度10%为条件,测定经沉淀离心后上清液和沉淀中的PPO活力。数据显示,所有上清液都没有检测到PPO的活力。图2显示了不同饱和度硫酸铵沉淀条件下离心后所得沉淀的PPO活力。当硫酸铵饱和度达到40%时,离心所得沉淀的PPO活力最高,因此后续纯化都采取40%饱和度硫酸铵进行沉淀。
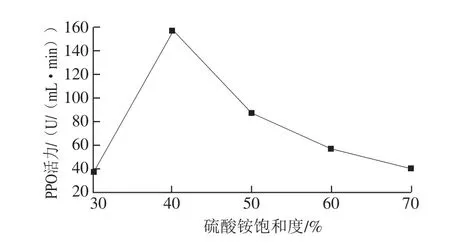
图2 不同饱和度硫酸铵沉淀条件下PPO的活力Fig. 2 Salting out of PPO at various saturation degrees with ammonium sulfate
2.2.2 柱层析结果

图3 南美白对虾PPO的层析普通洗脱曲线Fig. 3 Elution curve of PPO from Litopenaeus vannamei
PPO两次层析的结果见图3,阴离子交换层析洗脱线有一个高峰,为第4号管。数据显示,第4~12号管中PPO活力较高,其中第4~6号管中的PPO活力最高,收集这3管的酶液(D1),混合后倒入装好的Sephadex G-100进行洗脱分离,收集50 管后测定每管的PPO活力,结果如图3所示,洗脱线有一个高峰,为7*号管,其中第5*~8*号管中的PPO活力都比较高,分别为8.33、8.33、8.40、8.33 U/(mL·min)。收集这4 管酶液(G1,纯化PPO),备用。
2.2.3 SDS-PAGE检验纯化效果

图4 南美白对虾PPO的SDS-PAGE图谱Fig. 4 SDS-PAGE patterns of PPO
本实验使用SDS-PAGE检测PPO的纯化效果。电泳图如图4所示。D1、D2泳道的条带并不单一,两条主要条带(75 kDa附近)下面还有几条不明显的条带。G1、G2泳道主条带下面的杂带都已经被筛除。由此得出,两次层析分离纯化PPO达到了理想的效果。不同虾体中PPO的分子质量不同,对虾的种类、大小、性别以及产地都是影响其PPO分子质量[25]及活力的因素。由图4可知,最后所得PPO的分子质量在75 kDa左右。
2.3 纯化PPO动力学研究
2.3.1 AEW处理对纯化PPO活力的影响
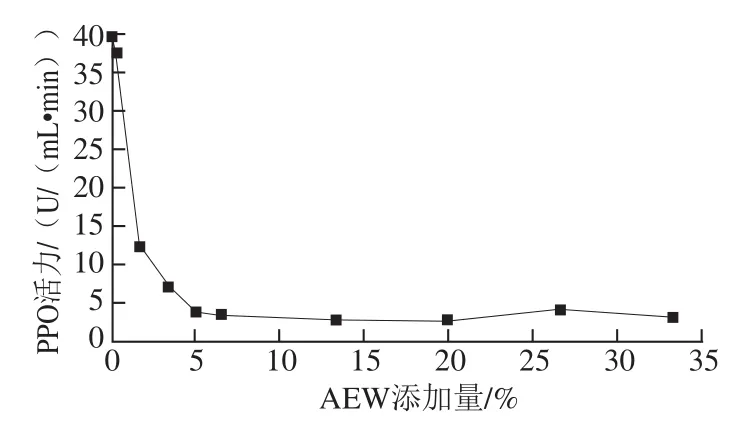
图5 AEW处理对纯化PPO活力的抑制效果拟合图Fig. 5 Inhibitory effect of AEW on PPO
图5 是不同添加量的AEW对纯化PPO活力的抑制效果拟合图。结果显示,随着AEW添加量的增加,纯化PPO活力相应降低。纯化PPO初始活力为39 U/(mL·min),当AEW添加量为1.67%时,纯化PPO活力为12 U/(mL·min),当AEW的添加量达到5.00%时,纯化PPO的活力达到最低,为3 U/(mL·min)。结果说明AEW对纯化PPO活力有显著的抑制效果,并且呈现剂量依赖关系。pH值、离子种类等因素都会影响PPO活力[26]。AEW的pH值低,ORP高,并具有高浓度有效氯成分[27],这些特性都是抑制纯化PPO活力的关键因素。随着AEW添加量的增加,纯化PPO活力下降的速率呈现先快后缓的现象,推测可能是由于在不同添加量下AEW抑制纯化PPO活力的主导因素不同,在快速抑制阶段AEW的3 种性质同时起作用;在AEW添加量较低或者较高的情况下,可能抑制纯化PPO活力的主导因素比较单一。通过上述结果可以判断,AEW确实可以通过抑制南美白对虾中PPO的活力延缓对虾黑变速率。
2.3.2 AEW对PPO活力的抑制类型判定
通过作Lineweaver-Burk双倒数图,判定AEW对PPO活力的抑制作用类型,图6是在反应体系中分别加入不同抑制剂和不同浓度底物后,测定的PPO反应初始速率。由Lineweaver-Burk双倒数图可见随着AEW的加入,曲线的纵轴截距和横轴截距都不断增大,并在第三象限交于一点,由此可判定AEW对于PPO的抑制类型属于混合型抑制[28]。说明AEW中多种成分都可以与PPO及其复合物进行相互作用[29]。这可能是由于AEW中的不同氯离子成分与PPO及其复合物进行结合,抑制了酶的活力。通过进一步计算,可得出抑制常数Ki为0.64 mmol/L。Ki与抑制剂作用效果相关,值越小,说明抑制作用越强[30],说明了AEW对PPO的抑制效果越好。
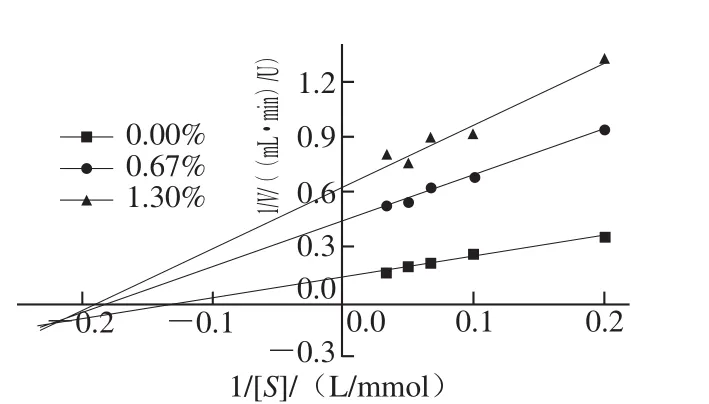
图6 Lineweaver-Burk双倒数图Fig. 6 Lineweaver-Burk plots for the inhibition of AEW on the oxidation of L-DOPA by PPO
3 结 论
AEW能够明显抑制南美白对虾的黑变速率,延长南美白对虾的货架期。
本研究通过硫酸铵沉淀法、DEAE-52阴离子交换层析、Sephadex G-100葡聚糖凝胶层析提取纯化南美白对虾中PPO,取得了较为理想的效果
通过研究AEW对PPO进行抑制动力学发现,AEW能够有效抑制虾中PPO的活力,并呈混合型抑制,且抑制常数Ki为0.64 mmol/L。
本研究从内源酶的角度解释了AEW延迟对虾黑变的原因。AEW通过抑制黑变过程中的关键酶的活力而抑制了南美白对虾黑变。目前市场出现的PPO抑制剂大部分是竞争性抑制剂,对于混合型抑制剂则很少报道,本研究发现,AEW是PPO的一种混合型抑制剂,是一种新型的抑制剂成分。由于AEW的成分比较复杂,具体抑制活性成分还需进一步探究。
参考文献:
[1] NIRMAL N P, BENJAKUL S, AHMAD M, et al. Undesirable enzymatic browning in crustaceans: causative effects and its inhibition by phenolic compounds[J]. Critical Reviews in Food Science & Nutrition,2015, 55(14): 1992-2003. DOI:10.1080/10408398.2012.755148.
[2] MU H L, CHEN H J, FANG X J, et al. Effect of cinnamaldehyde on melanosis and spoilage of Pacific white shrimp (Litopenaeus vannamei) during storage[J]. Journal of the Science of Food and Agriculture, 2012, 92(10): 2177-2182. DOI:10.1002/jsfa.5605.
[3] 黄万有, 吉宏武, 刘书成, 等. 凡纳滨对虾PPO的组织分布和活性与其贮藏过程中黑变的关系[J]. 现代食品科技, 2014, 30(2): 89-94.DOI:10.13982/j.mfst.1673-9078.2014.02.029.
[4] 吕艳芳, 张艳平, 蔡路昀, 等. 曲酸对南美白对虾酚氧化酶活性和结构的影响[J]. 食品科学, 2017, 38(18): 22-28. DOI:10.7506/spkx1002-6630-201718004.
[5] NIRMAL N P, BENJAKUL S. Effect of green tea extract in combination with ascorbic acid on the retardation of melanosis and quality changes of pacific white shrimp during iced storage[J]. Food and Bioprocess Technology, 2012, 5(8): 2941-2951. DOI:10.1007/s11947-010-0483-5.
[6] 蔡燕萍, 张建友. 虾体多酚氧化酶特性及其抑制技术研究进展[J].食品工业科技, 2012, 33(13): 424-428; 432. DOI:10.13386/j.issn1002-0306.2012.13.053.
[7] ENCARNACION A B, FAGUTAO F, JINTASATAPORN O, et al.Application of ergothioneine-rich extract from an edible mushroom Flammulina velutipes for melanosis prevention in shrimp, Penaeus monodon and Litopenaeus vannamei[J]. Food Research International,2012, 45(1): 232-237. DOI:10.1016/j.foodres.2011.10.030.
[8] 吕艳芳, 魏春娇, 王娇, 等. 南美白对虾酚氧化酶的提取及生化特性[J]. 食品科学, 2014, 35(7): 113-117. DOI:10.7506/spkx1002-6630-201407023.
[9] 谢军, 孙晓红, 潘迎捷, 等. 电解水和有机酸对虾的杀菌效果及感官品质影响[J]. 食品与发酵工业, 2010(5): 57-63. DOI:10.13995/j.cnki.11-1802/ts.2010.05.024.
[10] 林婷, 王敬敬, 潘迎捷, 等. 酸性电解水对纯培养及食品中食源性致病菌杀菌效果比较研究[J]. 食品科学, 2013, 34(15): 69-74.DOI:10.7506/spkx1002-6630-201315015.
[11] HRICOVA D, STEPHAN R, ZWEIFEL C. Electrolyzed water and its application in the food industry[J]. Journal of Food Protection, 2008,71(9): 1934-1947. DOI:10.5167/uzh-4971.
[12] 谢军, 孙晓红, 潘迎捷, 等. 酸性电解水在水产品安全中的应用[J].渔业现代化, 2010, 37(2): 55-58.
[13] LI J B, LIN T, LU Q, et al. Changes in physicochemical properties and bactericidal efficiency of acidic electrolyzed water ice and available chlorine decay kinetics during storage[J]. LWT-Food Science and Technology, 2014, 59(1): 43-48. DOI:10.1016/j.lwt.2014.05.043.
[14] POSADA-IZQUIERDO G D, PÉREZ-RODRÍGUEZ F, LÓPEZGÁLVEZ F, et al. Modeling growth of Escherichia coli, O157:H7 in fresh-cut lettuce treated with neutral electrolyzed water and under modified atmosphere packaging[J]. International Journal of Food Microbiology, 2014, 177: 1-8. DOI:10.1016/j.ijfoodmicro.2013.12.025.
[15] HAO J, LI H, WAN Y, et al. Combined effect of acidic electrolyzed water (AcEW) and alkaline electrolyzed water (AlEW) on the microbial reduction of fresh-cut cilantro[J]. Food Control, 2015, 50:699-704. DOI:10.1016/j.foodcont.2014.09.027.
[16] WANG Meng, WANG Jingjing, SUN Xiaohong, et al. Preliminary mechanism of acidic electrolyzed water ice on improving the quality and safety of shrimp[J]. Food Chemistry, 2015, 176: 333-341.DOI:10.1016/j.foodchem.2014.12.089.
[17] 周然, 谢晶, 高启耀, 等. 微酸性电解水结合壳聚糖对水蜜桃护色保鲜的效果[J]. 农业工程学报, 2012, 28(18): 281-286. DOI:10.3969/j.issn.1002-6819.2012.18.040.
[18] JIA Guoliang, SHI Jingying, SONG Zhanhua, et al. Prevention of enzymatic browning of Chinese yam (Dioscorea spp.) using electrolyzed oxidizing water[J]. Journal of Food Science, 2015, 80(4):C718-C728. DOI:10.1111/1750-3841.12820.
[19] LIN Ting, WANG Jingjing, LI Jibing, et al. Use of acidic electrolyzed water ice for preserving the quality of shrimp[J].Journal of Agricultural and Food Chemistry, 2013, 61(36): 8695-702.DOI:10.1021/jf4019933.
[20] NIRMAL N P, BENJAKUL S. Effect of ferulic acid on inhibition of polyphenoloxidase and quality changes of Pacific white shrimp(Litopenaeus vannamei) during iced storage[J]. Food Chemistry, 2009,116(1): 323-331. DOI:10.1016/j.foodchem.2009.02.054.
[21] MANHEEM K, BENJAKUL S, KIJROONGROJANA K, et al. The effect of heating conditions on polyphenol oxidase, proteases and melanosis in pre-cooked Pacific white shrimp during refrigerated storage[J]. Food Chemistry, 2012, 131(4): 1370-1375. DOI:10.1016/j.foodchem.2011.10.001.
[22] GIOACCHINO B, CINZIA B, ANTONINO C, et al. Effect of temporal variation, gender and size on cuticle polyphenol oxidase activity in deep-water rose shrimp (Parapenaeus longirostris)[J]. Food Chemistry,2010, 123(2): 489-493. DOI:10.1016/j.foodchem.2010.04.055.
[23] 陈闽榕. 对虾微冻保鲜技术及多酚氧化酶的生化特性研究[D]. 福州: 福建农林大学, 2009: 40-41.
[24] 张轶群, 林洪, 李振兴, 等. 虾过敏原蛋白纯化中硫酸铵沉淀法的改进[J]. 食品与药品, 2008(11): 50-52.
[25] 钱韻芳, 谢晶, 吴文惠. 虾类保藏过程中酚氧化酶酶促黑变作用机理及其抑制方法的研究进展[J]. 食品工业科技, 2012, 33(22): 400-405. DOI:10.13386/j.issn1002-0306.2012.22.092.
[26] 冯寅洁, 冯成玉, 应铁进. 食品中多酚氧化酶的性质及抑制方法[J].食品工业, 2013(7): 174-178.
[27] 谢军, 孙晓红, 潘迎捷, 等. 电解水的保存特性及杀菌效果[J]. 江苏农业学报, 2010, 26(5): 1053-1059.
[28] 张海均, 贾冬英, 孙慧, 等. 石榴皮多酚提取物及纯化物对α-葡萄糖苷酶的抑制作用研究[J]. 天然产物研究与开发, 2012, 24(9): 1253-1256. DOI:10.16333/j.1001-6880.2012.09.022.
[29] ZHANG J P, CHEN Q X, SONG K K, et al. Inhibitory effects of salicylic acid family compounds on the diphenolase activity of mushroom tyrosinase[J]. Food Chemistry, 2006, 95(4): 579-584.DOI:10.1016/j.foodchem.2005.01.042.
[30] 刘杰超, 焦中高, 张春岭, 等. 苹果多酚提取物对酪氨酸酶的抑制作用[J]. 日用化学工业, 2013, 43(6): 414-417. DOI:10.13218/j.cnki.csdc.2013.06.011.
