超声改性大豆分离蛋白与大豆可溶性多糖复合乳化体系的冻融稳定性研究
2018-05-25史博瑞孙红波齐宝坤江连洲隋晓楠
丁 俭,李 杨,史博瑞,孙红波,齐宝坤,江连洲,隋晓楠*
大豆分离蛋白作为天然的乳化剂可以形成O/W型乳状液,是调味料、饮料、冰淇淋、蛋黄酱等食品的重要原料,在食品工业中具有广泛的应用。为了延长食品的保质期、抑制微生物生长和维持食品的化学稳定性,通常采用冷冻贮藏的方法,而蛋白乳状液是一种非均多相分散体系,其不稳定等问题极大地影响了食品的品质和感官特性。因此,许多研究者利用物理(加热、超声、微波、超高压处理等)[1-4]、化学(化学试剂改性、糖基化等)[5-7]和酶法(限制性酶解、生物修饰等)[8]等方式改变蛋白质的空间结构和分子特性,从而改善蛋白的功能特性。也有研究通过在蛋白形成的乳液中加入多糖、果胶等大分子,增加乳液的界面层厚度、静电斥力和空间位阻的作用,强化乳液的稳定性[9]。
在食品加工过程中,乳液通常会经历反复的冻融循环,在冷冻-解冻的过程中会发生各种物理化学变化,包括脂肪结晶、水的冻结、乳液冷冻浓缩、界面相变和生物大分子构象改变等[9],从而影响乳液的稳定性。乳液的这些冻融变化会对产品的品质、外观、风味产生重要影响,而乳液的冻融稳定性与多种因素有关,包括乳液的剪切加工条件、乳化剂的类型、油相的组成、冻融环境等[10-11]。Yerramilli等[12]对比研究了大豆分离蛋白和酪蛋白酸钠等不同乳化剂对乳液的冻融稳定性影响,发现大豆分离蛋白在冷冻处理过程中会造成界面聚合和乳液失稳,而酪蛋白酸钠并没有发生界面乳化剂的聚合。Estevez等[13]的研究发现,界面组成、加工条件等对乳液的形成机制及稳定性有一定的影响,而在乳液冷冻过程中脂肪的结晶也不尽相同。Hjorth等[14]研究纯油体系的甘油酯的结晶,表明在快速冷冻时通常会得到α型晶体,然后保持略高的温度继续冷冻会转变成熔点较高的β’晶型和β晶型。综上所述,目前关于乳化剂对纯油体系结晶和乳液的加工手段对乳液冻融稳定性影响的研究较多,但对改性大豆分离蛋白-多糖形成的乳化体系中乳液的稳定机理与乳液结构特性的构效关系研究相对较少。本研究以不同超声处理的大豆分离蛋白作为乳化剂,利用大豆可溶性多糖作为分散剂,研究蛋白与多糖协同稳定乳液的特性,揭示通过超声改变蛋白质构象、展开柔性结构与多糖交互作用对乳液界面的影响,对所形成的乳液在冷冻-解冻过程中失稳机理进行分析研究,通过对冻融前后乳液粒径、电位和激光共聚焦微观结构观察,对比分析乳液中固脂含量(solid fat content,SFC)、油脂被乳化量的差异,探究不同结构特性的复合物作为乳化剂对体系冻融稳定性和乳滴聚结程度的影响,从而解析乳液的稳定机理。
1 材料与方法
1.1 材料与试剂
大豆多糖(商品级) 郑州荔诺生物有限公司;低温脱脂豆粕 山东禹王公司;葵花籽油 上海佳格食品有限公司。
氢氧化钠 天津市光复精细化工研究所;盐酸北京新光化工试剂厂;磷酸二氢钠、磷酸氢二钠 天津市东丽区天大化学试剂厂;所有试剂均为国产分析纯。
1.2 仪器与设备
超声波细胞破碎仪 宁波新芝生物科技股份有限公司;均质机 上海标本模型有限公司;LGR20-W台式高速冷冻离心机 北京京立离心机有限公司;Mastersizer 2000激光粒度仪、电位及纳米粒度分析仪英国马尔文仪器有限公司;激光共聚焦扫描显微镜德国徕卡公司;FD-1A-50真空冷冻干燥机 上海比朗仪器有限公司;超低温冰箱 上海茸研公司;UV-5100型高性能紫外-可见分光光度计 上海奥析科学仪器;MAGNA-IR560傅里叶变换红外光谱仪 美国NICOLET公司;Q1000示差扫描量热仪 美国TA仪器;Minispec l20/100RTS脉冲核磁共振仪 德国Bruker公司;ICI-2数显型恒温水浴锅 金坛市精达仪器制造厂。
1.3 方法
1.3.1 大豆分离蛋白的提取
大豆分离蛋白的提取参考Wolf[15]的方法。将低温脱脂豆粕粉碎过60 目筛,将粉碎物与水按1∶10(m/V)的比例混合,然后用2 mol/L的NaOH溶液调节溶液的pH值至8.5,45 ℃搅拌2 h后,将其悬浮液在4 ℃条件下10 000×g离心20 min,取上层清液用2 mol/L HCl溶液调节pH值至4.5。静置30 min后在4 ℃条件下6 000×g离心20 min,所得蛋白沉淀水洗2 次,最后用2 mol/L NaOH溶液调节pH值至7.0。将溶液冷冻干燥后研磨,即得大豆分离蛋白。
1.3.2 大豆分离蛋白的超声处理
配制4 组大豆分离蛋白溶液,将大豆分离蛋白溶解在0.05 mmol/L pH 7.0的磷酸盐缓冲液中,使其质量浓度为50 mg/mL,大豆分离蛋白溶液在不同的超声功率(0、200、300、400、500 W)下超声15 min,在室温下搅拌2 h[16]。
1.3.3 不同超声处理大豆分离蛋白与大豆可溶性多糖复合乳液的制备
将未超声的大豆分离蛋白和超声改性后的大豆分离蛋白稀释后搅拌,然后将大豆分离蛋白溶液向可溶性多糖溶液中边滴加边磁力搅拌,大豆分离蛋白与可溶性多糖的质量比为3∶1,用2 mol/L HCl溶液将体系pH值调节至3.0,磁力搅拌3 h形成复合物,然后分别加入质量分数2.5%的葵花籽油,20 000 r/min均质3 min,制备出不同类型的乳液[17]。
1.3.4 乳液的冻融处理
将制备得到的乳液立即进行冻融处理。取不同的乳液样品50 mL装入塑料容器中,在-20 ℃的冰箱中恒温贮存24 h,将冷冻后的样品在20 ℃水浴中解冻,取部分样品保持20 ℃不变并进行分析。再将解冻的乳液置于-20 ℃冰箱中恒温贮存24 h,进行第二次冻融循环,最后得到的样品在进行分析前保持20 ℃不变。
1.3.5 冻融前后乳液的微观结构分析
通过观察乳液的微观结构分析乳液的冻融稳定特性。将未处理的乳液和经过冻融处理的各乳液利用尼罗红进行染色,取1 mL乳液样品加入40 μL染色液,混合均匀后染色30 min,取染色的乳液样品一滴,置于带凹槽的载玻片上,盖上盖玻片并用甘油密封。在激发光波长488 nm下进行激光共聚焦扫描,使用油镜进行图像采集,分辨率为1 024×1 024,避免玻片上污染物对图像的影响。
1.3.6 乳液Zeta电位和平均粒径的测定
将未处理的乳液和冻融后的乳液分散在去离子水中,乳液质量分数为0.005%,在常温下测定其Zeta电位,测定时温度为25 ℃,每个样品平行测定3 次。将乳液分散到去离子水中,质量分数为0.1%,用激光粒度仪测定其乳液的粒径分布,达到相应的遮光度后进行测定,每个样品平行测定3 次[18]。
1.3.7 乳液中油脂等温结晶SFC的测定
将乳液样品放入低场脉冲核磁共振仪的专用玻璃样品管中,在60 ℃下恒温水浴30 min,充分熔化以消除热历史对结晶的影响,转移至0 ℃恒温水浴器中保持60 min,测定其SFC,再升温至20 ℃,测定在此温度下不同乳液中油脂在结晶过程中SFC的变化。
1.3.8 乳液冻融循环后油脂被乳化量的测定
采用染料稀释法来确定冻融后乳液油脂释放量,实验根据Palazolo等[19]的方法作少许修改。利用质量分数0.001 5%的苏丹III染液与葵花籽油混合,磁力搅拌过夜。选择波长为508 nm,以葵花籽油为空白对照,得到标准曲线。将4 g苏丹III染液与16 g冻融处理后的乳液样品轻轻混合,静置60 min后700×g离心20 min。从乳液的顶部等量吸取1.5 mL油状物,在高速离心机15 000×g条件下离心20 min。上清液在508 nm波长处测定吸光度,染料的吸光度与游离油量变化相关,根据下式计算乳液油脂被乳化量。

式中:m0为苏丹III染液质量/g;me为乳液样品质量/g;φe为乳液中油脂的含量/%;A=Ab/Aa,其中Aa、Ab分别为乳液冻融处理前、后加入染料的吸光度。
1.3.9 傅里叶变换红外光谱分析
将超声处理后的大豆分离蛋白溶液进行冻干,冻干后的样品置于干燥器中用P2O5充分干燥,取样品1.5 mg,与200 mg溴化钾研磨混匀后压片进行红外光谱测定。在实验过程中,为了减少蒸汽的干扰,用干燥的N2持续注入测量室。测定时波数范围为4 000~400 cm-1,扫描次数为64 次,分辨率4 cm-1,得到的红外吸收曲线采用Peak fitting软件和高斯曲线拟合,分析大豆分离蛋白不同超声功率下的二级结构含量的变化[20]。
1.4 数据统计分析
每个实验重复3 次,结果以±s表示。采用SPSS软件对数值进行ANOVA差异显著性分析,以P<0.05表示差异显著。采用Origin 8.0软件作图。
2 结果与分析
2.1 乳液的微观结构与粒径分布
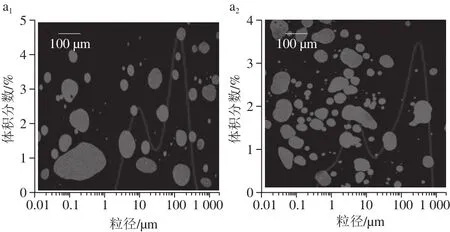
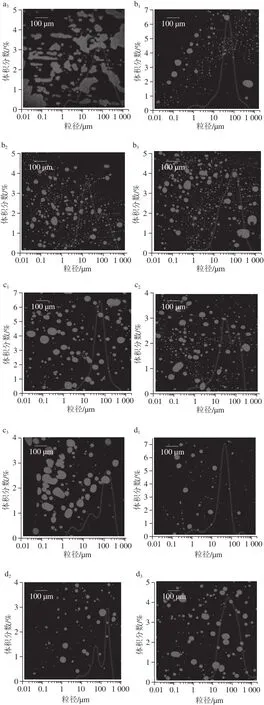

图1 不同超声处理的大豆分离蛋白与大豆可溶性多糖复合乳液2 次冻融循环前后的微观结构与粒径分布Fig. 1 Micrstructures of ultrasonic-modified SPI-SSP emulsions before and after two freeze-thaw cycles
激光共聚焦显微镜可以直观地反映出乳液颗粒大小、分散状况及产生的不稳定现象。由图1可知,经第一次冻融循环后,未经超声处理组在加入大豆可溶性多糖的乳液中冻融稳定性最差,第二次冻融后乳滴出现成片聚集,这是由于未经处理的大豆分离蛋白与大豆可溶性多糖复合后,其蛋白的乳化性较差,乳液的界面膜不稳定,冷冻时形成的冰晶很容易刺穿界面膜,在热融时发生油滴之间的聚集。随着超声功率的增加,高功率超声处理的大豆分离蛋白与大豆可溶性多糖形成的复合乳液,其乳液粒径相对较小,分布在50 μm左右且呈球形。400 W和500 W超声的蛋白乳液冻融后也发生了乳滴的部分絮凝和聚集,但粒径增加较小,随着功率的增加这种不稳定现象逐渐减弱。
超声处理使蛋白的乳化性能增加,在油-水混合体系中能够迅速地在油滴表面形成界面膜,而且超声处理后大豆分离蛋白的柔韧性和空间结构改变[21],形成的乳液膜更加致密,使乳液在冷冻条件下固体脂肪晶体和冰晶很难渗透破坏界面膜,有效抑制了低温状态下油滴之间的聚结和絮凝,从而改善了乳液的冻融稳定性。说明超声处理得到的蛋白与大豆可溶性多糖复合,其分子结构的不同对乳状液稳定性的影响可能不同。
2.2 乳液电位变化
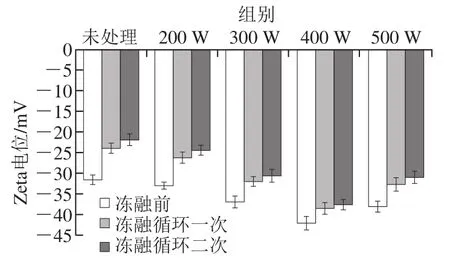
图2 不同超声处理的大豆分离蛋白与大豆可溶性多糖复合乳液冻融前后的Zeta电位变化Fig. 2 Change in zeta-potential of ultrasonic-modified SPI-SSP emulsions after freeze-thaw treatments
乳液的表面电荷密度能有效反应乳滴之间的静电相互作用。如图2所示,在pH 7.0的缓冲溶液中,未经超声处理的大豆分离蛋白形成乳液加入大豆可溶性多糖后Zeta电位为-25.29 mV,随着超声功率的增加,整体的电位绝对值呈先升高后降低的趋势,经冻融循环后乳液的电位绝对值都有所下降,稳定性也发生了明显的减弱。经400 W超声处理的大豆分离蛋白形成的乳液与大豆可溶性多糖复合后Zeta电位为-42 mV,表面电荷密度最大,结合乳液的粒径分布和微观结构分析,说明此乳液的冻融稳定性最好。第二次冻融后乳液表面的电荷绝对值进一步降低。这是由于不同的超声处理使大豆分离蛋白的柔性区域和二级结构构象发生改变[22],使蛋白质结合大豆可溶性多糖的分子数不同,蛋白质结构的伸展和构象的改变影响了多糖分子的结合,造成乳液表面所带电荷的不同。此外,多糖可以吸附到蛋白质层形成界面络合物,从而有效地避免界面复合物降解,增加乳液的稳定性[23]。Thanasukarn等[24]的研究认为,在冻融处理过程中乳液的蛋白质分子会从油滴表面解吸出来,降低蛋白质的乳化效率,同时表面电荷的减少导致乳液冷冻处理后油滴之间斥力减弱发生聚结。
2.3 乳液不同温度下SFC的变化
不同超声处理蛋白形成的乳液加入大豆可溶性多糖后,在等温结晶过程中SFC随时间变化的速率曲线如图3所示。不同乳液SFC曲线的形状不同,在20 ℃较高的结晶温度下,乳液的SFC没有明显的变化,因为温度较高的乳液中油脂结晶困难,SFC增加较为缓慢。随着等温结晶贮藏温度的降低,不同超声功率处理组SFC的增加速率有所不同,从12 ℃的室温条件下降到-4 ℃的过程中,未经超声处理的蛋白乳液固体脂肪结晶的起始温度为8 ℃,而处理后的蛋白乳液固体脂肪结晶的起始温度都有所延迟,当达到2.5 ℃左右时,乳液中SFC最大,且平衡时的SFC相同,但SFC的增加速率不同。这表明随着超声功率的增加,乳液中固体脂肪结晶的速率增加,说明乳液表面的复合物仅影响体系的结晶速率,并未影响乳液中油脂结晶平衡时的SFC,这与Palazolo等[19]的结论相吻合。但经过2 次冻融循环后乳液都发生不稳定絮凝,可能是由于乳液油脂结晶速率的不同,产生不同形状的晶体结构,影响乳液形状的变化,使乳液在经过冻融处理时产生不稳定性的差异。造成乳液中油脂结晶速率不同的原因还可能是由于超声处理使蛋白分子质量产生不同,当蛋白的分子质量与油脂酰基链长相接近时,蛋白质分子就会并入结晶网络或吸附于结晶位点,加强结晶的影响,同时促进同质多晶转变的产生,影响乳液的稳定性[25]。

图3 不同超声处理的大豆分离蛋白与大豆可溶性多糖复合乳液等温结晶SFC变化Fig. 3 Change in SFC during isothermal crystallizations of ultrasonic-modified SPI-SSP emulsions
2.4 乳液冻融循环后油脂的被乳化量
不同乳液经2 次冻融循环后油脂的被乳化量如表1所示,未经超声处理的蛋白与多糖复合乳液表现出高度的不稳定性,经第二次冻融处理后油脂的被乳化量从(3.50±0.20)%降低到(1.20±0.07)%,结合粒径变化的聚结程度说明,此时乳液的界面膜不稳定,在冻融的过程中容易发生破裂。其他经过超声处理的蛋白与多糖复合乳液也发生了不同程度的聚集,但游离油的释放量少于未经超声处理的蛋白与多糖复合乳液,而且随着超声功率的增加,乳液中游离油的释放量先降低后升高,与共聚焦粒径图分析结果一致。乳液中游离油的释放量依次为:未经超声处理的蛋白乳液>200 W超声处理>300 W超声处理>500 W超声处理>400 W超声处理。游离油的产生是由于乳液在冻融处理的过程中降低了水相中自由水的含量,乳滴相互靠近发生聚结,造成油脂释放。其结果表明乳液中乳化剂的特性不同影响乳液的稳定性,乳液不稳定聚集较为明显的现象主要发生在未经超声处理和200、300 W超声处理的蛋白乳液,可能由于未经超声处理和低功率处理的蛋白乳化性和柔性较差,空间构象和分子结构与水相中大豆可溶性多糖分子键合的能力较弱,形成较薄的界面膜,使乳液的油-水大分子晶体很容易从乳滴中穿透,发生聚结。另一方面,由于乳液中油脂和水在此温度下都发生结晶,水的结晶会促进乳滴间靠近发生絮凝,水分的冻结也会降低乳液表面蛋白的水化程度并出现乳滴的聚集[26-27]。

表1 不同乳液经冻融循环后油脂的被乳化量Table 1 Amount of emulsified oil in different emulsion systems after freeze-thaw cycles%
2.5 超声处理大豆分离蛋白傅里叶变换红外光谱分析
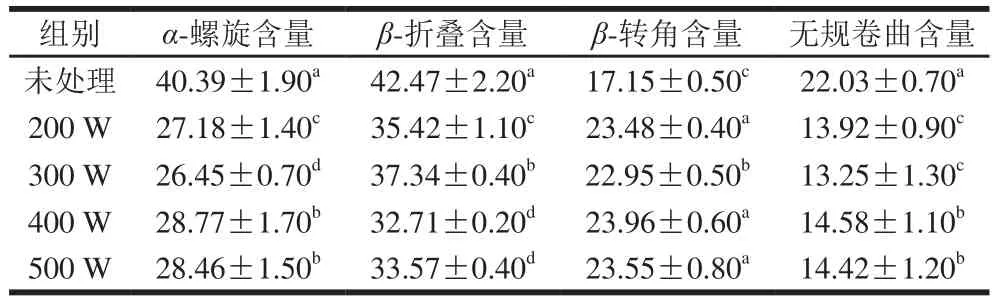
表2 不同超声条件下大豆分离蛋白的二级结构含量Table 2 Secondary structure contents of SPI under different ultrasonic treatment conditions%

图4 不同超声处理的大豆分离蛋白傅里叶变换红外光谱图Fig. 4 Fourier transform infrared spectra of SPI subjected to different ultrasonic treatments
由表2、图4可见,大豆分离蛋白的二级结构在超声处理时表现出不同的含量,与Li Chen等[28]的研究结果一致,在超声处理的样品中,经过400 W超声处理蛋白质的α-螺旋、β-转角和无规卷曲含量最高,β-折叠含量最低。Ruan Jishou等[29]提出蛋白质的柔性区域为在蛋白质分子中空间结构易于发生改变的部分,可以连接各段刚性区间调整相对位置关系,蛋白质的二级结构折叠形成螺旋或线状会影响蛋白质的空间构象。通过上述研究表明,400 W超声处理的蛋白质二级结构的空间构象更易于形成界面吸附。另外,蛋白质的二级结构取决于氨基酸序列和蛋白质分子构象的稳定性,超声波产生的空化作用导致蛋白质二级结构的变化。Fainerman等[30]的研究表明,蛋白质的无规卷曲结构可以形成较厚的界面膜,抵抗乳液的聚集。本实验中400 W超声处理的大豆分离蛋白无规卷曲含量较高,因此能够形成较厚的蛋白膜。而且此时蛋白的二级结构影响蛋白质整体构象的柔韧性和内部肽链结构的改变和伸展,同时影响与多糖分子的键合作用,进而影响复合物的界面特性。但超声功率过高反而使蛋白质发生聚集无法伸展,影响蛋白的界面活性,造成了500 W超声条件下乳液的不稳定。因此,超声处理得到的蛋白质二级结构的构象改变也是影响乳液冻融稳定性的重要因素。
3 结 论
经不同超声处理的大豆分离蛋白与大豆可溶性多糖所形成乳液具有不同的冻融稳定性,400 W超声处理的大豆分离蛋白与大豆可溶性多糖复合形成乳液,经2 次冻融循环后乳滴聚结程度最小,表现出较好的界面稳定特性。
不同超声功率处理的大豆分离蛋白与大豆可溶性多糖所形成乳液在等温结晶过程中SFC增加速率不同,但最终含量相同;结合油脂被乳化量分析不同乳液冻融前后稳定性,表明400 W超声处理的大豆分离蛋白与大豆可溶性多糖复合形成的乳液经2 次冻融循环后游离油的释放量最小,表明乳化剂特性、分子结构对乳液稳定性的影响较大。而且适当的超声功率处理使大豆分离蛋白的空间构象和分子结构发生改变,更多地键合大豆可溶性多糖,增加乳液界面膜的厚度,提高乳液的稳定性,防止脂肪结晶和冰晶穿透界面膜,从而发生乳滴的聚结。
超声处理改变了大豆分离蛋白二级结构的含量和蛋白柔性,400 W超声处理大豆分离蛋白中无规卷曲的含量最高,无规卷曲的松散结构使蛋白柔性增加,更易发生改变和伸展,进而影响乳液的界面稳定性,说明乳液冻融稳定性与乳液界面层厚度和蛋白结构特性有关。
参考文献:
[1] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J].Journal of Food Engineering, 2014, 121(1): 15-23. DOI:10.1016/j.jfoodeng.2013.08.012.
[2] FLOURY J, DESRUMAUX A, LEGRAND J. Effect of ultra-highpressure homogenization on structure and on rheological properties of soy isolated protein-stabilized emulsions[J]. Journal of Food Science,2002, 67(9): 3388-3395. DOI:10.1111/j.1365-2621.2002.tb09595.x.
[3] KNORR D, HEINZ V, BUCKOW R. High pressure application for food biopolymers[J]. Biochimica et Biophysica Acta Proteins & Proteomics, 2006, 1764(3): 619-631. DOI:10.1016/j.bbapap.2006.01.017.
[4] YANN D, ARNAUD S J, ANNIINA S, et al. Strong improvement of interfacial properties can result from slight structural modifications of proteins: the case of native and dry-heated lysozyme[J]. Langmuir,2011, 27(24): 14947-14957. DOI:10.1021/la203485y.
[5] SUBIRADE M, LOUPIL F, ALLAIN A F, et al. Effect of dynamic high pressure on the secondary structure of β-lactoglobulin and on its conformational properties as determined by Fourier transform infrared spectroscopy[J]. Inter-National Dairy Journal, 1998, 8(2): 135-140.DOI:10.1016/S0958-6946(98)00034-X.
[6] XIA N, WANG J, YANG X, et al. Preparation and characterization of protein from heat-stabilized rice bran using hydrothermal cooking combined with amylase pretreatment[J]. Journal of Food Engineering,2012, 110(1): 95-101. DOI:10.1016/j.jfoodeng.2011.12.004.
[7] XU W, WANG H B, XIANG T. A comparison of gelling properties stability of dry-heating and maillard-type egg white proteins[J].Advanced Materials Research, 2015, 3857: 287-290. DOI:10.4028/www.scientific.net/AMR.1095.287.
[8] 张晋博. 多糖对大豆分离蛋白的修饰及其界面、乳化和凝胶性质的研究[D]. 广州: 华南理工大学, 2013: 57-87.
[9] MCCLEMENTS D J. Protein-stabilized emulsions[J]. Current Opinion in Colloid and Interface Science, 2004, 9(5): 305-313. DOI:10.1016/j.cocis.2004.09.003.
[10] SANCHEZ C C, PATINO J M R. Interfacial, foaming and emulsifying characteristics of sodium caseinate as influenced by protein concentration in solution[J]. Food Hydrocolloids, 2005, 19(3): 407-416. DOI:10.1016/j.foodhyd.2004.10.007.
[11] GHOSH S, COUPLAND J N. Factors affecting the freeze-thaw stability of emulsions[J]. Food Hydrocolloids, 2008, 22(1): 105-111.DOI:10.1016/j.foodhyd.2007.04.013.
[12] YERRAMILLI M, LONGMORE N, GHOSH S. Improved stabilization of nanoemulsions by partial replacement of sodium caseinate with pea protein isolate[J]. Food Hydrocolloids, 2017, 64:99-111. DOI:10.1016/j.foodhyd.2016.10.027.
[13] ESTEVEZ C A, TORO-VAZQUEZ F J, HARTEL R W. Effects of processing and composition on the crystallization and mechanical properties of water-in-oil emulsions[J]. Journal of the American Oil Chemists Society, 2013, 90(8): 1195-1201. DOI:10.1007/s11746-013-2268-2.
[14] HJORTH J L, WOODLEY J, KIIL S, et al. Mathematical modeling of vegetable-oil crystallization[J]. Technical University of Denmark,2014, 5(9): 191-195.
[15] WOLF W J. Soybean proteins. their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6):969-976. DOI:10.1021/jf60172a025.
[16] HU H, WU J, LI-CHAN C Y E, et al. Effects of ultrasound on structural and physical properties of soy isolated protein isolate(SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[17] RAY M, ROUSSEAU D. Stabilization of oil-in-water emulsions using mixtures of denatured soy whey proteins and soluble soybean polysaccharides[J]. Food Research International, 2013, 52(1):298-307. DOI:10.1016/j.foodres.2013.03.008.
[18] TRAN T, ROUSSEAU D. Stabilization of acidic soy proteinbased dispersions and emulsions by soy soluble polysaccharides[J].Food Hydrocolloids, 2013, 30(1): 382-392. DOI:10.1016/j.foodhyd.2012.06.001.
[19] PALAZOLO G G, MITIDIERI F E, WAGNER J R. Relationship between interfacial behaviour of native and denatured soybean isolates and microstructure and coalescence of oil in water emulsions: effect of salt and protein concentration[J]. Food Science and Technology International, 2003, 9(6): 409-419.
[20] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J].Biochim Biophys Acta, 1988, 952(2): 115-130. DOI:10.1016/0167-4838(88)90107-0.
[21] WANG Z J, HAN F F, SUI X N, et al. Effect of ultrasound treatment on the wet heating Maillard reaction between mung bean (Vigna radiate L.) protein isolates and glucose and on structural and physicochemical properties of conjugates[J]. Journal of the Science of Food and Agriculture, 2016, 96(5): 1532-1540. DOI:10.1002/jsfa.7255.
[22] JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009,93(4): 386-393. DOI:10.1016/j.jfoodeng.2009.02.001.
[23] ROPERS M H, NOVALES B, BOUÉ F, et al. Polysaccharide/surfactant complexes at the air-water interface-effect of the charge density on interfacial and foaming behaviors[J]. Langmuir, 2008,24(22): 12849-12857. DOI:10.1021/la802357m.
[24] THANASUKARN P, PONGSAWATMANIT R, MCCLEMENTS J D.Influence of emulsifier type on freeze-thaw stability of hydrogenated palm oil-in-water emulsions[J]. Food Hydrocolloids, 2004, 18(6):1033-1043. DOI:10.1016/j.foodhyd.2004.04.010.
[25] PALAZOLO G G, SORGENTINI D A, WAGNER J R. Emulsifying properties and surface behavior of native and denatured whey soy proteins in comparison with other proteins. creaming stability of oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society,2004, 81(7): 625-632. DOI:10.1007/s11746-004-953-0.
[26] GOIBIER L, LECOMTE S, LEAL-CALDERON F, et al. The effect of surfactant crystallization on partial coalescence in O/W emulsions[J].Journal of Colloid and Interface Science, 2017, 500: 304-314.DOI:10.1016/j.jcis.2017.04.021.
[27] MCCLEMENTS D J, DUNGAN S R, GERMAN J B, et al. Droplet size and emulsifier type affect crystallization and melting of hydrocarbon-in-water emulsions[J]. Journal of Food Science, 1993,58(5): 1148-1151. DOI:10.1111/j.1365-2621.1993.tb06135.x.
[28] LI Chen, HUANG Xingjian, PENG Qiang, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5):1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[29] RUAN Jishou, CHEN Ke, TUSZYNSKI J A, et al. Quantitative analysis of the conservation of the tertiary structure of protein segments[J]. Research in Science Education, 2006, 25(5): 301-315.DOI:10.1007/s10930-006-9016-5.
[30] FAINERMAN V B, LUCASSEN-REYNDERS E H, MILLER R.Description of the adsorption behaviour of proteins at water/fluid interfaces in the framework of a two-dimensional solution model[J].Advances in Colloid & Interface Science, 2003, 106(12): 237-259.DOI:10.1016/S0001-8686(03)00112-X.
