超声对花色苷稳定性的影响及其降解动力学
2018-05-25李澜奇陈健乐刘闪闪陈士国叶兴乾
龚 辉,傅 丽,李澜奇,陈健乐,刘闪闪,陈士国,叶兴乾*
花色苷是一种广泛分布于自然界的水溶性天然色素,在化学结构上是2-苯基苯并吡喃阳离子的多羟基或多甲氧基衍生物[1],属于多酚类化合物中的黄酮类物质[2]。目前已经报道的花色苷有700多种[3],其中最常见的6 种分别是飞燕草素(delphinidin,Dp)-3-葡萄糖苷(glucoside,glu)、矢车菊素(cyanidin,Cy)-3-葡萄糖苷、天竺葵素(pelargonidin,Pg)-3-葡萄糖苷、锦葵素(malvidin,Mv)-3-葡萄糖苷、芍药素(peonidin,Pn)-3-葡萄糖苷、矮牵牛素(petunidin,Pt)-3-葡萄糖苷[4],6 种常见花色苷的化学结构如图1所示。
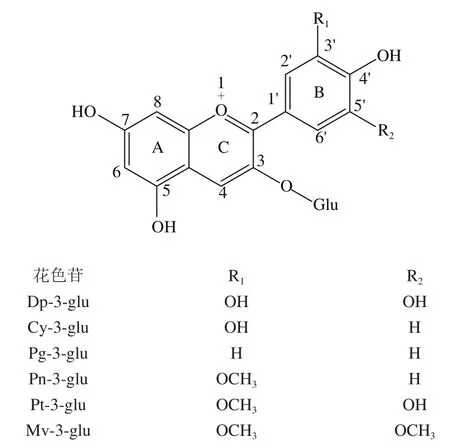
图1 6 种常见花色苷的化学结构Fig. 1 Structural classification of six common anthocyanidins
天然来源的花色苷具有安全性高、无副作用的优点,是优良的食品着色剂[5],随着消费者对合成色素越来越排斥,花色苷将成为一种具有良好应用前景的天然着色剂。同时,许多研究也表明,花色苷对人体健康具有一定的促进作用,如预防心血管疾病[6-7]、减肥[8]、抗炎[1]、预防糖尿病、保护视力[9]、抗菌、抗肿瘤[10-11]等。因此花色苷的提取分离是花色苷研究的重要内容之一。
超声作为一种简单高效、节约成本的提取手段,已经广泛应用于天然产物的提取研究中,大多数研究证明,相比于传统浸提法,超声辅助提取能够明显提高目标成分的提取量[12]。然而,超声过程中由于空化效应产生的羟自由基可能会与易于氧化的相关成分发生反应,取决于不同的加工目的和食品基质,这种超声空化作用引起的化学效应可能有害也可能有益[12]。有文献报道,超声处理能够引起胡萝卜素[13]、咖啡酸和芥子酸[14]的降解以及多糖的聚合与裂解[15-16]。而超声处理对花色苷稳定性的影响也有少量报道,Tiwari等[17]用超声处理草莓汁,发现当处理条件达到最大值时(振幅100%,20 kHz,10 min,脉冲5 s、间歇5 s)花色苷会有3.2%的降解。Dubrovic等[18]研究发现,与未超声的草莓汁相比,超声(20 ℃,3、6、9 min)和热超声(40 ℃,3、6、9 min和60 ℃,3、6 min)处理后的草莓汁花色苷含量会下降0.7%~4.4%,而在55 ℃下超声处理9 min,花色苷含量会下降5.8%~7.1%。Carrera等[19]在超声提取(200 W、24 kHz)红葡萄花色苷的研究中,发现超声处理时间为6 min时,花色苷产量达到最大,超声提取15 min时花色苷产量显著性下降。Mohideen等[20]的研究也发现,和未超声的蓝莓汁相比(花色苷质量浓度(408.29±21.60) mg/L),当超声振幅从40%增加至80%和100%时,花色苷质量浓度依次下降为(401.61±23.67)、(397.26±18.23)、(393.58±17.45) mg/L。
目前超声辅助提取花色苷以工艺优化研究居多,且大多研究探讨超声对花色苷提取总量的影响[21-23],而超声对花色苷稳定性影响规律、降解动力学及可能的降解过程却鲜有报道。因此,本研究拟采用单因素试验探究超声提取模拟体系中4 种超声因素(功率密度、温度、溶剂、pH值)对花色苷稳定性的影响规律,同时根据经典化学反应模型,采用试错法分析花色苷在超声场下的降解动力学,包括反应级数、半衰期、反应速率常数等。并结合液相色谱-质谱联用技术对超声处理后的花色苷降解产物进行鉴定,以期为超声辅助提取花色苷的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
5 种花色苷标准品:飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷(纯度均大于95%) 美国Sigma公司;甲醇、乙腈、甲酸(色谱级) 上海阿拉丁生化科技股份有限公司;纯净水 杭州娃哈哈集团有限公司;盐酸(优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
2695高效液相色谱(high performance liquid chromatography,HPLC)系统(配有可变波长紫外检测器和Empower色谱工作站) 美国Waters公司;1100液相色谱-质谱联用仪(配有电喷雾离子源和Mass Hunter Qualitative Analysis B.07工作站) 美国Agilent公司;PHS-550 pH计 杭州陆恒生物科技有限公司;MS105DU电子天平 瑞士Mettler Toledo公司;浴式超声波装置 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 超声条件对花色苷稳定性的影响
1.3.1.1 花色苷超声处理
准确称取飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷各1.00 mg,溶解到pH 2的70%(体积分数,下同)甲醇溶液中。用25 mL容量瓶配制40 μg/mL的混合物母液,取5 mL母液加35 mL 70%甲醇配制成5 μg/mL的稀释液。取2 mL 5 μg/mL的稀释液加入超声管,密封后进行超声处理,每个梯度做3 个平行。采用单因素试验研究超声功率密度(27、81、135、189、243 W/L)、温度(10、25、40、55、70 ℃)、溶剂(100%甲醇、70%甲醇、100%乙醇、70%乙醇、水)、pH值(1、2、3、4、5)4 种因素对常见的5 种花色苷的稳定性影响规律。单因素试验设置的前提条件如下:溶剂为70%甲醇;温度10 ℃;时间10 min;pH 2;功率密度为135 W/L。超声处理的功率密度、溶剂、温度、pH值按照单因素试验设计进行,超声处理后的样品过0.22 μ m有机滤膜后存放在-20 ℃冰箱用于HPLC检测。
1.3.1.2 花色苷HPLC测定
参照Tiwari等[24]的方法并加以改进,对5 种花色苷进行定量。液相条件:Agilent ZORBAX SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相:A相为5%甲酸溶液,B相为100%甲醇。洗脱程序为:0~25 min:15%~35% B;25~30 min:35%~15% B。检测波长520 nm,流速为1 mL/min,柱温设置30 ℃,进样量10 μL。外标法绘制5 种花色苷的标准曲线,在1.00~9.00 μg/mL范围内标准样品的浓度与峰面积具有良好的线性相关(R2≥0.996)。
1.3.2 花色苷超声降解动力学模型构建
釆用试错法构建10 ℃下pH 2的70%甲醇中,功率密度135 W/L时5 种花色苷在超声波处理0~70 min内的降解动力学模型。该方法具体原理如下:假设级数为零、一、二、三级,则反应物质量浓度ρ与时间t、反应物质量浓度的对数ln ρ与时间t、反应物质量浓度的倒数1/ρ与时间t、反应物质量浓度的倒数平方1/ρ2与时间t呈线性关系,相应线性回归系数最高的模型可以确定为花色苷超声降解动力学模型。零、一、二、三级动力学模型如式(1)~(4)所示。

式中:ρ为反应物质量浓度/(μg/mL);ρ0为反应物初始质量浓度/(μg/mL);k为反应速率常数/(μg/(mL·min));t为反应时间/min。
1.3.3 花色苷超声降解产物液相色谱-质谱联用分析
参考Sadilova等[25]的液相色谱-质谱联用分析方法,液相条件:色谱柱Agilent ZORBAX SB C18(250 mm×4.6 mm,5 μm);流动相:A相为0.5%甲酸溶液,B相为100%乙腈。洗脱程序为:0~5 min:100% A,5~20 min:100%~90% A,20~40 min:90%~87% A,40~44 min:87%~80% A,44~50 min:80%~75% A,50~55 min:75%~100% A。检测波长280 nm,流速1 mL/min,柱温25 ℃,进样量20 μL。
质谱条件:电喷雾离子源;正负离子同时扫描;质量扫描范围m/z 100~1 000;干燥气流速5 L/min;干燥气温度325 ℃;雾化器压力310 kPa;鞘气温度为350 ℃;鞘气流速11 L/min;阳离子模式毛细管电压为3 000 V,阴离子模式毛细管电压为3 500 V。
1.4 数据处理
实验结果以平均值±标准差表示,使用Origin 2016软件绘制图表,SPSS 19.0软件进行单因素方差分析及差异显著性分析(邓肯氏多项式比较),P<0.05表示差异显著。同时采用Chemical Draw 15.0软件绘制超声降解过程图。
2 结果与分析
2.1 超声条件对花色苷稳定性的影响
2.1.1 超声功率密度对花色苷稳定性影响
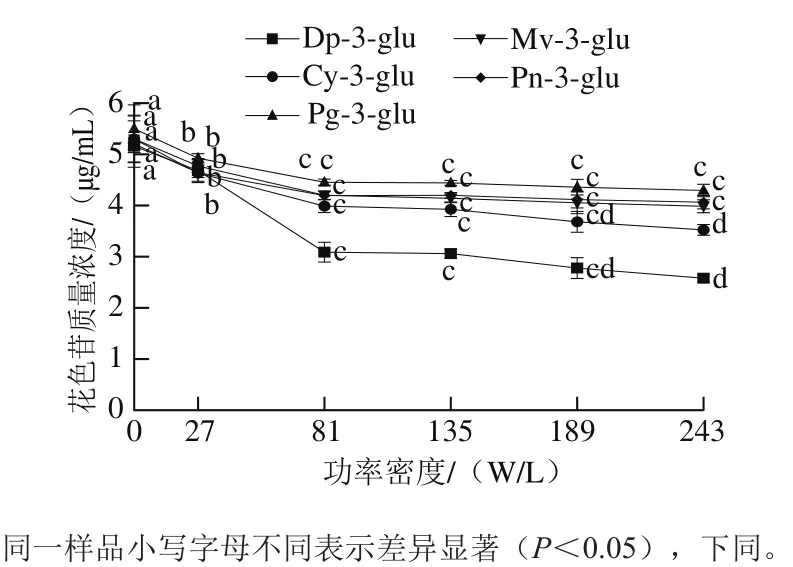
图2 超声功率密度对5 种花色苷稳定性的影响Fig. 2 Effect of ultrasonic power intensity on the stability of five anthocyanins under ultrasound treatment conditions
超声功率密度在0~243 W/L范围内对5 种花色苷稳定性的影响如图2所示。结果表明:超声功率密度在0~81 W/L范围内时,随着超声功率密度增加,5 种花色苷质量浓度逐渐下降,且下降趋势明显(P<0.05)。这是因为在超声功率密度相对较低的范围内时,空化泡较容易形成,并且随着超声功率密度的增加,空化泡破裂时释放的能量更强[26]。同时由于空化作用产生高温、高压,促使水分子裂解为自由基,而自由基由于含有未配对电子,性质非常活泼,具有强氧化性,也会导致花色苷的降解[27]。随着超声功率密度的继续增加(81~243 W/L),5 种花色苷的质量浓度除飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷外,变化不再明显,仅有微弱的减少。这可能是由于当超声功率密度增大时,过大的功率密度导致空化泡来不及破裂,以至过多的气泡对超声波的传播有所阻碍,所以继续增大超声功率密度不再带来更大的降解作用。而飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷质量浓度随着超声密度的增加仍然呈现下降的趋势,可能与其结构有关。它们的B环结构中都含有邻二酚羟基,羟基越多,花色苷越不稳定,相反,甲基化却能够增加花色苷的稳定性[28]。因此,含有甲氧基的锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷相对更加稳定。Cheynier等[29]的研究也发现,含有邻二酚羟基的花色苷比没有邻二酚羟基的花色苷降解率大,而没有邻二酚羟基的花色苷对氧化敏感性也相对较低。
2.1.2 超声温度对花色苷稳定性的影响
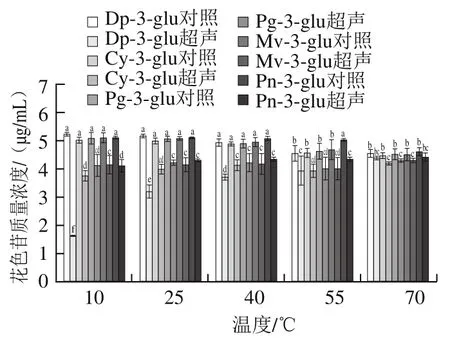
图3 超声温度对5 种花色苷稳定性的影响Fig. 3 Effect of temperature on the stability of five anthocyanins under ultrasound treatment
超声温度在10~70 ℃变化范围内对5 种花色苷稳定性的影响如图3所示,5 种花色苷在超声处理条件下的降解率随着温度升高而下降,在10 ℃超声处理下5 种花色苷质量浓度分别是相应对照组的19%、74%、81%、81%和80%;而在70 ℃时5 种花色苷的质量浓度却达到对照组的90%~96%。这一规律与本课题组先前对β-胡萝卜素和常见7 种酚酸的研究结果类似[13-14],这可能与温度对溶剂物理性质的影响有关,升高温度会使液体黏度和表面张力降低,同时饱和蒸气压的上升使更多溶剂蒸汽进入空化泡腔内,从而导致空化泡破裂时的剧烈程度减弱,进而导致超声空化效应的下降[30]。而体积分数70%甲醇的饱和蒸汽压随着温度的升高而增大,因此空化强度随着温度的升高而下降,即导致了花色苷在低温下超声降解率高,高温下降解率低的结果。
从对照组可以看出,5 种花色苷质量浓度随温度增加,在55、70 ℃都呈现显著下降趋势(P<0.05),表明花色苷的热稳定性较差。Dubrovic等[18]报道,与对照组相比,用85 ℃、2 min巴氏杀菌法处理的草莓汁花色苷含量减少了5.3%~5.8%。Shaheer等[31]报道,和未处理样品相比,80 ℃、5 min巴氏杀菌法处理后的阎浮树果汁花色苷含量下降了34%。Brownmiller等[32]也报道了与鲜果中花色苷相比,95 ℃漂烫3 min会使蓝莓中总花色苷含量损失43%。结合温度对超声空化效应的影响及其对花色苷的影响,可以得出花色苷的提取适宜在40 ℃下进行。
2.1.3 超声溶剂对花色苷稳定性的影响

图4 溶剂对超声处理下5 种花色苷稳定性的影响Fig. 4 Effect of solvents on the stability of five anthocyanins under ultrasound treatment
花色苷的提取通常在温和条件下进行,提取溶剂多是酸性的水和极性有机溶剂(甲醇、乙醇等)组成的混合物。因此本研究选用5 种常见的花色苷提取溶剂研究花色苷在不同超声溶剂下的稳定性。从图4可以看出,与对照组相比,在不同溶剂超声处理下的花色苷质量浓度都有显著性下降(P<0.05),但是在不同溶剂中下降程度有所不同。5 种花色苷质量浓度在100%(体积分数,下同)甲醇、100%乙醇和70%乙醇溶液中下降相对较少,其中在70%乙醇溶液中下降最少,而在70%甲醇溶液和水中下降较多(P<0.05)。这一结果表明,不同溶剂类型对超声空化效应也有一定的影响。Ashokkumar等[33]研究也发现向提取介质中加入乙醇能够减少提取过程中羟自由基的产生。在降解最多的70%甲醇溶液中,飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖的降解率分别为38%和26%,高于天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷(降解率分别为20%、23%、22%),表明花色苷在超声场中的稳定性也和自身的化学结构有关。如前所述,这可能与飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖的B环结构中都含有邻二酚羟基有关。
Wang Wenjie等[23]研究发现樱桃(Prunus avium L.)和红梨皮(Pyrus communis L.)的超声辅助提取最优条件分别是80%乙醇、30 ℃、20 min和60%乙醇、30 ℃、60 min。Dranca等[34]研究发现茄子皮(Solanum melongena L.)超声辅助提取的最优条件是54.4%甲醇、37 kHz、55.1 ℃、44.85 min。Boulekbache-Makhlouf等[35]也报道70%甲醇是最合适的茄子皮(S. melongena L.)花色苷提取的溶剂。表明从花色苷提取总量的角度考虑,甲醇或乙醇与水的混合物都有可能是最好的提取溶剂,但是从花色苷稳定性以及溶剂毒性的角度来看,70%乙醇是更合适的提取溶剂。
2.1.4 超声pH值对花色苷稳定性的影响

图5 pH值对超声处理下5 种花色苷稳定性的影响Fig. 5 Effect of pH on the stability of five anthocyanins under ultrasound treatment
从图5可以看出,与对照组相比,在不同pH值下超声处理后的花色苷质量浓度都有显著性下降(P<0.05)。在pH 1~5范围内,5 种花色苷降解率呈先增后减的趋势,在pH 3时下降值达到最大。这一结果可能与花色苷在不同pH值下具有不同的结构形式有关。Araceli等[36]报道了花色苷在不同pH值下具有不同存在形式(图6):pH 1时,花色苷以红色的黄烊盐离子为主要存在形式(图6A);pH 2~4之间,醌式碱是主要存在形式(图6B~D);当pH值处于5~6时,花色苷有2 种存在形式,分别是无色的甲醇假碱(图6E)和查耳酮(图6F)。从结构上可以看出,pH 2~4时的主要存在形式醌式碱具有碳氧双键,由于碳氧双键属于不饱和键,易发生氧化,因此在超声场中产生的自由基和活性氧的诱导下发生反应,从而导致花色苷在pH 3时降解较多(P<0.05)。另外,从图5中还可以看出,5 种花色苷在pH 1~2时降解最少,因此花色苷的提取适宜在低pH值下进行。
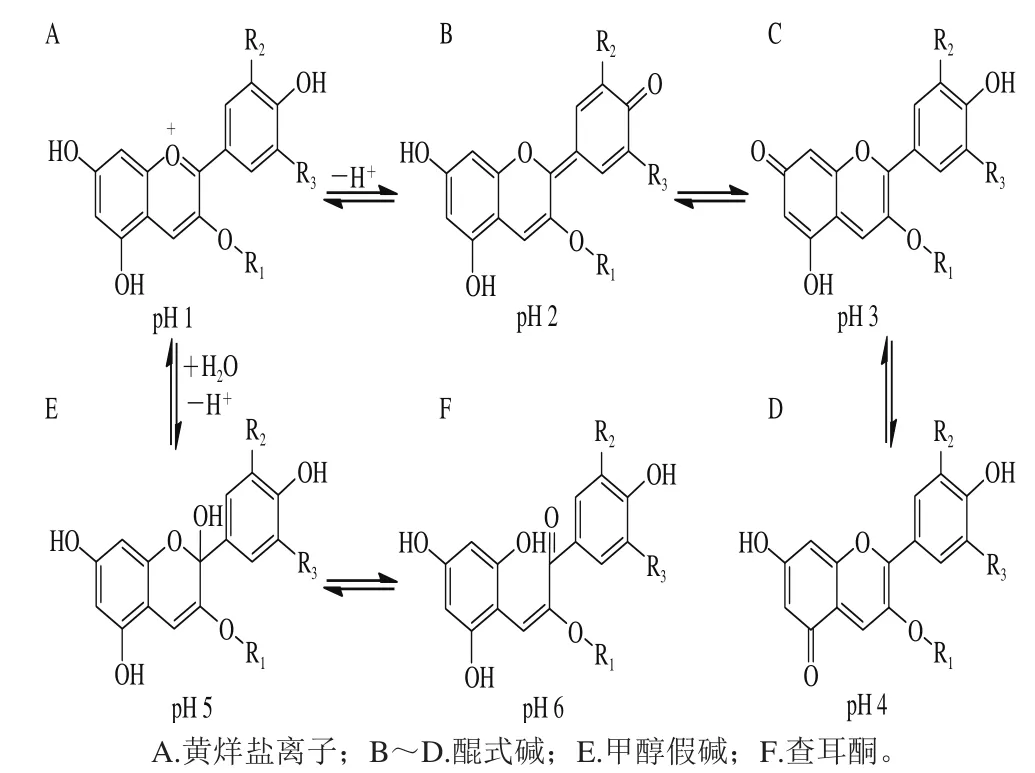
图6 花色苷在不同pH值下的存在形式Fig. 6 Chemical forms of anthocyanins under various pH conditions
2.2 花色苷超声降解动力学模型
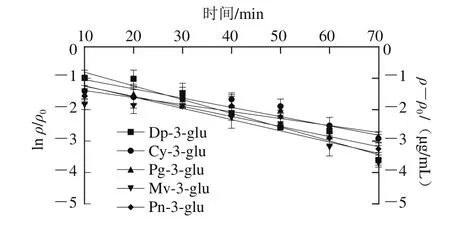
图7 5 种花色苷超声降解动力学分析Fig. 7 Kinetic analysis of five anthocyanins under ultrasonic treatment
5 种花色苷在10 ℃、pH 2、70%甲醇、功率密度135 W/L时,0~70 min内超声处理下的降解动力学模型如图7所示。根据试错法计算出花色苷的质量浓度变量ρ、ln ρ、1/ρ、1/ρ2与时间t的相关系数R(表1),依据相应线性回归系数最高的模型为花色苷超声降解动力学模型可以得出:飞燕草素-3-葡萄糖苷超声降解动力学模型为一级动力学模型,而矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷超声降解动力学模型为零级动力学模型。对花色苷超声降解过程进行动力学模型分析可用于预测超声提取或加工过程中花色苷的降解速度,从而可以控制花色苷的损失,提高花色苷的保留。由于诸多因素都会对花色苷稳定性产生影响,因此许多学者都针对不同因素对花色苷的降解动力学进行了模拟,发现在不同的条件下,花色苷符合的降解动力学模型也不尽相同,主要可分为零级、一级、二级和复杂反应动力学[27]。而花色苷在超声场下的降解动力学还只有少量报道,Tiwari等[37]对超声处理草莓汁中花色苷和抗坏血酸在贮藏期间稳定性的研究中发现,天竺葵素-3-葡萄糖苷超声降解符合一级动力学模型。Sun Jianxia等[38]研究发现天竺葵素-3-葡萄糖苷在低温超声场下降解也是一级动力学。Yao Guanglong等[39]在超声功率对蓝莓中矢车菊素-3-葡萄糖苷影响的研究中发现其超声场下的降解同样为一级动力学。而本研究中除飞燕草素-3-葡萄糖苷超声降解动力学模型为一级动力学模型外,其他4 种花色苷(矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷)的超声降解动力学模型均为零级动力学模型。这可能与超声处理的频率、振幅、功率密度、花色苷的质量浓度以及所处的介质有关。在相应的模型条件下对不同花色苷降解动力学反应速率常数k、半衰期t1/2和回归系数R2进行回归分析(表2)。
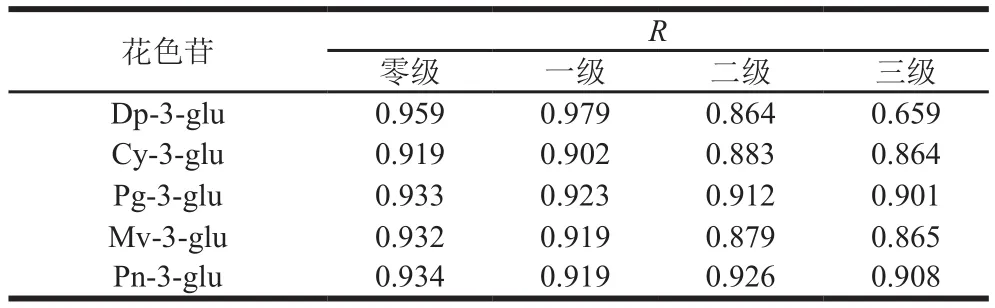
表1 5 种花色苷降解动力学拟合方程的线性回归系数Table 1 Fitting degradation equations of five anthocyanins with correlation coefficients
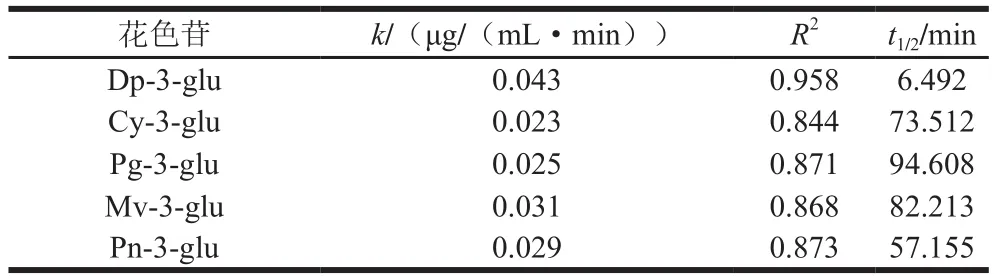
表2 5 种花色苷超声降解动力学参数Table 2 Degradation kinetic parameters of five anthocyanins under ultrasound treatment
2.3 花色苷超声降解产物鉴定


图8 5 种花色苷10 ℃下超声处理1 h前后液相色谱图Fig. 8 HPLC chromatogram of five anthocyanins before and after ultrasound treatment for 1 hour at 10 ℃
采用液相色谱-质谱联用技术对花色苷主要降解产物进行鉴定,由液相色谱图(图8)可以看出花色苷在超声处理后出现新的色谱峰,其相应的质谱信息如表3所示。天竺葵素-3-葡萄糖苷降解产物质谱信息中峰1和峰2的出峰时间十分接近,为20.201、21.117 min,且[M-H]−相同,均为m/z 343,根据Lopes等[40]的报道可判断为anthocyanone A1和anthocyanone A2(二者互为同分异构体),即8-β-D-吡喃葡萄糖基-2,4-二羟基-6-氧代环己基-2,4-二烯基乙酸(anthocyanone A)。峰3负离子模式下[M-H]−m/z 285,正离子模式下[M+H]+m/z 287,所以峰3的分子质量为286 Da,推测峰3为山柰酚。峰4 [M+H]+m/z 130,可推测其分子质量为129 Da。峰5从色谱图上对比可知为天竺葵素-3-葡萄糖苷。峰6在质谱中响应太低,需要进一步鉴定。峰7 [M-H]−m/z 465,[M+Cl]−m/z 501,[M+Na]+m/z 489,所以可推测峰7分子质量为466 Da。锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷的峰1和峰2出峰时间及[M-H]−都和天竺葵素-3-葡萄糖苷峰1和峰2的信息几乎完全相同,因此可同样判断为anthocyanone A1和anthocyanone A2。锦葵素-3-葡萄糖苷的峰3 [M-H]−m/z 355,可推测其分子质量为356 Da。峰4质谱响应太低,需要进一步鉴定。峰5 [M+H]+m/z 199,推测其为丁香酸。峰6负离子模式下[M-H]−m/z 153,正离子模式下[M+H]+m/z 155,所以峰6分子质量为154 Da,推断为2,6-二甲氧基苯酚。峰7从色谱图上对比可知为锦葵素-3-葡萄糖苷。芍药素-3-葡萄糖苷分离到的降解产物相对较少,峰3在质谱里响应太低,需要进一步鉴定;峰4从色谱图上对比可知为芍药素-3-葡萄糖苷。飞燕草素-3-葡萄糖苷分离到的降解产物也相对较少,峰1 [M-H]−m/z 479、[M+Cl]−m/z 515,可推测其分子质量为480 Da,可能的分子式为C21H20O13。峰2[M+H]+m/z 195,推测其为阿魏酸。从色谱图上对比可知峰3为飞燕草素-3-葡萄糖苷。矢车菊素-3-葡萄糖苷分离到的降解产物相对较多,峰3 [M-H]−m/z 367,可以推测其分子质量为368 Da。峰5 [M-H]−m/z 479、[M+Cl]−m/z 501,可以推测其分子质量为480 Da,可能的分子式为C21H20O13。峰6从色谱图上对比可知为矢车菊素-3-葡萄糖苷。峰10 [M-H]−m/z 301,可推测其分子质量为302 Da,为槲皮素。峰4、7~9、11质谱响应太低,需要进一步鉴定。

表3 5 种花色苷超声降解产物质谱信息Table 3 Assignments of new chromatographic peaks of five anthocyanins obtained by HPLC-MS after ultrasound treatment
2.4 花色苷超声降解过程推测
对于天竺葵素-3-葡萄糖苷的降解产物山柰酚,其可能的降解过程如图9A所示,天竺葵素-3-葡萄糖苷首先进行脱糖反应生成天竺葵素,然后水分子进攻C环中的4位碳原子产生羟基,并进一步被氧化生成山柰酚。通过对比底物和最终产物之间的结构,可以推测矢车菊素-3-葡萄糖苷超声降解形成槲皮素(图9B)与天竺葵素-3-葡萄糖苷降解成山柰酚过程的机制相同。对于飞燕草素-3-葡萄糖苷中降解成阿魏酸,其过程可能为低pH值下部分由飞燕草素-3-葡萄糖苷转化而来的甲醇假碱在超声作用下B环和C环间发生断裂,并进一步生成中间产物转化为阿魏酸,而其具体的降解过程及在4 种花色苷(天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷)降解产物中都检测到的anthocyanone A、在锦葵素-3-葡萄糖苷的降解产物中检测到的丁香酸、2,6-二甲氧基苯酚的降解过程仍需要进一步的研究和探索。

图9 降解途径Fig. 9 Hypothetical schemes for the formation of degradation products
3 结 论
在0~81 W/L范围内,随着超声功率密度的增加,5 种花色苷质量浓度逐渐下降,继续增加超声功率密度(81~243 W/L),5 种花色苷质量浓度除飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷外,变化不再明显,仅有微弱减少,表明花色苷稳定性和其结构有关;随着温度升高,花色苷在超声处理下的降解率反而下降,即超声空化效应与温度呈现负相关;5 种花色苷在70%乙醇溶液中降解最少,因此花色苷的提取剂以70%乙醇溶液为宜;pH 1~5范围内,花色苷降解率呈先增后减趋势。动力学结果表明飞燕草素-3-葡萄糖苷超声降解符合一级动力学模型,矢车菊素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷超声降解符合零级动力学模型。在天竺葵素-3-葡萄糖苷、锦葵素-3-葡萄糖苷、芍药素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷4 种花色苷降解产物中都检测到anthocyanone A,同时也检测到山柰酚、槲皮素、丁香酸、阿魏酸、2,6-二甲氧基苯酚等。对其降解过程推测,发现花色苷超声降解和热降解及微波降解过程有所不同。而关于花色苷在其他超声条件下的降解动力学以及更为详尽的降解过程仍需进一步研究。
参考文献:
[1] JOSEPH S V, EDIRISINGHE I, BURTON-FREEMAN B M. Berries:anti-inflammatory effects in humans[J]. Journal of Agricultural and Food Chemistry, 2014, 62(18): 3886-3903. DOI:10.1021/jf4044056.
[2] SIGURDSON G T, TANG P, GIUSTI M M. Natural colorants:food colorants from natural sources[J]. Annual Review of Food Science and Technology, 2017, 8: 261-280. DOI:10.1146/annurevfood-030216-025923.
[3] WALLACE T C, GIUSTI M M. Anthocyanins in health and disease[M]. Boca Raton: CRC Press, 2013: 14-15. DOI:10.1016/j.jneb.2014.11.002.
[4] CABRITA L, FOSSEN T, ANDERSEN Ø M. Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J].Food Chemistry, 2000, 68(1): 101-107. DOI:10.1016/S0308-8146(99)00170-3.
[5] 宋会歌, 刘美艳, 董楠, 等. 食品中花色苷降解机制研究进展[J]. 食品科学, 2011, 32(13): 355-359.
[6] CASSIDY A, MUKAMAL K J, LIU L, et al. High anthocyanin intake is associated with a reduced risk of myocardial infarction in young and middle-aged women[J]. Circulation, 2013, 127(2): 188-196.DOI:10.1161/CIRCULATIONAHA.112.122408.
[7] KRUGER M J, DAVIES N, MYBURGH K H, et al.Proanthocyanidins, anthocyanins and cardiovascular diseases[J].Food Research International, 2014, 59(4): 41-52. DOI:10.1016/j.foodres.2014.01.046.
[8] TSUDA T. Dietary anthocyanin-rich plants: biochemical basis and recent progress in health benefits studies[J]. Molecular Nutrition &Food Research, 2012, 56(1): 159-170. DOI:10.1002/mnfr.201100526.
[9] GHOSH D, KONISHI T. Anthocyanins and anthocyanin-rich extracts:role in diabetes and eye function[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(2): 200-208. DOI:10.3390/ijms13022472.
[10] SMERIGLIO A, BARRECA D, BELLOCCO E, et al. Chemistry,pharmacology and health benefits of anthocyanins[J]. Phytotherapy Research, 2016, 30(8): 1265-1286. DOI:10.1002/ptr.5642.
[11] LIN B W, GONG C C, SONG H F, et al. Effects of anthocyanins on the prevention and treatment of cancer[J]. British Journal of Pharmacology, 2017, 174: 1226-1243. DOI:10.1111/bph.13627.
[12] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science& Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[13] SUN Y, MA G, YE X, et al. Stability of all-trans-β-carotene under ultrasound treatment in a model system: effects of different factors,kinetics and newly formed compounds[J]. Ultrasonics Sonochemistry,2010, 17(4): 654-661. DOI:10.1016/j.ultsonch.2009.12.005.
[14] QIAO L P, YE X Q, SUN Y J, et al. Sonochemical effects on free phenolic acids under ultrasound treatment in a model system[J].Ultrasonics Sonochemistry, 2013, 20(4): 1017-1025. DOI:10.1016/j.ultsonch.2012.12.007.
[15] YASUO I, TORU T, KYUICHI Y, et al. Control of viscosity in starch and polysaccharide solutions with ultrasound after gelatinization[J].Innovative Food Science & Emerging Technologies, 2008, 9(2): 140-146. DOI:10.1016/j.ifset.2007.03.029.
[16] GÜLSEREN I, GÜZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.DOI:10.1016/j.ultsonch.2005.07.006.
[17] TIWARI B K, O’DONNELL C P, PATRAS A, et al. Anthocyanin and ascorbic acid degradation in sonicated strawberry juice[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10071-10077.DOI:10.1021/jf801824v.
[18] DUBROVIC I, HERCEG Z, JAMBRAK A R, et al. Effect of high intensity ultrasound and pasteurization on anthocyanin content in strawberry juice[J].Food Technology & Biotechnology, 2011, 49(2): 196-204.
[19] CARRERA C, RUIZRODRÍGUEZ A, PALMA M, et al. Ultrasound assisted extraction of phenolic compounds from grapes[J]. Analytica Chimica Acta, 2012, 732: 100-104. DOI:10.1016/j.aca.2011.11.032.
[20] MOHIDEEN F W, SOLVAL K M, LI J, et al. Effect of continuous ultra-sonication on microbial counts and physico-chemical properties of blueberry (Vaccinium corymbosum) juice[J]. LWT-Food Science and Technology, 2015, 60(1): 563-570. DOI:10.1016/j.lwt.2014.07.047.
[21] CHEN F, SUN Y, ZHAO G, et al. Optimization of ultrasoundassisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J]. Ultrasonics Sonochemistry,2007, 14(6): 767-778. DOI:10.1016/j.ultsonch.2006.12.011.
[22] GHAFOOR K, CHOI Y H, JEON J Y, et al. Optimization of ultrasound-assisted extraction of phenolic compounds, antioxidants,and anthocyanins from grape (Vitis vinifera) seeds[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4988-4994.DOI:10.1021/jf9001439.
[23] WANG Wenjie, JUNG J, TOMASINO E, et al. Optimization of solvent and ultrasound-assisted extraction for different anthocyanin rich fruit and their effects on anthocyanin compositions[J]. LWT-Food Science and Technology, 2016, 72: 229-238. DOI:10.1016/j.lwt.2016.04.041.
[24] TIWARI B K, PATRAS A, BRUNTON N, et al. Effect of ultrasound processing on anthocyanins and color of red grape juice[J].Ultrasonics Sonochemistry, 2010, 17(3): 598-604. DOI:10.1016/j.ultsonch.2009.10.009.
[25] SADILOVA E, CARLE R, STINTZING F C. Thermal degradation of anthocyanins and its impact on color and in vitro antioxidant capacity[J]. Molecular Nutrition & Food Research, 2007, 51(12):1461-1471. DOI:10.1002/mnfr.200700179.
[26] ENTEZARI M H, NAZARY S H, KHODAPARAST M H H. The direct effect of ultrasound on the extraction of date syrup and its micro-organisms[J]. Ultrasonics Sonochemistry, 2004, 11(6): 379-384.DOI:10.1016/j.ultsonch.2003.10.005.
[27] 马琳, 赵瑞洁, 李京阳, 等. 超声波对桑葚花色苷中矢车菊素稳定性的影响[J]. 食品工业科技, 2015, 36(12): 138-141. DOI:10.13386/j.issn1002-0306.2015.12.020.
[28] GOULD K, DAVIES K, WINEFIELD C. Anthocyanins: biosynthesis,functions, and applications[M]. New York: Springer, 2008: 260-261.
[29] CHEYNIER V, SOUQUET J M, KONTEK A, et al. Anthocyanin degradation in oxidising grape musts[J]. Journal of the Science of Food& Agriculture, 1994, 66(3): 283-288. DOI:10.1002/jsfa.2740660304.
[30] CAPELO-MARTINEZ J. Ultrasound in chemistry: analytical applications[M]. Darmstadt: John Wiley & Sons, 2009: 5-6.
[31] SHAHEER C A, HAFEEDA P, KUMAR R, et al. Effect of thermal and thermosonication on anthocyanin stability in jamun (Eugenia jambolana) fruit juice[J]. International Food Research Journal, 2014,21(12): 363-365.
[32] BROWNMILLER C, HOWARD L R, PRIOR R L. Processing and storage effects on monomeric anthocyanins, percent polymeric colour, and antioxidant capacity of processed blueberry products[J].Journal of Food Science, 2008, 73(5): 72-79. DOI:10.1111/j.1750-3841.2008.00855.x.
[33] ASHOKKUMAR M, SUNARTIO D, KENTISH S, et al. Modification of food ingredients by ultrasound to improve functionality: a preliminary study on a model system[J]. Innovative Food Science& Emerging Technologies, 2008, 9(2): 155-160. DOI:10.1016/j.ifset.2007.05.005.
[34] DRANCA F, OROIAN M. Optimization of ultrasound-assisted extraction of total monomeric anthocyanin (TMA) and total phenolic content (TPC) from eggplant (Solanum melongena L.) peel[J].Ultrasonics Sonochemistry, 2016, 31: 637-646. DOI:10.1016/j.ultsonch.2015.11.008.
[35] BOULEKBACHE-MAKHLOUF L, MEDOUNI L, MEDOUNIADRAR S,et al. Effect of solvents extraction on phenolic content and antioxidant activity of the byproduct of eggplant[J]. Industrial Crops & Products,2013, 49(4): 668-674. DOI:10.1016/j.indcrop.2013.06.009.
[36] ARACELI C, MADELOURDES P H, MAELENA P, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4):859-871. DOI:10.1016/j.foodchem.2008.09.001.
[37] TIWARI B K, O’DONNELL C P, PATRAS A, et al. Stability of anthocyanins and ascorbic acid in sonicated strawberry juice during storage[J]. European Food Research and Technology, 2009, 228(5):717-724. DOI:10.1007/s00217-008-0982-z.
[38] SUN Jianxia, MEI Zhouxiong, TANG Yajuan, et al. Stability, antioxidant capacity and degradation kinetics of pelargonidin-3-glucoside exposed to ultrasound power at low temperature[J]. Molecules, 2016,21(9): 1109-1121. DOI:10.3390/molecules21091109.
[39] YAO Guanglong, MA Xinghui, CAO Xianyin, et al. Effects of power ultrasound on stability of cyanidin-3-glucoside obtained from blueberry[J]. Molecules, 2016, 21(11): 1564-1578. DOI:10.3390/molecules21111564.
[40] LOPES P, RICHARD T, SAUCIER C, et al. Anthocyanone A: a quinone methide derivative resulting from malvidin 3-O-glucoside degradation[J]. Journal of Agricultural and Food Chemistry, 2007,55(7): 2698-2704. DOI:10.1021/jf062875o.
