贮藏及消化对蓝莓酸奶中酚类物质稳定性及抗氧化活性影响
2018-05-25赵永波杜玲玲曲秀伟王海霞李晓东
赵永波,杜玲玲,刘 璐,曲秀伟,王海霞,陈 萍,李晓东*
蓝莓富含黄酮、花色苷等植物多酚,具有抵抗氧化应激、抗炎、抑菌及降低心血管疾病发病率等生物活性和生理功能[1-2],营养和保健价值较高。随着蓝莓的研究与开发,蓝莓酸奶等新型功能性乳制品受到消费者青睐,并成为补充日常膳食多酚的常见选择。
食物中酚类物质的稳定性影响其抗氧化活性和吸收利用[3]。国内外文献报道,蓝莓多酚的稳定性与其种类及结构有关[4],同时受pH值、温度及食品添加剂等因素影响,例如花色苷在酸性条件下较为稳定,而高温条件会导致其迅速降解,且VC能够降低其热稳定性[5]。另外,胃肠消化环境对多酚类物质的稳定性有不同程度影响,同时会改变其抗氧化活性,研究发现蓝莓经模拟胃肠消化后其总酚、总黄酮含量及2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiozoline-6)-sulphonic acid,ABTS)自由基清除能力均高于消化前水平,而花色苷含量则变化不大[6],也有报道称蓝莓的总酚、花色苷含量在模拟胃液消化时较为稳定,但在模拟肠液消化时分别降低了49%、15%[7]。在酸奶体系中,莓类多酚的不同添加工艺对酚类物质的稳定性有影响[8],但在贮藏及消化时,酸奶中酚类物质的稳定性及抗氧化活性仍需进一步研究。
本实验通过测定蓝莓酸奶在4 ℃贮藏21 d及体外消化过程中总酚、总黄酮、花色苷含量及总抗氧化活力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和ABTS+·清除能力变化,并以蓝莓果料、酸奶为对照,研究蓝莓酸奶中多酚类物质的稳定性及抗氧化活性,为蓝莓酸奶的健康功效和消费提供理论依据和建议。
1 材料与方法
1.1 材料与试剂
速冻蓝莓由东北农业大学园艺学院提供,-20 ℃冷藏备用;脱脂乳粉 新西兰纾祺公司;酸奶发酵剂北京川秀科技有限公司;变性淀粉(马铃薯羟丙基二淀粉磷酸酯) 天津顶峰淀粉开发有限公司;蔗糖、果胶(高甲氧基果胶)均为市售食品级;福林-酚试剂北京索莱宝科技有限公司;α-淀粉酶、胃蛋白酶、胰蛋白酶、牛胆盐、DPPH、ABTS 美国Sigma公司;没食子酸(纯度99%)、VC(纯度99.7%) 天津市光复精细化工研究所;芦丁(纯度95%) 上海金穗生物科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
721紫外-可见分光光度计 上海元析仪器有限公司;高速冷冻离心机 德国Sigma公司;高速组织剪切机 上海乔越电子有限责任公司;分析天平 赛多利斯仪器系统有限公司;pH计 梅特勒-托利多仪器有限公司;数显恒温水浴锅 上海比朗仪器有限公司;数字式搅拌器 德国维根斯公司。
1.3 方法
1.3.1 样品的制备
蓝莓果料的制备:参考Ścibisz等[9]方法并略有改动。速冻蓝莓(60%,质量分数,下同)、蔗糖(35%)、变性淀粉(2%)、果胶(0.6%)、水(2.4%),混匀并煮制10 min,灌装于100 mL旋盖玻璃瓶中,85 ℃、15 min杀菌,冷却至室温备用,最终蓝莓果料的白利度(°Brix)为41.25。
酸奶的制备:取适量脱脂乳粉用温水溶解,使得复原乳的总固形物含量为15 g/100 mL,均质(60 ℃、20 MPa),杀菌(85℃、15 min),冷却至43 ℃并添加发酵剂(添加量为1 g/L),43.5 ℃恒温发酵约4.5 h,至pH值低于4.7后终止发酵,冷却至室温后,取适量与蓝莓果料混合,剩余部分作为酸奶对照备用。
蓝莓酸奶的制备:蓝莓果料在酸奶中的添加比例为20%。无菌条件下混匀并灌装于上述灭菌玻璃瓶中。各样品设3 组平行,4 ℃条件避光贮藏并确保贮藏条件一致。
贮藏期实验:分别在1、5、10、15、21 d测定蓝莓酸奶(2 g果料+8 g酸奶)、蓝莓果料(2 g果料+8 g去离子水)及酸奶对照(8 g酸奶+2 g去离子水)的总酚、总黄酮、花色苷含量及总抗氧化活力、DPPH自由基和ABTS+·清除能力,并进行相关性分析。
体外消化实验:在第3天分别对蓝莓酸奶(2 g果料+8 g酸奶)、蓝莓果料(2 g果料+8 g去离子水)及酸奶对照(8 g酸奶+2 g去离子水)进行体外消化处理,测定各样品在消化前、模拟口腔、胃液及肠液消化后的多酚类物质含量和抗氧化活性。
1.3.2 各样品提取液的制备
蓝莓酸奶中多酚类物质的提取参考Cebeci等[10]方法并略有改动。取10 g蓝莓酸奶置于50 mL离心管中,加15 mL酸化甲醇(含0.05 mL浓盐酸),12 000 r/min剪切提取1 min,-20 ℃静置1 h以使蛋白充分沉淀,4℃、7 000 r/min离心10 min,上清液用于多酚类物质含量和体外抗氧化活性测定。
2 g蓝莓果料与8 g去离子水混匀作为蓝莓果料的提取样,8 g酸奶与2 g去离子水混匀作为酸奶对照的提取样,其他处理同蓝莓酸奶。
1.3.3 多酚类物质含量的测定
总酚含量的测定采用福林-酚法[11],结果用没食子酸当量表示(mg/100 g提取样);总黄酮含量的测定参考蔡萌等[12]方法,结果用芦丁当量表示(mg/100 g提取样);花色苷含量的测定采用pH值示差法[13],结果用矢车菊素-3-葡萄糖苷当量表示(mg/100 g提取样)。
1.3.4 抗氧化活性的测定
总抗氧化活力的测定参考Berker等[14]方法,DPPH自由基清除能力的测定参考Shen Yingbin等[15]方法,ABTS+·清除能力的测定参考Re等[16]方法,均以VC(0.025~0.120 mg/mL)为标准品作标准曲线,结果用VC当量表示(mg/100 g提取样)。
1.3.5 体外消化实验
蓝莓酸奶的体外消化实验参考Oliveira等[17]方法。蓝莓酸奶消化样的质量为10 g,分别置于4 组50 mL离心管中,进行消化前、模拟口腔(1 min)、模拟胃液(1 h)和模拟肠液(2 h)消化;2 g蓝莓果料与8 g去离子水混匀作为蓝莓果料的消化样,8 g酸奶与2 g去离子水混匀作为酸奶对照的消化样,其他处理同蓝莓酸奶。各样品消化前后的提取和测定按照1.3.2~1.3.4节方法执行。
1.4 数据处理
各实验重复3 次,结果用 ±s表示,用SigmaPlot 12.5软件作图,用SPSS 20.0统计软件分析数据的差异显著性(P<0.05表示差异显著)和相关性。
2 结果与分析
2.1 贮藏期各样品多酚类物质含量变化

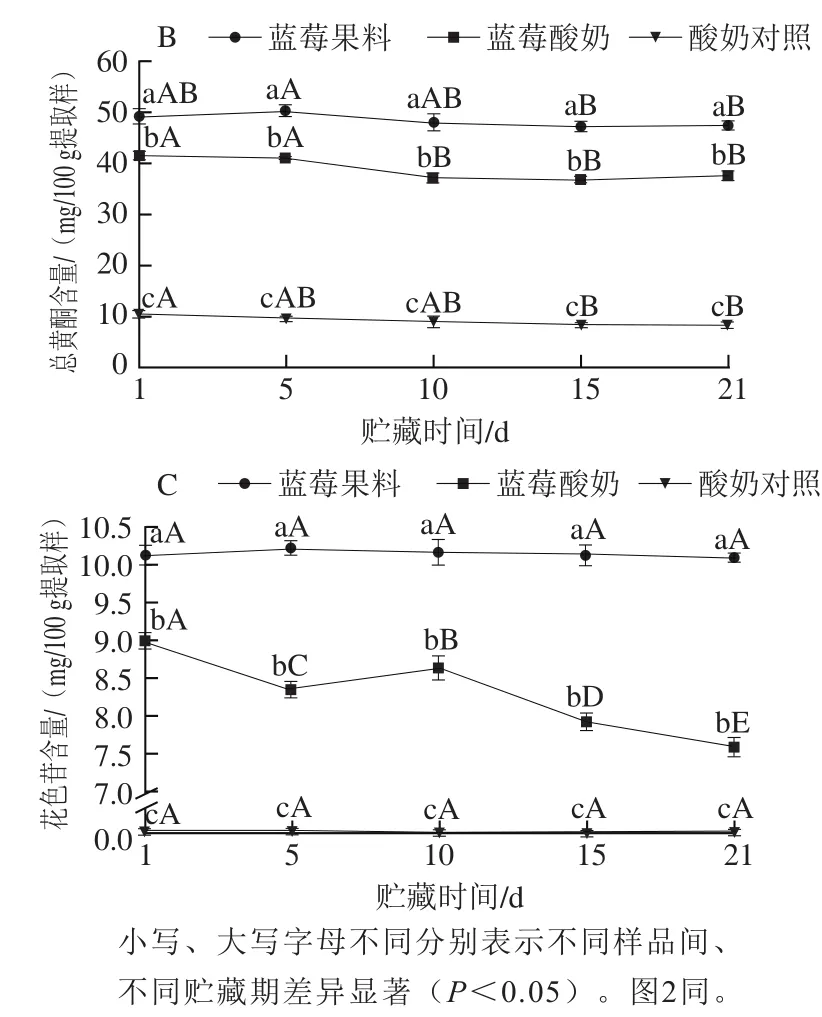
图1 贮藏期各样品的总酚(A)、总黄酮(B)和花色苷(C)含量变化Fig. 1 Changes in the contents of total phenolics (A), total flavonoids (B)and anthocyanins (C) in different samples during storage
由图1A可知,蓝莓酸奶的总酚含量在1~10 d呈下降趋势(P<0.05),从46.14 mg/100 g提取样降至40.24 mg/100 g提取样,10~21 d无明显变化,到21 d结束时较第1天降低了10.20%;蓝莓果料、酸奶对照的总酚含量均在第5天达到最大值(63.72、8.50 mg/100 g提取样),到21 d结束时,前者较第1天降低了1.93%,后者则提高了5.80%。
由图1B可以看出,贮藏初期,蓝莓酸奶的总黄酮含量为41.63 mg/100 g提取样,1~5 d无显著变化(P>0.05),5~10 d显著降低(P<0.05),后期保持相对稳定,整个贮藏期降幅为9.86%;蓝莓果料的总黄酮含量在第5天最高(50.33 mg/100 g提取样),5~15 d显著降低(P<0.05),贮藏期结束时较第1天降低了3.46%;酸奶对照的总黄酮含量略有降低,从10.35 mg/100 g提取样降为8.34 mg/100 g提取样。
从图1C可明显看出,蓝莓酸奶的花色苷含量在贮藏期间显著降低,1~5 d从9.01 mg/100 g提取样降至8.37 mg/100 g提取样(P<0.05),中期虽有所回升,但后期又不断下降,整个贮藏期降幅为15.54%(P<0.05),而蓝莓果料的花色苷含量在贮藏期间无显著变化(P>0.05),贮藏末期较第1天仅降低了0.03%;酸奶对照中无花色苷检出。
结合图1可以得出,蓝莓酸奶的总酚、总黄酮和花色苷含量均低于蓝莓果料,降幅均高于蓝莓果料。研究表明,蓝莓果料与酸奶混合后,酸奶中与多酚类物质亲和力较高的β-乳球蛋白[18]以及α-、β-、κ-酪蛋白[19]与蓝莓多
酚化合物发生络合反应,生成大量蛋白-多酚络合物并发生聚沉,多酚化合物的提取率降低,可提取的游离态多酚类物质含量低于蓝莓果料;贮藏期间,蓝莓酸奶中各酚类物质含量降幅大于蓝莓果料,表明酸奶体系降低了多酚类物质的贮藏稳定性,一方面可能是蓝莓酸奶中相对较高的pH值环境(蓝莓酸奶的pH 4.05~4.01,蓝莓果料pH 3.04~3.02)对酚类物质的稳定性不利;另一方面乳酸菌的分解代谢作用也加剧了多酚类物质的降解和转化[8-9]。另外,酸奶对照中检测到总酚、总黄酮,但含量较低,有报道称这可能是酸奶中可溶性蛋白组分影响检测方法的结果[10,20]。
2.2 贮藏期各样品抗氧化活性变化
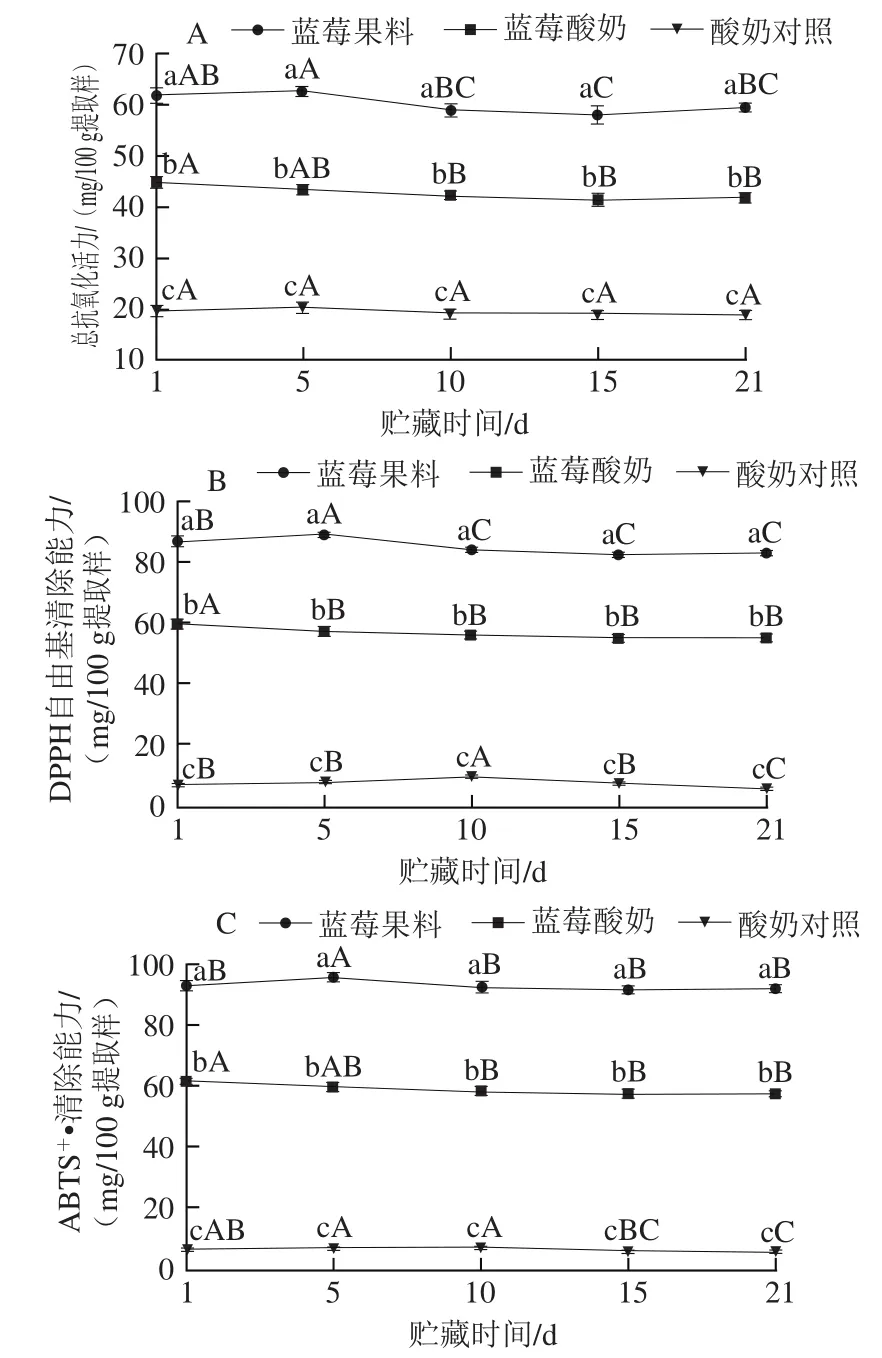
图2 贮藏期各样品的总抗氧化活力(A)、DPPH自由基(B)和ABTS+ ·清除能力(C)变化Fig. 2 Changes in total antioxidant capacity (A), DPPH (B) and ABTS (C)radical scavenging activity of different samples during storage
由图2A可知,蓝莓酸奶的总抗氧化活力在1~10 d呈降低趋势,从44.51 mg/100 g提取样降至42.06 mg/100 g提取样,10~21 d无显著变化(P>0.05),整个贮藏期降幅为6.52%;蓝莓果料的总抗氧化活力在第5天达到最大值(62.42 mg/100 g提取样),贮藏期结束时较第1天降低了3.58%;酸奶对照的总抗氧化活力在贮藏期间保持稳定。
由图2B可知,蓝莓酸奶的DPPH自由基清除能力在1~5 d显著降低,从59.49 mg/100 g提取样降至56.76 mg/100 g提取样(P<0.05),5~21 d无显著变化(P>0.05),贮藏期降幅为6.22%;蓝莓果料的DPPH自由基清除能力在第5天达到最大值(88.43 mg/100 g提取样),到21 d结束时较初期降低了4.17%;酸奶对照的DPPH自由基清除能力在第10天达到最大值(9.65 mg/100 g提取样),贮藏末期降为5.62 mg/100 g提取样。
由图2C可知,蓝莓酸奶的ABTS+·清除能力在1~10 d有所降低,从61.39 mg/100 g提取样降至58.30 mg/100 g提取样,10~21 d无显著变化(P>0.05),贮藏期降幅为4.91%;蓝莓果料的ABTS+·清除能力在第5天达到最大值(95.36 mg/100 g提取样),贮藏期结束时较初期降幅为1.29%;酸奶对照的ABTS+·清除能力在第10天最高(7.57 mg/100 g提取样),贮藏末期降至5.67 mg/100 g提取样。
结合图1、2可知,蓝莓酸奶中各抗氧化指标与其多酚类物质含量变化情况相似,可能是蓝莓酸奶的抗氧化活性主要受多酚类物质含量影响。在蓝莓酸奶体系中,多酚-蛋白发生共价和非共价结合并产生沉淀,使得能够参与自由基清除反应的游离态多酚含量降低[21],从而导致其对DPPH自由基及ABTS+·的清除能力降低;也有研究称乳蛋白的交联作用阻碍其酚环上羟基等活性基团的供电子能力[22],总抗氧化活性随之降低。另外,3 种抗氧化指标中均检测到酸奶对照具有一定的抗氧化活性,这是由于酸奶在发酵及贮藏期间水解生成部分抗氧化肽以及具有抗氧化活性的游离氨基酸等成分造成的[23]。
2.3 相关性分析
各样品的总酚、总黄酮和花色苷含量及总抗氧化活力、DPPH自由基和ABTS+·清除能力的相关系数(R)如表1所示,蓝莓酸奶的总酚、总黄酮含量与各抗氧化指标均呈显著正相关(P<0.05);蓝莓果料的总酚含量与总抗氧化活力呈极显著正相关(P<0.01),与其他抗氧化指标呈显著正相关(P<0.05),总黄酮含量与DPPH自由基清除能力呈极显著正相关(P<0.01),与其他抗氧化指标呈显著正相关(P<0.05),表明蓝莓酸奶、蓝莓果料中总酚、总黄酮含量与其抗氧化活性之间密切相关。
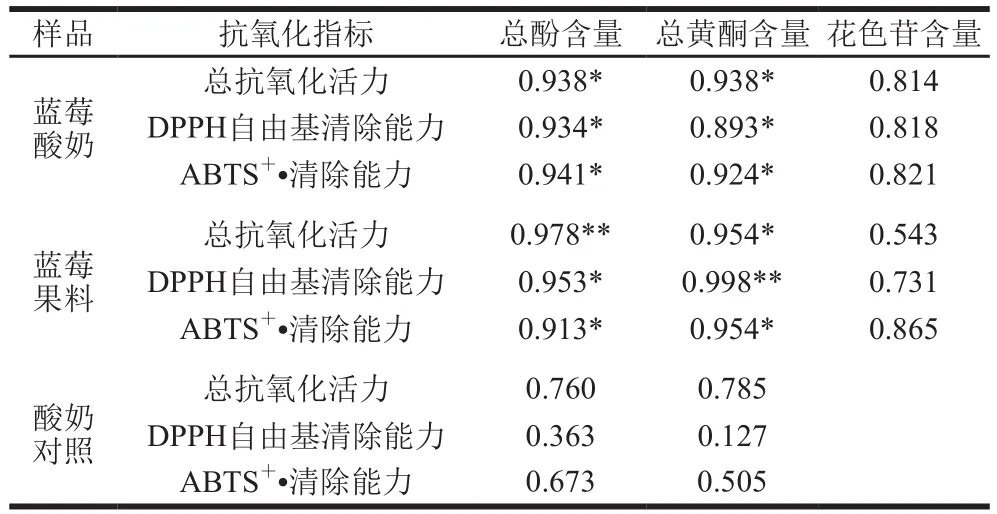
表1 多酚类物质含量与抗氧化活性的相关性分析Table 1 Correlation analysis between polyphenol content and antioxidant activity of different samples
2.4 体外消化前后各样品多酚类物质含量变化
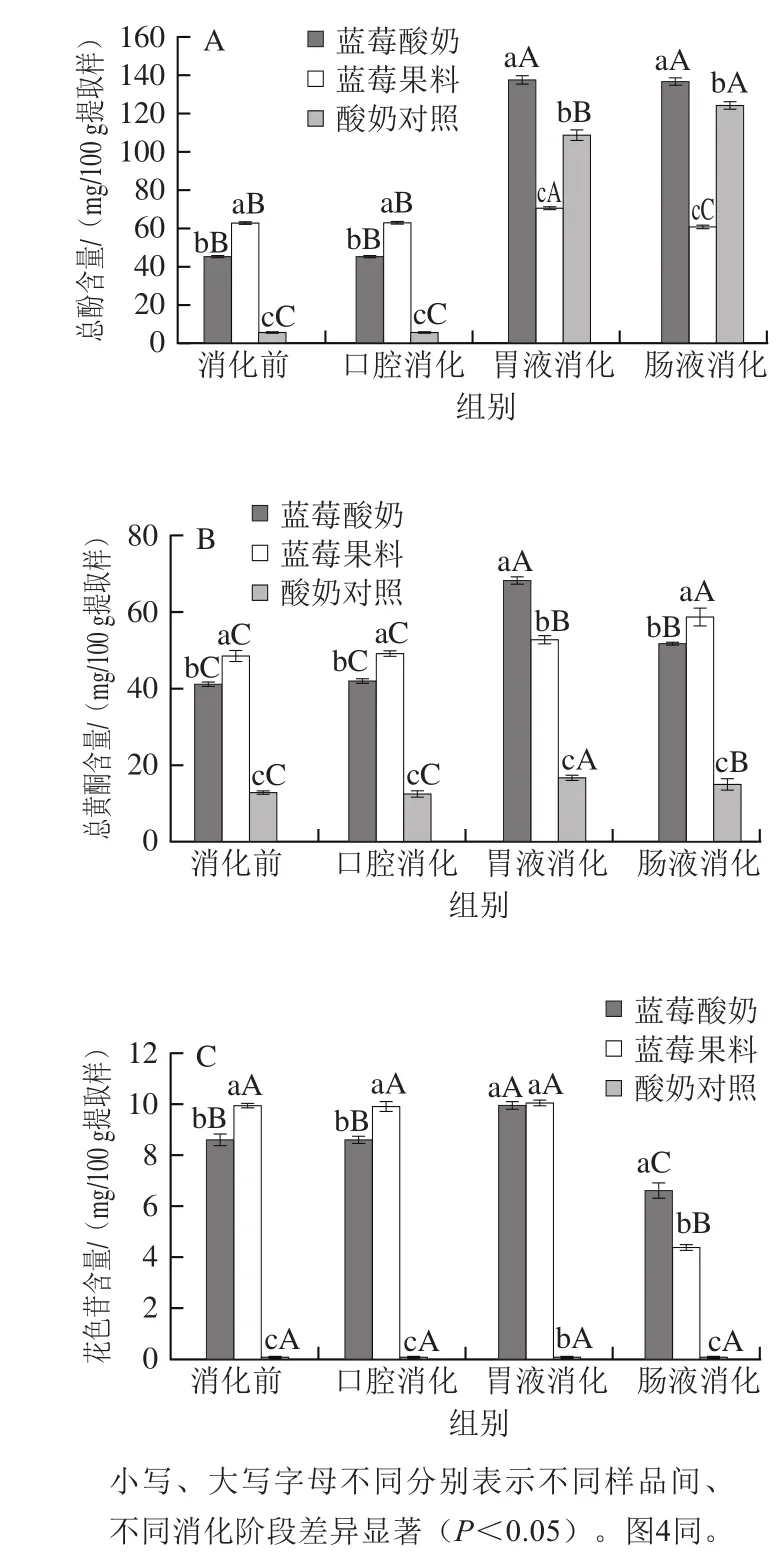
图3 各样品体外消化前后总酚(A)、总黄酮(B)和花色苷(C)含量变化Fig. 3 Changes in the contents of total phenolics (A), total flavonoids (B) and anthocyanins (C) in different samples during simulated gastrointestinal digestion
由图3A可知,消化前蓝莓酸奶、蓝莓果料、酸奶对照的总酚含量分别为45.63、62.67、6.04 mg/100 g提取样;模拟口腔消化1 min后,总酚含量均无显著变化(P>0.05),表明口腔消化对多酚类物质影响不大;模拟胃液消化1 h后,各样品的总酚含量较消化前分别提高了199.56%、12.28%、1 708.33%(P<0.05),表明模拟胃液消化能够促进各样品酚类物质的释放,可能是在胃蛋白酶和胃酸作用下,有利于酚类物质从蛋白、果胶等的交联作用中释放[7,24],并从结合态转化为游离态;同时,蓝莓酸奶、酸奶对照的总酚含量均高于蓝莓果料,这可能是乳蛋白被胃蛋白酶水解后生成大量水溶性蛋白[25],导致其总酚测定结果大大提高;模拟肠液消化2 h后,蓝莓酸奶、酸奶对照的总酚含量较消化前分别提高了198.03%、1 961.67%,而蓝莓果料的总酚含量却较消化前降低了3.35%(P<0.05),表明蓝莓多酚在模拟肠液消化时部分发生降解,而蓝莓酸奶中的乳蛋白在胰蛋白酶作用下进一步水解并释放水溶性蛋白,掩盖了蓝莓多酚的损失,总酚含量仍保持较高水平。
由图3B可知,消化前,蓝莓酸奶、蓝莓果料、酸奶对照的总黄酮含量分别为41.10、48.48、12.78 mg/100 g提取样;模拟胃液消化1 h后,蓝莓酸奶、蓝莓果料、酸奶对照的总黄酮含量较消化前分别提高了66.18%、8.45%、31.25%(P<0.05),表明模拟胃液消化能够促进黄酮物质的释放;模拟肠液消化2 h后,蓝莓果料的总黄酮含量达到最大值(58.79 mg/100 g提取样),一方面可能是胰蛋白酶、胆盐等作用有利于黄酮类物质从果料基质中游离释放;另一方面也可能是非黄酮类物质在肠液pH值环境中转化为黄酮类物质[17];但蓝莓酸奶的总黄酮含量(51.86 mg/100 g提取样)却低于蓝莓果料,可能是酸奶基质阻碍了蓝莓黄酮的释放,相同报道称蓝莓与牛奶共同消化会降低蓝莓黄酮的生物利用率[26]。
由图3C可知,消化前,蓝莓酸奶、蓝莓果料的花色苷含量分别为8.57、9.96 mg/100 g提取样;模拟胃液消化1 h后,蓝莓酸奶的花色苷含量较消化前提高了16.22%(P<0.05),蓝莓果料则较消化前无显著变化(P>0.05);模拟肠液消化2 h后,蓝莓酸奶、蓝莓果料的花色苷含量(6.62、4.40 mg/100 g提取样)均显著降低(P<0.05),甚至低于消化前水平,表明花色苷在肠液消化环境下发生了降解,但蓝莓酸奶的花色苷含量大于蓝莓酸奶,可能是酸奶对花色苷有保护作用。McDougall等[27]同样报道树莓与面包、冰淇淋等结合能够提高其花色苷等不稳定多酚类物质的小肠消化耐受性。
2.5 体外消化前后各样品抗氧化活性变化

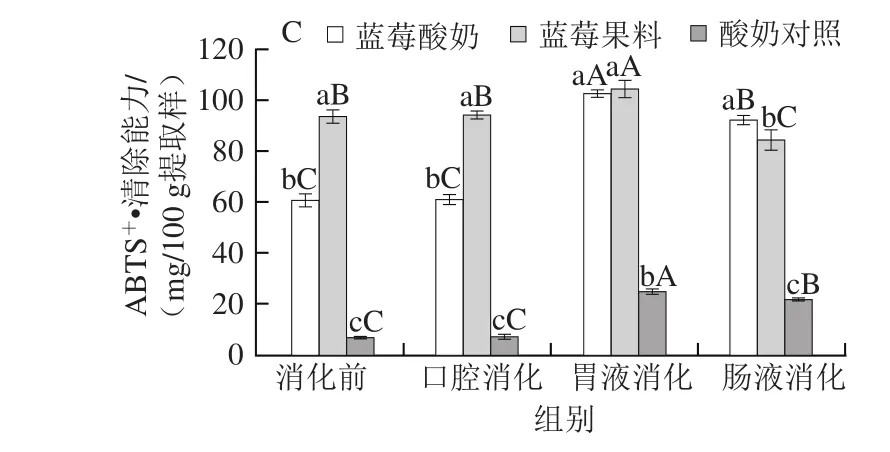
图4 各样品体外消化前后总抗氧化活力(A)、DPPH自由基(B)和ABTS+ ·清除能力(C)变化Fig. 4 Changes in total antioxidant capacity (A), DPPH (B) and ABTS (C) radical scavenging activity of different samples during simulated gastrointestinal digestion
由图4A可知,消化前,蓝莓酸奶、蓝莓果料、酸奶对照的总抗氧化活力分别为43.48、60.57、26.89 mg/100 g提取样;模拟口腔消化1 min后,各样品的总抗氧化活力较消化前均无显著变化(P>0.05);模拟胃液消化1 h后,各样品的总抗氧化活力较消化前分别提高了100.92%、15.35%、107.43%(P<0.05);模拟肠液消化2 h后,各样品的总抗氧化活力较胃液消化有所下降,但较消化前仍分别提高了79.31%、6.27%、98.51%(P<0.05)。
由图4B可知,消化前,蓝莓酸奶、蓝莓果料、酸奶对照的DPPH自由基清除能力分别为61.25、86.38、6.35 mg/100 g提取样;模拟胃液消化1 h后,各样品的DPPH自由基清除能力较消化前分别提高了32.63%、7.18%、209.38%(P<0.05);模拟肠液消化2 h后,蓝莓酸奶、蓝莓果料的DPPH自由基清除能力较胃液消化无明显变化(P>0.05),而酸奶对照的DPPH自由基清除能力无检出,可能是酸奶对照中抗氧化物质的DPPH自由基清除活性受pH值影响。
由图4C可知,消化前,蓝莓酸奶、蓝莓果料、酸奶对照的ABTS+·清除能力分别为60.61、93.46、6.62 mg/100 g提取样;模拟胃液消化1 h后,各样品的ABTS+·清除能力较消化前分别提高了69.47%、11.44%、274.24%(P<0.05);模拟肠液消化2 h后,各样品的ABTS+·清除能力较胃液消化均显著下降(P<0.05),但对比消化前水平,蓝莓酸奶、酸奶对照的ABTS+·清除能力分别提高了52.15%、222.73%,而蓝莓果料则降低了10.16%。
结合图3、4可知,各样品的抗氧化活性物质主要在胃消化阶段释放,抗氧化活性随之提高,但不同抗氧化指标对蓝莓酸奶、蓝莓果料的抗氧化活性大小评价结果不同,可能是由于经模拟胃液消化后,蓝莓酸奶中除酚类物质外,伴随释放的可溶性蛋白、半纤维素、游离氨基酸、抗氧化肽、活性多糖等[17]也在同时发挥抗氧化作用,不同抗氧化物对铁离子还原力或不同人造自由基的清除能力各异,且不同抗氧化成分间还可能存在抗氧化相互作用[28],造成评价结果有差异。模拟肠液消化后,蓝莓酸奶的总抗氧化活力和ABTS+·清除能力均大于蓝莓果料,但由于酸奶对照丧失其DPPH自由基清除能力,造成蓝莓酸奶对DPPH自由基的清除能力低于蓝莓果料。
3 结 论
贮藏期间,蓝莓酸奶的总酚、总黄酮、花色苷含量及总抗氧化活力、DPPH自由基和ABTS+·清除能力降幅均高于蓝莓果料,表明酸奶体系降低了多酚类物质的稳定性和抗氧化活性。消化前,蓝莓酸奶的各指标水平均低于蓝莓果料,经模拟胃肠消化后,蓝莓酸奶中除花色苷外其他各指标水平较消化前均显著提高(P<0.05),且总酚、花色苷、总抗氧化活力、ABTS+·清除能力均高于蓝莓果料,说明蓝莓酸奶经胃肠消化后其多酚类物质被释放,抗氧化活性得到增强。
参考文献:
[1] RISO P, KLIMIS-ZACAS D, DEL BO C, et al. Effect of a wild blueberry (Vaccinium angustifolium) drink intervention on markers of oxidative stress, inflammation and endothelial function in humans with cardiovascular risk factors[J]. European Journal of Nutrition, 2013,52(3): 949-961. DOI:10.1007/s00394-012-0402-9.
[2] BISWAS D, WIDEMAN N E, O’ BRYAN C A, et al. Pasteurized blueberry (Vaccinium corymbosum) juice inhibits growth of bacterial pathogens in milk but allows survival of probiotic bacteria[J].Journal of Food Safety, 2012, 32(2): 204-209. DOI:10.1111/j.1745-4565.2012.00369.x.
[3] BOHN T, MCDOUGALL G J, ALEGRÍA A, et al. Mind the gap:deficits in our knowledge of aspects impacting the bioavailability of phytochemicals and their metabolites: a position paper focusing on carotenoids and polyphenols[J]. Molecular Nutrition & Food Research,2015, 59(7): 1307-1323. DOI:10.1002/mnfr.201400745.
[4] 李颖畅, 李冰心, 孟良玉, 等. 圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J]. 食品科学, 2012, 33(9): 105-109.
[5] 曹雪丹, 方修贵, 赵凯, 等. 蓝莓汁花色苷热降解动力学及抗坏血酸对其热稳定性的影响[J]. 中国食品学报, 2013, 13(3): 47-54.
[6] 李亚, 陈卫, 庄晶晶, 等. 体外消化对蓝莓活性成分及防护氧化损伤的影响[J]. 中国食品学报, 2015, 15(8): 10-17.
[7] CORREA-BETANZO J, ALLEN-VERCOE E, MCDONALD J, et al.Stability and biological activity of wild blueberry (Vaccinium angustifolium) polyphenols during simulated in vitro gastrointestinal digestion[J]. Food Chemistry, 2014, 165(20): 522-531. DOI:10.1016/j.foodchem.2014.05.135.
[8] SUN-WATERHOUSE D, ZHOU J, WADHWA S S. Drinking yoghurts with berry polyphenols added before and after fermentation[J]. Food Control, 2013, 32(2): 450-460. DOI:10.1016/j.foodcont.2013.01.011.
[9] ŚCIBISZ I, ZIARNO M, MITEK M, et al. Effect of probiotic cultures on the stability of anthocyanins in blueberry yoghurts[J]. LWT-Food Science and Technology, 2012, 49(2): 208-212. DOI:10.1016/j.lwt.2012.06.025.
[10] CEBECI F, ŞAHIN-YEŞILÇUBUK N. The matrix effect of blueberry,oat meal and milk on polyphenols, antioxidant activity and potential bioavailability[J]. International Journal of Food Sciences and Nutrition, 2014, 65(1): 69-78. DOI:10.3109/09637486.2013.825699.
[11] TRIGUEROS L, WOJDYŁO A, SENDRA E. Antioxidant activity and protein-polyphenol interactions in a pomegranate (Punica granatum L.)yogurt[J]. Journal of Agricultural and Food Chemistry, 2014, 62(27):6417-6425. DOI:10.1021/jf501503h.
[12] 蔡萌, 杜双奎, 柴岩, 等. 黄土高原小粒大豆抗氧化活性研究[J]. 中国食品学报, 2014, 14(8): 108-115.
[13] LEE J, DURST R W, WROLSTAD R E. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages,natural colorants, and wines by the pH differential method:collaborative study[J]. Journal of AOAC International, 2005, 88(5):1269-1278.
[14] BERKER K I, GÜÇLÜ K, TOR İ, et al. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method[J]. Food Analytical Methods, 2010, 3(3): 154-168. DOI:10.1007/s12161-009-9117-9.
[15] SHEN Yingbin, ZHANG Hui, CHENG Liling, et al. In vitro and in vivo antioxidant activity of polyphenols extracted from black highland barley[J]. Food Chemistry, 2016, 194: 1003-1012. DOI:10.1016/j.foodchem.2015.08.083.
[16] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[17] OLIVEIRA A, PINTADO M. Stability of polyphenols and carotenoids in strawberry and peach yoghurt throughout in vitro gastrointestinal digestion[J]. Food & Function, 2015, 6(5): 1611-1619. DOI:10.1039/C5FO00198F.
[18] STOJADINOVIC M, RADOSAVLJEVIC J, OGNJENOVIC J, et al.Binding affinity between dietary polyphenols and β-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J]. Food Chemistry,2013, 136(3/4): 1263-1271. DOI:10.1016/j.foodchem.2012.09.040.
[19] ARTS M J T J, HAENEN G R M M, WILMS L C, et al. Interactions between flavonoids and proteins: effect on the total antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(5):1184-1187. DOI:10.1021/jf010855a.
[20] VÁZQUEZ C V, ROJAS M G V, RAMÍREZ C A, et al. Total phenolic compounds in milk from different species. design of an extraction technique for quantification using the Folin-Ciocalteu method[J]. Food Chemistry, 2015, 176(8): 480-486. DOI:10.1016/j.foodchem.2014.12.050.
[21] OLIVEIRA A, ALEXANDRE E M C, COELHO M, et al.Incorporation of strawberries preparation in yoghurt: impact on phytochemicals and milk proteins[J]. Food Chemistry, 2015, 171: 370-378.DOI:10.1016/j.foodchem.2014.08.107.
[22] LEOPOLDINI M, RUSSO N, TOSCANO M. The molecular basis of working mechanism of natural polyphenolic antioxidants[J].Food Chemistry, 2011, 125(2): 288-306. DOI:10.1016/j.foodchem.2010.08.012.
[23] FARVIN K H S, BARON C P, NIELSEN N S, et al. Antioxidant activity of yoghurt peptides: part 2: characterisation of peptide fractions[J]. Food Chemistry, 2010, 123(4): 1090-1097. DOI:10.1016/j.foodchem.2010.05.029.
[24] ŚWIECA M, GAWLIK-DZIKI U, DZIKI D, et al. The influence of protein-flavonoid interactions on protein digestibility in vitro and the antioxidant quality of breads enriched with onion skin[J]. Food Chemistry, 2013, 141(1): 451-458. DOI:10.1016/j.foodchem.2013.03.048.
[25] PIHLANTO A. Antioxidative peptides derived from milk proteins[J].International Dairy Journal, 2006, 16(11): 1306-1314. DOI:10.1016/j.idairyj.2006.06.005.
[26] SERAFINI M, TESTA M F, VILLAÑO D, et al. Antioxidant activity of blueberry fruit is impaired by association with milk[J]. Free Radical Biology and Medicine, 2009, 46(6): 769-774. DOI:10.1016/j.freeradbiomed.2008.11.023.
[27] MCDOUGALL G J, DOBSON P, SMITH P, et al. Assessing potential bioavailability of raspberry anthocyanins using an in vitro digestion system[J]. Journal of Agricultural and Food Chemistry, 2005, 53(15):5896-5904. DOI:10.1021/jf050131p.
[28] 蒋海伟, 杨婷婷, 李红艳, 等. 茄子、紫薯和胡萝卜中植物化学物之间的抗氧化相互作用[J]. 中国食品学报, 2016, 16(7): 17-24.DOI:10.16429/j.1009-7848.2016.07.003.
