CXCL4对人真皮微血管内皮细胞的功能及分泌血管舒缩因子的影响①
2018-05-25姜智星梁敏锐邹和建
姜智星 杨 森 陈 琛 梁敏锐 邹和建
(复旦大学附属华山医院风湿科,上海 200000)
系统性硬化症(Systemic sclerosis,SSc)是一种以皮肤、肺等多器官发生炎症、血管病变、纤维化为特征的慢性自身免疫性疾病。内皮细胞功能失调与SSc早期血管病变有关,在血管重塑中起到重要作用[1]。其中,自身免疫诱导内皮细胞产生的细胞因子及黏附因子最终导致内皮细胞的损伤及凋亡[2]。血管病变主要包括肺动脉高压、雷诺现象、指端溃疡,严重影响患者预后及生活治疗,目前研究发现内皮素-1、Fli-1(Friend leukemia virus integration 1,Fli-1)、血管紧张素Ⅱ1型受体(Angiotensin Ⅱ type 1 receptor,AT1R)、内皮素受体A(Endothelin-1 type A receptor,ETAR)等血管舒缩因子可通过作用于SSc患者血管内皮细胞发挥其生物学功能,参与SSc血管病变进程[3-5]。
CXCL4[Chemokine(C-X-C motif)ligand 4,CXCL4]是由70个氨基酸组成的,分子量为7.8 kD的趋化因子。其特异性受体为CXCR3,可通过干扰血管生成因子(Vascular endothelial growth factor,VEGF)和成纤维生成因子(Fibroblast growth factors,FGF)的生成发挥抗血管生成等作用。CXCL4可以与这些促血管生成因子结合,从而阻断其特异性受体6,7,或通过与FGF或VEGF竞争细胞表面硫酸乙酰肝素蛋白多糖[7,8],拮抗血管生成。既往研究发现,CXCL4在SSc患者体内血清学水平较健康人群明显升高,且在SSc伴肺动脉高压患者中CXCL4升高尤为明显[9]。然而具体调控机制尚不明确。
因HDMEC广泛用于研究SSc血管病变机制研究中,故本研究旨在探讨CXCL4对HDMEC的增殖和血管形成功能,及其分泌内皮素-1、Fli-1、AT1R、ETAR的影响。
1 材料与方法
1.1实验材料、试剂 原代HDMEC购自中国科学院细胞库;内皮细胞完全生长培养液购自Promocell公司;胎牛血清购自Gibco公司;CXCL4购自PeproTech 公司,anti-CXCL4 antibody购自R&D公司;CCK-8细胞计数试剂盒购自日本同仁化学所;基质胶购自BD公司;TRIZOL购自Invitrogen公司;PrimeScript RT reagent kit及SYBR Green PCR Master mix 购自TaKaRa公司;引物由上海生物工程有限公司合成。
1.2实验方法
1.2.1细胞培养 原代HDMEC细胞采用内皮细胞完全培养基培养于37℃、5%CO2环境下,待细胞融合度达80%时传代,实验所用为第3~7代细胞。
1.2.2CXCL4对HDMEC增殖的影响 将HDMEC分5组接种于96孔板,依次为对照组,CXCL4组(终浓度为5、10、20 ng/ml)及CXCL4+CXCL4拮抗剂组,每组设6个复孔,细胞密度为104个/孔。24 h 后应用无血清内皮细胞生长培养液饥饿培养24 h,后换为含10%胎牛血清的内皮细胞生长培养液,并加入CXCL4。分别干预24、48 h后将培养基更换为无血清内皮细胞生长培养液(100 μl/孔),并加入CCK-8试剂10 μl处理2 h。最后在酶标仪上检测每组在450 nm的吸光度(A)值。参照CCK-8试剂盒说明书计算细胞活力。
1.2.3实时定量聚合酶链反应(Real-time PCR) 将HDMEC接种于24孔板,每组设3个复孔,细胞密度为105个/孔,按上述分组干预细胞。24 h后用TRIZOL法提取RNA,根据PrimeScript RT reagent kit试剂盒说明书合成cDNA,按照SYBR Green PCR Master mix试剂盒说明书在ABI 7500 Fast Real-Time PCR System上进行聚合酶链反应。反应条件为:95℃变性5 min;95℃15 s,60℃34 s,循环40次;60℃延伸30 s,结果以Ct值表示,通过ΔΔCt法进行分析。并运用PrimerPremier5.0软件设计CXCR3、内皮素-1、Fli-1、AT1R、ETAR的mRNA引物,以GAPDH为内参。CXCR3及GAPDH的PCR产物行10 g/L琼脂糖凝胶电泳。引物序列见表1。
1.2.4体外血管形成实验 将HDMEC接种于6孔板,分CXCL4实验组(终浓度为20 ng/ml)及对照组。干预24 h后收集各组细胞,制成2×105ml单细胞悬液备用。将冻存的基质胶放入4℃冰箱溶解过夜,铺于96孔板,每组设3个复孔,每孔铺胶50 μl。放置于37℃孵箱30 min后每孔加入100 μl细胞悬液,培养4 h后在相差显微镜下观察每孔管腔形成并拍照计数。
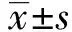
2 结果
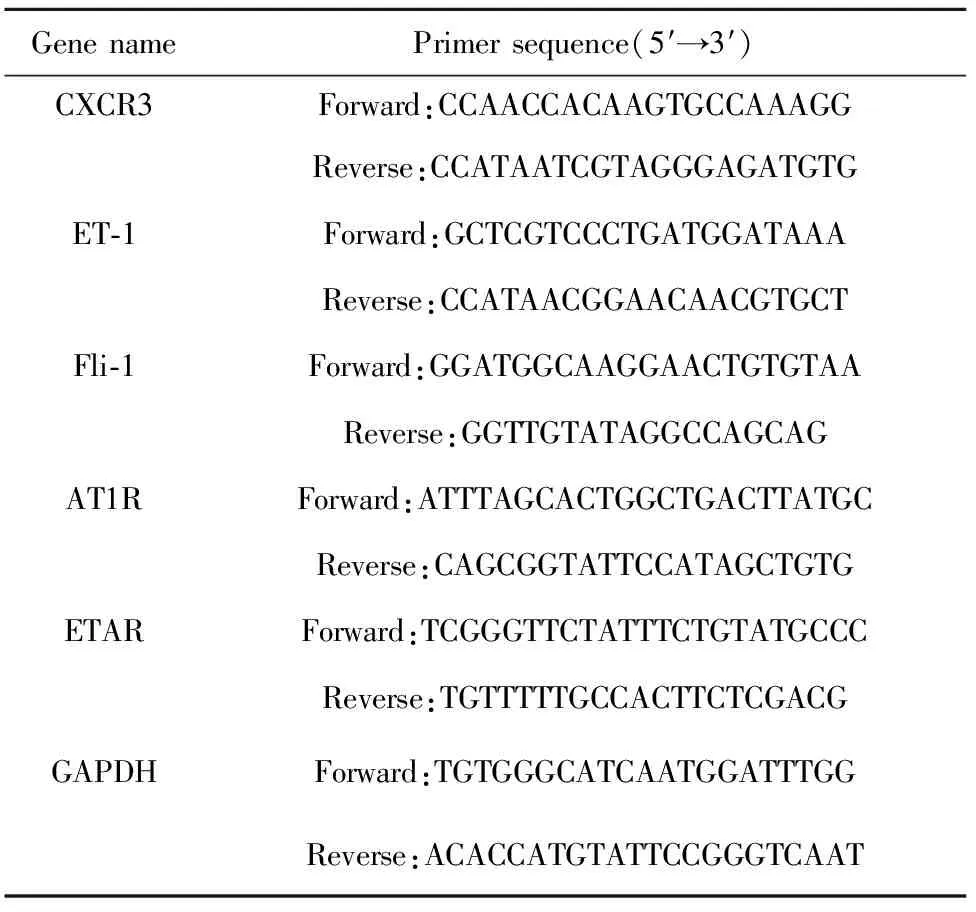
2.1CXCR3在HDMEC中表达 RT-PCR结果显示HDMEC有CXCL4特异性受体CXCR3的mRNA表达。见图1。
2.2CXCL4对HDMEC增殖的影响 分别检测5组(对照组,CXCL4浓度5、10、20 ng/ml组及CXCL4+拮抗剂组)在450 nm的A值,计算细胞增殖活力,结果显示:各组在时间点24 h时的细胞增殖活性分别为100.00%±3.16%,92.14%±0.62%,85.14%±0.35%,74.99%±1.77%,99.11%±0.62%;对照组与CXCL4组两两比较差异均有统计学意义(P均<0.01);提示HDMEC细胞增殖能力随着CXCL4浓度不断升高而呈剂量依赖性下降。CXCL4+拮抗剂组与20 ng/ml的CXCL4组比较差异有统计学意义(P<0.01),说明CXCL4拮抗剂能显著减少CXCL4抑制HDMEC细胞增殖的能力。在时间点48 h时,5个组(对照组,CXCL4浓度5、10、20 ng/ml组及CXC4+拮抗剂组)的细胞增殖活性分别为100%±0.64%,95.45%±1.08%,94.63%±0.65%,93.56%±0.22%,98.42%±1.48%;对照组与CXCL4组两两比较差异均有统计学意义(P均<0.01),CXCL4+拮抗剂组与20 ng/ml的CXCL4组比较有统计学意义(P<0.01)。见图2。
表1引物序列
Tab.1Primersequence
GenenamePrimersequence(5′→3′)CXCR3Forward:CCAACCACAAGTGCCAAAGGReverse:CCATAATCGTAGGGAGATGTGET⁃1Forward:GCTCGTCCCTGATGGATAAAReverse:CCATAACGGAACAACGTGCTFli⁃1Forward:GGATGGCAAGGAACTGTGTAAReverse:GGTTGTATAGGCCAGCAGAT1RForward:ATTTAGCACTGGCTGACTTATGCReverse:CAGCGGTATTCCATAGCTGTGETARForward:TCGGGTTCTATTTCTGTATGCCCReverse:TGTTTTTGCCACTTCTCGACGGAPDHForward:TGTGGGCATCAATGGATTTGGReverse:ACACCATGTATTCCGGGTCAAT
2.3CXCL4对HDMEC血管形成功能的影响 结果显示,5个组(对照组,CXCL4浓度5、10、20 ng/ml组及CXC4+拮抗剂组)管腔形成数量分别为(51.70±8.74)个、(31.33±4.16)个、(24.33±2.08)个、(20.01±12.12)个、(49.02±3.00)个;对照组CXCL4组两两比较差异均有统计学意义(P=0.022,P<0.01,P=0.021)。CXCL4+拮抗剂组与20 ng/ml的CXCL4组比较有统计学意义(P<0.01)。见图3。
2.4CXCL4对HDMEC分泌内皮素-1、Fli-1、AT1R、ETAR的mRNA表达水平的影响 Real-time PCR检测结果显示,5个组(对照组,CXCL4终浓度5、10、20 ng/ml 组及CXC4+拮抗剂组)内皮素-1基因的mRNA扩增倍数分别为1.00±0.48,1.73±0.72,3.24±0.36,5.64±0.73,1.38±0.51;对照组与CXCL4组两两比较差异均有统计学意义(P=0.023,P<0.01,P<0.01)。CXCL4终浓度20 ng/ml组与CXCL4+拮抗剂组比较差异有统计学意义(P<0.01)。Fli-1基因分别为1.00±0.35,0.73±0.54,0.11±0.23,0.03±0.06, 0.84±0.41; 对照组与CXCL4终浓度10、20 ng/ml组两两比较差异均有统计学意义(P均<0.01)。CXCL4终浓度20 ng/ml组与CXCL4+拮抗剂组比较差异有统计学意义(P<0.01)。AT1R基因分别为1.00±0.55,1.43±0.38,3.26±0.55,5.92±0.54,1.17±0.27;对照组与CXCL4终浓度10、20 ng/ml组两两比较差异均有统计学意义(P均<0.01)。CXCL4终浓度20 ng/ml组与CXCL4+拮抗剂组比较差异有统计学意义(P<0.01)。ETAR基因分别为1.00±0.45,1.07±0.38,1.20±0.93,1.23±0.89,0.58±0.45;对照组与CXCL4组两两比较差异无统计学意义(P=0.70,P=0.57,P=0.49),CXCL4终浓度20 ng/ml组与CXCL4+拮抗剂组比较差异也无统计学意义(P=0.07)。见图4。
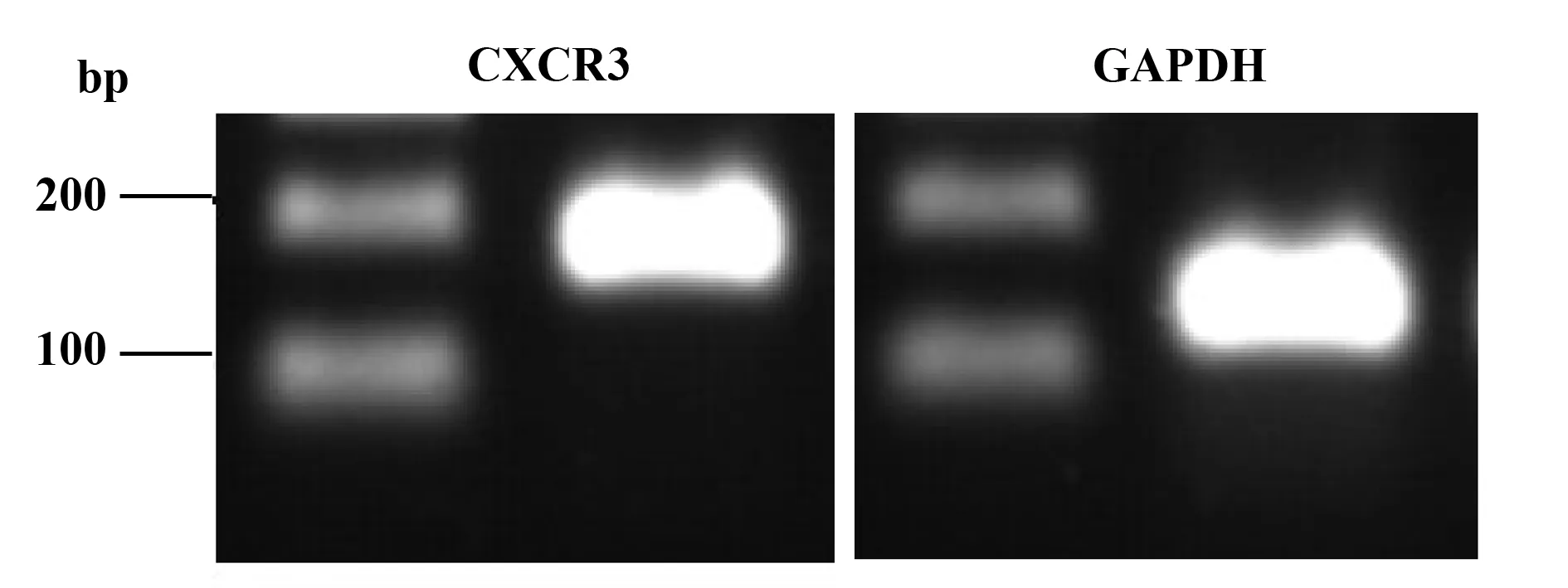
图1 CXCR3在HDMEC上表达Fig.1 CXCR3 expressed on HDMECs
图2 CXCL4抑制HDMEC增殖Fig.2 CXCL4 inhibit proliferation of HDMECsNote:Compared with control group,**.P<0.01.
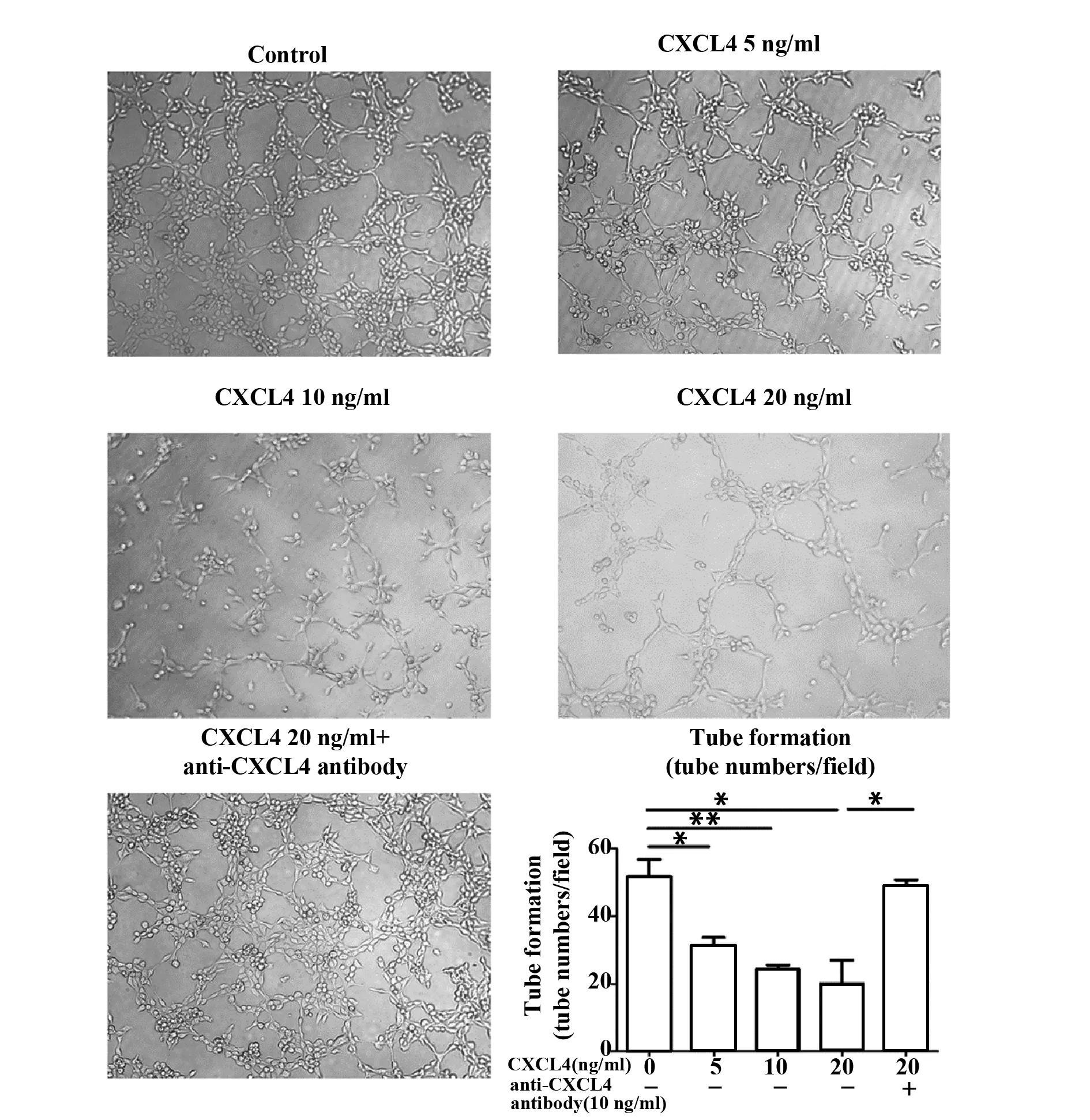
图3 CXCL4抑制HDMEC血管形成数目Fig.3 CXCL4 inhibit number of tube formation on HDMECsNote:Compared with control group,*.P<0.05,**.P<0.01.
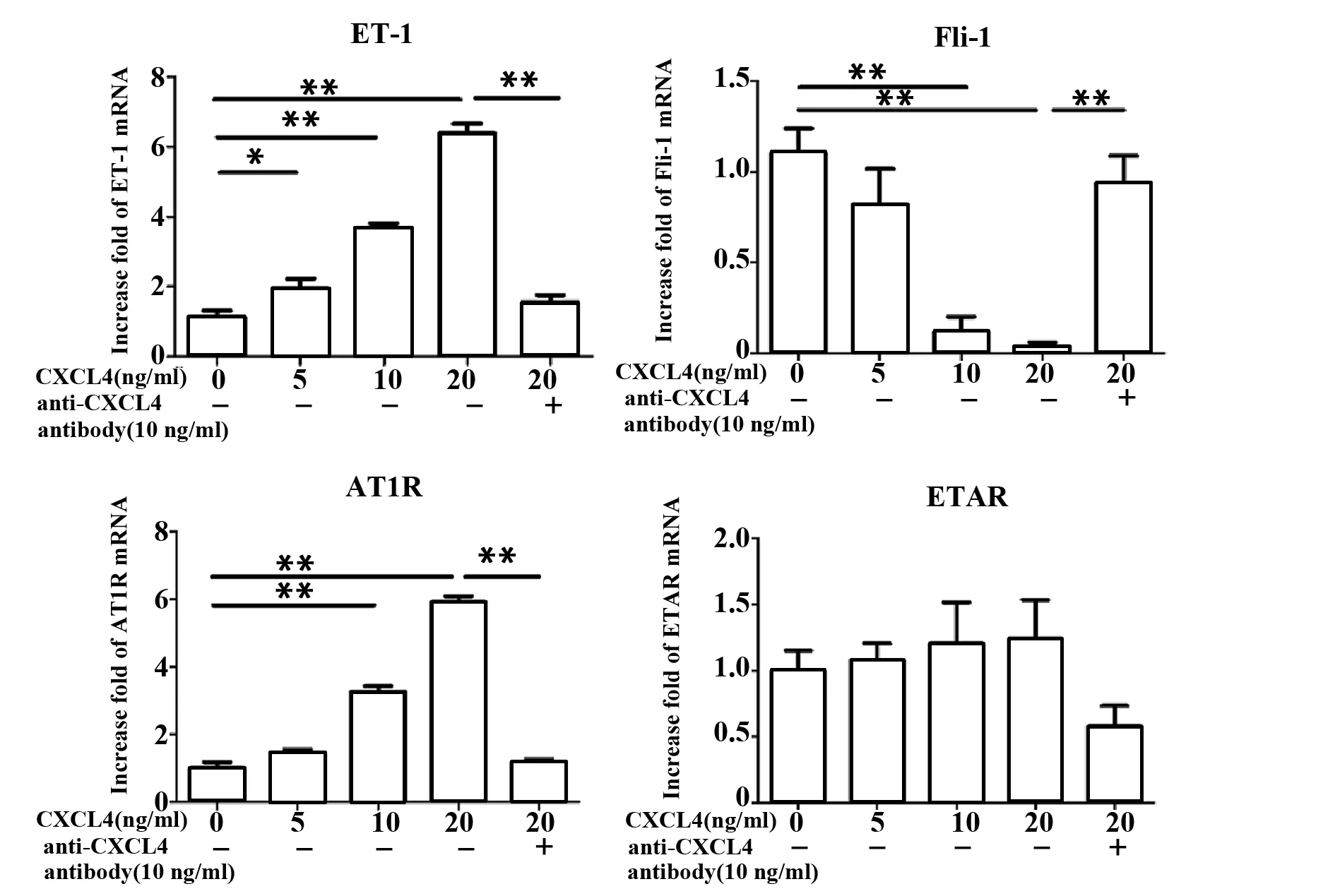
图4 CXCL4对内皮素-1、Fli-1、AT1R、ETAR基因mRNA水平影响Fig.4 Effect of CXCL4 on mRNA expression of vasomo-tion factors in HDMECsNote:Compared with control group,*.P<0.05,**.P<0.01.
3 讨论
血管损伤是SSc起病最早也是最主要的病变,其中微血管损伤和内皮细胞活化是中心环节,可引起毛细血管减少,血管平滑肌增殖,血管壁增厚,管腔狭窄,组织缺氧以及氧化应激等一系列病理生理改变[10]。近年来,CXCL4被证实在SSc病程中起到重要作用。由浆细胞/树突状细胞分泌的CXCL4通过下调Fli-1基因表达使SSc患者血管系统中内皮细胞表面标记降低,参与SSc血管病变[9]。此外,CXCL4可诱导促纤维化因子白介素-4(Interleukin-4,IL-4)和IL-13表达上调,抑制抗纤维化细胞因子干扰素-γ(Interferon-γ,IFN-γ)的表达[11],还可通过干扰调节性T细胞参与免疫反应[12]。然而关于CXCL4能否直接作用于内皮细胞,影响血管生成因子表达尚不清楚。本研究发现CXCL4能显著抑制HDMEC增殖,抑制HDMEC血管形成功能,通过促进内皮素-1、AT1R基因的mRNA水平表达,抑制Fli-1基因mRNA水平表达,多种途径发挥抗血管生成的作用。内皮细胞功能失调表现为内皮细胞活化,凋亡,分泌细胞因子异常,可导致血管重构,动脉粥样硬化增多,毛细血管缺如,最终导致血管阻塞。而内皮细胞的凋亡被视为内皮细胞损伤最直接的病理生理改变[13]。本研究中,应用CCK-8的方法证实,在体外,CXCL4能抑制HDMEC增殖,并呈剂量依赖性。当CXCL4的终浓度分别为5、10、20 ng/ml时,CXCL4表现出明显的抗内皮细胞增殖作用,且进一步利用针对CXCL4的拮抗剂与CXCL4同时干预细胞,结果显示内皮细胞增殖能力较CXCL4干预组明显增高,提示CXCL4可能通过抑制内皮细胞增殖直接参与SSc血管病变。
内皮细胞分泌细胞因子异常亦可导致血管损伤。内皮素-1是一种由内皮细胞分泌的强效收缩血管及促纤维化因子,在SSc患者及SSc伴指端溃疡患者体内血清学水平明显升高[3]。波生坦作为内皮素受体拮抗剂,已经广泛应用于临床上治疗SSc及预防SSc指端溃疡的发生[14]。在本研究中发现,内皮素-1基因的mRNA水平可随CXCL4终浓度升高而呈剂量依赖性升高,而CXCL4拮抗剂可显著抑制这种升高趋势。
近年来,有关Fli-1基因研究颇多。选择性敲除内皮细胞Fli-1基因的小鼠可下调经典内皮细胞表面标记的表达,这些小鼠可表现为血管凋亡、缺如,血管重塑等类似SSc血管病变表现[4]。van Bon等研究发现CXCL4能通过下调Fli-1基因的mRNA和蛋白的表达引起血管损伤[9]。本研究亦提示,CXCL4能显著下调Fli-1基因的mRNA水平。
目前认为,AT1R和ETAR也参与了SSc疾病相关进程[5]。在大多数SSc患者体内可检测出Anti-AT1R 和 anti-ETAR 抗体,这些自身抗体表达于内皮细胞上,与疾病活动度和致死率呈正相关。本研究发现CXCL4可显著升高AT1R基因的mRNA水平,但对ETAR基因表达无明显改变。
既往研究中,CXCL4对血管损伤的作用机制尚不清楚。本研究探讨CXCL4能直接抑制HDMEC增殖能力,影响多种细胞因子分泌,使血管形成能力受损,从而产生抗血管生成作用。有关CXCL4抗血管生成作用,仍需要更多的体内实验进一步证实。
参考文献:
[1] Cantatore FP,Maruotti N,Corrado A,etal.Angiogenesis dysregulation in the pathogenesis of systemic sclerosis [J].Biomed Res Int,2017,2017(1):6.
[2] Kahaleh B.Vascular disease in scleroderma:mechanisms of vascular injury[J].Rheum Dis Clin North Am,2008,34(1):57-71.
[3] Silva I,Teixeira A,Oliveira J,etal.Predictive value of vascular disease biomarkers for digital ulcers in systemic sclerosis patients[J].Clin Exp Rheumatol,2015,33(4 Suppl 91):S127-S130.
[4] Asano Y,Stawski L,Hant F,etal.Endothelial Fli1 deficiency impairs vascular homeostasis:a role in scleroderma vasculopathy[J].Am J Pathol,2010,176(4):1983-1998.
[5] Riemekasten G,Philippe A,Näther M,etal.Involvement of functional autoantibodies against vascular receptors in systemic sclerosis[J].Ann Rheum Dis,2011,70(3):530-536.
[6] Perollet C,Han ZC,Savona C,etal.Platelet factor 4 modulates fibroblast growth factor 2(FGF-2)activity and inhibits FGF-2 dimerization[J].Blood,1998,91(9):3289-3299.
[7] Sato Y,Abe M,Takaki R.Platelet factor 4 blocks the binding of basic fibroblast growth factor to the receptor and inhibits the spontaneous migration of vascular endothelial cells[J].Biochem Biophys Res Commun,1990,172(2):595-600.
[8] Gengrinovitch S,Greenberg SM,Cohen T,etal.Platelet factor-4 inhibits the mitogenic activity of VEGF121 and VEGF165 using several concurrent mechanisms[J].J Biol Chem,1995,270(25):15059-15065.
[9] van Bon L,Affandi AJ,Broen J,etal.Proteome-wide analysis and CXCL4 as a biomarker in systemic sclerosis[J].N Engl J Med,2014,370(5):433-443.
[10] Allanore Y,Simms R,Distler O,etal.Systemic sclerosis[J].Nat Rev Dis Primers,2015,15002(1):1-21.
[11] Romagnani P,Maggi L,Mazzinghi B,etal.CXCR3-mediated opposite effects of CXCL10 and CXCL4 on TH1 or TH2 cytokine production[J].J Allergy Clin Immunol,2005,116(6):1372-1379.
[12] Liu CY,Battaglia M,Lee SH,etal.Platelet factor 4 differentially modulates CD4+CD25+(regulatory)versus CD4+CD25-(nonregulatory)T cells[J].J Immunol,2005,174(5):2680-2686.
[13] Mostmans Y,Cutolo M,Giddelo C,etal.The role of endothelial cells in the vasculopathy of systemic sclerosis:A systematic review[J].Autoimmun Rev,2017,16(8):774-786.
[14] Corallo C,Cutolo M,Kahaleh B,etal.Bosentan and macitentan prevent the endothelial-to-mesenchymal transition(EndoMT)in systemic sclerosis:in vitro study[J].Arthritis Res Ther,2016,18(1):228.
