两种药剂亚致死浓度对稻纵卷叶螟生长发育及解毒酶活性的影响
2018-05-25杨亚军王彩云徐红星鲁艳辉吕仲贤
杨亚军 王彩云,2 徐红星 鲁艳辉 吕仲贤,*
(1浙江省植物有害生物防控重点实验室省部共建国家重点实验室培育基地/浙江省农业科学院 植物保护与微生物研究所,杭州 310021;2浙江师范大学 化学与生命科学学院,浙江 金华 321004;*通讯联系人,E-mail:luzxmh@163.com)
稻纵卷叶螟(Cnaphalocrocis medinalisGuenée)是我国水稻上重要的两迁害虫之一,广泛分布于中国、日本、朝鲜、韩国、越南、泰国、菲律宾等国家,其主要以幼虫纵卷水稻叶片取食为害[1,2]。20世纪60年代以后,随着耕作制度的改变、品种更新和密植高肥等措施的实行,稻纵卷叶螟的发生数量与危害程度逐年加重,20世纪70年代后在全国主要稻区大发生的频率明显增加[2]。2000年以来,稻纵卷叶螟的发生日益严重,其中2003年和2007年在全国大暴发[3]。据农业部统计,2014年和2015年稻纵卷叶螟全国累计发生面积分别为1497.4万hm2·次和1554.51万hm2·次,给水稻生产造成巨大损失[4]。
目前,稻纵卷叶螟的防治主要以化学防治为主,其他防治为辅。然而,很长一段时间,化学防治作为农林害虫防治的重要手段,农药的过量、不合理使用常带来环境污染、害虫抗药性产生和生物多样性下降等负面影响[5]。为了改善这一状况,包括中国在内的许多国家通过政策措施减少农药的使用[6]。另外,许多生物因素(如植物吸收和降解)和非生物因素(风、阳光、挥发、化学降解和滴落等)均会影响田间害虫接触的农药剂量[7]。接触低剂量农药会对昆虫的生长发育、生物学行为、繁殖等方面产生影响[8,9]。考虑到农业的可持续发展,农药对靶标害虫和益虫的影响越来越受到关注[8,9]。二化螟经氯虫苯甲酰胺亚致死剂量处理后,雌成虫体内卵黄蛋白CsVg表达量下降[10]。吡虫啉亚致死剂量可以降低褐飞虱的生殖力[11]。Zhang等[12]发现溴氰菊酯亚致死剂量可以降低黑肩绿盲蝽的捕食率,但氯虫苯甲酰胺则没有影响。然而,农药低剂量处理也会对害虫产生有利影响[9]。氟虫腈亚致死剂量处理的西花蓟马的生态适应性增强[13]。拟除虫菊酯低剂量可以刺激玉米象(Sitophilus zeamais)的生殖[14]。本研究用氯虫苯甲酰胺和毒死蜱亚致死剂量处理稻纵卷叶螟2龄幼虫后,并分析了其生长发育以及体内解毒酶活性的变化,以期为科学使用杀虫剂防治稻纵卷叶螟提供理论依据。
1 材料与方法
1.1 供试昆虫
稻纵卷叶螟幼虫于2016年采自杭州市萧山常规水稻田,在人工气候室内(26±1℃,相对湿度75%,16 h光照/8 h黑暗)用60日龄的水稻(台中在来1号,TN1)饲养至成虫后,饲以10%蜂蜜水,置于交配笼内交配产卵。卵孵化后移至离体的水稻叶片饲养至2龄初期,选择大小一致幼虫备用。
1.2 供试农药
毒死蜱(95%)购自西格玛奥德里奇(上海)贸易有限公司,氯虫苯甲酰胺(95%)购自上海杜邦农化有限公司。
1.3 生物测定
采用离体稻叶浸渍法进行生物测定。配置5~7个浓度梯度药剂,将新鲜嫩稻叶剪成5~9 cm小段,放入各处理药液中浸30 s,取出后晾干,以浸湿的脱脂棉包住叶两端放入培养皿,在培养皿中接入稻纵卷叶螟2龄幼虫,然后用保鲜膜封口。置人工气候箱中饲养。每个培养皿接虫20头,每个浓度3次重复。72 h后检查幼虫存活状况。计算出LC50,LC25和LC10。
1.4 亚致死剂量药剂处理稻纵卷叶螟幼虫对其生长发育的影响
根据生物测定结果,LC10和LC25作为低剂量浓度(72 h),蒸馏水作对照。将稻纵卷叶螟2龄初期幼虫接入已浸药30 s且晾干的离体水稻叶片上,72 h后将存活的稻纵卷叶螟幼虫转移到正常水稻叶片上继续饲养至化蛹,蛹羽化后,饲以10%的蜂蜜水,让其交配产卵。观察记录稻纵卷叶螟3~5龄幼虫发育历期、蛹历期和成虫寿命。每300头2龄初期幼虫为一个重复,每个处理3个重复。
1.5 稻纵卷叶螟高龄幼虫中肠酶的提取
亚致死剂量处理后转移到正常水稻叶片饲养至5龄中期幼虫用于中肠酶活性测定。取5头幼虫中肠作为一个处理,每个处理3个重复。取供试幼虫5头在冰上解剖,截取中肠置于400 μL、0.1 mol/L、pH 7.6的磷酸缓冲液[含1 mmol/L乙二胺四乙酸(EDTA),1 mmol/L二硫苏糖醇(DTT),1 mmol/L苯基硫,1 mmol/L苯甲基磺酰氟(PMSF)中匀浆,匀浆液在4℃、10000g下离心30min,取上清液在4℃以下保存备用。以牛血清蛋白(BSA)为标准蛋白,采用考马斯亮蓝G-250法测定中肠酶液中蛋白质含量[15]。
1.6 酯酶(EST)活性测定
酯酶活性测定参照杨亦桦[16]的方法进行,略有修改。取96孔酶标板,每孔加入200 μL底物与显色剂混合液(用0.2 mol/L、pH 6.0的磷酸缓冲液配制含10 mmol乙酸-1-萘酯和1 mmol固蓝RR盐,充分混合后过滤即可得到底物与显色剂混合液)。然后用8通道移液器迅速加入5 μL酶液于每孔中,在酶标仪450 nm下进行测定,每隔30 s记录一次光密度值,共记录20次。酶促反应阶段温度为27℃。实验条件的设定和数据记录均在计算机上完成,取光密度值0~3.5之间的数据计算反应速度,以反应速率表示酯酶活性(OD·min-1mg-1)。
1.7 谷胱甘肽-S-转移酶(GST)活性测定
谷胱甘肽-S-转移酶活性测定参照杨亦桦[16]的方法进行测定,略有修改。在96孔酶标板中依次加入20 μL稀释酶液(酶液用0.1 mol/L、pH 7.6的磷酸缓冲液稀释10倍)、100 μL 1.2 mmol/L的1-氯-2,4-二硝基苯(CDNB)和100 μL 6 mmol/L的谷胱甘肽(GSH)。在酶标仪340 nm下进行测定,间隔15 s记录一次光密度值,共记录60次。酶促反应阶段的温度为30℃,取光密度值0~2.0范围之间的数据计算反应速率,以反应速率表示酶活性(OD·min-1mg-1)。
1.8 多功能氧化酶(MFO)活性测定
多功能氧化酶活性测定参照杨亦桦[16]的方法进行,略有修改。在96孔酶标板中依次加入100 μL 2 mmol/L的对硝基苯甲醚(先溶于少量乙醇,再取少量溶于预热的0.1 mol/L、pH 7.8的磷酸缓冲液)、10 μL 9.6 mmol/L还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和100 μL酶液。在酶标仪405 nm下进行测定,每隔25 s记录一次光密度值,共记录40次。酶促反应的温度为30℃,数据记录与处理由软件进行。取光密度值范围0~1.5之间的数据计算反应速率,以反应速率表示酶活性(OD·min-1mg-1)。
1.9 数据统计与分析
生物测定数据用POLO Plus软件进行分析[17]。生长发育和酶活力数据以平均数±标准误(Mean±SE)表示,并用SPSS 18.0统计软件进行处理,进行方差分析。
2 结果与分析
2.1 生物测定
使用离体稻叶法测定了毒死蜱和氯虫苯甲酰胺对稻纵卷叶螟的毒力。结果显示,毒死蜱对稻纵卷叶螟的LC10、LC25和LC50分别为 0.044、0.209和1.169 mg/L;氯虫苯甲酰胺对稻纵卷叶螟的LC10、LC25和LC50分别为0.017、0.033和0.068 mg/L。
2.2 亚致死剂量农药处理对稻纵卷叶螟的幼虫发育历期及蛹期的影响
毒死蜱LC10和LC25处理稻纵卷叶螟2龄幼虫后,幼虫历期显著长于对照组,但LC10和LC25处理组间无显著差异(图1-A)。毒死蜱LC10和LC25处理组,蛹历期间无显著差异,但均显著低于对照组(图1-B)。分别使用氯虫苯甲酰胺亚致死剂量LC10和LC25处理稻纵卷叶螟2龄幼虫,处理后幼虫历期与对照组无显著差异(图1-A),蛹历期与处理组也无显著差异(图1-B)。
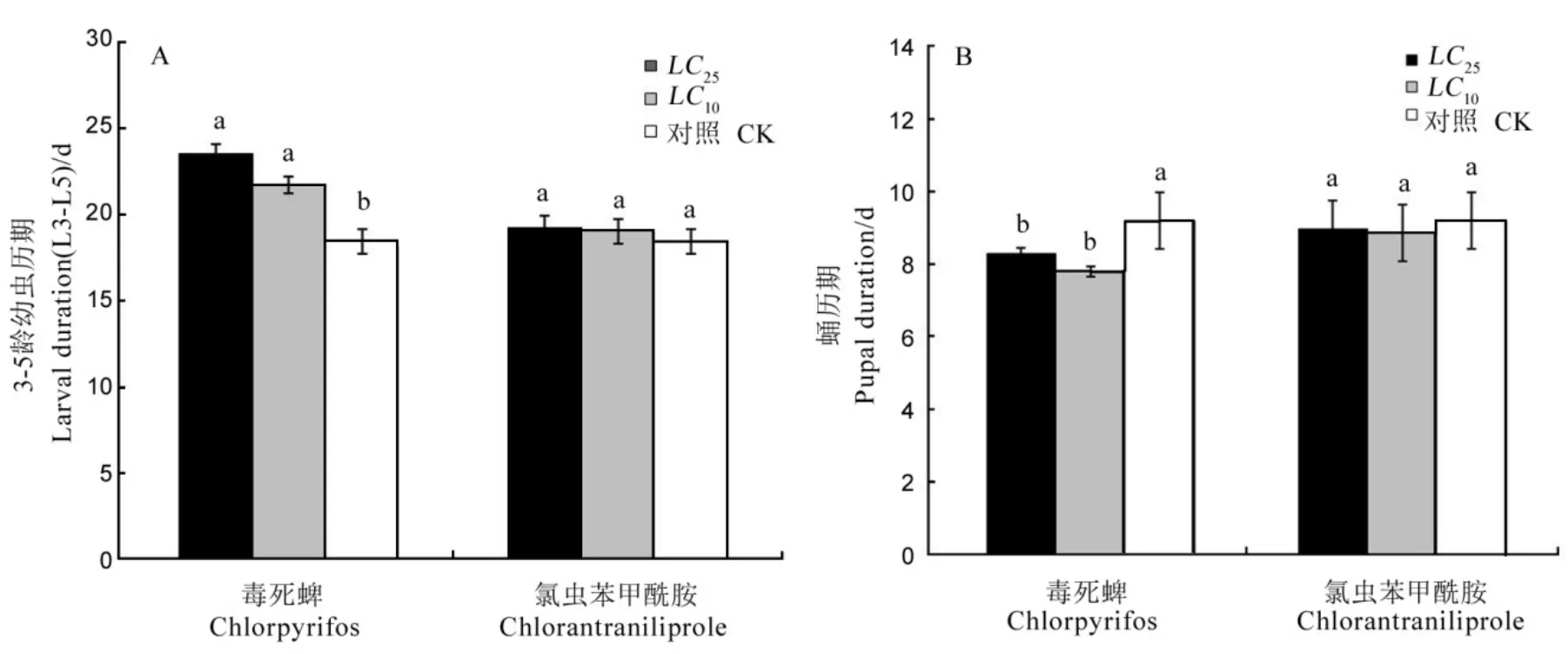
图1 两种农药亚致死剂量对稻纵卷叶螟幼虫生长历期(A)和蛹历期(B)的影响(平均数±标准误)Fig.1.Sublethal effect of two insecticides on larval duration(A)and pupal duration(B)of Cnaphalocrocis medinalis(Mean±SE).
2.3 亚致死剂量农药处理对稻纵卷叶螟成虫寿命的影响
毒死蜱LC10和LC25处理稻纵卷叶螟2龄幼虫72 h后,稻纵卷叶螟雌雄成虫寿命均与对照组没有显著差异。氯虫苯甲酰胺LC10和LC25处理对雄成虫寿命无明显影响,LC10处理后雌成虫的寿命显著低于LC25处理和对照组,但LC25处理和对照组无差异(图 2)。
2.4 亚致死剂量农药处理对稻纵卷叶螟体内3种解毒酶活性的影响
亚致死剂量药剂处理稻纵卷叶螟2龄初期幼虫72 h后,用正常水稻叶片饲养至5龄,其体内3种重要的解毒酶发生很大的变化。毒死蜱LC10和LC25处理幼虫后,其体内的酯酶活性显著高于对照组;LC10和LC25处理后谷胱甘肽转移酶活性也明显高于对照组;毒死蜱2个剂量处理对稻纵卷叶螟幼虫体内多功能氧化酶没有明显影响(图3)。幼虫经氯虫苯甲酰胺LC10和LC25处理后其体内的酯酶活性显著增加;2个低剂量处理组稻纵卷叶螟体内谷胱甘肽转移酶的活性之间无差异,但氯虫苯甲酰胺LC25处理组的谷胱甘肽转移酶活性显著高于对照组;氯虫苯甲酰胺亚致死剂量处理后多功能氧化酶的活性与对照组之间无差异(图4)。
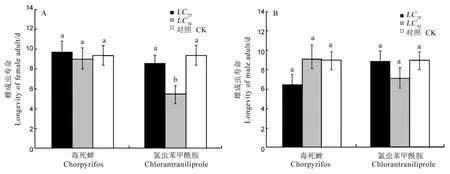
图2两种农药亚致死剂量对稻纵卷叶螟雌雄成虫寿命的影响(平均数±标准误)Fig.2.Sublethal effect of two insecticides on the longevity of Cnaphalocrocis medinalis female and male adults(Mean±SE).
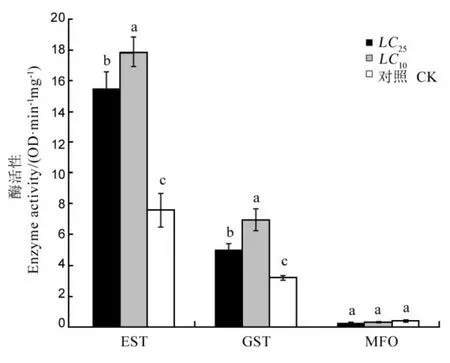
图3毒死蜱亚致死剂量对稻纵卷叶螟解毒酶活性影响(平均数±标准误)Fig.3.Sublethal effect of chlorpyrifos on detoxified enzyme activityofCnaphalocrocismedinalis(Mean±SE).
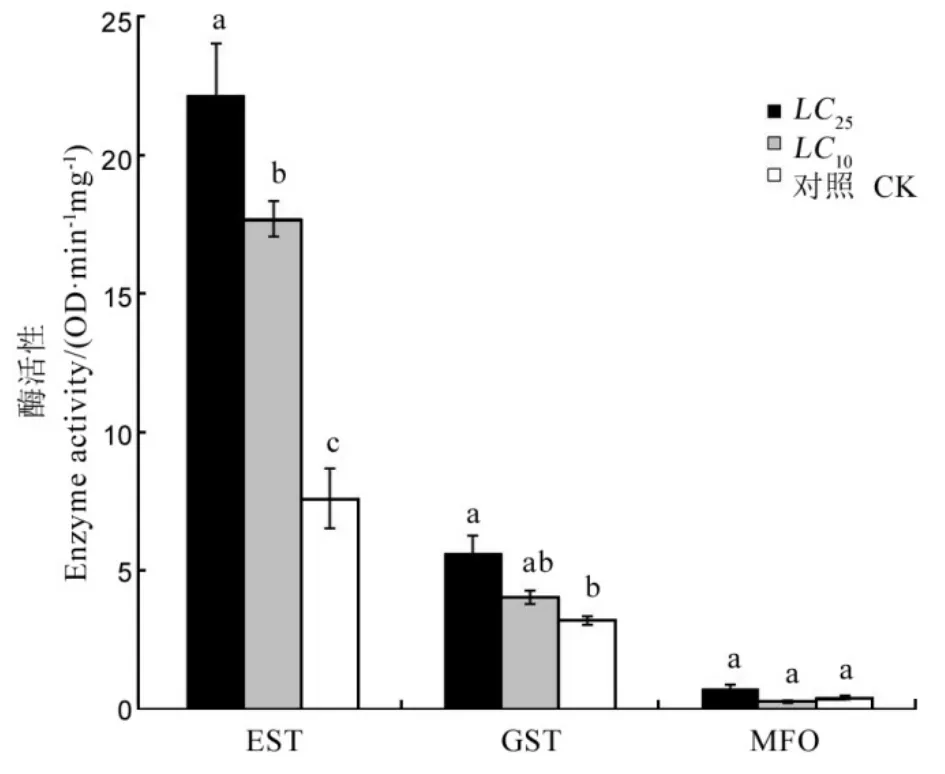
图4氯虫苯甲酰胺亚致死剂量稻纵卷叶螟解毒酶活性影响(平均数±标准误)Fig.4.Sublethal effect of chlorantraniliprole on detoxified enzymeactivityofCnaphalocrocismedinalis(Mean±SE).
3 讨论
杀虫剂通常由于其对害虫的致死作用强而广泛被关注,然而在实际使用过程中,由于一些生物或非生物因素害虫常接触到亚致死剂量的杀虫剂[18]。亚致死剂量的杀虫剂可对昆虫个体的生长发育、生态学行为和生殖等产生影响,从而引起昆虫种群动态的变化[19]。本研究发现,毒死蜱LC10和LC25处理后,稻纵卷叶螟幼虫发育历期比对照组长,但蛹历期较对照缩短,雌雄成虫寿命与未处理组无显著差异。这表明毒死蜱亚致死浓度对稻纵卷叶螟幼虫的生长发育具有一定的抑制作用。毒死蜱亚致死剂量处理1龄和3龄大螟(Sesamia inferens)幼虫后,幼虫的发育历期与对照相比显著延长[20]。亚致死浓度的毒死蜱处理禾谷缢管蚜(Rhopalosiphum padi)后,其种群幼虫发育速率放缓,成蚜寿命缩短[21]。然而,不同害虫对毒死蜱的反应也有差异,毒死蜱亚致死剂量处理会对灰飞虱(Laodelphax striatellus)蜜露分泌量、虫体增重和单雌产卵量均表现不同程度的促进作用,进而可能会导致灰飞虱致害性加剧[22]。不同害虫对药剂亚致死浓度的反应与应对策略可能具有差异。氯虫苯甲酰胺LC10处理后稻纵卷叶螟雌成虫寿命较对照组缩短;氯虫苯甲酰胺LC10和LC25处理后,稻纵卷叶螟幼虫历期、蛹历期和雄成虫寿命均无显著差异。梁立成[23]也得到相似的结果。氯虫苯甲酰胺LC10和LC25处理棉铃虫(Helicoverpa armigera)幼虫,能延长幼虫历期,缩短成虫寿命[24]。亚致死浓度氯虫苯甲酰胺对甜菜夜蛾(Spodoptera exigua)生长发育与种群增长有一定的抑制作用[25]。
解毒酶系是昆虫体内防御外源物质和体内代谢的重要酶系[26]。低剂量药剂不仅对害虫的生长发育和繁殖等产生影响,还能诱导害虫体内的解毒酶的改变,为害虫抗药性提供长期选择压力,就有利于抗药性能力的积累和发展[18]。甘蓝薄翅螟(Crocidolomia pavonana)体内的羧酸酯酶(CarbE)、谷胱苷肽转移酶(GSTs)和多功能氧化酶(MFO)的活力增强有利于其对毒死蜱抗药性的形成和发展[27]。我们研究发现,毒死蜱低浓度(LC10和LC25)处理稻纵卷叶螟幼虫后,体内酯酶和谷胱甘肽转移酶活性均较对照有所增强,且LC10处理组高于LC25处理组,这表明稻纵卷叶螟通过提高体内主要代谢酶来应对低剂量药剂的伤害。然而,酯酶和谷胱甘肽转移酶活性增加后对稻纵卷叶螟抗药性发展的影响仍需进一步深入研究。邢静等[28]认为亚致死浓度氯虫苯甲酰胺处理的小菜蛾(Plutella xylostella)体内的羧酸酯酶活性增加可能与其对氯虫苯甲酰胺的敏感度下降有关。欧善生等[24]发现氯虫苯甲酰胺亚致死浓度处理棉铃虫后其体内羧酸酯酶活性增强。本研究表明,低浓度氯虫苯甲酰胺处理稻纵卷叶螟幼虫后能诱导体内酯酶和谷胱甘肽转移酶的活性增强。季正文[29]用半致死剂量氯虫苯甲酰胺处理稻纵卷叶螟后发现谷胱甘肽转移酶的活性上升。但也有害虫经低剂量农药处理后体内解毒酶活性受到抑制的例子,如低剂量的毒死蜱处理的舞毒蛾3龄幼虫体内羧酸酯酶、谷胱甘肽S-转移酶和乙酰胆碱酯酶(AChE)活性都受到一定程度的抑制[30];尹飞等[31]用亚致死浓度的氯虫苯甲酰胺处理小菜蛾能抑制其幼虫体内的多功能氧化酶、谷胱甘肽转移酶和乙酰胆碱酯酶活性。不同昆虫或种群对农药的应对策略不同可能导致生理反应的差异。另外,对于不同昆虫或种群来说亚致死浓度值是有差别的,昆虫或种群接触农药的实际剂量的差异以及药剂处理代数也可能影响昆虫种群对农药的反应策略。亚致死浓度氯虫苯甲酰胺处理小菜蛾第1代,其羧酸酯酶比活力上升,但细胞色素P450 O-脱乙基酶(ECOD)、谷胱甘肽S-转移酶明显下降,而连续处理5代后,小菜蛾羧酸酯酶和ECOD的比活力显著提高,但GSTs的比活力则仍然下降[27]。
毒死蜱在水稻上可以兼治稻飞虱和稻纵卷叶螟,氯虫苯甲酰胺是目前防治稻纵卷叶螟的主要药剂之一。自2016年12月31日起,毒死蜱完全禁止在蔬菜上使用。随着对农产品质量安全和环境安全的重视,农业部实施了农药减量使用政策。研究农药亚致死浓度对害虫的影响对于合理使用农药、减量使用农药具有重要作用。本研究表明,亚致死浓度处理稻纵卷叶螟,其部分生长期发育放缓,但刺激体内解毒酶的活性增强,用以抵御农药的伤害。害虫处于杀虫剂低浓度(剂量)的选择压力下,有利于抗药性的积累与发展。在实际生产中,应注意亚致死浓度的杀虫剂可能带来的害虫抗药性增强的风险。在稻纵卷叶螟的防治中,应综合种群数量、种群密度、抗药性水平、农药亚致死效应等多种因素,合理选择农药种类和剂量。本研究仅对这两种药剂亚致死剂量对单代稻纵卷叶螟的影响进行了分析,今后还应进一步研究药剂亚致死浓度对稻纵卷叶螟的连续影响,以全面阐明其亚致死效应。
[1]BarrionAT, Litsinger JA,Medina E B,Aguda RM,Bandong J P,Pantua PC Jr.,ViajanteVD, delaCruzCG,VegaC R, Soriano J S Jr.,Camanag E E, SaxenaRC,Tryon E H, Shepard B M. The rice Cnaphalocrocis and Marasmia (lepidoptera: Pyralidae)leaffolder complex in the Philippines: Taxonomy, bionomics,and control. Phil Entomol, 1991, 8(4): 987-1074.
[2]程家安.水稻害虫.北京:中国农业出版社,1996.Chen J A.Rice Pests.Beijing:China Agricultural Press,1996.(in Chinese)
[3]杨亚军,徐红星,郑许松,田俊策,鲁艳辉,吕仲贤.中国水稻纵卷叶螟防控技术进展.植物保护学报,2015,42(5):691-701.Yang Y J,Xu H X,Zheng X S,Tian J C,Lu Y H,Lu Z X.Progresses in management technology of rice leaffolders in China.J Plant Prot,2015,42(5):691-701.(in Chinese with English abstract)
[4]吕仲贤.稻纵卷叶螟绿色防控彩色图谱.北京:中国农业出版社,2017.Lu Z X.Pictorial Handbook on Sustainable Management of Rice Leaffolder. Beijing: China Agricultural Press,2017.(in Chinese)
[5]Heckel D V.Insecticide resistance after Silent Spring.Science,2012,337(6102):1612-1614.
[6]Xu H X,Yang Y J,Lu Y H,Zheng X S,Tian J C,Lai F X,Fu Q,Lu Z X.Sustainable management of rice Insect pests by non-chemical-insecticide technologies in China.Rice Sci,2017,24(2):61-72.
[7]Desneux N,Fauvergue X,Dechaume-Moncharmont F X,Kerhoas L,Ballanger Y,Kaiser L.Diaeretiella rapaelimitsMyzus persicaepopulations after applications of deltamethrin in oilseed rape.J Econ Entomol,2005,98(1):9-17.
[8]Desneux N,Decourtye A,Delpuech J M.The sublethal effects of pesticides on beneficial arthropods.Annu Rev Entomol,2007,52(1):81-106.
[9]Guedes R N,Cutler G C.Insecticide-induced hormesis and arthropod pest management.Pest Manag Sci,2014,70(5):690-697.
[10]Huang L,Lu M,Han G,Du Y,Wang J.Sublethal effects of chlorantraniliprole on development,reproduction and vitellogenin gene(CsVg)expression in the rice stem borer,Chilo suppressalis.Pest Manag Sci, 2016,72(12):2280-2286.
[11]Bao H,Liu S,Gu J,Wang X,Liang X,Liu Z.Sublethal effects of four insecticides on the reproduction and wing formation of brown planthopper,Nilaparvata lugens.Pest Manag Sci,2009,65(2):170-174.
[12]Zhang X,Xu Q,Lu W,Liu F.Sublethal effects of four synthetic insecticides on the generalist predatorCyrtorhinuslividipennis.JPestSci,2015,88(2):383-392.
[13]Gong Y,Xu B,Zhang Y,Gao X,Wu Q.Demonstration of an adaptive response to preconditioningFrankliniella occidentalis(Pergande)to sublethal doses of spinosad:A hormetic-dose response.Ecotoxicol,2015,24(5):1141-1151.
[14]Guedes N M P,Tolledo J,Corrêa A S,Guedes R N C.Insecticide-induced hormesis in an insecticide resistant strain of the maize weevil,Sitophilus zeamais.J Appl Entomol,2010,134(2):142-148.
[15]Bradford,M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of dye-protein binding.Anal Biochem,1976(72):248-254.
[16]杨亦桦.棉铃虫对拟除虫菊酯氧化代谢抗性的生化与分子机理.南京:南京农业大学.2005.Yang Y H.Biochemical and molecular mechanism of oxidative metabolism for pyrethroid resistance inHelicoverpa armigeraH.Nanjing:Nanjing Agricultural University.2005.(in Chinese with English abstract)
[17]LeOra.Polo Plus:A User's Guide to Probit or Logit Analysis.LeOra Software,Berkeley,CA,2002.
[18]Guedes R N C,Smagghe G,Stark J D,Desneux N.Pesticide-induced stress in arthropod pests for optimized integrated pest management programs.Annu Rev Entomol,2016,61(1):43-62.
[19]李正辉,杜海涛,丁旭,周耀东,吴进才,刘井兰.杀虫剂对昆虫生殖行为亚致死效应的研究进展.农药,2017(1):1-5,13.Li Z H,Du H T,Ding X,Wu J C,Liu J L.Research progress of the sublethal effects of insecticides on the reproductive behaviors of insects.Pesticide,2017(1):1-5,13.(in Chinese with English abstract)
[20]杨国庆,李丽,戈林泉,吴进才.三唑磷和毒死蜱亚致死剂量对大螟种群增长和卵黄蛋白含量的影响.应用昆虫学报,2014,51(6):1582-1588.Yang G Q,Li L,Ge L Q,Wu J C.Effects of sublethal doses of triazophos and chlorpyrifos on the population growth and yolk protein content ofSesamia inferens(Walker).Chin J Appl Entomol,2014,51(6):1582-1588.(in Chinese with English abstract)
[21]段辛乐,乔宪凤,陈茂华.亚致死浓度毒死蜱和异丙威对禾谷缢管蚜试验种群的影响.中国生态农业学报,2015,23(3):329-336.Duan X L,Qiao X F,Chen M H.Effects of sub-lethal concentrations of chlorpyrifos and isoprocarb on experimental population ofRhopalosiphum padi.Chin J Eco-Agrc,2015,23(3):329-336.(in Chinese with English abstract)
[22]徐广春,顾中言,徐德进,许小龙.毒死蜱亚致死剂量对灰飞虱致害性和繁殖力的影响.昆虫学报,2011,54(6):680-686.Xu G C,Gu Z Y,Xu D J,Xu X L.Effects of sublethal dose of chlorpyrifos on the virulence and productivity of the small brown planthopper,Laodelphax striatellus(Fallén)(Homoptera:Delphacidae).Acta Entomol Sin,2011,54(6):680-686.(in Chinese with English abstract)
[23]梁立成.氯虫苯甲酰胺和阿维菌素亚致死剂量处理对稻纵卷叶螟生长发育和繁殖的影响.南宁:广西大学,2014.Liang LC.Sublethal effects of chlorantraniliprole and avermectin in growth development and fecundity ofCnaphalocrocis medinalisGuenee.Nanning:Guangxi University,2014.(in Chinese with English abstract)
[24]欧善生,梁沛,宋敦伦,史雪岩,高希武.氯虫苯甲酰胺亚致死剂量对棉铃虫生长发育和解毒酶活性的影响.植物保护,2012,38(4):1-8.Ou S S,Liang P,Song D L,Shi X Y,Gao X W.Effects of sublethal dosage of chlorantraniliprole on development and detoxifying enzymes activity ofHelicoverpa armigera.Plant Prot,2012,38(4):1-8.(in Chinese with English abstract)
[25]陈琼,黄水金,秦文婧.氯虫苯甲酰胺对甜菜夜蛾的亚致死效应研究.江西农业大学学报,2011,33(4):690-695,706.Chen Q,Huang S J,Qin W J.Sublethal effect of chlorantraniliprole onSpodoptera exigua.Acta Agric Univ Jiangxi,2011,33(4):690-695,706.(in Chinese with English abstract)
[26]张红英,赤国彤,张金林.昆虫解毒酶系与抗药性研究进展.河北农业大学学报,2002,25(S1):193-195.Zhang H Y,Chi G T,Zhang J L.The progress of insect detoxification enzyme system and resistance of insecticide.J Agric Univ Hebei,2002,25(S1):193-195.(in Chinese with English abstract)
[27]曾东强,高华,李晶晶,徐汉虹.甘蓝薄翅螟对毒死蜱的抗性风险评估及解毒酶活性研究.华南农业大学学报,2008,29(4):38-41.Zeng D Q,Gao H,Li J J,Xu H H.Resistance risk assessment and activities of detoxification enzymes to chlorpyrifos inCrocidolomia pavonana.J South China Agric Univ,2008,29(4):38-41.(in Chinese with English abstract)
[28]邢静,梁沛,高希武.亚致死浓度氯虫苯甲酰胺对小菜蛾药剂敏感度和解毒酶活性的影响.农药学学报,2011,13(5):464-470.Xing J,Liang P,Gao XW.Effectsofsublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity inPlutellaxylostella.Chin J Pestic Sci,2011,13(5):464-470.(in Chinese with English abstract)
[29]季正文.氯虫苯甲酰胺对稻纵卷叶螟防效评价及其对水稻生长发育的影响.扬州:扬州大学.2010.Ji Z W. Evaluation of control effect of chlorantraniliproleon Cnaphalocrocis medinalis (Guenée) and its influence on the rice growth. Yangzhou: Yangzhou University, 2010.(in Chinese with English abstract)
[30]李慧,严善春,王志英,葛士林,曹传旺.毒死蜱对舞毒蛾食物利用和解毒酶及AChE活性的影响.林业科学研究,2011,24(3):345-349.Li H,Yan S C,Wang Z Y,Ge S L,Cao C W.Effects of chlorpyrifos on food utilization and detoxifying enzymes and acetylcholinesterase ofLymantria dispar.Forest Res,2011,24(3):345-349.(in Chinese with English abstract)
[31]尹飞,冯夏,李振宇,林庆胜,胡珍娣,张德雍,陈焕瑜.亚致死剂量氯虫苯甲酰胺对小菜蛾体内活性酶的影响.植物保护,2014,40(2):66-69.Yin F, Feng X, Li Z Y, Lin Q S, Hu D Z, Zhang D Y,Chen H Y. Effects of sublethal concentrations of chlorantraniliprole on detoxifying enzyme activity in Plutella xylostella. Plant Prot, 2014, 40(2): 66-69. (in Chinese with English abstract)
