利用体外法研究不同水平黄曲霉毒素B1对蜀宣花牛瘤胃内环境的影响
2018-05-25方东辉付茂忠
方东辉,付茂忠,唐 慧,甘 佳,王 淮,易 军,王 巍
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,成都 610066)
黄曲霉毒素(Aflatoxin,AF)被世界卫生组织癌症机构认定为Ⅰ类致癌物(WHO,1993)[1]。在所有黄曲霉毒素中,B1的毒性最强,黄曲霉毒素B1(AFB1)的毒性约为氰化钾的10倍,三氧化二砷的68倍,致癌性为二甲基亚硝胺的75倍,奶油黄的900倍[2]。常见的几种AF的毒性按大小顺序排列依次为 B1>M1>G1>B2>G2。黄曲霉广泛存在于自然界,潮湿易发霉的植物和食品中易滋生。饲料中污染的黄曲霉毒素以B1最多见,毒性和致癌性最强。各种畜禽对它的敏感性不一样,其顺序大致为仔猪>犊牛>肥育猪>成年牛>绵羊。但奶牛采食的饲料原料种类繁多,而且采食总量也较其他动物更多,因而奶牛接触霉菌毒素的种类及概率高于其他动物[3-4]。奶牛采食AFB1污染的饲料后,很少一部分会在瘤胃中被降解,剩下的大部分AFB1在消化道被吸收,但吸收率相对较低[4]。进入动物机体的AFB1在肝脏内被羟基化成黄曲霉毒素 M1(AFM1)[5-6]。有试验证明,日粮中AFB1转化为乳中AFM1的效率与精料水平关联密切。高产母牛由于饲料采食量大,食入的AFB1多,转化效率可高达6%[7]。四川省地处亚热带季风气候,夏季高温高湿、冬季低温高湿,更容易导致饲料霉变滋生黄曲霉,从而影响奶牛生产。因此,本试验以湿热环境下蜀宣花牛产奶母牛为试验对象,通过体外培养法研究不同水平的黄曲霉毒素B1对瘤胃微生物代谢的影响,旨在探究奶牛瘤胃中黄曲霉毒素B1的最大耐受浓度。
1 材料与方法
1.1 试验动物
选择安装永久性瘤胃瘘管的3头蜀宣花牛产奶母牛(540 kg±28 kg)作为供体牛开展试验,饲喂 TMR,自由饮水,日粮情况见表1。
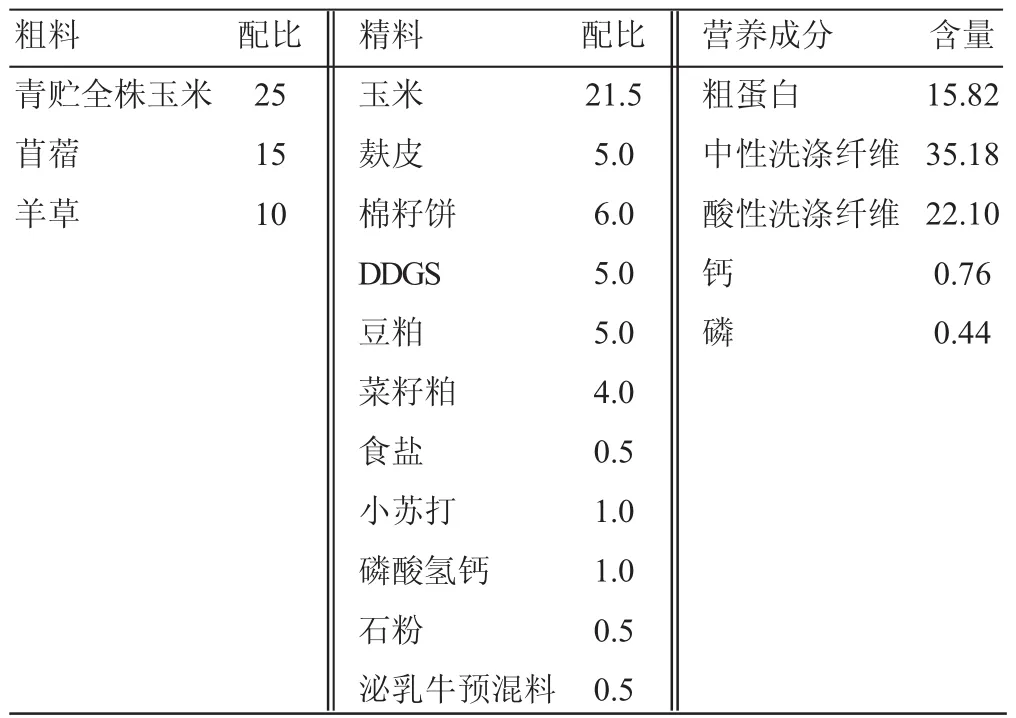
表1 TMR日粮组成及营养成分含量%
1.2 试验设计
将TMR饲料烘干粉碎,经60目筛制后作为底物,采集供体牛的瘤胃液进行体外培养。本研究设置4个试验组和1个对照组,每种处理均设3个重复,分别为A组(瘤胃液中添加0.1μg/mLB1)、B组(添加1μg/mL B1)、C 组(添加 5μg/mL B1)、D 组(添加 10 μg/mL B1)和cg组(对照组,不添加),B1由FERMENTEK公司生产。各试验组在体外发酵装置中(自研)培养0,2,4,8,12和24 h后取样,测定培养液的pH值、氨态氮和VFA。
1.3 方法
1.3.1 瘤胃液的采集 晨饲后2 h采集供体奶牛瘤胃液各300mL,置于饱和CO2保温瓶中迅速带回实验室后用4层纱布过滤,39℃水浴保温并持续通入CO2直至分装使用。
1.3.2 体外培养 分别精确称取2.00 g TMR饲料底物于不同组号的锥形瓶中。用蒸馏水将AFB1溶液稀释成0.01,0.1,0.5,1.0mg/mL 的溶液,各取 1mL AFB1 稀释溶液于对应锥形瓶中,对照组加入1mL蒸馏水。取人工唾液与瘤胃液混合液(人工唾液与瘤胃液比例为2∶1)99mL于各个锥形瓶中混合均匀,置于39℃的恒温水浴摇床上培养0,2,4,8,12和24 h,取培养液经离心处理后待分析。人工唾液配置参照Menke等[8]方法。
1.3.3 pH值测定 发酵结束采完气体样后用pH计测定发酵液的pH值。
1.3.4 氨态氮和VFA的测定 取1.0 mL的发酵液在4℃下10 000×g离心10min,取上清液加0.3mL的25%(w/v)偏磷酸混匀,4℃静置 30min,然后 10 000×g离心10min,取上清液待分析。发酵液中氨态氮浓度采用靛酚比色法测定[9]。挥发性脂肪酸浓度测定采用气相色谱法外标法进行测定[10]。
1.4 数据处理与分析
采用SPSS 17.0统计软件中的单因素ANOVA进行方差分析,差异显著时采用Duncan氏法进行多重比较,结果以平均数±标准差表示。
2 结果与讨论
2.1 不同添加量AFB1对底物pH值变化的影响
由表2可见,发酵2 h之前所有试验组pH值均小幅升高,2 h后显著下降,其中2~4 h的下降速率最大。4 h时D组pH值极显著高于其他各组(P<0.01),8 h时D组pH值也极显著高于其他各组(P<0.01)。
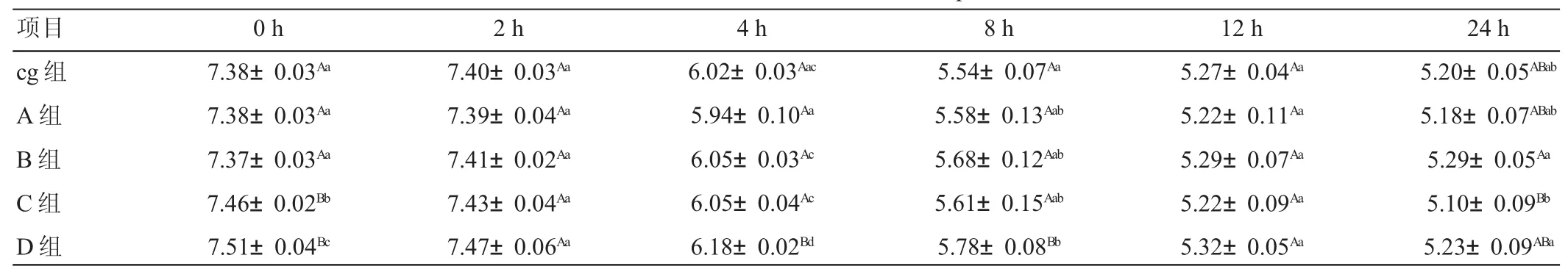
表2 不同添加水平AFB1对体外发酵瘤胃液pH值的影响
瘤胃液pH值的变化受日粮性质有机酸积聚和唾液分泌量的影响,其可反映瘤胃的综合发酵水平[11]。pH值随瘤胃微生物对发酵底物的分解产生NH3-N和挥发性脂肪酸等产物而发生变化,其正常变化范围是5.5~7.5,pH值过高或者过低对瘤胃微生物生长、繁殖及底物发酵均造成不利的影响。当pH值低于下限时,瘤胃内的微生物活力降低,数量减少或完全被酸性环境杀死。本试验发酵8 h内,pH值均在5.54~7.51之间,12 h后,各组pH值均处于下限水平。因此,体外发酵其他指标只利用12 h之内的数据进行分析。
2.2 不同添加量AFB1对底物氨氮浓度的影响
由表3可见,添加0.1μg/mL B1后,氨态氮浓度的变化模式与对照组基本一致,均为2 h内下降,2~8 h缓慢上升,12 h后迅速下降,且各时间节点两组间差异均不显著(P>0.05)。添加 1μg/mLB1时,8 h以内,氨氮浓度变化模式与对照组一致,且各时间节点两组间差异也不显著(P>0.05);8~12 h,氨氮浓度则出现下降且极限值均低于对照组(P<0.01)和 A 组(P<0.01);12~24 h,氨氮浓度无明显变化,24 h时氨氮浓度与对照组和A组间差异均不显著(P>0.05)。添加5μg/mLB1时,2 h以内,氨氮浓度变化模式与对照组一致,且两组间差异均不显著(P>0.05);2~4 h,氨氮浓度上升且显著高于对照组(P<0.05)和 A 组(P<0.05);4~12 h,氨氮浓度下降,12 h的氨氮浓度极显著低于对照组(P<0.01)和A组(P<0.01),显著低于B 组(P<0.05);12~24 h,氨氮浓度上升,24 h氨氮浓度与对照组、A组和B组间差异均不显著(P>0.05)。添加10μg/mL B1时,2 h以内,氨氮浓度变化模式与对照组一致,且两组间差异均不显著(P>0.05);2~4 h,氨氮浓度缓慢上升,且极显著低于B组、C组和对照组(P<0.01);4~12 h,氨氮浓度下降,且极显著低于其它各组(P<0.01);12~24 h,氨氮浓度上升,24 h氨氮浓度也极显著低于其他各组(P<0.01)。
氨氮是瘤胃内饲料蛋白质肽氨基酸氨化物尿素和其他非蛋白氮化合物分解的终产物,同时又是微生物合成菌体蛋白的主要原料[12]。适宜的NH3-N浓度是瘤胃氮代谢重要的中间环节。本试验氨氮浓度的变化符合瘤胃微生物最佳生长所需浓度(5~28mg/100mL)的要求[13]。本试验发现,添加 1 μg/mLB1 和 5 μg/mLB1时,氨氮浓度在8 h后均极显著下降;添加10μg/mLB1时,氨氮在2 h后极显著下降。说明添加黄曲霉毒素B1会降低微生物降解蛋白质的活性,且随着B1浓度的升高,微生物降解能力下降的起始时间节点逐步提前。
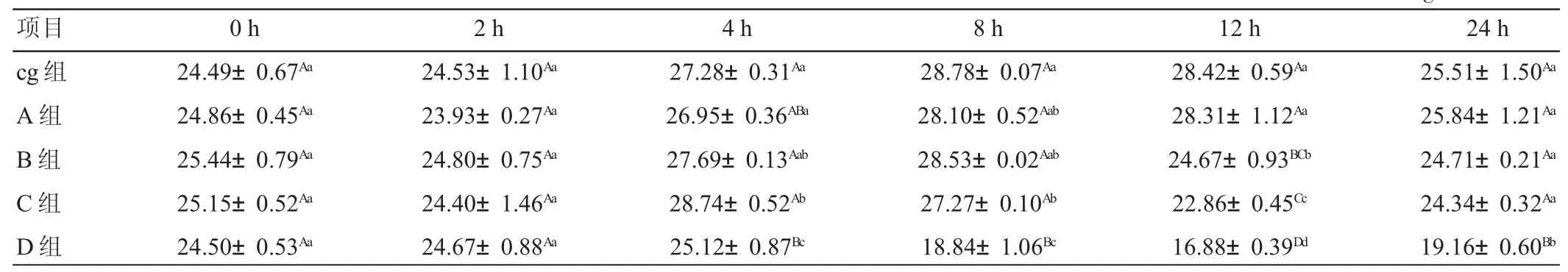
表3 不同添加水平AFB1对体外发酵瘤胃液氨氮浓度的影响mg/100mL
2.3 不同添加量AFB1对挥发性脂肪酸产量的影响
如表4所示,在体外发酵装置中培养12 h时,添加10μg/mLB1组的乙酸浓度显著低于对照组(P<0.05),与其余各试验组间均差异不显著(P>0.05);各组间丙酸浓度均差异不显著(P>0.05);添加10μg/mL组总挥发性脂肪酸浓度显著低于对照组(P<0.05),与其余各组间均差异不显著(P>0.05)。
有研究发现,在瘤胃微生物体外静态培养中添加不同浓度的AFB1,可减少总挥发性脂肪酸的产量,乙酸、丙酸、丁酸和戊酸产量也逐渐下降(P<0.05)[14]。本研究结果表明,10μg/mLB1组的VFA浓度较低,说明该水平下微生物活性较弱,不利于瘤胃发酵。Mertens等[15]研究发现,瘤胃微生物对AFB1很敏感,添加AFB1会扰乱瘤胃微生物的生长和功能,进而会改变VFA的组成比例。乙酸是由微生物慢速发酵饲料中纤维物质生成的,乙酸含量的高低可反映微生物降解纤维的活性。本研究结果表明,添加10μg/mL组的乙酸比例较低,因此推测,10μg/mL水平下纤维分解菌的活性相对受到抑制。

表4 不同黄曲霉毒素B1添加水平对体外发酵12 h混合物VFA浓度的影响mmol/L
3 小结
(1)本试验结果表明,4 h和8 h时添加10μg/mL B1组的pH值均极显著高于其他各组(P<0.01)。
(2)添加1μg/mLB1和5μg/mLB1时,氨氮浓度在8 h后极显著下降,添加10μg/mLB1时,氨氮在2 h后极显著下降。说明添加黄曲霉毒素B1能够降低微生物降解蛋白质的活性,随着B1浓度的升高,微生物降解能力下降的起始时间节点逐步提前。
(3)添加10μg/mLB1组的VFA浓度较低,说明该水平下微生物活性较弱,不利于瘤胃发酵,且添加10μg/mL B1组的乙酸比例较低,因此推测,10μg/mLB1水平下纤维分解菌的活性相对受到抑制。
[1] Elisabete Y S,Mario A O,Fabia Y F.et al.Evaluation of fumonisin-aflatoxin co-occurrence in Brazilian corn hybrids by ELISA[J].Food Addit Contam,2001,18(8):719-729.
[2] 张文玲,袁涛,李书国.近10年粮油食品中黄曲霉毒素检测技术的研究进展[J].粮食加工,2012,37(1):77-81.
[3] 孙安权.霉菌毒素对奶牛生产的危害及控制方案[C]//中国牛业健康发展与科技创新——中国畜牧兽医学会第七届养牛学分会2009年学术研讨会论文集.2009.
[4] Kuilman M E,Maas R F,Fink G J.Cytochrome P450-mediated metabolism and cytotoxicity of AFB1 in bovine hepatocytes[J].Toxicology In vitro,2000,14:321-327.
[5] Pong R S,Wogan G N.Toxicity and biochemical and fine structural effects of synthetic aflatoxins M1 and B1 in rat’s liver[J].J Natl Cancer Inst,1971,47(3):585-592.
[6] Purchase.Acute toxicity of aflatoxins M1 and M2 in one-day-old ducklings[J].Food Cosmet Toxicol,1967,5(3):339-342.
[7] Veldman A,Meijst J,Borggreve G,et al.Carry-over of aflatoxin from cow’s food tomilk[J].Animal Production,1992,55:163-168.
[8] Menke K H,Steingass H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fliud[J].Animal Reserch and Develop,1988,28:7-55.
[9] Verdouw H,Van Echteld C JA,Dekkers EM J.Ammonia determination based on indophenol formation with sodium salicylate[J].Water Research,1978,12(6):399-402.
[10]杨红建,黎大洪,谢春元,等.阿魏酸酯酶处理对羊草、玉米秸、稻秸及麦秸瘤胃体外发酵特性的影响[J].动物营养学报,2009,21(6):207-211.
[11]魏晓玲.苜蓿总皂苷粗提物的提取工艺及其对绵羊瘤胃发酵功能的影响[D].呼和浩特:内蒙古农业大学,2007:39.
[12]沈美英.日粮内不同粗饲料品质对绵羊瘤胃发酵功能和微生物区系的影响[D].呼和浩特:内蒙古农业大学,2006:37.
[13] Wanaapat M,Pimpa O.Effect of ruminal NH3-N levels on ruminal fermentation,purine derivatives,digestibility and rice straw intake in Swamp Buffaloes[J].Asian Australian JAnim Sci,1999,12(6):904.
[14]姜雅慧,杨红建.不同剂量黄曲霉毒素B1对奶牛瘤胃混合微生物发酵的抑制作用[J].中国农学通报,2010,26(12):8-13.
[15]Mertens D R.Biological effects of mycotoxins upon rumen fermentation and lactating dairy cows[C]//interactions of mycotoxins in animal production symposium.Washington,D C:National Academy Press,1978:118-136.
