垂体腺瘤中Fascin Ki-67的表达与肿瘤侵袭性的相关研究
2018-05-25李洋王洋许健赵冬刘祺
李 洋 王 洋 许 健 赵 冬 刘 祺
石河子大学医学院第一附属医院,新疆 石河子 832000
垂体腺瘤是一种常见的神经内分泌肿瘤,占所有颅内肿瘤的10%~15%,多表现为良性,但仍有部分腺瘤呈侵袭性生长,表现为破坏鞍底骨质、侵犯海绵窦壁、包绕颈内动脉等,这类肿瘤被定义为侵袭性垂体腺瘤(invasive pituitary adenomas,IPA)[1]。目前,IPA手术全切困难,术后易复发,治愈率较低,多数表现为“恶性肿瘤”特征,尽管多学科协作团队模式(Multi-disciplinary Team,MDT)已被运用于IPA的诊治,但仍有部分患者在首次治疗后表现出生长速度过快、对常规治疗抵抗及频繁复发等征象[2-3]。近年来,预测垂体腺瘤侵袭性生物学标记物成为研究热点[4]。本研究检测Fascin、Ki-67的表达情况,并分析它们与Knosp分级的相关性,以期对侵袭性垂体瘤的诊断及治疗提供更多帮助。
1 对象和方法
1.1临床资料收集2013-06—2017-02石河子大学医学院第一附属医院神经外科诊治的垂体腺瘤患者资料共60例,收集一般资料(临床基本信息、术前、术后影像学检查、术后病理结果),其中侵袭性垂体腺瘤30例,非侵袭性垂体腺瘤30例,男33例,女27例,年龄29~82岁(平均48.9岁)。免疫组织化学确定激素类型为GH腺瘤7例,PRL腺瘤9例,ACTH腺瘤2例,TSH腺瘤1例,混合型腺瘤33例,无功能性腺瘤8例。
1.2 IPA的诊断标准Knosp[1]分级:0级:肿瘤未超过颈内动脉血管管径的内切连线,海绵窦未受累;Ⅰ级,肿瘤位于颈内动脉血管管径的中心连线内,海绵窦内侧部静脉丛消失;Ⅱ级:肿瘤位于颈内动脉血管管径的外切连线内,海绵窦上部和下部静脉丛消失;Ⅲ级:肿瘤超过颈内动脉血管管径的外切连线,突到海绵窦外;Ⅳ级:海绵窦内颈内动脉被肿瘤包裹,静脉丛消失,Ⅰ~Ⅱ级定义为NIPA,Ⅲ~Ⅳ级定义为IPA。
1.3免疫组化实验方法所有组织标本均以4%甲醛固定,石蜡包埋,4μm厚度连续切片,免疫组织化学染色采用Envision法:切片脱蜡,酒精水化,微波抗原修复及过氧化氢去除内源性过氧化物酶,PBS冲洗后,分别滴加一抗(兔单克隆抗体Fascin,1:200,Abcam;兔抗人增殖细胞抗原Ki-67,1:600,中杉金桥),4 ℃孵育过夜,37 ℃复温30 min后PBS冲洗,分别滴加二抗后孵育30 min,再次PBS冲洗后DAB显色,苏木紫复染,酸酒精酸化,返蓝,二甲苯透明,37 ℃烘干后中性树胶封片,显微镜下观察。
1.4结果判读免疫组化结果由2名有经验的病理科医师进行判定,于光学显微镜下,根据阳性细胞占视野中所有组织细胞中的比例及阳性细胞的染色强度来进行统计:(1)阳性细胞百分数评分:比例≤5%记为0分,比例在6%~25%范围内记为1分,比例在26%~50%范围内记为2分,在51%~75%范围内记为3分,>75%以上记为4分;(2)阳性反应强度评分:无染色为0分,轻度染色(淡黄色)为 1 分,中度染色(棕黄色) 为 2 分,重度染色(棕褐色)为 3 分。结果判定参照免疫反应积分 IRS 半定量法,如表 1 所示。将表中 A、B 项得分相乘,0 分为阴性 (-),1~2 分为弱阳性(+),3~6 分为中度阳性(++),超过 6 分为强阳性(+++)。

表1 IRS半定量法得分评估表
1.5统计学处理应用SPSS 18.0软件包进行统计学分析,Fascin 蛋 白免疫组织化学结果采用 Wilcoxon秩和检验,Ki-67蛋白免疫组织化学结果采用t检验,以P<0.05为差异具有统计学意义。χ2检验用于Fascin、Ki-67蛋白表达水平与临床病例特征关系的检验,相关性统计学分析采用Speaman法,以双侧P<0.05为差异具有统计学意义。
2 结果
2.1垂体腺瘤中Fascin、Ki-67蛋白的表达和患者临床特征的相关性60例垂体腺瘤患者中,36例患者年龄>50岁,24例患者年龄≤50岁;2组中男33例,女27例;影像学评判其肿瘤最大径>3 cm 20例,肿瘤最大径<3 cm 40例;激素分型单纯PRL、GH、TSH、ACTH型共19例,混合型共33例,无功能型共8例,Fascin、Ki-67蛋白的表达和患者性别、年龄、肿瘤大小、激素类型无明显相关性,差异无统计学意义(P>0.05)。见表2。
2.2免疫组织化学染色结果Fascin阳性染色主要定位于细胞质,呈棕黄色,以弥漫性存在为主,2组中Fascin蛋白的表达具有差异性(P<0.01)。Ki-67阳性染色主要定位于细胞核,呈棕褐色,侵袭性组中Ki-67的截断值为3.9±1.88,非侵袭组中Ki-67的截断值为1.6±0.73,2组中 Ki-67蛋白的表达具有差异性,且差异有统计学意义(见图1、2,表3、4)。

表2 60例垂体腺瘤标本中Fascin、Ki-67蛋白表达水平与临床资料的相关性
注:低表达为免疫组化半定量分值<3,高表达为免疫组化半定量分值≥3,Fascin、Ki-67表达和性别、年龄、肿瘤大小、激素分型无明显相关性,P>0.05

图1 Fascin蛋白的表达情况(200×),A为 NIPA,B为 IPA

表3 Fascin蛋白在垂体腺瘤中表达的统计学描述
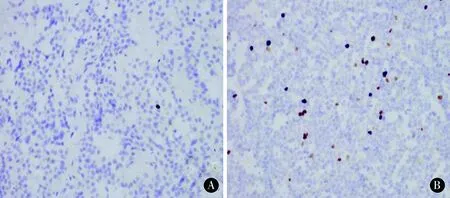
图2 Ki-67蛋白的表达情况(200×),A为 NIPA,B为IPA

表4 Ki-67蛋白在垂体腺瘤中表达的统计学描述
2.3 Spearman相关性分析法Fascin(r=0.366、P<0.01)、Ki-67(r=0.454、P<0.01)蛋白的表达与垂体腺瘤Konsp分级呈正相关(表5)。
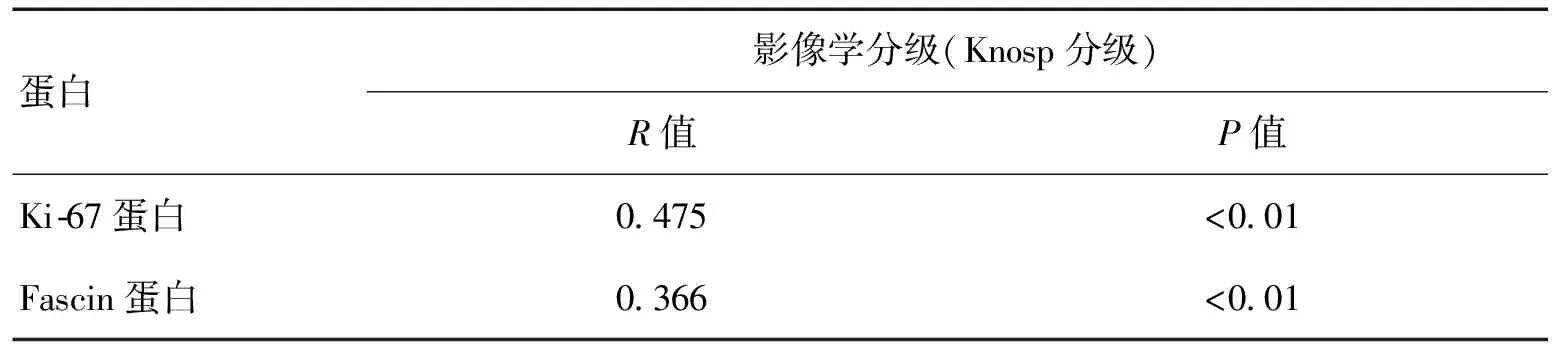
表5 垂体腺瘤侵袭性发生影响因素的Spearman相关性分析结果
3 讨论
2004年WHO[5]对于垂体腺瘤进行了新的分型,包括典型垂体腺瘤、非典型垂体腺瘤和垂体癌,IPA表现出的侵袭特征和恶性肿瘤仍有一定差别,只有垂体腺瘤出现脑、脊髓以及全身性的转移才被称之为垂体癌(pituitary carcinomas,PC),部分学者认为,侵袭性和非侵袭性垂体腺瘤之间并无严格的界限,其区别仅在于侵袭能力的大小有所不同。DAI等[6]人在2016年发表在Oncotarget杂志的文章中对“侵袭性垂体腺瘤”的概念做了进一步的完善和补充,称之为“难治性垂体腺瘤”,新的分类可以早期对患者进行个体化治疗,极大的改善患者的预后,延缓肿瘤的复发。既往总结垂体腺瘤侵袭性的机制有以下几点:解剖结构的异常导致肿瘤侵袭;肿瘤新生血管形成;肿瘤细胞粘附和迁移(细胞丝状伪足形成;细胞核的移动和变形);细胞外基质(Extracellular Matrixc,ECM)理化性质改变;肿瘤细胞的上皮间充质转化(Epithelial-Mesenchymal Transition,EMT)[7-10]。
肿瘤细胞转移的关键步骤之一是细胞迁移和入侵,这其中需要肌动蛋白细胞骨架重组,丝状伪足是细胞骨架突出的重要结构,可使肿瘤细胞突破细胞外基质和基底膜等天然结构性屏障,就像细胞感觉器官与细胞外微环境进行沟通,并参与细胞的基本功能,如细胞黏附、扩散和迁移[9,11]。Fascin蛋白是肌动蛋白结合蛋白家族中的一员,由Bryan于20世纪70年代从海胆卵母细胞胞质中发现,由Fascin基因编码[12]。主要集中于微丝、丝状伪足等离子膜下方的肌动蛋白骨架突起,其功能是在细胞突起中形成和稳定平行肌动蛋白束,诱导肿瘤细胞的侵袭和转移[9,13],在大多数正常上皮组织中检测到Fascin蛋白表达极少,但是在许多上皮组织来源的肿瘤组织中却出现高表达现象[14],最近的一篇综述表明[10],在乳腺、结肠直肠癌和食管癌中,Fascin的高表达与增加患者病死率风险以及肿瘤的发生发展密切相关,可能提供了一个新的生物学标记物对于早期诊断侵袭性和转移性肿瘤。HUANG等[11]的研究已证实癌细胞可利用丝状伪足向器官表面黏附和侵袭,而Fascin的一种小分子抑制剂G2可以有效地抑制乳腺癌细胞的侵袭和迁移,JAYO发表在Development Cell的文章中[15]描述细胞核膜蛋白nesprin-2可以联合Fascin蛋白调节细胞核的运动和变形,从而促进肿瘤细胞的侵袭和转移。MAO等[16]在研究胆管癌时发现,Fascin通过调控Wnt/β-Catenin信号通路可诱导胆管癌细胞EMT的转化。本组研究表明,侵袭性垂体腺瘤组中Fascin蛋白的表达水平高于非侵袭组,差异具有统计学意义,并且蛋白的表达水平和Knosp分级呈正相关,结合实验数据和相关文献,作者认为IPA中Fascin蛋白高表达,原因可能为侵袭性垂体腺瘤细胞中相关机制发挥作用,总结有以下几点:(1)垂体腺瘤细胞侵袭周围组织需要细胞膜上产生密集的侵袭性丝状伪足以及其细胞骨架的重组,Fascin蛋白是丝状伪足中主要的肌动蛋白交联体,Fascin蛋白聚集在细胞膜表面形成平行的肌动蛋白束,组成和稳定细胞骨架[17-18]。(2)最新研究发现[19-20]Stat3/ NF-kB介导的信号通路可以调节Fascin的表达在乳腺癌中,并促进肿瘤的侵袭和转移。研究证实 IL-6 是激活 Jak/Stat3信号通路的主要因子,可以使 Fascin 蛋白的表达水平增高,促进乳腺癌细胞的迁移。Fascin 蛋白又能进一步诱导EMT 的发生,而且作者发现IL-6R/Stat3 信号通路与垂体裸细胞瘤侵袭性相关[21],所以我们推测Fascin蛋白是通过诱导EMT来促进肿瘤的侵袭。同时在实验中,我们发现,在垂体肿瘤组织切片的血管壁上,均可见Fascin蛋白的高表达,查阅相关文献,孔霞等[22]在研究鼻咽癌时发现Fascin-1蛋白表达的趋势分别与Rg3对血管生成拟态和迁移能力的变化趋势呈正相关,考虑Fascin蛋白可能在肿瘤组织和血管拟态生成方面存在一定的相关性。综上所述,Fascin蛋白可能是预测垂体腺瘤侵袭性的潜在生物学标记物及治疗靶点。
肿瘤细胞的高增殖特性是其侵袭的关键步骤之一,当其在一个封闭的微环境中生长时,最初可能是非侵袭性的,随着肿瘤细胞数目的不断增殖,并且处于一个高增殖水平状态,体积不断增大,压缩周围的细胞外基质,这使得肿瘤组织内空间越来越小,压力越来越来高,导致了肿瘤向周围组织侵袭性生长。研究表明[23]细胞数目的扩增和凋亡是其自身调控其细胞多少的一个重要平衡机制,当肿瘤细胞有较高的增殖活性时,就提示了处于增殖状态的细胞比例处于高水平状态,持续的增殖在临床上表现为腺瘤快速增长,以及术后残余肿瘤易迅速复发[24]。Ki-67是一种与DNA结合的核内蛋白,属于IgG1家族,是Scholzen等人于1983年研究淋巴瘤细胞系时发现的,定位于人类第10号染色体长臂上,位于细胞核仁区,开始表达于细胞周期的G1期,在S期和G2期表达水平上升,至M期到达高峰,在细胞有丝分裂终末期迅速降解[25-26]。它可以识别G1晚期、S期和G2/M期胞核中的抗原,因其半衰期较短,只在细胞增殖各期表达,处于增殖过程中的肿瘤胞核和染色体均可以被标记,不易受生长因子等其他因素影响,所以能够较好的判断肿瘤的生长增殖特性[27]。既往研究的证据充分表明较高的Ki-67标记指数和垂体腺瘤的侵袭性相关,ALIREZA等[28]研究11例侵袭性垂体腺瘤Ki-67的表达,其中10例患者的Ki-67 LI>3%,曹学霞等人[29]的研究表明Ki-67 LI对预测垂体腺瘤患者的预后有一定的指导意义,于泽奇等人[30]研究表明,Ki-67蛋白的表达和颅内胶质瘤的发生发展密切相关,且蛋白表达水平和肿瘤病理级别呈正相关。本研究中,Ki-67的表达在两组之间比较,差异具有统计学意义,并且蛋白的表达和Knosp分级呈正相关,因此,Ki-67蛋白可能是预测肿瘤侵袭性的指标之一。
研究结果证实,Fascin、Ki-67蛋白在垂体腺瘤中的表达水平和年龄、性别、肿瘤大小、激素类别无明显相关性(P>0.05),2组中Fascin、Ki-67蛋白的表达水平相比,差异具有统计学意义(P<0.01),且表达水平和影像学分级呈正相关性(P<0.01),王红云等[31]人既往研究212例垂体腺瘤(侵袭性97例,非侵袭性115例),结果表明Fascin蛋白的表达和垂体腺瘤是否侵袭呈密切相关,是预测垂体腺瘤复发的候选基因。本研究结果与其相符,提示Fascin、Ki-67可以作为判断垂体腺瘤有无侵袭性的潜在生物学指标,并可能为未来临床应用Fascin相关分子抑制剂治疗侵袭性垂体腺瘤提供研究方向。
[1] ALEXANDRAKI E,ANDROULAKIS K I,ANDROULAKIS Ⅱ,et al.Aggressive pituitary tumors[J].Neuroendocrinology,2015,101(2):87-104.
[2] 刘飞,王卫红,李志范,等.多学科协作团队模式在垂体腺瘤诊疗的价值与实施[J].中国微侵袭神经外科杂志,2016,21(5):236-238.
[3] ZHOU K,FAN Y D,WU P F,et al.MicroRNA-145 inhibits the activation of the mTOR signaling pathway to suppress the proliferation and invasion of invasive pituitary adenoma cells by targeting AKT3 in vivo and in vitro[J].Onco Targets Ther,2017,10:1 625-1 635.
[4] 何璐,郭亮,胡春洪,等.垂体腺瘤MRI Knosp分级与Ki-67、p53、MMP-9的相关性分析[J].中华神经外科疾病研究杂志,2016,15(5):410-413.
[5] ZADA G,LOPES M B S,JR S M,et al.Atypical Pituitary Adenomas[M]// Atlas of Sellar and Parasellar Lesions.Springer International Publishing,2016:605-618.
[6] DAI C,FENG M,LIU X,et al.Refractory pituitary adenoma:a novel classification for pituitary tumors[J].Oncotarget,2016,7(50):83 657-83 668.
[7] 位振清,姚勇,邓侃,等.垂体腺瘤的侵袭性与解剖学基础[J].中国微侵袭神经外科杂志,2015,(1):43-45.
[8] 谢民,丁永忠,周旺宁,等.侵袭性垂体腺瘤中fascin蛋白、mmp-2和mmp-9的表达与研究[J].中国神经肿瘤杂志,2013,11(1):15-21.
[9] MACHESKY L M,LI A.Fascin:Invasive filopodia promoting metastasis[J].Commun Integr Biol,2010,3(3):263-270.
[10] TAN V Y,LEWIS S J,ADAMS J C,et al.Association of fascin-1 with mortality,disease progression and metastasis in carcinomas:a systematic review and meta-analysis[J].BMC Med,2013,11:52-68.
[11] HUANG F K,HAN S,XING B,et al.Targeted inhibition of fascin function blocks tumour invasion and metastatic colonization[J].Nat Commun,2015,6:7 465-7 478.
[12] JAYO A,PARSONS M.Fascin:a key regulator of cytoskeletal dynamics[J].Int J Biochem Cell Biol,2010,42(10):1 614-1 617.
[13] LIU C,GAO H,CAO L,et al.The role of FSCN1 in migration and invasion of pituitary adenomas[J].Mol Cell Endocrinol,2016,419:217-224.
[14] HASHIMOTO Y,SKACEL M,ADAMS J C.Roles of fascin in human carcinoma motility and signaling:Prospects for a novel biomarker?[J].Int J Biochem Cell Biol,2005,37(9):1 787-1 804.
[15] JAYO A,MALBOUBI M,ANTOKU S,et al.Fascin Regulates Nuclear Movement and Deformation in Migrating Cells[J].Dev Cell,2016,38(4):371-383.
[16] MAO X,DUAN X,JIANG B.Fascin Induces Epithelial-Mesenchymal Transition of Cholangiocarcinoma Cells by Regulating Wnt/β-Catenin Signaling[J].Med Sci Monit,2016,22:3 479-3 485.
[17] 周晟,李太原.Fascin蛋白与肿瘤的关系研究进展[J].南昌大学学报(医学版),2013,53(2):94-96.
[18] RODRIGUES P C,SAWAZAKI-CALONE I,OLIVEIRA C E D,et al.Fascin promotes migration and invasion and is a prognostic marker for oral squamous cell carcinoma[J].Oncotarget,2017,8(43):74 736-74 754.
[19] SNYDER M,HUANG J,HUANG X Y,et al.A signal transducer and activator of transcription 3·Nuclear Factor κB (Stat3·NFκB) complex is necessary for the expression of fascin in metastatic breast cancer cells in response to interleukin (IL)-6 and tumor necrosis factor (TNF)-α[J].J Biol Chem,2014,289(43):30 082-30 089.
[20] ZHAO H,YANG F,ZHAO W,et al.Fascin Overexpression Promotes Cholangiocarcinoma RBE Cell Proliferation,Migration,and Invasion[J].Technol Cancer Res Treat,2016,15(2):322-333.
[21] 冯洁,于升远,洪礼传,等.基于蛋白质组学的IL-6R/STAT3信号通路与垂体裸细胞瘤侵袭性的相关性研究[J].中华神经外科杂志,2017,33(12):1 268-1 272.
[22] 孔霞,尚九龙,李丽,等.口虾蛄提取物对人鼻咽癌细胞迁移和体外血管生成拟态的抑制作用[J].中国病理生理杂志,2013,29(6):1 025-1 028.
[23] 梁龙,焦阳.微环境促进的侵袭性肿瘤生长的元胞自动机模拟[J].物理学报,2015,64(5):21-37.
[24] 刘巧,凌斌.PIWI、Ki-67与肿瘤关系的研究进展[J].医学综述,2010,16(4):542-544.
[25] SCHOLZEN T,GERDES J.The Ki-67 protein:from the known and the unknown[J].J Cell Physiol,2000,182(3):311-322.
[26] 苏静,郑杰.肿瘤增殖标记分子Ki-67和增殖细胞核抗原及其在病理诊断中的应用[J].中华病理学杂志,2009,38(8):568-571.
[27] 段建中,王殿栋.ki-67基因在肿瘤发生发展中作用的研究进展[J].中国肿瘤外科杂志,2011,3(1):50-51.
[28] SADEGHIPOUR A,MAHOUZI L,SALEM M M,et al.Ki67 Labeling Correlated With Invasion But Not With Recurrence[J].Appl Immunohistochem Mol Morphol,2017,25(5):341-345.
[29] 曹雪霞,陈革,王立,等.基于Ki-67对垂体瘤的预后评价[J].中国病案,2017,18(5):92-94.
[30] 于泽奇,程世翔,涂悦,等.Ki-67、Bcl-2、Bax和Caspase-3在脑胶质瘤组织中的表达及临床意义[J].中国医药导报,2017,14(5):9-12.
[31] 王红云,刘春晖,张亚卓,等.组织芯片技术研究FSCN1蛋白在垂体腺瘤中的表达及意义[J].中华神经外科杂志,2016,32(5):454-457.
